Genforschung: Krebszellen und Therapieansätze - hellinger
Werbung

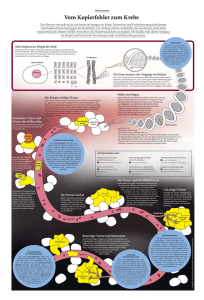
Genforschung: Krebszellen und Therapieansätze 1) Die Entstehung der Krebszellen Es ist allgemein bekannt, dass die Entstehung von Krebszellen kein Verschleiß-Syndrom der Zellen ist, dass es keinen klaren äußeren Erreger der dazu führen soll gibt, dass es auch keinen einfachen Ursache-Wirkungs-Zusammenhang gibt, der die Entstehung erklären kann. Im menschlichen Körper gibt es einen ständig ablaufenden Zellerneuerungsprozess von dem nur die Nervenzellen und die Keimzellen ausgenommen sind. Zwischen der Neubildung und dem Absterben von Zellen herrscht ein kontrolliertes Gleichgewicht. Für die Neubildung sorgt der Zellteillungs-Zyklus auch Mitose-Zyklus genannt. Dabei entstehen zunächst aus dem Zellkern einer Zelle zwei neue Zellkerne mit der identisch überlieferten Erbsubstanz (DNA). Dieser Prozess kann Einwand frei verlaufen, d.h. es wird die absolut identische Kopie erzeugt, oder mit kleineren oder größeren Fehler, d. h. mit fehlerhaften Kopien der DNA. Anschließend folgt nach der Wachstumsphase die Arbeitsphase der neu gebildeten Zellen. In diesen Phasen ist die Hauptaufgabe der Zellen die Biosynthese von Proteinen gemäß der einzelnen Bauplänen, die in den einzelnen Genen der DNA überliefert wurden. Die Fehler in den überlieferten Kopien der DNA sind nun fehlerhafte ProteinBaupläne, die in der Regel von der Zelle nicht in die entsprechenden Proteinen umgesetzt werden können. Besonders gravierend sind Schäden in den folgenden drei DNA Gen-Gruppen: - In den Onkogenen, die Baupläne für das Zellwachstum regelnde Proteine enthalten. - In den Supressor-Genen, die Baupläne für das Zellwachstum drosselnde oder unterdrückende Proteine enthalten. - In den Reparatur-Genen, die Baupläne für derartige Proteine enthalten, die kleinere Erbgutschäden beheben können. Wenn das nicht gelingt, veranlassen diese Proteine die Zelle zur kontrollierten Selbstzerstörung (Apoptose) oder zumindest zur Aussetzung ihrer zukünftiger Zellteilungen, d.h. zu einen Zustand der Seneszenz genannt wird. Diese Maßnahmen sind biologisch sinnvoll, um zu verhindern, dass schwerwiegende Erbschäden im Rahmen der nächsten Zellteilungen an die Tochterzellen weitergegeben werden. Schäden an den angeführten Gen-Gruppen führen dazu, dass dieses fein abgestimmte genetische Kontrollsystem außer Kontrolle gerät, es kommt zur Entwicklungsstörung der Zelle und es entsteht eine entartete Zelle. Wenn der Entartung der Zelle ein unkontrolliertes Wachstum zu Grunde liegt, dann wird sie eine Tumorzelle. Teilt sich eine Tumorzelle weiter, wird die Entartung an alle aus ihr entstandenen Zellgenerationen weitergegeben und es entsteht ein Tumor, der gutartig oder auch bösartig sein. Ein bösartiger Tumor besteht aus entarteten Zellen (Krebszellen), die sich schneller als die gesunden teilen und infolgedessen das umliegende gesunde Gewebe zerstören. Manche dieser Krebszellen wandern vom Primärtumor in andere Organe aus und dort Sekundärtumore (Metastasen) bilden. Ein bösartiger Tumor, der aus entarteten Zellen der Haut, der Schleimhaut oder der Drüsenzellen besteht heißt Karzinom. Ein bösartiger Tumor, der aus entarteten Bindegewebszellen, Muskelzellen, Fettzellen und Knochenzellen besteht heißt Sarkom. Die entarteten Krebszellen, die aus den Zellbestandteilen des Blutes und der Blutbildungsorgane entstanden sind werden Leukämien genannt. Ein gutartiger Tumor besteht aus entarteten Zellen, die sich nicht schneller teilen als die gesunden und auch keinen Sekundärtumor bilden. Die häufigsten bekannten gutartigen Tumore sind die Muttermale, die Fettgeschwülste, die Gefäßgeschwülste und die Muskelzellgeschwülste. Folgende Einbettung der Tumorentstehung in geltende Naturgesetzte auch wenn es drastisch klingt, ist nicht von der Hand zu weisen: Krebs ist das Ergebnis der Anwendung des Murphy-Gesetzes (alles was schief gehen kann wird früher oder später schief gehen) auf Darwins Selektionstheorie (die stärksten Zellen, d.h. hier die am schnellsten wachsenden, überleben und vermehren sich). 2) Äußere Faktoren, die eine Bildung von Krebszellen einleiten können In der Rangliste der Faktoren, die eine Bildung von Krebszellen einleiten können gibt es folgende drei fast gleich gewichtete Gruppen: - Die mit tierischen Fetten unausgewogene Ernährung wegen der bei der Verdauung entstehenden aggressiven Moleküle (freie Radikale). Auch andere in einigen Nahrungsmittel enthaltene Stoffe wie Nitrosamine und Aflatoxine (Schimmelpilzgifte) favorisieren die Bildung von Krebszellen - Das Rauchen wegen der vielen im Teer enthaltenen kanzerogenen Einzelbestandteile. - Die zusammengefasste Wirkung aller aus der Umweltverschmutzung (Schadstoffe in der Luft, Wasser und Boden), aus der Strahlung (Sonnenlicht und Radioaktiverund Röntgenstrahlung) und aus den so genannten krebserregenden Stoffe (Asbestfasern , Chemikalien und Ruß). Der Anteil der einzelnen in dieser Gruppe zusammengefassten Faktoren ist gering. 3) Genforschung zu Krebszellen Der Inhalt des Unterpunktes a) liefert nur eine verkürzte Zusammenfassung der Prozesse, die zur Entstehung der Krebszellen führen kann. Viele der Einzelheiten sind noch ungeklärt und werden noch erforscht. Hier werden einige der neuesten Erkenntnisse dazu kurz erläutert. a) Protein-Kooperationen ermöglichen das schnelle Tumorwachstum - Forscher konnten unlängst zeigen, dass entartete Zellen den Zustand der Seneszenz überwinden, wenn die Proteine Myc und Miz1, deren Baupläne auf den gleichnamigen Gene gespeichert sind, sich verbinden. In den entsprechenden Zellen werden danach schnelle Folgen von Zellteilungen eingeleitet und damit das Tumorwachstum ermöglicht. - Eine weitere unerwünschte Kooperation ist die des Proteins Myc mit einem Protein namens beta-TrCP. Das Protein Myc ist zwingend notwendig, damit Zellen normal wachsen und sich teilen können. Damit es nicht zuviel davon gibt lagert sich zu den Myc-Proteinen knapp 30 Minuten nach ihrer Synthese ein weiteres Protein namens Ubiquitin und veranlasst deren Abbau. Wenn dem jedoch beta-TrCP zuvor kommt, dann wird Myc nicht mehr abgebaut und die erhöhte Konzentration an Myc führt zu einem unkontrollierten Wachstum. Zwar ziehen die neuen Erkenntnisse noch keine neuen Therapiemöglichkeiten nach sich, denn dafür müssten die Gene verändert werden. Langfristig sei aber alles von Bedeutung, was zum Verständnis der Krebsentstehung beiträgt. b) Der Tumor tarnt sich gegenüber der Immunabwehr Lymphozyten sind Teil des angeborenen Immunsystems des Menschen und machen erkannte Krankheitserreger, Fremdstoffe oder auch Krebszellen unschädlich. Wissenschaftler konnten beweisen, dass ein Tumor das angeborene Immunsystem des Körpers austrickst, indem er ihm vorspiegelt, körpereigenes Gewebe zu sein. Dafür wird von Tumoren, die sich in der Lymphe befinden, das Protein CCL21 freigesetzt, das aktivierend auf die Abwehrzellen (Lymphozyten) wirkt und ein Gewebe bildet, das dem von Lymphknoten ähnelt. Diese Schicht zieht nun die weißen Blutkörperchen (Lymphozyten ) zwar an, aber sie werden nun umprogrammiert und akzeptieren den verkleideten Tumor als unschädliches Gewebe. Auch in dem Blut tarnen sich Tumore vor der Immunabwehr, in dem sie die regulatorischen T-Zellen anlocken und zwischen sich und der Immunabwehr stellen. Diese T-Zellen haben ähnliche Aufgaben wie die „Blauhelmsoldaten“, d. h. sie unterdrücken Abwehrreaktionen und beruhigen scharf geschaltete Abwehrzellen. Die mittels Botenstoffe angelockten T-Zellen verhindern die Immunabwehr die Krebszellen als fremd und gefährlich einzustufen. Diese Erkenntnis verhilft zu folgender neuartigen Behandlungsstrategie: Es gilt zu Versuchen die fehlgeleiteten T-Zellen gezielt auszuschalten, um den Tumor nicht mehr vor dem Immunsystem zu schützen. Dies ist Wissenschaftlern bei Mäusen mit zufrieden stellenden Ergebnissen gelungen. c) Die Wanderung der Krebszellen (die Metastasenbildung) könnte mit einem bestimmten Enzym verhindert werden. Das Enzym PEAK1 (Akronym aus pseudopodium-enriched atypical kinase 1) ist an der Bildung von Scheinfüßchen (Pseudopodien) an der Zelloberfläche beteiligt. Diese auch Ausbuchtungen auf der Zelloberfläche dienen der Fortbewegung der Zelle. Auch die Krebszellen nutzen die vom PEAK1 Enzym vermittelte Fähigkeit zur Fortbewegung und lösen sich vom Primärtumor und wandern in den Blutkreislauf, um in anderen Geweben neue Tumore anzusiedeln. Wie die Wissenschaftler zeigen konnten, finden sich im Blut von Krebspatienten entsprechend erhöhte Mengen von PEAK1. Diese Erkenntnis führt aber auch zu folgenden möglichen Therapieansatz: Durch Unterdrückung von PEAK1 könnte das Wandern der Krebszellen verhindert werden, denn die Struktur des Enzyms eignet sich sogar für die Herstellung eines künstlichen molekularen Ein-Aus-Schalters. d) Tumor-TV ein bereits erprobter Therapieansatz Für eine geeignete Krebstherapie ist wichtig die richtige Einzuschätzung der Wachstumsgeschwindigkeit und der Aggressivität eines Tumors. Zuverlässige Antworten liefert eine neue Methode zur Tumorüberwachung, und zwar die Tumor-TV. Es ist bekannt, dass die Menge des im Tumor produzierten Milchsäuresalzes Laktat Rückschlüsse auf dessen Wachstumsgeschwindigkeit und Aggressivität zulässt. Es galt diesen Vorgang mit Hilfe eines geeigneten Bildgebungsverfahrens sichtbar zu machen. Die Grundlage dafür bildet das Salz Pyruvat, ein Zwischenprodukt der Zuckerverbrennung, das vom Tumor in Laktat umgewandelt wird. Die Wissenschaftler erhöhten die Sichtbarkeit der beiden Substanzen um den Faktor 50.000, indem sie das Pyruvat in einem starken magnetischen Feld bei -272 Grad Celsius polarisierten, dann schlagartig auf Körpertemperatur erwärmten und den Patienten injizierten. Wurden die Patienten anschließend sofort mit einem Magnetresonanztomographen untersucht, waren die genauen Umrisse des Tumors sowie seine Stoffwechselaktivität aufgrund der einige Minuten anhaltenden Polarisierung des Pyruvats deutlich sichtbar. Auch die Frage, ob bestimmte Medikamente tatsächlich anschlagen, lässt sich durch einen Blick auf den Bildschirm beantworten, noch lange bevor äußerliche Anzeichen wie etwa ein Schrumpfen des Tumors zu beobachten sind. e) Tumorzellen entwickeln eigene Blutversorgung Ohne die Versorgung mit Sauerstoff und Nährstoffen ist das Krebsgewebe nicht lebensfähig. Seit einigen Jahren werden deshalb besondere Wirkstoffe AngiogeneseHemmer, die in die Blutgefäßbildung eingreifen, in der Krebstherapie verwendet. Den erwarteten großen Erfolg kann man mit den Aushungern der Tumore allerdings nicht erzielen, denn sie verlängern das Leben der Patienten allenfalls um ein paar Monate. Untersuchungen an Hirntumoren konnten zeigen, dass die Blutgefäße in diesen Tumoren typische Auffälligkeiten im Erbgut aufweisen, die zur Vermutung führen, dass das Adersystem nach einer weile vom Krebsgewebe selbst gebildet wird. Diese Fähigkeit führen die Wissenschaftler auf die Eigenschaft mancher Krebszellen, die genetisch instabil sind und ihr Erbgut leicht verändern können, gänzlich neue Gewebetypen auszubilden, wie es sonst nur von Stammzellen bekannt ist. f) Kontrollierter Selbst-Kannibalismus der Tumorzellen Bei den Selbstverdauungsprozess die Autophagie von Zellen werden alte und kaputte Zellbestandteile zerlegt und dem Stoffwechsel wieder neu zugeführt. Der Recyclingprozess liefert der Zelle dadurch neue Bausteine, wichtige Nährstoffe und macht sie damit widerstandsfähiger gegen die Chemotherapie. Aktuelle Untersuchungen haben gezeigt, dass die Regulation der Autophagie das Protein HMGB1 übernimmt. Zu Beginn der Stresssituation leitet es den Recyclingprozess ein, ist der Stress vorüber, bremst es den Selbst-Kannibalismus wieder ab. Nach Ansicht der Wissenschaftler könnte diese Entdeckung dazu beitragen, effektivere Therapien gegen chronische Entzündungen oder Krebs zu entwickeln. Denkbar seien etwa Wirkstoffe, die das Schlüsselprotein HMGB1 vorübergehend blockieren.