Clinical Trial Protocol
Werbung
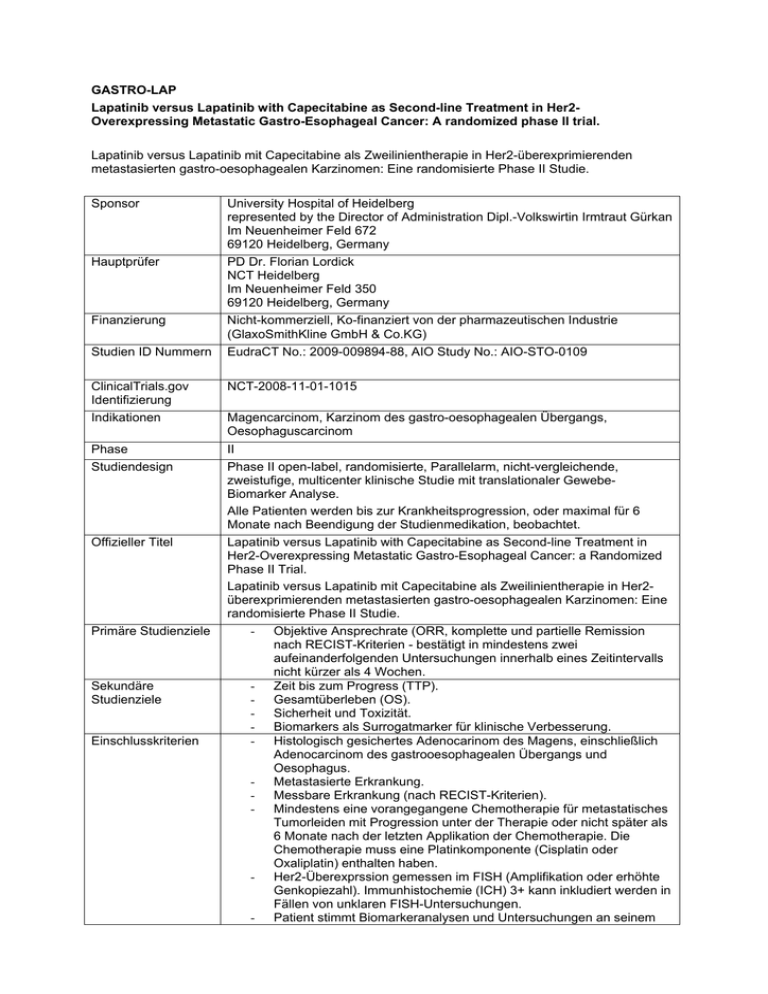
GASTRO-LAP Lapatinib versus Lapatinib with Capecitabine as Second-line Treatment in Her2Overexpressing Metastatic Gastro-Esophageal Cancer: A randomized phase II trial. Lapatinib versus Lapatinib mit Capecitabine als Zweilinientherapie in Her2-überexprimierenden metastasierten gastro-oesophagealen Karzinomen: Eine randomisierte Phase II Studie. Sponsor Hauptprüfer Finanzierung Studien ID Nummern ClinicalTrials.gov Identifizierung Indikationen Phase Studiendesign Offizieller Titel Primäre Studienziele Sekundäre Studienziele Einschlusskriterien University Hospital of Heidelberg represented by the Director of Administration Dipl.-Volkswirtin Irmtraut Gürkan Im Neuenheimer Feld 672 69120 Heidelberg, Germany PD Dr. Florian Lordick NCT Heidelberg Im Neuenheimer Feld 350 69120 Heidelberg, Germany Nicht-kommerziell, Ko-finanziert von der pharmazeutischen Industrie (GlaxoSmithKline GmbH & Co.KG) EudraCT No.: 2009-009894-88, AIO Study No.: AIO-STO-0109 NCT-2008-11-01-1015 Magencarcinom, Karzinom des gastro-oesophagealen Übergangs, Oesophaguscarcinom II Phase II open-label, randomisierte, Parallelarm, nicht-vergleichende, zweistufige, multicenter klinische Studie mit translationaler GewebeBiomarker Analyse. Alle Patienten werden bis zur Krankheitsprogression, oder maximal für 6 Monate nach Beendigung der Studienmedikation, beobachtet. Lapatinib versus Lapatinib with Capecitabine as Second-line Treatment in Her2-Overexpressing Metastatic Gastro-Esophageal Cancer: a Randomized Phase II Trial. Lapatinib versus Lapatinib mit Capecitabine als Zweilinientherapie in Her2überexprimierenden metastasierten gastro-oesophagealen Karzinomen: Eine randomisierte Phase II Studie. - Objektive Ansprechrate (ORR, komplette und partielle Remission nach RECIST-Kriterien - bestätigt in mindestens zwei aufeinanderfolgenden Untersuchungen innerhalb eines Zeitintervalls nicht kürzer als 4 Wochen. - Zeit bis zum Progress (TTP). - Gesamtüberleben (OS). - Sicherheit und Toxizität. - Biomarkers als Surrogatmarker für klinische Verbesserung. - Histologisch gesichertes Adenocarinom des Magens, einschließlich Adenocarcinom des gastrooesophagealen Übergangs und Oesophagus. - Metastasierte Erkrankung. - Messbare Erkrankung (nach RECIST-Kriterien). - Mindestens eine vorangegangene Chemotherapie für metastatisches Tumorleiden mit Progression unter der Therapie oder nicht später als 6 Monate nach der letzten Applikation der Chemotherapie. Die Chemotherapie muss eine Platinkomponente (Cisplatin oder Oxaliplatin) enthalten haben. - Her2-Überexprssion gemessen im FISH (Amplifikation oder erhöhte Genkopiezahl). Immunhistochemie (ICH) 3+ kann inkludiert werden in Fällen von unklaren FISH-Untersuchungen. - Patient stimmt Biomarkeranalysen und Untersuchungen an seinem - - Ausschlusskriterien - - - - - - - Tumorgewebe zu. Unterschriene Einverständnis vor Beginn einer Studienprozedur, Vermögen die Studieninhalte zu verstehen. Alter ≥ 18 Jahre. ECOG Status ≤ 2. Lebenserwartung > 3 Monate. Adäquate hämatologische, hepatische und renale Funktion. Patienten mit Begleitmedikation, die die Phamakokinetik oder Wirkung von Lapatinib beeinflussen könnten werden bezüglich der Einschließbarkeit vom lokalen Hauptprüfer evaluiert. Vermögen zu Schlucken und orale Medikation einzunehmen. Negativer Schwangerschaftstest (Urin oder Serum) innerhalb von 28 Tagen vor Randomisation bei allen Frauen im geburtsfähigen Alter (muss verifiziert werden innerhalb von 7 Tagen vor Randomisation und während der Studie nach dem Urteil des Untersuchers). Bereitschaft zur Durchführung einer doppelte Kontrazeption während der Studie und 6 Monate nach der Beendigung der Therapie. Vorangegangene nicht kurativ behandelte maligne Erkrankung außer dem gastro-oesophagealen Carcinom mit einem Krankheitsfreihenüberleben von weniger als 5 Jahren. Anamnese einer signifikanten neurologischen oder psychiatrischen Erkrankung, Demenz oder Krampfleiden, die ein Verständnis oder die Gabe eines Einverständnisses verhindern. Vorgeschichte einer aktiven Hepatitis B oder C oder eine HIV Infektion. Aktive unkontrollierte Infektion. Aktuelle Behandlung mit anderen experimentellen Medikamenten. Beteiligung an einer anderen klinischen Studie mit einem experimentellen Medikament innerhalb von 30 Tagen vor der Randomisation. Gleichzeitige Behandlung mit einer anderen anti-tumorösen-Therapie. Gleichzeitige Therapie mit anderen Medikamenten, die möglicherweise mit der Studienmedikation intergieren oder die Ergebnisse der Studie beeinflussen. Anamnese einer allergischen Reaktion auf eine Komponente von Lapatinib oder dessen Zusatzstoffe. Anamnese einer allergischen Reaktion auf eine Komponente von Capecitabine, Fluoruracil oder deren Zusatzstoffe. Bekannte DPD Defizienz. Gleichzeitig benötigte Medikation mit CYP3A4 Induktoren oder Inhibitoren. Bestehende aktive Hepatitis oder biliäre Erkrankung (mit Ausnahme von Patienten mit Gilbert's Syndrom, asymptomatischen Gallensteinen, Lebermetastasen oder stabiler chronischer Lebererkrankung nach Beurteilung des Prüfarztes). Aktive kardiale Erkrankung definiert als: o Anamnese einer unkontrollierten oder symptomatischen Angina pectoris. o Anamnese von Arrhythmie, mit Notwendigkeit einer Medikation oder mit klinischer Signifikanz, mit Ausnahme von asymptomatischem Vorhofflimmern mit notwendiger Antikoagulation. o Unkontrollierte oder symptomatische Herzinsuffizienz (NYHA >II). o Ejektionsfraktion unter dem Normwert der jeweiligen Institution. o Jegliche andere kardiale Kondition, die nach der Meinung des behandelnden Arztes, eine unangemessene Gefährdung. für den Patienten darstellen Schwangerschaft oder Stillzeit Anamnese einer Hypersensitivität gegen die Prüfmedikation oder ein - anderes Medikament mit ähnlicher chemischer Struktur oder deren Zusatzstoffe Beteiligung in einer anderen klinischen Studie