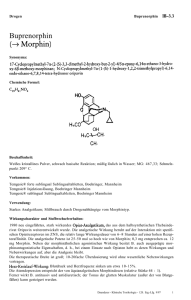
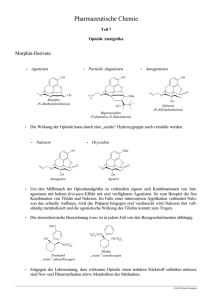
Suboxone, INN- buprenorphine/naloxone
Werbung

ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Suboxone 2 mg/0,5 mg Sublingualtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Sublingualtablette enthält 2 mg Buprenorphin (als Hydrochlorid) und 0,5 mg Naloxon (als Hydrochlorid-Dihydrat). Sonstige Bestandteile mit bekannter Wirkung: Eine Sublingualtablette enthält 42 mg Lactose. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Sublingualtablette Weiße, sechseckige, bikonvexe, 6,5 mm große Tabletten mit einem eingeprägten Schwert-Logo auf der einen Seite und der Einprägung „N2“ (2 mg) auf der anderen Seite. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Substitutionstherapie bei Opioidabhängigkeit im Rahmen medizinischer, sozialer und psychotherapeutischer Maßnahmen. Mit dem Naloxon-Bestandteil soll ein intravenöser Missbrauch verhindert werden. Die Substitutionstherapie ist zur Behandlung von Erwachsenen und Jugendlichen über 15 Jahren bestimmt, die einer Suchtbehandlung zugestimmt haben. 4.2 Dosierung, Art und Dauer der Anwendung Die Behandlung muss unter der Aufsicht eines Arztes mit Erfahrung in der Behandlung von Opiatabhängigkeit/-sucht erfolgen. Dosierung Besondere Vorsichtsmaßnahmen vor Einleitung der Therapie Vor Einleitung der Therapie sollten die Leberfunktionswerte und der Virushepatitis-Status bestimmt werden Bei Patienten mit positivem Virushepatitisbefund, bei Patienten, die Begleitmedikationen erhalten (siehe Abschnitt 4.5), und/oder bei Patienten, bei denen eine Leberfunktionsstörung vorliegt, besteht das Risiko einer schnelleren Leberschädigung. Eine regelmäßige Kontrolle der Leberfunktion wird empfohlen (siehe Abschnitt 4.4). Vor der Einleitung der Therapie sollten die Art der Opioidabhängigkeit (d. h. lang- oder kurzwirksames Opioid), der Zeitraum seit der letzten Opioidanwendung und der Grad der Opioidabhängigkeit berücksichtigt werden. Zur Verhinderung eines beschleunigten Entzugs sollte eine Einleitung mit Buprenorphin/Naloxon oder Buprenorphin erst dann erfolgen, wenn objektive und eindeutige Anzeichen eines Entzugs vorliegen (z. B. kann eine Punktzahl, die eine leichte bis mäßige Entzugssymptomatik auf der validierten Clinical Opioid Withdrawal Scale (COWS) anzeigt, als Richtwert verwendet werden). 2 o Bei heroinabhängigen oder von kurzwirksamen Opioiden abhängigen Patienten sollte die erste Dosis Buprenorphin/Naloxon bei den ersten Anzeichen von Entzug, frühestens jedoch 6 Stunden nach der letzten Opioidanwendung verabreicht werden. o Bei Patienten unter Methadon muss die Methadon-Dosis vor Beginn der Buprenorphin/Naloxon-Therapie auf maximal 30 mg/Tag reduziert werden. Bei Einleitung einer Buprenorphin/Naloxon-Therapie ist die lange Halbwertszeit von Methadon zu berücksichtigen. Die erste Dosis Buprenorphin/Naloxon sollte erst beim Auftreten von Entzugserscheinungen, frühestens jedoch 24 Stunden nachdem der Patient zuletzt Methadon eingenommen hat, verabreicht werden. Buprenorphin kann bei methadonabhängigen Patienten das Auftreten von Entzugssymptomen beschleunigen. Initialtherapie (Einleitung) Die empfohlene Initialdosis bei Erwachsenen und Jugendlichen über 15 Jahren beträgt ein bis zwei Sublingualtabletten Suboxone 2 mg/0,5 mg. In Abhängigkeit vom individuellen Bedarf des Patienten können am ersten Tag ein bis zwei weitere Sublingualtabletten Suboxone 2 mg/0,5 mg verabreicht werden. Zu Beginn der Therapie wird eine tägliche Überwachung der Dosierung empfohlen, um sicherzustellen, dass die Tablette korrekt unter der Zunge eingenommen wird und die Therapieantwort des Patienten beobachten zu können, auf deren Grundlage eine effektive Dosistitration entsprechend der klinischen Wirkung erfolgt. Dosisanpassung und Erhaltungstherapie Nach Einleitung der Behandlung am ersten Tag sollte der Patient im Laufe der folgenden Tage entsprechend der individuell erzielten klinischen Wirkung durch schrittweise Dosisanpassung auf eine Erhaltungsdosis eingestellt werden. Die Dosistitration erfolgt in Schritten von 2-8 mg auf der Grundlage der Neubewertung des klinischen und psychologischen Status des Patienten und darf eine maximale tägliche Einzeldosis von 24 mg nicht überschreiten. Seltenere als einmal tägliche Gabe Nach Erreichen einer zufrieden stellenden Stabilisierung kann die Dosierungshäufigkeit auf ein 2Tagesintervall herabgesetzt werden, wobei der Patient die doppelte individuell titrierte Tagesdosis erhält. Beispiel: Ein Patient, der auf eine Tagesdosis von 8 mg stabil eingestellt ist, kann demnach an jedem zweiten Tag 16 mg erhalten. An den dazwischen liegenden Tagen erfolgen keine Dosisgaben. In bestimmten Fällen kann die Häufigkeit der Anwendung nach Erreichen einer zufriedenstellenden Stabilisierung auf eine 3-mal wöchentliche Gabe reduziert werden (z. B. montags, mittwochs und freitags). Die Montags- und die Mittwochsdosis sollten jeweils doppelt so hoch sein wie die individuell titrierte Tagesdosis. Die Freitagsdosis sollte das Dreifache der individuell titrierten Tagesdosis betragen. An den übrigen Tagen erfolgen keine Dosisgaben. Die an einem Tag gegebene Dosis sollte jedoch 24 mg nicht übersteigen. Für Patienten, die eine titrierte Tagesdosis von > 8 mg/Tag benötigen, ist dieses Behandlungsschema möglicherweise nicht geeignet. Medizinischer Entzug Nach Erreichen einer zufrieden stellenden Stabilisierung und bei Einverständnis des Patienten kann die Dosis allmählich auf eine niedrigere Erhaltungsdosis reduziert werden. In bestimmten günstigen Fällen kann die Therapie beendet werden. Die zur Verfügung stehenden Dosisstärken von 2 mg/0,5 mg und 8 mg/2 mg ermöglichen ein schrittweises Heruntertitrieren der Dosis. Bei Patienten, die eine niedrigere Buprenorphin-Dosis benötigen, kann Buprenorphin 0,4 mg angewandt werden. Nach der gezielten Ausleitung sind die Patienten zu überwachen, da die Möglichkeit eines Rückfalls besteht. Spezielle Patientengruppen Ältere Patienten Es liegen keine Daten zur Sicherheit und Wirksamkeit von Buprenorphin/Naloxon bei Patienten über 65 Jahren vor. Es können keine speziellen Dosierungsempfehlungen gegeben werden. 3 Leberfunktionsstörung Vor Einleitung der Therapie sollten die Leberfunktionswerte und der Virushepatitis-Status bestimmt werden. Bei Patienten mit positivem Virushepatitisbefund, bei Patienten, die Begleitmedikationen erhalten (siehe Abschnitt 4.5), und/oder bei Patienten, bei denen eine Leberfunktionsstörung vorliegt, besteht das Risiko einer schnelleren Leberschädigung. Eine regelmäßige Kontrolle der Leberfunktion wird empfohlen (siehe Abschnitt 4.4). Beide Wirkstoffe von Suboxone, Buprenorphin und Naloxon, werden extensiv in der Leber metabolisiert; bei Patienten mit mittelschwerer oder schwerer Leberfunktionsstörung wurde ein erhöhter undPlasmaspiegel beider Wirkstoffe festgestellt. . Die Patienten sollten auf Anzeichen und Symptome von Opioid-Entzugserscheinungen und einer durch erhöhte Buprenorphin- und/oder Naloxonkonzentration verursachten Toxizität oder Überdosierung überwacht werden. Es ist nicht bekannt, ob beide Wirkstoffe in gleichem Maße beeinflusst werden. Da die Pharmakokinetik von Buprenorphin/Naloxon bei Patienten mit Leberfunktionsstörung verändert sein kann, werden bei Patienten mit einer leichten bis mittelschweren Leberfunktionsstörung niedrigere Initialdosen und eine vorsichtige Dosistitration empfohlen (siehe Abschnitt 5.2). Buprenorphin/Naloxon ist bei Patienten mit schwerer Leberfunktionsstörung kontraindiziert (siehe Abschnitt 4.3 and 5.2). Nierenfunktionsstörung Bei Patienten mit Nierenfunktionsstörung ist in der Regel keine Änderung der Buprenorphin/Naloxon-Dosis erforderlich. Bei Patienten mit schwerer Niereninsuffizienz (KreatininClearance < 30 ml/min) ist Vorsicht geboten (siehe Abschnitt 4.4 und 5.2). Kinder und Jugendliche Die Sicherheit und Wirksamkeit von Buprenorphin/Naloxon bei Kindernunter 15 Jahren ist nicht erwiesen. Es liegen keine Daten vor. Art der Anwendung Der Arzt muss den Patienten darüber informieren, dass die sublinguale Anwendung die einzige wirksame und sichere Art der Anwendung dieses Arzneimittels darstellt (siehe Abschnitt 4.4). Die Tablette muss bis zur vollständigen Auflösung unter der Zunge gehalten werden. Die Patienten dürfen nicht schlucken und keine Speisen oder Getränke zu sich nehmen, bis sich die Tablette vollständig aufgelöst hat. Die Dosis wird aus Suboxone 2 mg/0,5 mg und Suboxone 8 mg/2 mg zusammengestellt, die gleichzeitig oder auf zwei Portionen aufgeteilt eingenommen werden können. Dabei ist die zweite Portion einzunehmen, sobald sich die erste Portion aufgelöst hat. 4.3 Gegenanzeigen Überempfindlichkeit gegen die Wirkstoffe oder einen der sonstigen Bestandteile. Schwere respiratorische Insuffizienz. Schwere Leberfunktionsstörung. Akuter Alkoholismus oder Delirium tremens. Gleichzeitige Verabreichung von Opioid-Antagonisten (Naltrexon, Nalmefen) zur Behandlung von Alkohol- oder Opiodabhängigkeit. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Nicht bestimmungsgemäßer Gebrauch und Missbrauch Buprenorphin kann, wie andere legale oder illegale Opioide auch, missbräuchlich oder nicht bestimmungsgemäß angewandt werden. Risiken einer missbräuchlichen oder nicht bestimmungsgemäßen Anwendung sind z. B. Überdosierung, Verbreitung von hämatogen übertragenen viralen oder lokalen und systemischen Infektionen, Atemdepression und Leberschädigung. Eine missbräuchliche Verwendung von Buprenorphin durch Personen, denen das 4 Arzneimittel nicht verordnet wurde, beinhaltet außerdem das Risiko neuer Drogenabhängiger, die Buprenorphin als Hauptdroge missbrauchen, wenn das Arzneimittel direkt vom betreffenden Patienten zum illegalen Grebrauch in Umlauf gebracht oder wenn es nicht genügend gegen Diebstahl gesichert wird. Eine suboptimale Behandlung mit Buprenorphin/Naloxon kann einen Arzneimittelmissbrauch durch den Patienten zur Folge haben, was zu Überdosierung oder Behandlungsabbruch führen kann. Ein Patient, der eine zu niedrige Dosis Buprenorphin/Naloxon erhält, könnte auf unkontrollierte Entzugssymptome weiterhin mit der Selbstbehandlung mit Opioiden, Alkohol oder sonstigen Sedativa/Hypnotika, insbesondere Benzodiazepinen, reagieren. Um das Risiko eines nicht bestimmungsgemäßen Gebrauchs und Missbrauchs zu minimieren, sollten die Ärzte bei der Verordnung und Ausgabe von Buprenorphin geeignete Vorsichtsmaßnahmen ergreifen. Daher sollten in der frühen Therapiephase nicht mehrere Dosen gleichzeitig verschrieben und dem Bedarf des Patienten angemessene Nachbeobachtungstermine zur klinischen Überwachung angesetzt werden. Durch die Kombination von Buprenorphin mit Naloxon in Suboxone sollen nicht bestimmungsgemäßer Gebrauch und Missbrauch von Buprenorphin vermieden werden. Da der Naloxon-Bestandteil in Suboxone das Auftreten von Entzugssymptomen bei von Heroin, Methadon oder sonstigen Opioid-Agonisten abhängigen Personen beschleunigen kann, ist die Wahrscheinlichkeit, dass Suboxone missbräuchlich intravenös oder intranasal appliziert wird, voraussichtlich geringer als bei der alleinigen Gabe von Buprenorphin. Atemdepression Es wurden einige Todesfälle infolge von Atemdepression beschrieben, insbesondere bei kombinierter Anwendung von Buprenorphin mit Benzodiazepinen (siehe Abschnitt 4.5) oder wenn Buprenorphin nicht gemäß der Fachinformation angewandt wurde. Todesfälle wurden auch in Zusammenhang mit der gleichzeitigen Anwendung von Buprenorphin und anderen zentral dämpfenden Mitteln, z. B. Alkohol und anderen Opioiden, berichtet. Bei Verabreichung von Buprenorphin an nicht opioidabhängige Personen, die keine Toleranz gegenüber den Wirkungen von Opioiden haben, kann eine möglicherweise tödliche Atemdepression auftreten. Das Arzneimittel sollte bei Patienten mit Asthma bronchiale oder respiratorischer Insuffizienz (z. B. chronisch obstruktive Lungenerkrankung, Cor pulmonale, eingeschränkte Atemreserve, Hypoxie, Hyperkapnie, vorbestehende Atemdepression oder Kyphoskoliose (Verkrümmung der Wirbelsäule mit potentiell resultierender Atemnot)) mit Vorsicht eingesetzt werden. Buprenorphin/Naloxon kann bei Kindern und nicht abhängigen Personen bei versehentlicher oder absichtlicher Einnahme zu einer schweren, möglicherweise tödlichen Atemdepression führen. Patienten müssen ermahnt werden, die Blisterpackung an einem sicheren Ort aufzubewahren, die Blisterpackung nie im Voraus zu öffnen, die Blisterpackung für Kinder und andere Haushaltsmitglieder unerreichbar aufzubewahren und dieses Arzneimittel nie vor Kindern einzunehmen. Bei versehentlicher Einnahme oder Verdacht auf Einnahme ist umgehend ein Notdienst zu verständigen. ZNS-dämpfende Wirkung Buprenorphin/Naloxon kann Benommenheit hervorrufen, insbesondere wenn es zusammen mit Alkohol oder zentral dämpfenden Mitteln (z. B. Tranquilizern, Sedativa oder Hypnotika) eingenommen wird (siehe Abschnitt 4.5). Abhängigkeit Buprenorphin wirkt am µ (my)-Opioidrezeptor partiell agonistisch. Eine Dauertherapie führt zur Abhängigkeit vom Opioidtyp. Tierexperimentelle Studien und die klinische Erfahrung haben gezeigt, dass Buprenorphin zur Abhängigkeit führen kann, wobei diese Abhängigkeit jedoch nicht so stark ausgeprägt ist wie bei einem vollen Agonisten, z. B. Morphin. 5 Ein plötzliches Absetzen des Arzneimittels wird nicht empfohlen, da dies zu einem Entzugssyndrom führen kann, das möglicherweise auch verzögert eintritt. Hepatitis und hepatische Ereignisse In klinischen Studien und Nebenwirkungsberichten nach Markteinführung wurden bei Opioidabhängigen Fälle von akuter Leberschädigung beschrieben. Das Spektrum der abnormen Veränderungen reicht von passageren asymptomatischen Erhöhungen der Lebertransaminasen bis hin zu Berichten von Leberversagen, Lebernekrose, hepatorenalem Syndrom, hepatischer Enzephalopathie und Tod. In vielen Fällen könnten vorbestehende mitochondriale Störungen (genetische Erkrankung, Abweichungen der Leberenzymwerte, Infektionen mit dem Hepatitis-B- oder Hepatitis-C-Virus, Alkoholmissbrauch, Anorexie, die gleichzeitige Anwendung von anderen potenziell hepatotoxischen Arzneimitteln) oder ein fortbestehender intravenöser Drogenmissbrauch ursächlich sein oder dazu beitragen. Vor der Verordnung von Buprenorphin/Naloxon und während der Therapie müssen diese zugrunde liegenden Faktoren berücksichtigt werden. Bei Verdacht auf ein hepatisches Ereignis ist eine weitergehende biologische und ätiologische Evaluierung erforderlich. Ausgehend von den Befunden kann das Arzneimittel vorsichtig abgesetzt werden, um Entzugssymptome und einen erneuten illegalen Drogenabusus zu verhindern. Bei Fortführung der Therapie ist die Leberfunktion engmaschig zu überwachen. Beschleunigt einsetzendes Opioidentzugssyndrom Zu Beginn der Behandlung mit Buprenorphin/Naloxon muss sich der Arzt über das partiell agonistische Wirkungsprofil von Buprenorphin im Klaren sein. Buprenorphin kann bei opioidabhängigen Patienten zum beschleunigten Eintreten von Entzugssymptomen führen, insbesondere wenn es dem Patienten früher als 6 Stunden nach der letzten Anwendung von Heroin oder eines anderen kurzwirksamen Opioids oder früher als 24 Stunden nach der letzten MethadonDosis verabreicht wird. Patienten sollten in der Umstellungsphase von Buprenorphin oder Methadon auf Buprenorphin/Naloxon genau beobachtet werden, da von Entzugssymptomen berichtet wurde. Zur Verhinderung eines beschleunigten Entzugs sollte die Einleitung der Behandlung mit Buprenorphin/Naloxon erfolgen, wenn objektive Anzeichen von Entzug vorliegen (siehe Abschnitt 4.2). Entzugssymptome können auch mit einer suboptimalen Dosierung assoziiert sein. Leberfunktionsstörung Der Einfluss einer beeinträchtigten Leberfunktion auf die Pharmakokinetik von Buprenorphin und Naloxon wurde in einer Anwendungsbeobachtung untersucht. Da Buprenorphin und Naloxon überwiegend in der Leber metabolisiert werden, wurden bei Patienten mit mittelschwerer und schwerer Leberfunktionsstörung nach einer Einzeldosisgabe erhöhte Plasmaspiegel von Buprenorphin und Naloxon festgestellt. Die Patienten sollten auf Anzeichen und Symptome von OpioidEntzugserscheinungen und einer durch erhöhte Buprenorphin- und/oder Naloxonkonzentration verursachten Toxizität oder Überdosierung überwacht werden. Suboxone Sublingualtabletten sollten bei Patienten mit mittelschwerer Beeinträchtigung der Leberfunktion mit Vorsicht angewendet werden (siehe Abschnitt 4.3 und 5.2). Buprenorphin/Naloxon sind bei Patienten mit schwerer Leberfunktionsstörung kontraindiziert (siehe Abschnitt 4.3). Nierenfunktionsstörung Die Ausscheidung über die Niere kann verzögert sein, da 30 % der applizierten Dosis renal eliminiert werden. Die Metaboliten von Buprenorphin akkumulieren sich bei Patienten mit Niereninsuffizienz. Bei der Verabreichung an Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance <30 ml/min) ist Vorsicht geboten (siehe Abschnitte 4.2 und 5.2). Anwendung bei Jugendlichen (15-<18 Jahre) 6 Aufgrund mangelnder Daten für Jugendliche (Alter 15-<18 Jahre) sollten Patienten dieser Altersgruppe während der Therapie engmaschiger überwacht werden. CYP3A-Hemmer Arzneimittel, die das Enzym CYP3A4 hemmen, können zu erhöhten Buprenorphin-Konzentrationen führen. Daher kann eine Reduzierung der Buprenorphin/Naloxon-Dosis erforderlich sein. Bei Patienten, die bereits mit CYP3A4-Hemmern behandelt werden, sollte die Dosistitration von Buprenorphin/Naloxon vorsichtig erfolgen, da bei diesen Patienten eine geringere Dosis ausreichend sein kann (siehe Abschnitt 4.5). Suboxone enthält Lactose. Patienten mit der seltenen hereditären Galactoseintoleranz sollten dieses Arzneimittel nicht anwenden. Allgemeine Warnhinweise für die Verabreichung von Opioiden Opioide können bei ambulant behandelten Patienten eine orthostatische Hypotonie verursachen. Opioide können zu einem erhöhten Liquordruck führen, der Krampfanfälle verursachen kann, so dass Opioide bei Patienten mit Kopfverletzungen, intrakraniellen Läsionen, anderen Zuständen mit möglicher Erhöhung des Liquordrucks oder Krampfanfällen in der Krankengeschichte mit Vorsicht anzuwenden sind. Vorsicht ist geboten, wenn Opioide bei Patienten mit Hypotonie, Prostatahypertrophie oder Urethralstenose angewendet werden. Eine durch Opioide verursachte Miosis, Veränderungen des Bewusstseinszustands und Veränderungen der Schmerzwahrnehmung als Symptom einer Krankheit können die Patientenbeurteilung beein-trächtigen und die Diagnose oder den klinischen Verlauf einer Begleiterkrankung verschleiern. Opioide sollten bei Patienten mit Myxödem, Hypothyreose oder Nebenniereninsuffizienz (z. B. Morbus Addison) mit Vorsicht angewendet werden. Es hat sich gezeigt, dass Opioide den Druck im Gallengang erhöhen und bei Patienten mit Dysfunktion der Gallenwege mit Vorsicht angewendet werden sollten. Bei der Verabreichung von Opioiden an ältere oder geschwächte Patienten ist Vorsicht geboten. Die gleichzeitige Einnahme von Monoaminoxidase-Hemmern (MAO-Hemmern) kann, ausgehend von der Erfahrung mit Morphin, zu einer Verstärkung der Wirkung von Opioiden führen (siehe Abschnitt 4.5). 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Suboxone sollte nicht zusammen angewendet werden mit: • alkoholischen Getränken oder alkoholhaltigen Arzneimitteln, da Alkohol die sedierende Wirkung von Buprenorphin verstärkt (siehe Abschnitt 4.7). Es ist Vorsicht geboten bei der Anwendung von Suboxone zusammen mit: o Benzodiazepinen: Diese Kombination kann eine zentrale Atemdepression auslösen, die zum Tode führt. Deshalb müssen die Dosen begrenzt und diese Kombination in Fällen vermieden werden, wo ein Missbrauchsrisiko besteht. Die Patienten sind zu warnen, dass es extrem gefährlich ist, nicht verordnete Benzodiazepine gleichzeitig mit diesem Arzneimittel einzunehmen. Die Patienten sind außerdem darauf hinzuweisen, dass Benzodiazepine 7 zusammen mit diesem Arzneimittel nur auf Anweisung ihres Arztes eingenommen werden dürfen (siehe Abschnitt 4.4). o anderen zentral dämpfenden Mitteln, anderen Opioidderivaten (z. B. Methadon, Analgetika und Antitussiva), bestimmten Antidepressiva, sedativen H1-Rezeptorantagonisten, Barbituraten, anderen Anxiolytika als Benzodiazepinen, Neuroleptika, Clonidin und verwandten Substanzen. Diese Kombinationen verstärken die dämpfende Wirkung auf das zentrale Nervensystem. Aufgrund der herabgesetzten Aufmerksamkeit kann es gefährlich sein, Fahrzeuge zu führen und Maschinen zu bedienen. o Zudem kann es schwierig sein, eine ausreichende Analgesie zu erreichen, wenn Patienten, die Buprenorphin/Naloxon erhalten, ein Opioid-Vollagonist verabreicht wird. Daher besteht die Möglichkeit der Überdosierung mit einem Vollagonisten, insbesondere wenn versucht wird, die partiell agonistische Wirkung von Buprenorphin zu überwinden oder wenn die BuprenorphinPlasmaspiegel sinken. o Naltrexon und Nalmefen sind Opioid-Antagonisten, die die pharmakologischen Wirkungen von Buprenorphin blockieren können. Von einer gleichzeitigen Verabreichung während einer Behandlung mit Buprenorphin/Naloxon ist wegen der potenziell gefährlichen Wechselwirkung, die ein plötzliches Auftreten von anhaltenden und starken Symptomen eines Opioidentzugs auslösen kann, unbedingt abzusehen (siehe 4.3). o CYP3A4-Hemmern: In einer Studie zur Wechselwirkung von Buprenorphin mit Ketoconazol (einem starken CYP3A4-Hemmer) wurden erhöhte Cmax- und AUC-Werte (Fläche unter der Kurve) für Buprenorphin (ca. 50 % bzw. 70 %) und zu einem geringeren Grad für Norbuprenorphin gemessen. Patienten, die Suboxone erhalten, sind engmaschig zu überwachen und bedürfen bei kombinierter Anwendung mit starken CYP3A4-Hemmern (z. B. den ProteaseHemmern Ritonavir, Nelfinavir oder Indinavir oder Antimykotika vom Azol-Typ, z. B. Ketoconazol, Makrolidantibiotika oder Itraconazol) möglicherweise einer Dosisreduzierung. o CYP3A4-Induktoren: Die gleichzeitige Anwendung von CYP3A4-Induktoren mit Buprenorphin kann die Buprenorphin-Plasmakonzentrationen senken und somit möglicherweise zu einer suboptimalen Behandlung der Opioidabhängigkeit mit Buprenorphin führen. Es wird empfohlen, Patienten, die Buprenorphin/Naloxon zusammen mit CYP3A4-Induktoren (z. B. Phenobarbital, Carbamazepin, Phenytoin, Rifampicin) erhalten, engmaschig zu überwachen. Die Buprenorphin- oder CYP3A4-Induktor-Dosis muss gegebenenfalls entsprechend angepasst werden. o Die gleichzeitige Einnahme von Monoaminoxidase-Hemmern (MAO-Hemmern) kann, ausgehend von der Erfahrung mit Morphin, zu einer Verstärkung der Wirkung von Opioiden führen. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Es liegen keine ausreichenden Daten zur Anwendung von Suboxone bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Das potentielle Risiko für den Menschen ist unbekannt. Gegen Ende der Schwangerschaft kann Buprenorphin auch nach kurzer Anwendungsdauer eine Atemdepression beim Neugeborenen hervorrufen. Eine Langzeitanwendung von Buprenorphin während der letzten drei Schwangerschaftsmonate kann zum Entzugssyndrom beim Neugeborenen führen (z. B. Hypertonie, neonataler Tremor, neonatale Agitation, Myoklonus oder Krämpfe). Das Syndrom tritt im Allgemeinen mit einer Verzögerung von einigen Stunden bis einigen Tagen nach der Geburt auf. 8 Wegen der langen Halbwertszeit von Buprenophin sollte das ungeborene Kind gegen Ende der Schwangerschaft mehrere Tage lang überwacht werden, um dem Risiko einer Atemdepression oder eines Entzugssyndroms bei Neugeborenen vorzubeugen. Zudem sollte der Einsatz von Buprenorphin/Naloxon während der Schwangerschaft durch den Arzt sorgfältig überprüft werden. Buprenorphin/Naloxon sollte während der Schwangerschaft nur angewendet werden, wenn der potentielle Nutzen das potentielle Risiko für den Fötus überwiegt. Stillzeit Es ist nicht bekannt, ob Naloxon beim Menschen in die Muttermilch übergeht. Buprenorphin und dessen Metaboliten werden in die Muttermilch ausgeschieden. Untersuchungen an Ratten haben gezeigt, dass Buprenorphin die Laktation hemmt. Das Stillen sollte deshalb während der Behandlung mit Suboxone unterbrochen werden. Fertilität Tierexperimentelle Studien haben eine Verringerung der weiblichen Fertilität unter hohen Dosen gezeigt (systemische Exposition > 2,4-Fache der Exposition des Menschen bei der empfohlenen Höchstdosis von 24 mg Buprenorphin, basierend auf den AUC-Werten). Siehe Abschnitt 5.3. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Buprenorphin/Naloxon hat geringen bis moderaten Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen, wenn es opioidabhängigen Patienten verabreicht wird. Das Arzneimittel kann Benommenheit, Schwindel oder eine Beeinträchtigung des Denkens verursachen, insbesondere bei Therapieeinleitung und Dosisanpassung. Diese Wirkung kann sich verstärken, wenn es gleichzeitig mit Alkohol oder Mitteln angewandt wird, die eine dämpfende Wirkung auf das zentrale Nervensystem ausüben (siehe Abschnitte 4.4 und 4.5). Patienten sollten davor gewarnt werden, Fahrzeuge zu führen oder gefährliche Maschinen zu bedienen, da Buprenorphin/Naloxon ihre diesbezüglichen Fähigkeiten beeinträchtigen kann. 4.8 Nebenwirkungen Zusammenfassung des Sicherheitsprofils Die häufigsten therapiebedingten Nebenwirkungen, die im Rahmen zulassungsrelevanter klinischer Studien beschrieben wurden, waren Obstipation und Symptome, die im Allgemeinen mit Entzugssymptomen assoziiert sind (d. h. Schlaflosigkeit, Kopfschmerzen, Übelkeit, Hyperhidrosis und Schmerzen). Bestimmte berichtete Fälle von Krampfanfällen, Erbrechen, Diarrhoe und erhöhten Leberfunktionswerten wurden als schwerwiegend beurteilt. Übersicht therapiebedingter Nebenwirkungen In Tabelle 1 sind die Nebenwirkungen aus zulassungsrelevanten klinischen Studien zusammengefasst, in denen 342 von 472 Patienten (72,5 %) Nebenwirkungen berichteten. Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: Sehr häufig (≥1/10), häufig (≥1/100bis <1/10), gelegentlich (≥1/1.000bis <1/100). Tabelle 1: Therapiebedingte Nebenwirkungen, die in klinischen Studien zu Buprenorphin/Naloxon berichtet wurden Sehr häufig Häufig (≥1/10) (≥1/100bis <1/10) Infektionen und parasitäre Erkrankungen Grippe Infektion 9 Gelegentlich (≥1/1.000bis <1/100) Harnwegsinfektion Vaginalinfektion Pharyngitis Rhinitis Erkrankungen des Blutes und des Lymphsystems Anämie Leukozytose Leukopenie Lymphadenopathie Thrombozytopenie Erkrankungen des Immunsystems Überempfindlichkeit Stoffwechsel- und Ernährungsstörungen Psychiatrische Erkrankungen Schlaflosigkeit Verminderter Appetit Hyperglykämie Hyperlipidämie Hypoglykämie Angstgefühl Depression Verminderte Libido Nervosität Abnormes Denken Erkrankungen des Nervensystems Kopfschmerzen Migräne Schwindel Hypertonie Parästhesie Somnolenz Augenerkrankungen Amblyopie Tränenflussstörung Herzerkrankungen Gefäßerkrankungen Abnorme Träume Agitiertheit Apathie Depersonalisation Arzneimittelabhängigkeit Euphorie Feindseligkeit Amnesie Konvulsion Hyperkinesie Sprachstörung Tremor Konjunktivitis Miosis Angina pectoris Bradykardie Myokardinfarkt Palpitationen Tachykardie Hypertonie Hypotonie Vasodilatation Erkrankungen der Atemwege, des Brustraums und Mediastinums Husten Asthma Dyspnoe Gähnen Erkrankungen des Gastrointestinaltrakts Obstipation Abdominalschmerz Mundulzeration Übelkeit Diarrhoe Verfärbung der Zunge Dyspepsie Flatulenz Erbrechen Erkrankungen der Haut und des Unterhautzellgewebes Hyperhidrosis Pruritus Akne Hautausschlag Alopezie Urtikaria Dermatitis exfoliativa 10 Trockene Haut Raumforderung der Haut Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Rückenschmerzen Arthralgie Muskelspasmen Myalgie Erkrankungen der Nieren und Harnwege Anomalie des Urins Arthritis Albuminurie Dysurie Hämaturie Nephrolithiasis Harnretention Erektionsstörung Amenorrhoe Ejakulationsstörung Menorrhagie Metrorrhagie Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Arzneimittelentzugssyndrom Asthenie Hypothermie Brustkorbschmerz Schüttelfrost Fieber Unwohlsein Schmerz Ödem peripher Untersuchungen Abnormer Erhöhter Kreatininwert im Leberfunktionstest Blut Gewichtsabnahme Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen Verletzung Hitzschlag Die häufigsten Nebenwirkungen, die nach Markteinführung berichtet wurden, sind in Tabelle 1 zusammengefasst. Beschreibung weiterer ausgewählter Nebenwirkungen, die nach Markteinführung beobachtet wurden Nachfolgend eine Zusammenfassung von weiteren nach Markteinführung berichteten Nebenwirkungsmeldungen, die als schwerwiegend oder aus anderem Grund nennenswert betrachtet werden und von denen einige möglicherweise nur bei der Behandlung von Opioidabhängigkeit mit Buprenorphin alleine beobachtet wurden: • • • • In Fällen intravenösen Missbrauchs von Medikamenten wurden lokale, in manchen Fällen septische Reaktionen (Abszess, Cellulitis) und eine potentiell schwerwiegende akute Hepatitis sowie andere akute Infektionen, wie Pneumonie und Endokarditis, beschrieben (siehe Abschnitt 4.4). Bei Patienten mit ausgeprägter Drogenabhängigkeit kann die initiale Gabe von Buprenorphin zu einem Arzneimittelentzugssyndrom führen, das dem für Naloxon beschriebenen Entzugssyndrom ähnlich ist (siehe Abschnitte 4.2 und 4.4). Zu den häufigsten Anzeichen und Symptomen einer Überempfindlichkeit zählen Hautausschläge, Urtikaria und Pruritus. Fälle von Bronchospasmus, Atemdepression, Angiödem und anaphylaktischem Schock wurden berichtet (siehe Abschnitt 4.3). Es sind Fälle von Lebertransaminasenerhöhung, Hepatitis, akuter Hepatitis, zytolytischer Hepatitis, Ikterus, hepatorenalem Syndrom, hepatischer Enzephalopathie und hepatischer Nekrose aufgetreten (siehe Abschnitt 4.4). 11 • • Ein neonatales Arzneimittelentzugssyndrom ist bei Neugeborenen berichtet worden, deren Mütter während der Schwangerschaft Buprenorphin erhalten hatten. Dieses Syndrom kann leichter und langwieriger sein als ein durch kurz wirksame μ-Opioid-Vollagonisten bedingtes Entzugssyndrom. Die Art des Syndroms kann in Abhängigkeit von der Vorgeschichte des Drogenkonsums der Mutter variieren (siehe Abschnitt 4.6). Halluzinationen, orthostatische Hypotonie, Synkope und Schwindelgefühl wurden berichtet. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das in Anhang V aufgeführte nationale Meldesystem anzuzeigen. 4.9 Überdosierung Symptome Das primäre Symptom bei Überdosierung, das eine Intervention erforderlich macht, ist eine Atemdepression in Folge einer Depression des Zentralnervensystems, da diese zum Atemstillstand und zum Tod führen könnte. Zeichen einer Überdosierung können unter anderem Somnolenz, Amblyopie, Miosis, Hypotonie, Übelkeit, Erbrechen und/oder Sprachstörungen sein. Behandlung Therapie: Es sind allgemeine supportive Maßnahmen einzuleiten, u. a. eine engmaschige Kontrolle der Atem- und Herzfunktionen des Patienten. Eine symptomatische Behandlung der Atemdepression und intensivmedizinische Standardmaßnahmen sind einzuleiten. Freie Atemwege und eine unterstützende oder kontrollierte Beatmung müssen sichergestellt werden. Der Patient ist in eine Einrichtung mit kompletter Reanimationsausrüstung zu überweisen. Bei Erbrechen ist darauf zu achten, dass es nicht zu einer Aspiration des Erbrochenen kommt. Die Anwendung eines Opioid-Antagonisten (d. h. Naloxon) wird trotz des im Vergleich zur Wirkung bei Opioid-Vollagonisten möglicherweise mäßigen Effekts bei der Behebung der Atemsymptome durch Buprenorphin empfohlen. Wird Naloxon verwendet, ist bei der Festlegung der Behandlungsdauer und der medizinischen Überwachung, die zur Behebung der Auswirkungen einer Überdosis erforderlich sind, die lange Wirkdauer von Buprenorphin zu berücksichtigen. Naloxon kann schneller als Buprenorphin ausgeschieden werden, was zu einem erneuten Auftreten der zuvor kontrollierten Symptome der Buprenorphin-Überdosis führen kann, weshalb eine Dauerinfusion erforderlich sein kann. Wenn keine Infusion möglich ist, kann eine wiederholte Naloxon-Verabreichung erforderlich sein. Die NaloxonInitialdosen können bis zu 2 mg betragen und alle 2-3 Minuten wiederholt werden, bis ein ausreichendes Ansprechen erreicht wird, wobei eine Anfangsdosis von 10 mg nicht überschritten werden sollte. Infusionsraten sind dem Ansprechverhalten des Patienten gemäß anzupassen. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Mittel zur Behandlung von Suchterkrankungen; Mittel zur Behandlung der Opiatabhängigkeit ATC-Code: N07BC51. Wirkmechanismus Buprenorphin ist ein partieller Opioid-Agonist/Antagonist, der an die µ und κ (Kappa)-OpioidRezeptoren des Gehirns bindet. Seine Wirksamkeit in der Aufrechterhaltungstherapie mit Opiaten 12 beruht auf seiner Fähigkeit, sich langsam reversibel an die µ-Opioid-Rezeptoren zu binden, wodurch das Bedürfnis des abhängigen Patienten nach Drogen über einen längeren Zeitraum minimiert werden kann. Opioid-agonistische Ceiling-Effekte wurden im Rahmen klinisch-pharmakologischer Studien bei Opioidabhängigen beschrieben. Naloxon wirkt antagonistisch an den µ-Opioidrezeptoren. Bei oraler oder sublingualer Gabe in den üblichen Dosierungen weist Naloxon bei Patienten unter Opioidentzug aufgrund seines nahezu vollständigen First-Pass-Metabolismus eine geringe oder keine pharmakologische Wirkung auf. Bei intravenöser Verabreichung an Opioidabhängige führt der Naloxon-Bestandteil in Suboxone jedoch zu ausgeprägten opioid- antagonistischen Wirkungen und zu Opioid-Entzugssymptomen, was einen intravenösen Missbrauch verhindert. Klinische Wirksamkeit Die Daten zur Wirksamkeit und zur Sicherheit von Buprenorphin/Naloxon stammen hauptsächlich aus einer einjährigen klinischen Studie, die einen 4-wöchigen randomisierten doppelblinden Vergleich von Buprenorphin/Naloxon, Buprenorphin und einem Placebo und im Anschluss daran eine 48wöchige Studie zur Sicherheit von Buprenorphin/Naloxon beinhaltete. In dieser Studie wurden 326 heroinabhängige Patienten randomisiert und erhielten entweder Buprenorphin/Naloxon 16 mg täglich oder Buprenorphin 16 mg täglich oder ein Placebo. Patienten, die einer der Verumgruppen zugewiesen wurden, erhielten zu Beginn der Therapie 8 mg Buprenorphin an Tag 1, danach 16 mg (zwei 8-mg-Tabletten) Buprenorphin an Tag 2. An Tag 3 wurden die Patienten, die der Buprenorphin/Naloxon-Gruppe zugewiesen worden waren, auf die Kombinationstablette umgestellt. Die Patienten kamen zur Ausgabe der Dosis und zur Beurteilung der Wirksamkeit täglich in die Klinik (Montag bis Freitag). Für die Wochenenden wurden Take-Home-Dosen ausgegeben. Primärer Vergleichswert der Studie war die Beurteilung der individuellen Wirksamkeit von Buprenorphin und Buprenorphin/Naloxon versus Placebo. Der prozentuale Anteil der dreimal wöchentlich entnommenen Urinproben, die im Hinblick auf Nicht-Studien-Opioide negativ waren, war sowohl für Buprenorphin/Naloxon versus Placebo (P < 0,0001) als auch für Buprenorphin versus Placebo (P < 0,0001) statistisch signifikant höher. In einer doppelblinden, doppelt placebokontrollierten Parallelgruppenstudie zum Vergleich von Buprenorphin-Ethanol-Lösung mit einem Vollagonisten als Verumkontrolle wurden 162 Patienten randomisiert und der Behandlung mit Buprenorphin als Ethanol-Sublinguallösung in einer Dosierung von 8 mg/Tag (diese Dosis entspricht ungefähr einer Dosis von 12 mg/Tag Buprenorphin/Naloxon) oder zwei relativ niedrigen Dosierungen des Verum-Kontrollpräparats zugewiesen (eine dieser Dosierungen war niedrig genug, um als Alternative zum Placebo zu dienen). Die Studie umfasste eine 3- bis 10-tägige Einleitungsphase, eine 16-wöchige Erhaltungsphase und eine 7-wöchige Detoxifikationsphase. Buprenorphin wurde bis Tag 3 auf die Erhaltungsdosis auftitriert. Die Dosistitration des Verum-Kontrollpräparats erfolgte langsamer. Ausgehend von den Patienten, die in Behandlung blieben und vom prozentualen Anteil der dreimal wöchentlich entnommenen Urinproben, die im Hinblick auf Nicht-Studien-Opioide negativ waren, zeigte sich Buprenorphin im Hinblick auf die Fortführung der Therapie durch die Heroinabhängigen und die Reduktion ihres Gebrauchs von Opioiden unter der Therapie wirksamer als das niedrig dosierte Kontrollpräparat. Die Wirksamkeit von Buprenorphin 8 mg täglich war mit der Wirksamkeit des moderat dosierten VerumKontrollpräparats vergleichbar, eine Äquivalenz wurde jedoch nicht belegt. 5.2 Pharmakokinetische Eigenschaften Buprenorphin Resorption Buprenorphin unterliegt bei oraler Anwendung einem First-Pass-Metabolismus, wobei es zu einer NDealkylierung und Glukuronidierung im Dünndarm und in der Leber kommt. Eine orale Anwendung ist für dieses Arzneimittel daher ungeeignet. 13 Die Plasmaspitzenkonzentrationen werden 90 Minuten nach der sublingualen Applikation erreicht. Die Buprenorphin-Plasmaspiegel stiegen mit der sublingual applizierten Dosis von Buprenorphin/Naloxon an. Sowohl die Cmax -Werte als auch die AUC von Buprenorphin stiegen mit Erhöhung der Dosis (im Bereich von 4 mg bis 16 mg) an. Der Anstieg war allerdings nicht dosisproportional, sondern fiel geringer aus. Pharmakokinetische Parameter Suboxone 4 mg Suboxone 8 mg Suboxone 16 mg Cmax ng/ml 1,84 (39) 3,0 (51) 5,95 (38) AUC0-48 Stunde ng/ml 12,52 (35) 20,22 (43) 34,89 (33) Verteilung Auf die Resorption von Buprenorphin folgt eine rasche Verteilungsphase (die Distributionshalbwertszeit beträgt 2 bis 5 Stunden). Biotransformation und Eliminierung Buprenorphin wird durch 14-N-Dealkylierung und Glukuronidierung des Stammmoleküls und des dealkylierten Metaboliten metabolisiert. Klinische Daten bestätigen, dass CYP3A4 für die NDealkylierung von Buprenorphin verantwortlich ist. N-Dealkylbuprenorphin ist ein µ-Opioidagonist mit einer schwachen intrinsischen Aktivität. Die Eliminierung von Buprenorphin verläuft mit einer mittleren Plasma-Halbwertszeit von 32 Stunden bi- oder tri-exponentiell. Buprenorphin wird nach biliärer Exkretion der glukuronidierten Metaboliten (zu 70 %) über die Fäzes ausgeschieden. Der Rest wird über den Urin ausgeschieden. Naloxon Resorption und Verteilung Nach intravenöser Applikation wird Naloxon rasch verteilt (Distributionshalbwertszeit ~ 4 Minuten). Nach oraler Gabe ist Naloxon kaum im Plasma nachweisbar. Nach sublingualer Gabe von Buprenorphin/Naloxon sind die Plasmaspiegel von Naloxon niedrig und nehmen rasch ab. Biotransformation Das Arzneimittel wird in der Leber, vorwiegend durch Glukuronidierung, metabolisiert und über den Urin ausgeschieden. Naloxon hat eine mittlere Plasma-Halbwertszeit von 1,2 Stunden. Besondere Patientengruppen Ältere Patienten Es liegen keine pharmakokinetischen Daten zu älteren Patienten vor. Nierenfunktionsstörung Die renale Eliminierung spielt bei der Gesamtclearance von Buprenorphin/Naloxon eine relativ geringe Rolle (~ 30 %). Ausgehend von der Nierenfunktion ist keine Dosismodifikation erforderlich. Vorsicht ist jedoch bei Patienten mit schwerer Nierenfunktionsstörung geboten (siehe Abschnitt 4.3). Leberfunktionsstörung Die Auswirkungen einer Leberfunktionsstörung auf die Pharmakokinetik von Buprenorphin und Naloxon wurde in einer Anwendungsbeobachtung untersucht. 14 Tabelle 3 fasst die Ergebnisse einer klinischen Studie nach Einzeldosisgabe von Suboxone 2,0/0,5mg (Buprenorphin/Naloxon) an gesunde Probanden und an Probanden mit Leberfunktionsstörungen zusammen. Tab. 3: Auswirkungen von Leberfunktionsstörungen auf die Pharmakokinetik von Buprenorphin und Naloxon nach Verabreichung von SUBOXONE (Veränderungen im Vergleich zu gesunden Probanden) PK Parameter Leichte Leberfunktionsstörung (Child-Pugh Class A) (n=9) Mittelschwere Leberfunktionsstörung (Child-Pugh Class B) (n=8) Schwere Leberfunktionsstörun (Child-Pugh Class C) (n=8) Buprenorphin Cmax AUClast 1,2fache Erhöhung 1,1fache Erhöhung 1,7fache Erhöhung Vergleichbar zur gesunden Kontrollgruppe 1,6fache Erhöhung 2,8fache Erhöhung Naloxon Cmax AUClast Vergleichbar zur gesunden Kontrollgruppe 2,7fache Erhöhung 11,3fache Erhöhung 0,2fache Erhöhung 3,2fache Erhöhung 14,0fache Erhöhung Insgesamt wurde bei Patienten mit schwerer Leberfunktionsstörung ein Buprenorphine-Anstieg im Blutplasma um das Dreifache verzeichnet, während bei dieser Patientengruppe Naloxon im Blutplasma 14fach erhöht war. 5.3 Präklinische Daten zur Sicherheit Die Kombination von Buprenorphin und Naloxon ist in tierexperimentellen Studien auf akute Toxizität und auf Toxizität bei wiederholter Dosisgabe (bis zu 90 Tage bei Ratten) untersucht worden. Eine synergistische Erhöhung der Toxizität ist nicht beobachtet worden. Nebenwirkungen basierten auf der bekannten pharmakologischen Aktivität von Opioidagonisten und/oder -antagonisten. Die Kombination (4:1) von Buprenorphinhydrochlorid und Naloxonhydrochlorid erwies sich in einem bakteriellen Mutationsassay (Ames-Test) als nicht mutagen und in einem zytogenetischen In-vitroAssay mit Humanlymphozyten bzw. in einem intravenösen Mikronucleus-Test bei der Ratte als nicht klastogen. Reproduktionsstudien mit oraler Gabe von Buprenorphin und Naloxon im Verhältnis von 1:1 deuteten darauf hin, dass bei Ratten unter allen Dosen bei maternaler Toxizität Embryoletalität auftrat. Die geringste untersuchte Dosis repräsentierte die Exposition des 1-Fachen für Buprenorphin und des 5Fachen für Naloxon der auf einer mg/m²-Basis berechneten maximalen therapeutischen Dosis für den Menschen. Bei Kaninchen wurde keine Entwicklungstoxizität bei maternal toxischen Dosen beobachtet. Ferner ist weder bei Ratten noch bei Kaninchen Teratogenität beobachtet worden. Eine peri-postnatale Studie mit Buprenorphin/Naloxon wurde nicht durchgeführt. Die orale Verabreichung 15 von hohen Buprenorphin-Dosen an das Muttertier während der Gestation und Laktation führte jedoch zu Geburtsschwierigkeiten (möglicherweise infolge der sedierenden Wirkung von Buprenorphin), hoher neonataler Mortalität und einer leichten Verzögerung bei der Ausbildung bestimmter neurologischer Funktionen (Aufrichtungs- und Schreckreflex) bei neugeborenen Ratten. Die Verabreichung von Buprenorphin im Futter in Dosierungen von 500 ppm und darüber führte bei Ratten zu einer Verringerung der Fertilität, die sich in niedrigeren Konzeptionsraten bei den Weibchen äußerte. Eine Dosis von 100 ppm im Futter (die geschätzte Exposition betrug für Buprenorphin etwa das 2,4-Fache der Humandosis von 24 mg Buprenorphin/Naloxon, basierend auf der AUC; die Naloxon-Plasmaspiegel lagen unter der Nachweisgrenze für Ratten) beeinträchtigte die Fertilität der Weibchen nicht. Eine Kanzerogenitätsstudie mit Buprenorphin/Naloxon wurde bei Ratten in Dosierungen von 7, 30 und 120 mg/kg/Tag durchgeführt. Die geschätzte Exposition betrug hier das 3- bis 75-Fache einer sublingualen Tagesdosis von 16 mg beim Menschen (berechnet auf mg/m²-Basis). In allen Dosierungsgruppen wurde ein statistisch signifikanter Anstieg der Inzidenz benigner interstitieller Hodenadenome (Leydigzell-Tumor) festgestellt. Eine Umweltrisikobewertung von Buprenorphin/Naloxon ergab, dass bei der Anwendung von Suboxone keine negativen Auswirkungen auf die Umwelt zu erwarten sind. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Lactose-Monohydrat Mannitol (Ph.Eur.) Maisstärke Povidon K 30 Wasserfreie Citronensäure Natriumcitrat Magnesiumstearat (Ph.Eur.) Acesulfam-Kalium Natürliches Citronen- und Limonen-Aroma 6.2 Inkompatibilitäten Nicht zutreffend. 6.3 Dauer der Haltbarkeit 3 Jahre. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. 6.5 Art und Inhalt des Behältnisses 7 Tabletten in Blisterpackungen aus Papier/Aluminium/Nylon/Aluminium/PVC. 28 Tabletten in Blisterpackungen aus Papier/Aluminium/Nylon/Aluminium/PVC. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 16 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen. 7. INHABER DER ZULASSUNG RB Pharmaceuticals Limited 103-105 Bath Road Slough Berkshire SL1 3UH Vereinigtes Königreich 8. ZULASSUNGSNUMMER(N) EU/1/06/359/001 EU/1/06/359/002 9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG Datum der Erteilung der Zulassung: 26. September 2006 Datum der letzten Verlängerung: 26. September 2011 10. STAND DER INFORMATION Ausführliche Informationen zu diesem Arzneimittel sind auf der Website der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. 17 1. BEZEICHNUNG DES ARZNEIMITTELS Suboxone 8 mg/2 mg Sublingualtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Sublingualtablette enthält 8 mg Buprenorphin (als Hydrochlorid) und 2 mg Naloxon (als Hydrochlorid-Dihydrat). Sonstige Bestandteile mit bekannter Wirkung: Eine Sublingualtablette enthält 168 mg Lactose. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Sublingualtablette Weiße, sechseckige, bikonvexe, 11 mm große Tabletten mit einem eingeprägten Schwert-Logo auf der einen Seite und der Einprägung „N8“ (8 mg) auf der anderen Seite. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Substitutionstherapie bei Opioidabhängigkeit im Rahmen medizinischer, sozialer und psychotherapeutischer Maßnahmen. Mit dem Naloxon-Bestandteil soll ein intravenöser Missbrauch verhindert werden. Die Substitutionstherapie ist zur Behandlung von Erwachsenen und Jugendlichen über 15 Jahren bestimmt, die einer Suchtbehandlung zugestimmt haben. 4.2 Dosierung, Art und Dauer der Anwendung Die Behandlung muss unter der Aufsicht eines Arztes mit Erfahrung in der Behandlung von Opiatabhängigkeit/-sucht erfolgen. Dosierung Besondere Vorsichtsmaßnahmen vor Einleitung der Therapie Vor Einleitung der Therapie sollten die Leberfunktionswerte und der Virushepatitis-Status bestimmt werden Bei Patienten mit positivem Virushepatitisbefund, bei Patienten, die Begleitmedikationen erhalten (siehe Abschnitt 4.5), und/oder bei Patienten, bei denen eine Leberfunktionsstörung vorliegt, besteht das Risiko einer schnelleren Leberschädigung. Eine regelmäßige Kontrolle der Leberfunktion wird empfohlen (siehe Abschnitt 4.4). Vor der Einleitung der Therapie sollten die Art der Opioidabhängigkeit (d. h. lang- oder kurzwirksames Opioid), der Zeitraum seit der letzten Opioidanwendung und der Grad der Opioidabhängigkeit berücksichtigt werden. Zur Verhinderung eines beschleunigten Entzugs sollte eine Einleitung mit Buprenorphin/Naloxon oder Buprenorphin erst dann erfolgen, wenn objektive und eindeutige Anzeichen eines Entzugs vorliegen (z. B. kann eine Punktzahl, die eine leichte bis mäßige Entzugssymptomatik auf der validierten Clinical Opioid Withdrawal Scale (COWS) anzeigt, als Richtwert verwendet werden). 18 o Bei heroinabhängigen oder von kurzwirksamen Opioiden abhängigen Patienten sollte die erste Dosis Buprenorphin/Naloxon bei den ersten Anzeichen von Entzug, frühestens jedoch 6 Stunden nach der letzten Opioidanwendung verabreicht werden. o Bei Patienten unter Methadon muss die Methadon-Dosis vor Beginn der Buprenorphin/Naloxon-Therapie auf maximal 30 mg/Tag reduziert werden. Bei Einleitung einer Buprenorphin/Naloxon-Therapie ist die lange Halbwertszeit von Methadon zu berücksichtigen. Die erste Dosis Buprenorphin/Naloxon sollte erst beim Auftreten von Entzugserscheinungen, frühestens jedoch 24 Stunden nachdem der Patient zuletzt Methadon eingenommen hat, verabreicht werden. Buprenorphin kann bei methadonabhängigen Patienten das Auftreten von Entzugssymptomen beschleunigen. Initialtherapie (Einleitung) Die empfohlene Initialdosis bei Erwachsenen und Jugendlichen über 15 Jahren beträgt ein bis zwei Sublingualtabletten Suboxone 2 mg/0,5 mg. In Abhängigkeit vom individuellen Bedarf des Patienten können am ersten Tag ein bis zwei weitere Sublingualtabletten Suboxone 2 mg/0,5 mg verabreicht werden. Zu Beginn der Therapie wird eine tägliche Überwachung der Dosierung empfohlen, um sicherzustellen, dass die Tablette korrekt unter der Zunge eingenommen wird und die Therapieantwort des Patienten beobachten zu können, auf deren Grundlage eine effektive Dosistitration entsprechend der klinischen Wirkung erfolgt. Dosisanpassung und Erhaltungstherapie Nach Einleitung der Behandlung am ersten Tag sollte der Patient im Laufe der folgenden Tage entsprechend der individuell erzielten klinischen Wirkung durch schrittweise Dosisanpassung auf eine Erhaltungsdosis eingestellt werden. Die Dosistitration erfolgt in Schritten von 2-8 mg auf der Grundlage der Neubewertung des klinischen und psychologischen Status des Patienten und darf eine maximale tägliche Einzeldosis von 24 mg nicht überschreiten. Seltenere als einmal tägliche Gabe Nach Erreichen einer zufrieden stellenden Stabilisierung kann die Dosierungshäufigkeit auf ein 2Tagesintervall herabgesetzt werden, wobei der Patient die doppelte individuell titrierte Tagesdosis erhält. Beispiel: Ein Patient, der auf eine Tagesdosis von 8 mg stabil eingestellt ist, kann demnach an jedem zweiten Tag 16 mg erhalten. An den dazwischen liegenden Tagen erfolgen keine Dosisgaben. In bestimmten Fällen kann die Häufigkeit der Anwendung nach Erreichen einer zufriedenstellenden Stabilisierung auf eine 3-mal wöchentliche Gabe reduziert werden (z. B. montags, mittwochs und freitags). Die Montags- und die Mittwochsdosis sollten jeweils doppelt so hoch sein wie die individuell titrierte Tagesdosis. Die Freitagsdosis sollte das Dreifache der individuell titrierten Tagesdosis betragen. An den übrigen Tagen erfolgen keine Dosisgaben. Die an einem Tag gegebene Dosis sollte jedoch 24 mg nicht übersteigen. Für Patienten, die eine titrierte Tagesdosis von > 8 mg/Tag benötigen, ist dieses Behandlungsschema möglicherweise nicht geeignet. Medizinischer Entzug Nach Erreichen einer zufrieden stellenden Stabilisierung und bei Einverständnis des Patienten kann die Dosis allmählich auf eine niedrigere Erhaltungsdosis reduziert werden. In bestimmten günstigen Fällen kann die Therapie beendet werden. Die zur Verfügung stehenden Dosisstärken von 2 mg/0,5 mg und 8 mg/2 mg ermöglichen ein schrittweises Heruntertitrieren der Dosis. Bei Patienten, die eine niedrigere Buprenorphin-Dosis benötigen, kann Buprenorphin 0,4 mg angewandt werden. Nach der gezielten Ausleitung sind die Patienten zu überwachen, da die Möglichkeit eines Rückfalls besteht. Spezielle Patientengruppen Ältere Patienten Es liegen keine Daten zur Sicherheit und Wirksamkeit von Buprenorphin/Naloxon bei Patienten über 65 Jahren vor. Es können keine speziellen Dosierungsempfehlungen gegeben werden. 19 Leberfunktionsstörung Vor Einleitung der Therapie sollten die Leberfunktionswerte und der Virushepatitis-Status bestimmt werden. Bei Patienten mit positivem Virushepatitisbefund, bei Patienten, die Begleitmedikationen erhalten (siehe Abschnitt 4.5), und/oder bei Patienten, bei denen eine Leberfunktionsstörung vorliegt, besteht das Risiko einer schnelleren Leberschädigung. Eine regelmäßige Kontrolle der Leberfunktion wird empfohlen (siehe Abschnitt 4.4). Beide Wirkstoffe von Suboxone, Buprenorphin und Naloxon, werden extensiv in der Leber metabolisiert; bei Patienten mit mittelschwerer oder schwerer Leberfunktionsstörung wurde ein erhöhter undPlasmaspiegel beider Wirkstoffe festgestellt. . Die Patienten sollten auf Anzeichen und Symptome von Opioid-Entzugserscheinungen und einer durch erhöhte Buprenorphin- und/oder Naloxonkonzentration verursachten Toxizität oder Überdosierung überwacht werden. Es ist nicht bekannt, ob beide Wirkstoffe in gleichem Maße beeinflusst werden. Da die Pharmakokinetik von Buprenorphin/Naloxon bei Patienten mit Leberfunktionsstörung verändert sein kann, werden bei Patienten mit einer leichten bis mittelschweren Leberfunktionsstörung niedrigere Initialdosen und eine vorsichtige Dosistitration empfohlen (siehe Abschnitt 5.2). Buprenorphin/Naloxon ist bei Patienten mit schwerer Leberfunktionsstörung kontraindiziert (siehe Abschnitt 4.3 und 5.2). Nierenfunktionsstörung Bei Patienten mit Nierenfunktionsstörung ist in der Regel keine Änderung der Buprenorphin/Naloxon-Dosis erforderlich. Bei Patienten mit schwerer Niereninsuffizienz (KreatininClearance < 30 ml/min) ist Vorsicht geboten (siehe Abschnitt 4.4 und 5.2). Kinder und Jugendliche Die Sicherheit und Wirksamkeit von Buprenorphin/Naloxon bei Kindernunter 15 Jahren ist nicht erwiesen. Es liegen keine Daten vor. Art der Anwendung Der Arzt muss den Patienten darüber informieren, dass die sublinguale Anwendung die einzige wirksame und sichere Art der Anwendung dieses Arzneimittels darstellt (siehe Abschnitt 4.4). Die Tablette muss bis zur vollständigen Auflösung unter der Zunge gehalten werden. Die Patienten dürfen nicht schlucken und keine Speisen oder Getränke zu sich nehmen, bis sich die Tablette vollständig aufgelöst hat. Die Dosis wird aus Suboxone 2 mg/0,5 mg und Suboxone 8 mg/2 mg zusammengestellt, die gleichzeitig oder auf zwei Portionen aufgeteilt eingenommen werden können. Dabei ist die zweite Portion einzunehmen, sobald sich die erste Portion aufgelöst hat. 4.3 Gegenanzeigen Überempfindlichkeit gegen die Wirkstoffe oder einen der sonstigen Bestandteile. Schwere respiratorische Insuffizienz. Schwere Leberfunktionsstörung. Akuter Alkoholismus oder Delirium tremens. Gleichzeitige Verabreichung von Opioid-Antagonisten (Naltrexon, Nalmefen) zur Behandlung von Alkohol- oder Opiodabhängigkeit. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Nicht bestimmungsgemäßer Gebrauch und Missbrauch Buprenorphin kann, wie andere legale oder illegale Opioide auch, missbräuchlich oder nicht bestimmungsgemäß angewandt werden. Risiken einer missbräuchlichen oder nicht bestimmungsgemäßen Anwendung sind z. B. Überdosierung, Verbreitung von hämatogen übertragenen viralen oder lokalen und systemischen Infektionen, Atemdepression und Leberschädigung. Eine missbräuchliche Verwendung von Buprenorphin durch Personen, denen das 20 Arzneimittel nicht verordnet wurde, beinhaltet außerdem das Risiko neuer Drogenabhängiger, die Buprenorphin als Hauptdroge missbrauchen, wenn das Arzneimittel direkt vom betreffenden Patienten zum illegalen Gebrauch in Umlauf gebracht oder wenn es nicht genügend gegen Diebstahl gesichert wird. Eine suboptimale Behandlung mit Buprenorphin/Naloxon kann einen Arzneimittelmissbrauch durch den Patienten zur Folge haben, was zu Überdosierung oder Behandlungsabbruch führen kann. Ein Patient, der eine zu niedrige Dosis Buprenorphin/Naloxon erhält, könnte auf unkontrollierte Entzugssymptome weiterhin mit der Selbstbehandlung mit Opioiden, Alkohol oder sonstigen Sedativa/Hypnotika, insbesondere Benzodiazepinen, reagieren. Um das Risiko eines nicht bestimmungsgemäßen Gebrauchs und Missbrauchs zu minimieren, sollten die Ärzte bei der Verordnung und Ausgabe von Buprenorphin geeignete Vorsichtsmaßnahmen ergreifen. Daher sollten in der frühen Therapiephase nicht mehrere Dosen gleichzeitig verschrieben und dem Bedarf des Patienten angemessene Nachbeobachtungstermine zur klinischen Überwachung angesetzt werden. Durch die Kombination von Buprenorphin mit Naloxon in Suboxone sollen nicht bestimmungsgemäßer Gebrauch und Missbrauch von Buprenorphin vermieden werden. Da der Naloxon-Bestandteil in Suboxone das Auftreten von Entzugssymptomen bei von Heroin, Methadon oder sonstigen Opioid-Agonisten abhängigen Personen beschleunigen kann, ist die Wahrscheinlichkeit, dass Suboxone missbräuchlich intravenös oder intranasal appliziert wird, voraussichtlich geringer als bei der alleinigen Gabe von Buprenorphin. Atemdepression Es wurden einige Todesfälle infolge von Atemdepression beschrieben, insbesondere bei kombinierter Anwendungvon Buprenorphin mit Benzodiazepinen (siehe Abschnitt 4.5) oder wenn Buprenorphin nicht gemäß der Fachinformation angewandt wurde. Todesfälle wurden auch in Zusammenhang mit der gleichzeitigen Anwendung von Buprenorphin und anderen zentral dämpfenden Mitteln, z. B. Alkohol und anderen Opioiden, berichtet. Bei Verabreichung von Buprenorphin an nicht opioidabhängige Personen, die keine Toleranz gegenüber den Wirkungen von Opioiden haben, kann eine möglicherweise tödliche Atemdepression auftreten. Das Arzneimittel sollte bei Patienten mit Asthma bronchiale oder respiratorischer Insuffizienz (z. B. chronisch obstruktive Lungenerkrankung, Cor pulmonale, eingeschränkte Atemreserve, Hypoxie, Hyperkapnie, vorbestehende Atemdepression oder Kyphoskoliose (Verkrümmung der Wirbelsäule mit potentiell resultierender Atemnot)) mit Vorsicht eingesetzt werden. Buprenorphin/Naloxon kann bei Kindern und nicht abhängigen Personen bei versehentlicher oder absichtlicher Einnahme zu einer schweren, möglicherweise tödlichen Atemdepression führen. Patienten müssen ermahnt werden, die Blisterpackung an einem sicheren Ort aufzubewahren, die Blisterpackung nie im Voraus zu öffnen, die Blisterpackung für Kinder und andere Haushaltsmitglieder unerreichbar aufzubewahren und dieses Arzneimittel nie vor Kindern einzunehmen. Bei versehentlicher Einnahme oder Verdacht auf Einnahme ist umgehend ein Notdienst zu verständigen.. ZNS-dämpfende Wirkung Buprenorphin/Naloxon kann Benommenheit hervorrufen, insbesondere wenn es zusammen mit Alkohol oder zentral dämpfenden Mitteln (z. B. Tranquilizern, Sedativa oder Hypnotika) eingenommen wird (siehe Abschnitt 4.5). Abhängigkeit Buprenorphin wirkt am µ (my)-Opioidrezeptor partiell agonistisch. Eine Dauertherapie führt zur Abhängigkeit vom Opioidtyp. Tierexperimentelle Studien und die klinische Erfahrung haben gezeigt, dass Buprenorphin zur Abhängigkeit führen kann, wobei diese Abhängigkeit jedoch nicht so stark ausgeprägt ist wie bei einem vollen Agonisten, z. B. Morphin. 21 Ein plötzliches Absetzen des Arzneimittels wird nicht empfohlen, da dies zu einem Entzugssyndrom führen kann, das möglicherweise auch verzögert eintritt. Hepatitis und hepatische Ereignisse In klinischen Studien und Nebenwirkungsberichten nach Markteinführung wurden bei Opioidabhängigen Fälle von akuter Leberschädigung beschrieben. Das Spektrum der abnormen Veränderungen reicht von passageren asymptomatischen Erhöhungen der Lebertransaminasen bis hin zu Berichten von Leberversagen, Lebernekrose, hepatorenalem Syndrom, hepatischer Enzephalopathie und Tod. In vielen Fällen könnten vorbestehende mitochondriale Störungen (genetische Erkrankung, Abweichungen der Leberenzymwerte, Infektionen mit dem Hepatitis-B- oder Hepatitis-C-Virus, Alkoholmissbrauch, Anorexie, die gleichzeitige Anwendung von anderen potenziell hepatotoxischen Arzneimitteln) oder ein fortbestehender intravenöser Drogenmissbrauch ursächlich sein oder dazu beitragen. Vor der Verordnung von Buprenorphin/Naloxon und während der Therapie müssen diese zugrunde liegenden Faktoren berücksichtigt werden. Bei Verdacht auf ein hepatisches Ereignis ist eine weitergehende biologische und ätiologische Evaluierung erforderlich. Ausgehend von den Befunden kann das Arzneimittel vorsichtig abgesetzt werden, um Entzugssymptome und einen erneuten illegalen Drogenabusus zu verhindern. Bei Fortführung der Therapie ist die Leberfunktion engmaschig zu überwachen. Beschleunigt einsetzendes Opioidentzugssyndrom Zu Beginn der Behandlung mit Buprenorphin/Naloxon muss sich der Arzt über das partiell agonistische Wirkungsprofil von Buprenorphin im Klaren sein. Buprenorphin kann bei opioidabhängigen Patienten zum beschleunigten Eintreten von Entzugssymptomen führen, insbesondere wenn es dem Patienten früher als 6 Stunden nach der letzten Anwendung von Heroin oder eines anderen kurzwirksamen Opioids oder früher als 24 Stunden nach der letzten MethadonDosis verabreicht wird. Patienten sollten in der Umstellungsphase von Buprenorphin oder Methadon auf Buprenorphin/Naloxon genau beobachtet werden, da von Entzugssymptomen berichtet wurde. Zur Verhinderung eines beschleunigten Entzugs sollte die Einleitung der Behandlung mit Buprenorphin/Naloxon erfolgen, wenn objektive Anzeichen von Entzug vorliegen (siehe Abschnitt 4.2). Entzugssymptome können auch mit einer suboptimalen Dosierung assoziiert sein. Leberfunktionsstörung Der Einfluss einer beeinträchtigten Leberfunktion auf die Pharmakokinetik von Buprenorphin und Naloxon wurde in einer Anwendungsbeobachtung untersucht. Da Buprenorphin und Naloxon überwiegend in der Leber metabolisiert werden, wurden bei Patienten mit mittelschwerer und schwerer Leberfunktionsstörung nach einer Einzeldosisgabe erhöhte Plasmaspiegel von Buprenorphin und Naloxon festgestellt. Die Patienten sollten auf Anzeichen und Symptome von OpioidEntzugserscheinungen und einer durch erhöhte Buprenorphin- und/oder Naloxonkonzentration verursachten Toxizität oder Überdosierung überwacht werden. Suboxone Sublingualtabletten sollten bei Patienten mit mittelschwerer Beeinträchtigung der Leberfunktion mit Vorsicht angewendet werden (siehe Abschnitt 4.3 und 5.2). Buprenorphin/Naloxon sind bei Patienten mit schwerer Leberfunktionsstörung kontraindiziert (siehe Abschnitt 4.3). Nierenfunktionsstörung Die Ausscheidung über die Niere kann verzögert sein, da 30 % der applizierten Dosis renal eliminiert werden. Die Metaboliten von Buprenorphin akkumulieren sich bei Patienten mit Niereninsuffizienz. Bei der Verabreichung an Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance <30 ml/min) ist Vorsicht geboten (siehe Abschnitte 4.2 und 5.2). Anwendung bei Jugendlichen (15-<18 Jahre) Aufgrund mangelnder Daten für Jugendliche (Alter 15-<18 Jahre) sollten Patienten dieser Altersgruppe während der Therapie engmaschiger überwacht werden. 22 CYP3A-Hemmer Arzneimittel, die das Enzym CYP3A4 hemmen, können zu erhöhten Buprenorphin-Konzentrationen führen. Daher kann eine Reduzierung der Buprenorphin/Naloxon-Dosis erforderlich sein. Bei Patienten, die bereits mit CYP3A4-Hemmern behandelt werden, sollte die Dosistitration von Buprenorphin/Naloxon vorsichtig erfolgen, da bei diesen Patienten eine geringere Dosis ausreichend sein kann (siehe Abschnitt 4.5). Suboxone enthält Lactose. Patienten mit der seltenen hereditären Galactoseintoleranz sollten dieses Arzneimittel nicht anwenden. Allgemeine Warnhinweise für die Verabreichung von Opioiden Opioide können bei ambulant behandelten Patienten eine orthostatische Hypotonie verursachen. Opioide können zu einem erhöhten Liquordruck führen, der Krampfanfälle verursachen kann, so dass Opioide bei Patienten mit Kopfverletzungen, intrakraniellen Läsionen, anderen Zuständen mit möglicher Erhöhung des Liquordrucks oder Krampfanfällen in der Krankengeschichte mit Vorsicht anzuwenden sind. Vorsicht ist geboten, wenn Opioide bei Patienten mit Hypotonie, Prostatahypertrophie oder Urethralstenose angewendet werden. Eine durch Opioide verursachte Miosis, Veränderungen des Bewusstseinszustands und Veränderungen der Schmerzwahrnehmung als Symptom einer Krankheit können die Patientenbeurteilung beein-trächtigen und die Diagnose oder den klinischen Verlauf einer Begleiterkrankung verschleiern. Opioide sollten bei Patienten mit Myxödem, Hypothyreose oder Nebenniereninsuffizienz (z. B. Morbus Addison) mit Vorsicht angewendet werden. Es hat sich gezeigt, dass Opioide den Druck im Gallengang erhöhen und bei Patienten mit Dysfunktion der Gallenwege mit Vorsicht angewendet werden sollten. Bei der Verabreichung von Opioiden an ältere oder geschwächte Patienten ist Vorsicht geboten. Die gleichzeitige Einnahme von Monoaminoxidase-Hemmern (MAO-Hemmern) kann, ausgehend von der Erfahrung mit Morphin, zu einer Verstärkung der Wirkung von Opioiden führen (siehe Abschnitt 4.5). 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Suboxone sollte nicht zusammen angewendet werden mit: • alkoholischen Getränken oder alkoholhaltigen Arzneimitteln, da Alkohol die sedierende Wirkung von Buprenorphin verstärkt (siehe Abschnitt 4.7). Es ist Vorsicht geboten bei der Anwendung von Suboxone zusammen mit: o Benzodiazepinen: Diese Kombination kann eine zentrale Atemdepression auslösen, die zum Tode führt. Deshalb müssen die Dosen begrenzt und diese Kombination in Fällen vermieden werden, wo ein Missbrauchsrisiko besteht. Die Patienten sind zu warnen, dass es extrem gefährlich ist, nicht verordnete Benzodiazepine gleichzeitig mit diesem Arzneimittel einzunehmen. Die Patienten sind außerdem darauf hinzuweisen, dass Benzodiazepine zusammen mit diesem Arzneimittel nur auf Anweisung ihres Arztes eingenommen werden dürfen (siehe Abschnitt 4.4). 23 o anderen zentral dämpfenden Mitteln, anderen Opioidderivaten (z. B. Methadon, Analgetika und Antitussiva), bestimmten Antidepressiva, sedativen H1-Rezeptorantagonisten, Barbituraten, anderen Anxiolytika als Benzodiazepinen, Neuroleptika, Clonidin und verwandten Substanzen. Diese Kombinationen verstärken die dämpfende Wirkung auf das zentrale Nervensystem. Aufgrund der herabgesetzten Aufmerksamkeit kann es gefährlich sein, Fahrzeuge zu führen und Maschinen zu bedienen. o Zudem kann es schwierig sein, eine ausreichende Analgesie zu erreichen, wenn Patienten, die Buprenorphin/Naloxon erhalten, ein Opioid-Vollagonist verabreicht wird. Daher besteht die Möglichkeit der Überdosierung mit einem Vollagonisten, insbesondere wenn versucht wird, die partiell agonistische Wirkung von Buprenorphin zu überwinden oder wenn die BuprenorphinPlasmaspiegel sinken. o Naltrexon und Nalmefen sind Opioid-Antagonisten, die die pharmakologischen Wirkungen von Buprenorphin blockieren können. Von einer gleichzeitigen Verabreichung während einer Behandlung mit Buprenorphin/Naloxon ist wegen der potenziell gefährlichen Wechselwirkung, die ein plötzliches Auftreten von anhaltenden und starken Symptomen eines Opioidentzugs auslösen kann, unbedingt abzusehen (siehe 4.3). o CYP3A4-Hemmern: In einer Studie zur Wechselwirkung von Buprenorphin mit Ketoconazol (einem starken CYP3A4-Hemmer) wurden erhöhte Cmax- und AUC-Werte (Fläche unter der Kurve) für Buprenorphin (ca. 50 % bzw. 70 %) und zu einem geringeren Grad für Norbuprenorphin gemessen. Patienten, die Suboxone erhalten, sind engmaschig zu überwachen und bedürfen bei kombinierter Anwendung mit starken CYP3A4-Hemmern (z. B. den ProteaseHemmern Ritonavir, Nelfinavir oder Indinavir oder Antimykotika vom Azol-Typ, z. B. Ketoconazol, Makrolidantibiotika oder Itraconazol) möglicherweise einer Dosisreduzierung. o CYP3A4-Induktoren: Die gleichzeitige Anwendung von CYP3A4-Induktoren mit Buprenorphin kann die Buprenorphin-Plasmakonzentrationen senken und somit möglicherweise zu einer suboptimalen Behandlung der Opioidabhängigkeit mit Buprenorphin führen. Es wird empfohlen, Patienten, die Buprenorphin/Naloxon zusammen mit CYP3A4-Induktoren (z. B. Phenobarbital, Carbamazepin, Phenytoin, Rifampicin) erhalten, engmaschig zu überwachen. Die Buprenorphin- oder CYP3A4-Induktor-Dosis muss gegebenenfalls entsprechend angepasst werden. o Die gleichzeitige Einnahme von Monoaminoxidase-Hemmern (MAO-Hemmern) kann, ausgehend von der Erfahrung mit Morphin, zu einer Verstärkung der Wirkung von Opioiden führen. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Es liegen keine ausreichenden Daten zur Anwendung von Suboxone bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Das potentielle Risiko für den Menschen ist unbekannt. Gegen Ende der Schwangerschaft kann Buprenorphin auch nach kurzer Anwendungsdauer eine Atemdepression beim Neugeborenen hervorrufen. Eine Langzeitanwendung von Buprenorphin während der letzten drei Schwangerschaftsmonate kann zum Entzugssyndrom beim Neugeborenen führen (z. B. Hypertonie, neonataler Tremor, neonatale Agitation, Myoklonus oder Krämpfe). Das Syndrom tritt im Allgemeinen mit einer Verzögerung von einigen Stunden bis einigen Tagen nach der Geburt auf. Wegen der langen Halbwertszeit von Buprenophin sollte das ungeborene Kind gegen Ende der Schwangerschaft mehrere Tage lang überwacht werden, um dem Risiko einer Atemdepression oder eines Entzugssyndroms bei Neugeborenen vorzubeugen. 24 Zudem sollte der Einsatz von Buprenorphin/Naloxon während der Schwangerschaft durch den Arzt sorgfältig überprüft werden. Buprenorphin/Naloxon sollte während der Schwangerschaft nur angewendet werden, wenn der potentielle Nutzen das potentielle Risiko für den Fötus überwiegt. Stillzeit Es ist nicht bekannt, ob Naloxon beim Menschen in die Muttermilch übergeht. Buprenorphin und dessen Metaboliten werden in die Muttermilch ausgeschieden. Untersuchungen an Ratten haben gezeigt, dass Buprenorphin die Laktation hemmt. Das Stillen sollte deshalb während der Behandlung mit Suboxone unterbrochen werden. Fertilität Tierexperimentelle Studien haben eine Verringerung der weiblichen Fertilität unter hohen Dosen gezeigt (systemische Exposition > 2,4-Fache der Exposition des Menschen bei der empfohlenen Höchstdosis von 24 mg Buprenorphin, basierend auf den AUC-Werten (Fläche unter der Kurve)). Siehe Abschnitt 5.3. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Buprenorphin/Naloxon hat geringen bis moderaten Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen, wenn es opioidabhängigen Patienten verabreicht wird. Das Arzneimittel kann Benommenheit, Schwindel oder eine Beeinträchtigung des Denkens verursachen, insbesondere bei Therapieeinleitung und Dosisanpassung. Diese Wirkung kann sich verstärken, wenn es gleichzeitig mit Alkohol oder Mitteln angewandt wird, die eine dämpfende Wirkung auf das zentrale Nervensystem ausüben (siehe Abschnitte 4.4 und 4.5). Patienten sollten davor gewarnt werden, Fahrzeuge zu führen oder gefährliche Maschinen zu bedienen, da Buprenorphin/Naloxon ihre diesbezüglichen Fähigkeiten beeinträchtigen kann. 4.8 Nebenwirkungen Zusammenfassung des Sicherheitsprofils Die häufigsten therapiebedingten Nebenwirkungen, die im Rahmen zulassungsrelevanter klinischer Studien beschrieben wurden, waren Obstipation und Symptome, die im Allgemeinen mit Entzugssymptomen assoziiert sind (d. h. Schlaflosigkeit, Kopfschmerzen, Übelkeit, Hyperhidrosis und Schmerzen). Bestimmte berichtete Fälle von Krampfanfällen, Erbrechen, Diarrhoe und erhöhten Leberfunktionswerten wurden als schwerwiegend beurteilt. Übersicht therapiebedingter Nebenwirkungen In Tabelle 1 sind die Nebenwirkungen aus zulassungsrelevanten klinischen Studien zusammengefasst, in denen 342 von 472 Patienten (72,5 %) Nebenwirkungen berichteten. Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: Sehr häufig (≥1/10), häufig (≥1/100 bis <1/10) >, gelegentlich (≥1/1.000bis <1/100) Tabelle 1: Therapiebedingte Nebenwirkungen, die in klinischen Studien zu Buprenorphin/Naloxon berichtet wurden Sehr häufig Häufig (≥1/10) (≥1/100bis <1/10) Infektionen und parasitäre Erkrankungen Grippe Infektion Pharyngitis Rhinitis 25 Gelegentlich (≥1/1.000bis <1/100) Harnwegsinfektion Vaginalinfektion Erkrankungen des Blutes und des Lymphsystems Anämie Leukozytose Leukopenie Lymphadenopathie Thrombozytopenie Erkrankungen des Immunsystems Überempfindlichkeit Stoffwechsel- und Ernährungsstörungen Psychiatrische Erkrankungen Schlaflosigkeit Verminderter Appetit Hyperglykämie Hyperlipidämie Hypoglykämie Angstgefühl Depression Verminderte Libido Nervosität Abnormes Denken Erkrankungen des Nervensystems Kopfschmerzen Migräne Schwindel Hypertonie Parästhesie Somnolenz Augenerkrankungen Amblyopie Tränenflussstörung Herzerkrankungen Gefäßerkrankungen Abnorme Träume Agitiertheit Apathie Depersonalisation Arzneimittelabhängigkeit Euphorie Feindseligkeit Amnesie Konvulsion Hyperkinesie Sprachstörung Tremor Konjunktivitis Miosis Angina pectoris Bradykardie Myokardinfarkt Palpitationen Tachykardie Hypertonie Hypotonie Vasodilatation Erkrankungen der Atemwege, des Brustraums und Mediastinums Husten Asthma Dyspnoe Gähnen Erkrankungen des Gastrointestinaltrakts Obstipation Abdominalschmerz Mundulzeration Übelkeit Diarrhoe Verfärbung der Zunge Dyspepsie Flatulenz Erbrechen Erkrankungen der Haut und des Unterhautzellgewebes Hyperhidrosis Pruritus Akne Hautausschlag Alopezie Urtikaria Dermatitis exfoliativa Trockene Haut Raumforderung der Haut 26 Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Rückenschmerzen Arthralgie Muskelspasmen Myalgie Erkrankungen der Nieren und Harnwege Anomalie des Urins Arthritis Albuminurie Dysurie Hämaturie Nephrolithiasis Harnretention Erektionsstörung Amenorrhoe Ejakulationsstörung Menorrhagie Metrorrhagie Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Arzneimittelentzugssyndrom Asthenie Hypothermie Brustkorbschmerz Schüttelfrost Fieber Unwohlsein Schmerz Ödem peripher Untersuchungen Abnormer Erhöhter Kreatininwert im Leberfunktionstest Blut Gewichtsabnahme Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen Verletzung Hitzschlag Die häufigsten Nebenwirkungen, die nach Markteinführung berichtet wurden, sind in Tabelle 1 zusammengefasst. Beschreibung weiterer ausgewählter Nebenwirkungen, die nach Markteinführung beobachtet wurden Nachfolgend eine Zusammenfassung von weiteren nach Markteinführung berichteten Nebenwirkungsmeldungen, die als schwerwiegend oder aus anderem Grund nennenswert betrachtet werden und von denen einige möglicherweise nur bei der Behandlung von Opioidabhängigkeit mit Buprenorphin alleine beobachtet wurden: Die Nebenwirkungen mit unbekannter Häufigkeit wurden unter folgenden Umständen berichtet: • In Fällen intravenösen Missbrauchs von Medikamenten wurden lokale, in manchen Fällen septische Reaktionen (Abszess, Cellulitis) und eine potentiell schwerwiegende akute Hepatitis sowie andere akute Infektionen, wie Pneumonie und Endokarditis, beschrieben (siehe Abschnitt 4.4). • Bei Patienten mit ausgeprägter Drogenabhängigkeit kann die initiale Gabe von Buprenorphin zu einem Arzneimittelentzugssyndrom führen, das dem für Naloxon beschriebenen Entzugssyndrom ähnlich ist (siehe Abschnitte 4.2 und 4.4). • Zu den häufigsten Anzeichen und Symptomen einer Überempfindlichkeit zählen Hautausschläge, Urtikaria und Pruritus. Fälle von Bronchospasmus, Atemdepression, Angiödem und anaphylaktischem Schock wurden berichtet (siehe Abschnitt 4.3). • Es sind Fälle von Lebertransaminasenerhöhung, Hepatitis, akuter Hepatitis, zytolytischer Hepatitis, Ikterus, hepatorenalem Syndrom, hepatischer Enzephalopathie und hepatischer Nekrose aufgetreten (siehe Abschnitt 4.4). • Ein neonatales Arzneimittelentzugssyndrom ist bei Neugeborenen berichtet worden, deren Mütter während der Schwangerschaft Buprenorphin erhalten hatten. Dieses Syndrom kann 27 • leichter und langwieriger sein als ein durch kurz wirksame μ-Opioid-Vollagonisten bedingtes Entzugssyndrom. Die Art des Syndroms kann in Abhängigkeit von der Vorgeschichte des Drogenkonsums der Mutter variieren (siehe Abschnitt 4.6). Halluzinationen, orthostatische Hypotonie, Synkope und Schwindelgefühl wurden berichtet. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das in Anhang V aufgeführte nationale Meldesystem anzuzeigen. 4.9 Überdosierung Symptome Das primäre Symptom bei Überdosierung, das eine Intervention erforderlich macht, ist eine Atemdepression in Folge einer Depression des Zentralnervensystems, da diese zum Atemstillstand und zum Tod führen könnte. Zeichen einer Überdosierung können unter anderem Somnolenz, Amblyopie, Miosis, Hypotonie, Übelkeit, Erbrechen und/oder Sprachstörungen sein. Behandlung Therapie: Es sind allgemeine supportive Maßnahmen einzuleiten, u. a. eine engmaschige Kontrolle der Atem- und Herzfunktionen des Patienten. Eine symptomatische Behandlung der Atemdepression und intensivmedizinische Standardmaßnahmen sind einzuleiten. Freie Atemwege und eine unterstützende oder kontrollierte Beatmung müssen sichergestellt werden. Der Patient ist in eine Einrichtung mit kompletter Reanimationsausrüstung zu überweisen. Bei Erbrechen ist darauf zu achten, dass es nicht zu einer Aspiration des Erbrochenen kommt. Die Anwendung eines Opioid-Antagonisten (d. h. Naloxon) wird trotz des im Vergleich zur Wirkung bei Opioid-Vollagonisten möglicherweise mäßigen Effekts bei der Behebung der Atemsymptome durch Buprenorphin empfohlen. Wird Naloxon verwendet, ist bei der Festlegung der Behandlungsdauer und der medizinischen Überwachung, die zur Behebung der Auswirkungen einer Überdosis erforderlich sind, die lange Wirkdauer von Buprenorphin zu berücksichtigen. Naloxon kann schneller als Buprenorphin ausgeschieden werden, was zu einem erneuten Auftreten der zuvor kontrollierten Symptome der Buprenorphin-Überdosis führen kann, weshalb eine Dauerinfusion erforderlich sein kann. Wenn keine Infusion möglich ist, kann eine wiederholte Naloxon-Verabreichung erforderlich sein. Die NaloxonInitialdosen können bis zu 2 mg betragen und alle 2-3 Minuten wiederholt werden, bis ein ausreichendes Ansprechen erreicht wird, wobei eine Anfangsdosis von 10 mg nicht überschritten werden sollte. Infusionsraten sind dem Ansprechverhalten des Patienten gemäß anzupassen. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Mittel zur Behandlung von Suchterkrankungen; Mittel zur Behandlung der Opiatabhängigkeit ATC-Code: N07BC51. Wirkmechanismus Buprenorphin ist ein partieller Opioid-Agonist/Antagonist, der an die µ und κ (Kappa)-OpioidRezeptoren des Gehirns bindet. Seine Wirksamkeit in der Aufrechterhaltungstherapie mit Opiaten beruht auf seiner Fähigkeit, sich langsam reversibel an die µ-Opioid-Rezeptoren zu binden, wodurch das Bedürfnis des abhängigen Patienten nach Drogen über einen längeren Zeitraum minimiert werden kann. 28 Opioid-agonistische Ceiling-Effekte wurden im Rahmen klinisch-pharmakologischer Studien bei Opioidabhängigen beschrieben. Naloxon wirkt antagonistisch an den µ-Opioidrezeptoren. Bei oraler oder sublingualer Gabe in den üblichen Dosierungen weist Naloxon bei Patienten unter Opioidentzug aufgrund seines nahezu vollständigen First-Pass-Metabolismus eine geringe oder keine pharmakologische Wirkung auf. Bei intravenöser Verabreichung an Opioidabhängige führt der Naloxon-Bestandteil in Suboxone jedoch zu ausgeprägten opioid- antagonistischen Wirkungen und zu Opioid-Entzugssymptomen, was einen intravenösen Missbrauch verhindert. Klinische Wirksamkeit Die Daten zur Wirksamkeit und zur Sicherheit von Buprenorphin/Naloxon stammen hauptsächlich aus einer einjährigen klinischen Studie, die einen 4-wöchigen randomisierten doppelblinden Vergleich von Buprenorphin/Naloxon, Buprenorphin und einem Placebo und im Anschluss daran eine 48wöchige Studie zur Sicherheit von Buprenorphin/Naloxon beinhaltete. In dieser Studie wurden 326 heroinabhängige Patienten randomisiert und erhielten entweder Buprenorphin/Naloxon 16 mg täglich oder Buprenorphin 16 mg täglich oder ein Placebo. Patienten, die einer der Verumgruppen zugewiesen wurden, erhielten zu Beginn der Therapie 8 mg Buprenorphin an Tag 1, danach 16 mg (zwei 8-mg-Tabletten) Buprenorphin an Tag 2. An Tag 3 wurden die Patienten, die der Buprenorphin/Naloxon-Gruppe zugewiesen worden waren, auf die Kombinationstablette umgestellt. Die Patienten kamen zur Ausgabe der Dosis und zur Beurteilung der Wirksamkeit täglich in die Klinik (Montag bis Freitag). Für die Wochenenden wurden Take-Home-Dosen ausgegeben. Primärer Vergleichswert der Studie war die Beurteilung der individuellen Wirksamkeit von Buprenorphin und Buprenorphin/Naloxon versus Placebo. Der prozentuale Anteil der dreimal wöchentlich entnommenen Urinproben, die im Hinblick auf Nicht-Studien-Opioide negativ waren, war sowohl für Buprenorphin/Naloxon versus Placebo (P < 0,0001) als auch für Buprenorphin versus Placebo (P < 0,0001) statistisch signifikant höher. In einer doppelblinden, doppelt placebokontrollierten Parallelgruppenstudie zum Vergleich von Buprenorphin-Ethanol-Lösung mit einem Vollagonisten als Verumkontrolle wurden 162 Patienten randomisiert und der Behandlung mit Buprenorphin als Ethanol-Sublinguallösung in einer Dosierung von 8 mg/Tag (diese Dosis entspricht ungefähr einer Dosis von 12 mg/Tag Buprenorphin/Naloxon) oder zwei relativ niedrigen Dosierungen des Verum-Kontrollpräparats zugewiesen (eine dieser Dosierungen war niedrig genug, um als Alternative zum Placebo zu dienen). Die Studie umfasste eine 3- bis 10-tägige Einleitungsphase, eine 16-wöchige Erhaltungsphase und eine 7-wöchige Detoxifikationsphase. Buprenorphin wurde bis Tag 3 auf die Erhaltungsdosis auftitriert. Die Dosistitration des Verum-Kontrollpräparats erfolgte langsamer. Ausgehend von den Patienten, die in Behandlung blieben und vom prozentualen Anteil der dreimal wöchentlich entnommenen Urinproben, die im Hinblick auf Nicht-Studien-Opioide negativ waren, zeigte sich Buprenorphin im Hinblick auf die Fortführung der Therapie durch die Heroinabhängigen und die Reduktion ihres Gebrauchs von Opioiden unter der Therapie wirksamer als das niedrig dosierte Kontrollpräparat. Die Wirksamkeit von Buprenorphin 8 mg täglich war mit der Wirksamkeit des moderat dosierten VerumKontrollpräparats vergleichbar, eine Äquivalenz wurde jedoch nicht belegt. 5.2 Pharmakokinetische Eigenschaften Buprenorphin Resorption Buprenorphin unterliegt bei oraler Anwendung einem First-Pass-Metabolismus, wobei es zu einer NDealkylierung und Glukuronidierung im Dünndarm und in der Leber kommt. Eine orale Anwendung ist für dieses Arzneimittel daher ungeeignet. Die Plasmaspitzenkonzentrationen werden 90 Minuten nach der sublingualen Applikation erreicht. Die Buprenorphin-Plasmaspiegel stiegen mit der sublingual applizierten Dosis von 29 Buprenorphin/Naloxon an. Sowohl die Cmax -Werte als auch die AUC von Buprenorphin stiegen mit Erhöhung der Dosis (im Bereich von 4 mg bis 16 mg) an. Der Anstieg war allerdings nicht dosisproportional, sondern fiel geringer aus. Pharmakokinetische Parameter Suboxone 4 mg Suboxone 8 mg Suboxone 16 mg Cmax ng/ml 1,84 (39) 3,0 (51) 5,95 (38) AUC0-48 Stunde ng/ml 12,52 (35) 20,22 (43) 34,89 (33) Verteilung Auf die Resorption von Buprenorphin folgt eine rasche Verteilungsphase (die Distributionshalbwertszeit beträgt 2 bis 5 Stunden). Biotransformation und Eliminierung Buprenorphin wird durch 14-N-Dealkylierung und Glukuronidierung des Stammmoleküls und des dealkylierten Metaboliten metabolisiert. Klinische Daten bestätigen, dass CYP3A4 für die NDealkylierung von Buprenorphin verantwortlich ist. N-Dealkylbuprenorphin ist ein µ-Opioidagonist mit einer schwachen intrinsischen Aktivität. Die Eliminierung von Buprenorphin verläuft mit einer mittleren Plasma-Halbwertszeit von 32 Stunden bi- oder tri-exponentiell. Buprenorphin wird nach biliärer Exkretion der glukuronidierten Metaboliten (zu 70 %) über die Fäzes ausgeschieden. Der Rest wird über den Urin ausgeschieden. Naloxon Resorption und Verteilung Nach intravenöser Applikation wird Naloxon rasch verteilt (Distributionshalbwertszeit ~ 4 Minuten). Nach oraler Gabe ist Naloxon kaum im Plasma nachweisbar. Nach sublingualer Gabe von Buprenorphin/Naloxon sind die Plasmaspiegel von Naloxon niedrig und nehmen rasch ab. Biotransformation Das Arzneimittel wird in der Leber, vorwiegend durch Glukuronidierung, metabolisiert und über den Urin ausgeschieden. Naloxon hat eine mittlere Plasma-Halbwertszeit von 1,2 Stunden. Besondere Patientengruppen Ältere Patienten Es liegen keine pharmakokinetischen Daten zu älteren Patienten vor. Nierenfunktionsstörung Die renale Eliminierung spielt bei der Gesamtclearance von Buprenorphin/Naloxon eine relativ geringe Rolle (~ 30 %). Ausgehend von der Nierenfunktion ist keine Dosismodifikation erforderlich. Vorsicht ist jedoch bei Patienten mit schwerer Nierenfunktionsstörung geboten (siehe Abschnitt 4.3). Leberfunktionsstörung Die Auswirkungen einer Leberfunktionsstörung auf die Pharmakokinetik von Buprenorphin und Naloxon wurde in einer Anwendungsbeobachtung untersucht. Tabelle 3 fasst die Ergebnisse einer klinischen Studie nach Einzeldosisgabe von Suboxone 2,0/0,5mg (Buprenorphin/Naloxon) an gesunde Probanden und an Probanden mit Leberfunktionsstörungen zusammen. 30 Tab. 3: Auswirkungen von Leberfunktionsstörungen auf die Pharmakokinetik von Buprenorphin und Naloxon nach Verabreichung von SUBOXONE (Veränderungen im Vergleich zu gesunden Probanden) PK Parameter Leichte Leberfunktionsstörung (Child-Pugh Class A) (n=9) Mittelschwere Leberfunktionsstörung (Child-Pugh Class B) (n=8) Schwere Leberfunktionsstörun (Child-Pugh Class C) (n=8) Buprenorphin Cmax AUClast 1,2fache Erhöhung 1,1fache Erhöhung 1,7fache Erhöhung Vergleichbar zur gesunden Kontrollgruppe 1,6fache Erhöhung 2,8fache Erhöhung Naloxon Cmax AUClast Vergleichbar zur gesunden Kontrollgruppe 2,7fache Erhöhung 11,3fache Erhöhung 0,2fache Erhöhung 3,2fache Erhöhung 14,0fache Erhöhung Insgesamt wurde bei Patienten mit schwerer Leberfunktionsstörung ein Buprenorphine-Anstieg im Blutplasma um das Dreifache verzeichnet, während bei dieser Patientengruppe Naloxon im Blutplasma 14fach erhöht war. 5.3 Präklinische Daten zur Sicherheit Die Kombination von Buprenorphin und Naloxon ist in tierexperimentellen Studien auf akute Toxizität und auf Toxizität bei wiederholter Dosisgabe (bis zu 90 Tage bei Ratten) untersucht worden. Eine synergistische Erhöhung der Toxizität ist nicht beobachtet worden. Nebenwirkungen basierten auf der bekannten pharmakologischen Aktivität von Opioidagonisten und/oder -antagonisten. Die Kombination (4:1) von Buprenorphinhydrochlorid und Naloxonhydrochlorid erwies sich in einem bakteriellen Mutationsassay (Ames-Test) als nicht mutagen und in einem zytogenetischen In-vitroAssay mit Humanlymphozyten bzw. in einem intravenösen Mikronucleus-Test bei der Ratte als nicht klastogen. Reproduktionsstudien mit oraler Gabe von Buprenorphin und Naloxon im Verhältnis von 1:1 deuteten darauf hin, dass bei Ratten unter allen Dosen bei maternaler Toxizität Embryoletalität auftrat. Die geringste untersuchte Dosis repräsentierte die Exposition des 1-Fachen für Buprenorphin und des 5Fachen für Naloxon der auf einer mg/m²-Basis berechneten maximalen therapeutischen Dosis für den Menschen. Bei Kaninchen wurde keine Entwicklungstoxizität bei maternal toxischen Dosen beobachtet. Ferner ist weder bei Ratten noch bei Kaninchen Teratogenität beobachtet worden. Eine peri-postnatale Studie mit Buprenorphin/Naloxon wurde nicht durchgeführt. Die orale Verabreichung von hohen Buprenorphin-Dosen an das Muttertier während der Gestation und Laktation führte jedoch zu Geburtsschwierigkeiten (möglicherweise infolge der sedierenden Wirkung von Buprenorphin), hoher neonataler Mortalität und einer leichten Verzögerung bei der Ausbildung bestimmter neurologischer Funktionen (Aufrichtungs- und Schreckreflex) bei neugeborenen Ratten. 31 Die Verabreichung von Buprenorphin im Futter in Dosierungen von 500 ppm und darüber führte bei Ratten zu einer Verringerung der Fertilität, die sich in niedrigeren Konzeptionsraten bei den Weibchen äußerte. Eine Dosis von 100 ppm im Futter (die geschätzte Exposition betrug für Buprenorphin etwa das 2,4-Fache der Humandosis von 24 mg Buprenorphin/Naloxon, basierend auf der AUC; die Naloxon-Plasmaspiegel lagen unter der Nachweisgrenze für Ratten) beeinträchtigte die Fertilität der Weibchen nicht. Eine Kanzerogenitätsstudie mit Buprenorphin/Naloxon wurde bei Ratten in Dosierungen von 7, 30 und 120 mg/kg/Tag durchgeführt. Die geschätzte Exposition betrug hier das 3- bis 75-Fache einer sublingualen Tagesdosis von 16 mg beim Menschen (berechnet auf mg/m²-Basis). In allen Dosierungsgruppen wurde ein statistisch signifikanter Anstieg der Inzidenz benigner interstitieller Hodenadenome (Leydigzell-Tumor) festgestellt. Eine Umweltrisikobewertung von Buprenorphin/Naloxon ergab, dass bei der Anwendung von Suboxone keine negativen Auswirkungen auf die Umwelt zu erwarten sind. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Lactose-Monohydrat Mannitol (Ph.Eur.) Maisstärke Povidon K 30 Wasserfreie Citronensäure Natriumcitrat Magnesiumstearat (Ph.Eur.) Acesulfam-Kalium Natürliches Citronen- und Limonen-Aroma 6.2 Inkompatibilitäten Nicht zutreffend. 6.3 Dauer der Haltbarkeit 3 Jahre. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. 6.5 Art und Inhalt des Behältnisses 7 Tabletten in Blisterpackungen aus Papier/Aluminium/Nylon/Aluminium/PVC. 28 Tabletten in Blisterpackungen aus Papier/Aluminium/Nylon/Aluminium/PVC. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen. 32 7. INHABER DER ZULASSUNG RB Pharmaceuticals Limited 103 – 105 Bath Road Slough Berkshire SL1 3UH Vereinigtes Königreich 8. ZULASSUNGSNUMMER(N) EU/1/06/359/001 EU/1/06/359/002 9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG Datum der Erteilung der Zulassung: 26. September 2006 Datum der letzten Verlängerung: 26. September 2011 10. STAND DER INFORMATION Ausführliche Informationen zu diesem Arzneimittel sind auf der Website der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. 33 ANHANG II A. HERSTELLER, DER (DIE) FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST (SIND) B. BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE ABGABE UND DEN GEBRAUCH C. SONSTIGE BEDINGUNGEN UND AUFLAGEN DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN D. BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE SICHERE UND WIRKSAME ANWENDUNG DES ARZNEIMITTELS E. SPEZIFISCHE VERPFLICHTUNG ZUM ABSCHLUSS VON MASSNAHMEN NACH DER ZULASSUNG UNTER AUSSERGEWÖHNLICHEN UMSTÄNDEN 34 A. HERSTELLER, DER (DIE) FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST (SIND) Name und Anschrift des Herstellers, der für die Chargenfreigabe verantwortlich ist Reckitt Benckiser Healthcare (UK) Ltd Dansom Lane Hull, East Yorkshire HU8 7DS United Kingdom B. BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE ABGABE UND DEN GEBRAUCH Arzneimittel, das der besonderen und eingeschränkten ärztlichen Verschreibung unterliegt (siehe Anhang I: Zusammenfassung der Merkmale des Arzneimittels, Abschnitt 4.2). Die Substitutionstherapie zur Behandlung von Opioidabhängigkeit ist zur Anwendung bei Erwachsenen und Jugendlichen über 15 Jahren, die einer Suchtbehandlung zugestimmt haben, im Rahmen medizinischer, sozialer und psychotherapeutischer Maßnahmen unter Aufsicht eines Arztes mit Erfahrung in der Behandlung von Opiatabhängigkeit/-sucht bestimmt. C. SONSTIGE BEDINGUNGEN UND AUFLAGEN DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN • Regelmäßig aktualisierte Unbedenklichkeitsberichte Der Inhaber der Genehmigung für das Inverkehrbringen legt regelmäßig aktualisierte Unbedenklichkeitsberichte für dieses Arzneimittel gemäß den Anforderungen der – nach Artikel 107 c Absatz 7 der Richtlinie 2001/83/EG vorgesehenen und im europäischen Internetportal für Arzneimittel veröffentlichten – Liste der in der Union festgelegten Stichtage (EURD-Liste) vor. D. BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE SICHERE UND WIRKSAME ANWENDUNG DES ARZNEIMITTELS • Risikoanagement-Plan (RMP) Der Inhaber der Genehmigung für das Inverkehrbringen führt die notwendigen, im vereinbarten RMP beschriebenen und in Modul 1.8.2 der Zulassung dargelegten Pharmakovigilanzaktivitäten und Maßnahmen sowie alle künftigen vom Ausschuss für Humanarzneimittel (CHMP) vereinbarten Aktualisierungen des RMP durch. Ein aktualisierter RMP ist einzureichen: • nach Aufforderung durch die Europäische Arzneimittel-Agentur; • jedes Mal wenn das Risikomanagement-System geändert wird, insbesondere infolge neuer eingegangener Informationen, die zu einer wesentlichen Änderung des Nutzen-RisikoVerhältnisses führen können oder infolge des Erreichens eines wichtigen Meilensteins (in Bezug auf Pharmakovigilanz oder Risikominimierung). Fallen die Vorlage eines PSUR und die Aktualisierung eines RMP zeitlich zusammen, können beide gleichzeitig vorgelegt werden E. SPEZIFISCHE VERPFLICHTUNG ZUM ABSCHLUSS VON MASSNAHMEN NACH DER ZULASSUNG UNTER AUSSERGEWÖHNLICHEN UMSTÄNDEN 35 Nicht zutreffend 36 ANHANG III ETIKETTIERUNG UND PACKUNGSBEILAGE 37 A. ETIKETTIERUNG 38 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG PACKUNG MIT 7 bzw. 28 TABLETTEN; DOSISSTÄRKE 2 mg 1. BEZEICHNUNG DES ARZNEIMITTELS Suboxone 2 mg/0,5 mg Sublingualtabletten Buprenorphin/Naloxon 2. WIRKSTOFF(E) Eine Sublingualtablette enthält 2 mg Buprenorphin (als Hydrochlorid) und 0,5 mg Naloxon (als Hydrochlorid-Dihydrat). 3. SONSTIGE BESTANDTEILE Enthält Lactose-Monohydrat. 4. DARREICHUNGSFORM UND INHALT 7 Sublingualtabletten 28 Sublingualtabletten 5. HINWEISE ZUR UND ART(EN) DER ANWENDUNG Packungsbeilage beachten. Sublinguale Anwendung Nicht schlucken. Die Tablette bis zur Auflösung unter der Zunge halten. 6. WARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. WEITERE WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis 9. BESONDERE LAGERUNGSHINWEISE 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE 39 BESEITIGUNG VON NICHT VERWENDETEM ARZNEIMITTEL ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS RB Pharmaceuticals Limited 103-105 Bath Road Slough, Berkshire SL1 3UH Vereinigtes Königreich 12. ZULASSUNGSNUMMER(N) EU/1/06/359/001 EU/1/06/359/002 13. 2 mg Sublingualtabletten 7 2 mg Sublingualtabletten 28 CHARGENBEZEICHNUNG Ch.-B.: 14. VERKAUFSABGRENZUNG Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 16. INFORMATION IN BRAILLE-SCHRIFT Suboxone 2 mg/0,5 mg Sublingualtabletten 40 MINDESTANGABEN AUF BLISTERPACKUNGEN ODER FOLIENSTREIFEN PACKUNG MIT 7 bzw. 28 TABLETTEN; DOSISSTÄRKE: 2 mg 1. BEZEICHNUNG DES ARZNEIMITTELS Suboxone 2 mg/0,5 mg Sublingualtabletten Buprenorphin/Naloxon 2. NAME DES PHARMAZEUTISCHEN UNTERNEHMERS RB Pharmaceuticals Limited 3. VERFALLDATUM Verwendbar bis: 4. CHARGENBEZEICHNUNG Ch.-B.: 5. WEITERE ANGABEN 41 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG PACKUNG MIT 7 bzw. 28 TABLETTEN; DOSISSTÄRKE 8 mg 1. BEZEICHNUNG DES ARZNEIMITTELS Suboxone 8 mg/2 mg Sublingualtabletten Buprenorphin/Naloxon 2. WIRKSTOFF(E) Eine Sublingualtablette enthält 8 mg Buprenorphin (als Hydrochlorid) und 2 mg Naloxon (als Hydrochlorid-Dihydrat). 3. SONSTIGE BESTANDTEILE Enthält Lactose-Monohydrat. 4. DARREICHUNGSFORM UND INHALT 7 Sublingualtabletten 28 Sublingualtabletten 5. HINWEISE ZUR UND ART(EN) DER ANWENDUNG Packungsbeilage beachten. Sublinguale Anwendung Nicht schlucken. Die Tablette bis zur Auflösung unter der Zunge halten. 6. WARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. WEITERE WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM Verwendbar bis 9. BESONDERE LAGERUNGSHINWEISE 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE 42 BESEITIGUNG VON NICHT VERWENDETEM ARZNEIMITTEL ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS RB Pharmaceuticals Limited 103-105 Bath Road Slough, Berkshire SL1 3UH Vereinigtes Königreich 12. ZULASSUNGSNUMMER(N) EU/1/06/359/003 EU/1/06/359/004 13. 8 mg Sublingualtabletten 7 8 mg Sublingualtabletten 28 CHARGENBEZEICHNUNG Ch.-B.: 14. VERKAUFSABGRENZUNG Verschreibungspflichtig 15. HINWEISE FÜR DEN GEBRAUCH 16. INFORMATION IN BRAILLE-SCHRIFT Suboxone 8 mg/2 mg Sublingualtabletten 43 MINDESTANGABEN AUF BLISTERPACKUNGEN ODER FOLIENSTREIFEN PACKUNG MIT 7 bzw. 28 TABLETTEN; DOSISSTÄRKE: 8 mg 1. BEZEICHNUNG DES ARZNEIMITTELS Suboxone 8 mg/2 mg Sublingualtabletten Buprenorphin/Naloxon 2. NAME DES PHARMAZEUTISCHEN UNTERNEHMERS RB Pharmaceuticals Limited 3. VERFALLDATUM Verwendbar bis: 4. CHARGENBEZEICHNUNG Ch.-B.: 5. WEITERE ANGABEN 44 B. PACKUNGSBEILAGE 45 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Suboxone 2 mg/0,5 mg Sublingualtabletten Buprenorphin/Naloxon Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. • Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. • Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker. • Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie. • Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker. Siehe Abschnitt 4. Was in dieser Packungsbeilage steht: 1. Was ist Suboxone und wofür wird es angewendet? 2. Was sollten Sie vor der Anwendung von Suboxone beachten? 3. Wie ist Suboxone anzuwenden? 4. Welche Nebenwirkungen sind möglich? 5 Wie ist Suboxone aufzubewahren? 6. Inhalt der Packung und weitere Informationen 1. Was ist Suboxone und wofür wird es angewendet? Suboxone ist zur Behandlung der Abhängigkeit von Opioiden (Narkotika), z. B. Heroin oder Morphium, bei Drogenabhängigen bestimmt, die einer Suchtbehandlung zugestimmt haben. Suboxone ist zur Behandlung von Erwachsenen und Jugendlichen über 15 Jahren bestimmt, die gleichzeitig medizinisch, sozial und psychotherapeutisch betreut werden. 2. Was sollten Sie vor der Anwendung von Suboxone beachten? Suboxone darf nicht angewendet werden, • wenn Sie allergisch (überempfindlich) gegen Buprenorphin, Naloxon oder einen der sonstigen Bestandteile dieses Arzneimittels sind (siehe Abschnitt 6). • wenn Sie schwere Atemprobleme haben. • wenn Sie schwere Leberprobleme haben. • wenn Sie stark alkoholisiert sind oder alkoholbedingt an Zittern, starkem Schwitzen, Angstzuständen, Verwirrtheit oder Halluzinationen leiden. • Wenn Sie Naltrexon oder Nalmefen zur Behandlung von Alkohol- oder Opioid-Abhängigkeit einnehmen. Warnhinweise und Vorsichtsmaßnahmen Bitte sprechen Sie mit Ihrem Arzt bevor Sie Suboxone einnehmen, wenn: • bei Ihnen Asthma bronchiale oder sonstige Atemprobleme bestehen. • Lebererkrankungen wie Hepatitis vorliegen. • Sie niedrigen Blutdruck haben. • Sie vor Kurzem an einer Kopfverletzung oder Erkrankungen des Gehirns litten. • Sie an Erkrankungen der Harnwege (bei Männern insbesondere in Zusammenhang mit einer Prostatavergrößerung) leiden. • eine Nierenerkrankung vorliegt. 46 • • Sie Schilddrüsenprobleme haben. eine Erkrankung der Nebennierenrinde vorliegt (z. B. Morbus Addison). Warnhinweise und Vorsichtsmaßnahmen: • Nicht bestimmungsgemäßer Gebrauch und Missbrauch Dieses Arzneimittel kann für Personen von Interesse sein, die mit verschreibungspflichtigen Arzneimitteln Missbrauch betreiben. Daher sollte es diebstahlsicher aufbewahrt werden. Geben Sie dieses Arzneimittel nicht an Dritte weiter. Es kann bei anderen Menschen zum Tode führen oder diesen anderweitig schaden. • Atemprobleme Einige Menschen starben infolge respiratorischer Insuffizienz (Atemstillstand), weil sie dieses Arzneimittel missbräuchlich oder zusammen mit anderen, das zentrale Nervensystem dämpfenden Substanzen, wie z. B. Alkohol, Benzodiazepinen (Tranquilizern) oder anderen Opioiden, angewendet haben. • Abhängigkeit Dieses Arzneimittel kann zur Abhängigkeit führen. • Entzugssymptome Dieses Arzneimittel kann Entzugssymptome hervorrufen, wenn Sie es früher als sechs Stunden nach Anwendung eines kurzwirksamen Opioids (z. B. Morphin, Heroin) oder früher als 24 Stunden nach Anwendung eines langwirksamen Opioids, z. B. Methadon, anwenden. Suboxone kann auch dann Entzugssymptome hervorrufen, wenn Sie es plötzlich absetzen. • Leberschäden Fälle von Leberschäden wurden berichtet, insbesondere in Zusammenhang mit einer missbräuchlichen Anwendung von Suboxone. Diese Schädigungen könnten auf Virusinfektionen (chronische Hepatitis C), Alkoholmissbrauch, Anorexie oder Arzneimittel zurückzuführen sein (siehe Abschnitt 4). Ihr Arzt kann regelmäßige Blutuntersuchungen durchführen, um den Zustand Ihrer Leber zu überwachen. Informieren Sie Ihren Arzt vor Behandlungsbeginn mit Suboxone, falls Sie Leberprobleme haben. • Blutdruck Bei Anwendung dieses Arzneimittels kann es zu einem plötzlichen Blutdruckabfall kommen, der Schwindel hervorruft, wenn Sie plötzlich aus dem Sitzen oder Liegen aufstehen. • Diagnose nicht suchtassoziierter Erkrankungen Dieses Arzneimittel kann Schmerzsymptome verschleiern, die für die Diagnose bestimmter Erkrankungen von Bedeutung sein könnten. Vergessen Sie nicht, Ihren Arzt zu informieren, wenn Sie dieses Arzneimittel anwenden. Anwendung von Suboxone zusammen mit anderen Arzneimitteln Bei Anwendung von Suboxone zusammen mit bestimmten Arzneimitteln könnten die Nebenwirkungen verstärkt und manchmal sehr schwere Reaktionen ausgelöst werden. Sprechen Sie bitte mit Ihrem Arzt, bevor Sie Suboxone zusammen mit anderen, insbesondere den folgenden Medikamenten, anwenden: • Benzodiazepine (die zur Behandlung von Angstzuständen oder Schlafstörungen eingesetzt werden) wie z. B. Diazepam, Temazepam, Alprazolam. Ihr Arzt wird Ihnen die korrekte Dosis verschreiben. Die Einnahme der falschen Dosis Benzodiazepine kann zum Tod durch respiratorische Insuffizienz (Atemstillstand) führen. 47 • Andere Arzneimittel, die Sie möglicherweise schläfrig machen und die zur Behandlung von Krankheiten wie Angstzuständen, Schlaflosigkeit, Konvulsionen/Krampfanfällen, Schmerzen eingesetzt werden. Diese Art von Medikamenten setzt Ihre Aufmerksamkeit herab und erschwert das Führen von Fahrzeugen sowie das Bedienen von Maschinen. Sie können auch zu einer Depression des Zentralnervensystems führen, was sehr schwerwiegend ist. Unten finden Sie eine Auflistung dieser Art von Arzneimitteln: ­ ­ andere opioidhaltige Arzneimittel wie Methadon, bestimmte Schmerzmittel und Hustenblocker Antidepressiva (zur Behandlung von Depressionen), z. B. Isocarboxazid, Phenelzin, Selegelin, Tranylcypromin und Valproat, können die Wirkungen dieses Arzneimittels verstärken. sedative Hı-Rezeptorantagonisten (zur Behandlung allergischer Reaktionen), z. B. Diphenhydramin und Chlorphenamin. Barbiturate (die als Schlaf- oder Beruhigungsmittel eingesetzt werden), z. B. Phenobarbital, Secobarbital Tranquilizer (die als Schlaf- oder Beruhigungsmittel eingesetzt werden), z. B. Chloralhydrat. ­ ­ ­ • • • • • Clonidin (zur Behandlung von Bluthochdruck) kann die Wirkungen dieses Arzneimittels verstärken. Antiretrovirale Arzneimittel (zur Behandlung von AIDS), z. B. Ritonavir, Nelfinavir und Indinavir, können die Wirkungen dieses Arzneimittels verstärken. bestimmte Antimykotika (zur Behandlung von Pilzinfektionen), z. B. Ketoconazol, Itraconazol und bestimmte Antibiotika, können die Wirkungen dieses Arzneimittels verstärken. bestimmte Arzneimittel können die Wirkungen von Suboxone abschwächen. Dies betrifft u. a. Arzneimittel zur Behandlung von Epilepsie (z. B. Carbamazepin oder Phenytoin) und Arzneimittel zur Behandlung von Tuberkulose (Rifampicin). Naltrexon und Nalmefen können die therapeutische Wirkung von Suboxone blockieren. Sie dürfen nicht gleichzeitig mit Suboxone eingenommen werden, um ein plötzliches Auftreten lang anhaltender und starker Entzugserscheinungen zu vermeiden. Um den größtmöglichen Nutzen aus der Behandlung mit Suboxone zu ziehen, müssen Sie Ihren Arzt über alle Arzneimittel informieren, die Sie anwenden, einschließlich Alkohol, alkoholhaltiger Arzneimittel, Straßendrogen sowie aller verschreibungspflichtigen Arzneimittel, die Sie anwenden, jedoch nicht von Ihrem Arzt verordnet wurden. Bei Anwendung von Suboxone zusammen mit Nahrungsmitteln, Getränken und Alkohol Die Einnahme von Suboxone mit Alkohol kann die Schläfrigkeit verstärken und das Risiko respiratorischer Insuffizienz erhöhen. Wenden Sie Suboxone nicht zusammen mit Alkohol an. Nehmen Sie erst dann Speisen und Getränke zu sich, wenn sich die Tablette vollständig aufgelöst hat. Schwangerschaft und Stillzeit Die Risiken der Einnahme von Suboxone durch schwangere Frauen sind nicht bekannt. Informieren Sie Ihren Arzt, wenn Sie schwanger sind oder beabsichtigen, schwanger zu werden. Ihr Arzt wird entscheiden, ob Ihre Behandlung mit einer alternativen Medikation fortgeführt werden sollte. Die Anwendung von Arzneimitteln wie Suboxone während der Schwangerschaft, insbesondere gegen Ende der Schwangerschaft, kann zu Entzugssymptomen und Atemproblemen beim Neugeborenen führen. Dies ist auch noch einige Tage nach der Geburt möglich. Stillen Sie nicht während der Behandlung mit diesem Arzneimittel, da Suboxone in die Muttermilch übergeht. Fragen Sie vor der Einnahme von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat.“ Verkehrstüchtigkeit und das Bedienen von Maschinen 48 Suboxone kann Schläfrigkeit hervorrufen. Dies kann in den ersten Wochen der Behandlung, wenn Ihre Dosis eingestellt wird, öfter auftreten, ist jedoch auch dann möglich, wenn Sie unter der Behandlung mit Suboxone Alkohol trinken oder andere Beruhigungsmittel anwenden. Fahren Sie nicht Auto, bedienen Sie keine Geräte oder Maschinen und üben Sie keine gefährlichen Tätigkeiten aus, bis Sie genau wissen, wie dieses Arzneimittel bei Ihnen wirkt. Suboxone enthält Lactose Wenn Ihnen Ihr Arzt mitgeteilt hat, dass Sie an einer Unverträglichkeit gegenüber bestimmten Zuckern leiden, wenden Sie sich an Ihren Arzt, bevor Sie dieses Arzneimittel anwenden. 3. Wie ist Suboxone anzuwenden? Ihre Anwendung des Arzneimittels wird von Ärzten verordnet und überwacht, die Erfahrung in der Behandlung von Drogenabhängigkeit besitzen. Ihr Arzt bestimmt die für Sie am besten geeignete Dosis. Während Ihrer Behandlung wird der Arzt in Abhängigkeit von Ihrem Ansprechen die Dosierung möglicherweise anpassen. Wenden Sie dieses Arzneimittel immer genau nach der mit Ihrem Arzt oder Apotheker getroffenen Absprache an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind. Einleitung der Behandlung Die empfohlene Initialdosis für Erwachsene und Jugendliche über 15 Jahren beträgt ein bis zwei Suboxone-Tabletten 2 mg/0,5 mg. In Abhängigkeit von Ihrem Bedarf können am 1. Tag zusätzlich eine bis zwei Suboxone-Tabletten 2 mg/0,5 mg verabreicht werden. Vor Einnahme der ersten Suboxone-Dosis müssen eindeutige Anzeichen von Entzug vorliegen. Wenn Ihr Arzt anhand Ihrer Verfassung befindet, dass der Zeitpunkt für den Behandlungsbeginn geeignet ist, erhalten Sie Ihre erste Suboxone-Dosis. • Beginn einer Behandlung mit Suboxone bei bestehender Heroinabhängigkeit Wenn Sie heroinabhängig oder von einem kurzwirksamen Opioid abhängig sind, sollten Sie Ihre Dosis Suboxone bei den ersten Anzeichen von Entzug, frühestens jedoch 6 Stunden nach dem letzten Opioidgebrauch, einnehmen. • Beginn einer Behandlung mit Suboxone bei bestehender Methadonabhängigkeit Wenn Sie Methadon oder ein langwirksames Opioid angewandt haben, sollte die Tagesdosis idealerweise auf 30 mg/Tag herabgesetzt werden, ehe mit einer Suboxone-Therapie begonnen wird. Die erste Dosis Suboxone sollte bei den ersten Entzugserscheinungen, jedoch frühestens 24 Stunden nach Ihrem letzten Methadongebrauch eingenommen werden. Die Einnahme von Suboxone • Nehmen Sie die Dosis einmal täglich ein, indem Sie die Tabletten unter Ihre Zunge legen. • Halten Sie die Tabletten unter der Zunge, bis sie sich vollständig aufgelöst haben. Dies kann 5­10 Minuten dauern. • Kauen oder verschlucken Sie die Tabletten nicht, da das Arzneitmittel dann nicht wirkt und Entzugssymptome auftreten können. 49 • Nehmen Sie keine Speisen oder Getränke zu sich, bis sich die Tabletten vollständig aufgelöst haben. Dosisanpassung und Erhaltungstherapie: Nach Therapiebeginn kann der Arzt im Laufe der folgenden Tage Ihre Suboxone-Dosis an Ihren Bedarf anpassen. Wenn Sie den Eindruck haben, dass die Wirkung von Suboxone zu stark oder zu schwach ist, sprechen Sie bitte mit Ihrem Arzt oder Apotheker, Die maximale Tagesdosis beträgt 24 mg (das entspricht drei Tabletten Suboxone 8 mg/2 mg, wenn der Patient stabil eingestellt ist). Nachdem Sie eine Zeit lang erfolgreich behandelt wurden, werden Sie mit Ihrem Arzt möglicherweise vereinbaren, die Dosis schrittweise auf eine niedrigere Erhaltungsdosis herabzusetzen. Behandlungsabbruch In Abhängigkeit von Ihrer Verfassung kann die Suboxone-Dosis unter sorgfältiger ärztlicher Überwachung weiter reduziert werden, bis die Therapie schließlich beendet werden kann. Ohne vorherige Zustimmung Ihres behandelnden Arztes dürfen Sie die Behandlung auf keine Weise ändern oder abbrechen. Wenn Sie eine größere Menge von Suboxone eingenommen haben, als Sie sollten Wenn Sie oder eine andere Person eine zu hohe Dosis dieses Arzneimittels eingenommen haben, müssen Sie sich sofort zur Behandlung in eine Notaufnahme oder Klinik begeben bzw. dorthin gebracht werden, da eine Überdosierung mit Suboxone schwerwiegende und lebensbedrohliche Atemprobleme verursachen kann. Symptome einer Überdosierung können z. B. sein: Gefühl von Schläfrigkeit und Koordinationsprobleme mit verlangsamten Reflexen, verschwommenem Sehen und/oder undeutliche Sprache. Sie können möglicherweise nicht klar denken und Ihre Atmung kann deutlich langsamer sein, als das sonst bei Ihnen der Fall ist.“ Wenn Sie die Einnahme von Suboxone vergessen haben Informieren Sie baldmöglichst Ihren Arzt, wenn Sie eine Einnahme vergessen haben. Wenn Sie die Einnahme von Suboxone abbrechen Ohne vorherige Zustimmung Ihres behandelnden Arztes dürfen Sie die Behandlung auf keine Weise ändern oder abbrechen. Ein plötzlicher Abbruch der Behandlung kann zu Entzugssymptomen führen. Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker. Entnahme der Tablette aus der Blisterpackung 1 – Trennen Sie ein einzelnes Segment entlang der perforierten Linie von der Blisterpackung ab. 2 – Heben Sie die Versiegelung an der Ecke an und entfernen Sie dann die Folienabdeckung auf der Rückseite, um die Tablette zu entnehmen. 50 Falls die Blisterpackung beschädigt ist, entsorgen Sie die Tablette 4. Welche Nebenwirkungen sind möglich? Wie alle Arzneimittel kann Suboxone Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Informieren Sie umgehend Ihren Arzt bzw. lassen Sie sich sofort notfallmäßig versorgen, wenn folgende seltene Nebenwirkungen bei Ihnen auftreten: • Schwellung von Gesicht, Lippen, Zunge oder Hals, wodurch Schluck- oder Atembeschwerden auftreten können, schwerer Hautausschlag/Nesselsucht. Dies könnten Anzeichen einer lebensbedrohlichen allergischen Reaktion sein. • Gefühl von Schläfrigkeit und Koordinationsstörungen, verschwommenes Sehen, undeutliche Sprache, beeinträchtigtes, unklares Denken, oder Ihre Atmung ist deutlich langsamer, als das sonst bei Ihnen der Fall ist. Informieren Sie Ihren Arzt auch unverzüglich, wenn Sie an folgenden seltenen Nebenwirkungen leiden: • starke Müdigkeit, Juckreiz mit Gelbfärbung der Haut oder der Augen. Dies könnten Symptome einer Leberschädigung sein. • wenn Sie Dinge sehen oder hören, die in Wirklichkeit nicht da sind (Halluzinationen). Nebenwirkungen im Zusammenhang mit Suboxone Sehr häufige Nebenwirkungen (können bei mehr als 1 von 10 Behandelten auftreten): Insomnie (Schlaflosigkeit), Obstipation, Übelkeit, Schwitzen, Kopfschmerzen, Arzneimittelentzugssyndrom Häufige Nebenwirkungen (können bei bis zu 1 von 10 Behandelten auftreten): Gewichtsverlust, Schwellung (der Hände und der Füße), Müdigkeit, Schläfrigkeit , Angstgefühl, Nervosität, Kribbeln, Depressionen, verminderte Libido, erhöhte Muskelspannung, anomales Denken, vermehrte Tränenflüssigkeit (tränende Augen) oder andere Tränenflussstörungen, verschwommenes Sehen, Hitzegefühl, erhöhter Blutdruck, Migräne, laufende Nase, rauer Hals und Schmerzen beim Schlucken, verstärkter Husten, Magenverstimmung oder andere Magenprobleme, Diarrhoe, Leberfunktionsstörung, Appetitlosigkeit, Flatulenz, Erbrechen, Hautausschlag, Juckreiz, Nesselsucht, Schmerzen, Gelenkschmerzen, Muskelschmerzen, Krämpfe in den Beinen (Muskelkrampf), Schwierigkeiten, eine Erektion zu bekommen oder zu halten, Anomalie des Urins, Bauchschmerzen, Rückenschmerzen, Schwäche, Infektionen, Schüttelfrost, Schmerzen im Brustkorb, Fieber, grippeähnliche Symptome, allgemeines Unwohlsein, versehentliche Verletzungen aufgrund verringerter Aufmerksamkeit oder Koordination, Ohnmacht und Schwindel, Blutdruckabfall beim Aufstehen aus dem Sitzen oder dem Liegen. Gelegentliche Nebenwirkungen (können bei bis zu 1 von 100 Behandelten auftreten): Schwellung der Drüsen (Lymphknoten), Agitiertheit, Zittern (Tremor), abnorme Träume, übermäßige Muskelaktivität, Depersonalisation (Entfremdungsgefühl), Arzneimittelabhängigkeit, Amnesie (Gedächtnisstörungen), Interessenverlust, übertriebenes Gefühl des Wohlbefindens, Konvulsion (Anfälle), Sprachstörungen, kleine Pupillen, Probleme beim Wasserlassen, Augenentzündungen oder -infektionen, beschleunigter oder verlangsamter Herzschlag, niedriger Blutdruck, Palpitationen, Myokardinfarkt (Herzanfall), Brustenge, Kurzatmigkeit, Asthma, Gähnen, Schmerzen und wunde Stellen im Mund, Zungenverfärbung, Akne, Hautknoten, Haarausfall, trockene oder schuppige Haut, Gelenkentzündungen, Harnwegsinfektion, abnorme Blutbefunde, Blut im Urin, anomale Ejakulation, Menstruationsoder Vaginalprobleme, Nierensteine, Wärme- oder Kälteempfindlichkeit, Hitzschlag, Feindseligkeit. Seltene Nebenwirkungen (können bei bis zu 1 von 1.000 Behandelten auftreten): Verlangsamte Atmung oder Atemnot, Leberschädigung mit oder ohne Gelbsucht, 51 Halluzinationen, Schwellung von Gesicht und Hals oder lebensbedrohliche allergische Reaktionen. Nicht bekannt (Häufigkeit auf Grundlager der verfügbaren Daten nicht abschätzbar): Plötzlich auftretendes Entzugssyndrom in Folge einer zu frühen Anwendung von Suboxone nach dem Gebrauch illegaler Opioide, Arzneimittelentzugssyndrom bei Neugeborenen. Bei einer missbräuchlichen Anwendung dieses Arzneimittels mittels Injektion kann es zu Entzugssymptomen, Infektionen, anderen Hautreaktionen und potentiell schweren Leberproblemen kommen (siehe Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“). Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker. Meldung von Nebenwirkungen Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.Sie können Nebenwirkungen auch direkt über das in Anhang V aufgeführte nationale Meldesystem anzeigen.Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden. 5. Wie ist Suboxone aufzubewahren? Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. Suboxone kann für Personen von Interesse sein, die mit verschreibungspflichtigen Arzneimitteln Missbrauch betreiben. Daher sollte es diebstahlsicher aufbewahrt werden. Bewahren Sie dieses Arzneimittel für Kinder und andere Personen in Ihrem Haushalt unzugänglich auf. Buprenorphin kann bei Kindern und nicht abhängigen Personen bei versehentlicher oder absichtlicher Einnahme zu einer schweren, möglicherweise tödlichen Atemdepression führen. Bewahren Sie die Blisterpackung an einem sicheren Ort auf. Öffnen Sie die Blisterpackung nie im Voraus. Nehmen Sie dieses Arzneimittel nie vor Kindern ein. Bei versehentlicher Einnahme oder Verdacht auf Einnahme ist umgehend ein Notdienst zu verständigen. Sie dürfen Suboxone nach dem auf dem Umkarton angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats. Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft die Umwelt zu schützen. 6. Inhalt der Packung und weitere Informationen Was Suboxone enthält - Die Wirkstoffe sind Buprenorphin und Naloxon. Eine Sublingualtablette Suboxone 2 mg/0,5 mg enthält 2 mg Buprenorphin (als Hydrochlorid) und 0,5 mg Naloxon (als Hydrochlorid-Dihydrat). Die sonstigen Bestandteile sind Lactose-Monohydrat, Mannitol (Ph.Eur.), Maisstärke, Povidon K30, wasserfreie Citronensäure, Natriumcitrat, Magnesiumstearat (Ph.Eur.), Acesulfam-Kalium und natürliches Citronen- und Limonen-Aroma. 52 Wie Suboxone aussieht und Inhalt der Packung Suboxone-Sublingualtabletten 2 mg/0,5 mg sind weiße, sechseckige, bikonvexe, 6,5 mm große Tabletten mit einem eingeprägten Schwert-Logo auf der einen Seite und der Einprägung „N2“ (2 mg) auf der anderen Seite. Abgepackt in Packungen mit 7 bzw. 28 Tabletten Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. Pharmazeutischer Unternehmer und Hersteller Pharmazeutischer Unternehmer: RB Pharmaceuticals Limited 103-105 Bath Road Slough Berkshire SL1 3UH Vereinigtes Königreich Tel. + 800 270 81 901 Hersteller: Reckitt Benckiser Healthcare (UK) Ltd, Dansom Lane, Hull, East Yorkshire HU8 7DS, Vereinigtes Königreich. Falls weitere Informationen über das Arzneimittel gewünscht werden, setzen Sie sich bitte mit dem Pharmazeutischen Unternehmer in Verbindung. België/Belgique/Belgien, България, Česká republika, Danmark, Deutschland, Eesti, Ελλάδα, España, France, Hrvatska, Ireland, Ísland, Italia, Κύπρος, Latvija, Lietuva, Luxembourg/Luxemburg, Magyarország, Malta, Nederland, Norge, Österreich, Polska, Portugal, România, Slovenija, Slovenská republika, Suomi/Finland, Sverige, United Kingdom. RB Pharmaceuticals Limited Tel. +800 270 81 901 (Diese Telefonnummer gilt für den gesamten europäischen Raum.) E-Mail: [email protected] Diese Gebrauchsinformation wurde zuletzt überarbeitet im Ausführliche Informationen zu diesem Arzneimittel sind auf der Website der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. 53 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Suboxone 8 mg/2 mg Sublingualtabletten Buprenorphin/Naloxon Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. • Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. • Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker. • Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie. • Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker. Siehe Abschnitt 4. Was in dieser Packungsbeilage steht: 1. Was ist Suboxone und wofür wird es angewendet? 2. Was sollten Sie vor der Anwendung von Suboxone beachten? 3. Wie ist Suboxone anzuwenden? 4. Welche Nebenwirkungen sind möglich? 5 Wie ist Suboxone aufzubewahren 6. Inhalt der Packung und weitere Informationen 1. Was ist Suboxone und wofür wird es angewendet? Suboxone ist zur Behandlung der Abhängigkeit von Opioiden (Narkotika), z. B. Heroin oder Morphium, bei Drogenabhängigen bestimmt, die einer Suchtbehandlung zugestimmt haben. Suboxone ist zur Behandlung von Erwachsenen und Jugendlichen über 15 Jahren bestimmt, die gleichzeitig medizinisch, sozial und psychotherapeutisch betreut werden. 2. Was sollten Sie vor der Anwendung von Suboxone beachten ? Suboxone darf nicht angewendet werden, • wenn Sie allergisch (überempfindlich) gegen Buprenorphin, Naloxon oder einen der sonstigen Bestandteile dieses Arzneimittels sind (siehe Abschnitt 6). • wenn Sie schwere Atemprobleme haben. • wenn Sie schwere Leberprobleme haben. • wenn Sie stark alkoholisiert sind oder alkoholbedingt an Zittern, starkem Schwitzen, Angstzuständen, Verwirrtheit oder Halluzinationen leiden. • Wenn Sie Naltrexon oder Nalmefen zur Behandlung von Alkohol- oder Opioid-Abhängigkeit einnehmen. Warnhinweise und Vorsichtsmaßnahmen Bitte sprechen Sie mit Ihrem Arzt bevor Sie Suboxone einnehmen, wenn: • bei Ihnen Asthma bronchiale oder sonstige Atemprobleme bestehen. • Lebererkrankungen wie Hepatitis vorliegen. • Sie niedrigen Blutdruck haben. • Sie vor Kurzem an einer Kopfverletzung oder Erkrankungen des Gehirns litten. • Sie an Erkrankungen der Harnwege (bei Männern insbesondere in Zusammenhang mit einer Prostatavergrößerung) leiden. 54 • • • eine Nierenerkrankung vorliegt. Sie Schilddrüsenprobleme haben. eine Erkrankung der Nebennierenrinde vorliegt (z. B. Morbus Addison). Warnhinweise und Vorsichtsmaßnahmen: • Nicht bestimmungsgemäßer Gebrauch und Missbrauch Dieses Arzneimittel kann für Personen von Interesse sein, die mit verschreibungspflichtigen Arzneimitteln Missbrauch betreiben. Daher sollte es diebstahlsicher aufbewahrt werden. Geben Sie dieses Arzneimittel nicht an Dritte weiter. Es kann bei anderen Menschen zum Tode führen oder diesen anderweitig schaden. • Atemprobleme Einige Menschen starben infolge respiratorischer Insuffizienz (Atemstillstand), weil sie dieses Arzneimittel missbräuchlich oder zusammen mit anderen, das zentrale Nervensystem dämpfenden Substanzen, wie z. B. Alkohol, Benzodiazepinen (Tranquilizern) oder anderen Opioiden, angewendet haben. • Abhängigkeit Dieses Arzneimittel kann zur Abhängigkeit führen. • Entzugssymptome Dieses Arzneimittel kann Entzugssymptome hervorrufen, wenn Sie es früher als sechs Stunden nach Anwendung eines kurzwirksamen Opioids (z. B. Morphin, Heroin) oder früher als 24 Stunden nach Anwendung eines langwirksamen Opioids, z. B. Methadon, anwenden. Suboxone kann auch dann Entzugssymptome hervorrufen, wenn Sie es plötzlich absetzen. • Leberschäden Fälle von Leberschäden wurden berichtet, insbesondere in Zusammenhang mit einer missbräuchlichen Anwendung von Suboxone. Diese Schädigungen könnten auf Virusinfektionen (chronische Hepatitis C), Alkoholmissbrauch, Anorexie oder Arzneimittel zurückzuführen sein (siehe Abschnitt 4). Ihr Arzt kann regelmäßige Blutuntersuchungen durchführen, um den Zustand Ihrer Leber zu überwachen. Informieren Sie Ihren Arzt vor Behandlungsbeginn mit Suboxone, falls Sie Leberprobleme haben. • Blutdruck Bei Anwendung dieses Arzneimittels kann es zu einem plötzlichen Blutdruckabfall kommen, der Schwindel hervorruft, wenn Sie plötzlich aus dem Sitzen oder Liegen aufstehen. • Diagnose nicht suchtassoziierter Erkrankungen Dieses Arzneimittel kann Schmerzsymptome verschleiern, die für die Diagnose bestimmter Erkrankungen von Bedeutung sein könnten. Vergessen Sie nicht, Ihren Arzt zu informieren, wenn Sie dieses Arzneimittel anwenden. Anwendung von Suboxone zusammen mit anderen Arzneimitteln Bei Anwendung von Suboxone zusammen mit bestimmten Arzneimitteln könnten die Nebenwirkungen von Suboxone verstärkt und manchmal sehr schwere Reaktionen ausgelöst werden. Sprechen Sie bitte mit Ihrem Arzt, bevor Sie Suboxone zusammen mit anderen, insbesondere den folgenden Medikamenten, anwenden: • Benzodiazepine (die zur Behandlung von Angstzuständen oder Schlafstörungen eingesetzt werden) wie z. B. Diazepam, Temazepam, Alprazolam. Ihr Arzt wird Ihnen die korrekte Dosis verschreiben. Die Einnahme der falschen Dosis Benzodiazepine kann zum Tod durch respiratorische Insuffizienz (Atemstillstand) führen. 55 • Andere Arzneimittel, die Sie möglicherweise schläfrig machen und die zur Behandlung von Krankheiten wie Angstzuständen, Schlaflosigkeit, Konvulsionen/Krampfanfällen, Schmerzen eingesetzt werden. Diese Art von Medikamenten setzt Ihre Aufmerksamkeit herab und erschwert das Führen von Fahrzeugen sowie das Bedienen von Maschinen. Sie können auch zu einer Depression des Zentralnervensystems führen, was sehr schwerwiegend ist. Unten finden Sie eine Auflistung dieser Art von Arzneimitteln: ­ ­ andere opioidhaltige Arzneimittel wie Methadon, bestimmte Schmerzmittel und Hustenblocker Antidepressiva (zur Behandlung von Depressionen), z. B. Isocarboxazid, Phenelzin, Selegelin, Tranylcypromin und Valproat, können die Wirkungen dieses Arzneimittels verstärken. sedative Hı-Rezeptorantagonisten (zur Behandlung allergischer Reaktionen), z. B. Diphenhydramin und Chlorphenamin. Barbiturate (die als Schlaf- oder Beruhigungsmittel eingesetzt werden), z. B. Phenobarbital, Secobarbital Tranquilizer (die als Schlaf- oder Beruhigungsmittel eingesetzt werden), z. B. Chloralhydrat. ­ ­ ­ • • • • Clonidin (zur Behandlung von Bluthochdruck) kann die Wirkungen dieses Arzneimittels verstärken. Antiretrovirale Arzneimittel (zur Behandlung von AIDS), z. B. Ritonavir, Nelfinavir, und Indinavir, können die Wirkungen dieses Arzneimittels verstärken Bestimmte Antimykotika (zur Behandlung von Pilzinfektionen), z. B. Ketoconazol, Itraconazol und bestimmte Antibiotika, können die Wirkungen dieses Arzneimittels verstärken. Bestimmte Arzneimittel können die Wirkung von Suboxone abschwächen. Dies betrifft u. a. Arzneimittel zur Behandlung von Epilepsie (z. B. Carbamazepin oder Phenytoin) und Arzneimittel zur Behandlung von Tuberkulose (Rifampicin). • Naltrexon und Nalmefen können die therapeutische Wirkung von Suboxone blockieren. Sie dürfen nicht gleichzeitig mit Suboxone eingenommen werden, um ein plötzliches Auftreten lang anhaltender und starker Entzugserscheinungen zu vermeiden. Um den größtmöglichen Nutzen aus der Behandlung mit Suboxone zu ziehen, müssen Sie Ihren Arzt über alle Arzneimittel informieren, die Sie anwenden, einschließlich Alkohol, alkoholhaltiger Arzneimittel, Straßendrogen sowie aller verschreibungspflichtigen Arzneimittel, die Sie anwenden, jedoch nicht von Ihrem Arzt verordnet wurden. Bei Anwendung von Suboxone mit Nahurngsmitteln, Getränken und Alkohol Die Einnahme von Suboxone mit Alkohol kann die Schläfrigkeit verstärken und das Risiko respiratorischer Insuffizienz erhöhen. Wenden Sie Suboxone nicht zusammen mit Alkohol an. Nehmen Sie erst dann Speisen und Getränke zu sich, wenn sich die Tablette vollständig aufgelöst hat. Schwangerschaft und Stillzeit Die Risiken der Einnahme von Suboxone durch schwangere Frauen sind nicht bekannt. Informieren Sie Ihren Arzt, wenn Sie schwanger sind oder beabsichtigen, schwanger zu werden. Ihr Arzt wird entscheiden, ob Ihre Behandlung mit einer alternativen Medikation fortgeführt werden sollte. Dies ist auch noch einige Tage nach der Geburt möglich. Die Anwendung von Arzneimitteln wie Suboxone während der Schwangerschaft, insbesondere gegen Ende der Schwangerschaft, kann zu Entzugssymptomen und Atemproblemen beim Neugeborenen führen. Stillen Sie nicht während der Behandlung mit diesem Arzneimittel, da Suboxone in die Muttermilch übergeht. Fragen Sie vor der Einnahme von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat.“ 56 Verkehrstüchtigkeit und das Bedienen von Maschinen Suboxone kann Schläfrigkeit hervorrufen. Dies kann in den ersten Wochen der Behandlung, wenn Ihre Dosis eingestellt wird, öfter auftreten, ist jedoch auch dann möglich, wenn Sie unter der Behandlung mit Suboxone Alkohol trinken oder andere Beruhigungsmittel anwenden. Fahren Sie nicht Auto, bedienen Sie keine Geräte oder Maschinen und üben Sie keine gefährlichen Tätigkeiten aus, bis Sie genau wissen, wie dieses Arzneimittel bei Ihnen wirkt. Suboxone enthält Lactose Wenn Ihnen Ihr Arzt mitgeteilt hat, dass Sie an einer Unverträglichkeit gegenüber bestimmten Zuckern leiden, wenden Sie sich an Ihren Arzt, bevor Sie dieses Arzneimittel anwenden. 3. Wie ist Suboxone anzuwenden? Ihre Anwendung des Arzneimittels wird von Ärzten verordnet und überwacht, die Erfahrung in der Behandlung von Drogenabhängigkeit besitzen. Ihr Arzt bestimmt die für Sie am besten geeignete Dosis. Während Ihrer Behandlung wird der Arzt in Abhängigkeit von Ihrem Ansprechen die Dosierung möglicherweise anpassen. Wenden Sie dieses Arzneimittel immer genau nach der mit Ihrem Arzt oder Apotheker getroffenen Absprache an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind. Einleitung der Behandlung Die empfohlene Initialdosis für Erwachsene und Jugendliche über 15 Jahren beträgt ein bis zwei Suboxone-Tabletten 2 mg/0,5 mg. In Abhängigkeit von Ihrem Bedarf können am 1. Tag zusätzlich eine bis zwei Suboxone-Tabletten 2 mg/0,5 mg verabreicht werden. Vor Einnahme der ersten Suboxone-Dosis müssen eindeutige Anzeichen von Entzug vorliegen. Wenn Ihr Arzt anhand Ihrer Verfassung befindet, dass der Zeitpunkt für den Behandlungsbeginn geeignet ist, erhalten Sie Ihre erste Suboxone-Dosis. • Beginn einer Behandlung mit Suboxone bei bestehender Heroinabhängigkeit Wenn Sie heroinabhängig oder von einem kurzwirksamen Opioid abhängig sind, sollten Sie Ihre Dosis Suboxone bei den ersten Anzeichen von Entzug, frühestens jedoch 6 Stunden nach dem letzten Opioidgebrauch, einnehmen. • Beginn einer Behandlung mit Suboxone bei bestehender Methadonabhängigkeit Wenn Sie Methadon oder ein langwirksames Opioid angewandt haben, sollte die Tagesdosis idealerweise auf 30 mg/Tag herabgesetzt werden, ehe mit einer Suboxone-Therapie begonnen wird. Die erste Dosis Suboxone sollte bei den ersten Entzugserscheinungen, jedoch frühestens 24 Stunden nach Ihrem letzten Methadongebrauch eingenommen werden. Die Einnahme von Suboxone • Nehmen Sie die Dosis einmal täglich ein, indem Sie die Tabletten unter Ihre Zunge legen. • Halten Sie die Tabletten unter der Zunge, bis sie sich vollständig aufgelöst haben. Dies kann 5­10 Minuten dauern. • Kauen oder verschlucken Sie die Tabletten nicht, da das Arzneimittel dann nicht wirkt und Entzugssymptome auftreten können. 57 • Nehmen Sie erst dann Speisen und Getränke zu sich, wenn sich die Tablette vollständig aufgelöst hat. Dosisanpassung und Erhaltungstherapie: Nach Therapiebeginn kann der Arzt im Laufe der folgenden Tage Ihre Suboxone-Dosis an Ihren Bedarf anpassen. Wenn Sie den Eindruck haben, dass die Wirkung von Suboxone zu stark oder zu schwach ist, sprechen Sie bitte mit Ihrem Arzt oder Apotheker. Die maximale Tagesdosis beträgt 24 mg (das entspricht drei Tabletten Suboxone 8 mg/2 mg, wenn der Patient stabil eingestellt ist). Nachdem Sie eine Zeit lang erfolgreich behandelt wurden, werden Sie mit Ihrem Arzt möglicherweise vereinbaren, die Dosis schrittweise auf eine niedrigere Erhaltungsdosis herabzusetzen. Behandlungsabbruch In Abhängigkeit von Ihrer Verfassung kann die Suboxone-Dosis unter sorgfältiger ärztlicher Überwachung weiter reduziert werden, bis die Therapie schließlich beendet werden kann. Ohne vorherige Zustimmung Ihres behandelnden Arztes dürfen Sie die Behandlung auf keine Weise ändern oder abbrechen. Wenn Sie eine größere Menge von Suboxone eingenommen haben, als Sie sollten Wenn Sie oder eine andere Person eine zu hohe Dosis dieses Arzneimittels eingenommen haben, müssen Sie sich sofort zur Behandlung in eine Notaufnahme oder Klinik begeben bzw. dorthin gebracht werden, da eine Überdosierung mit Suboxone schwerwiegende und lebensbedrohliche Atemprobleme verursachen kann. Symptome einer Überdosierung können z. B. sein: Gefühl von Schläfrigkeit und Koordinationsprobleme mit verlangsamten Reflexen, verschwommenem Sehen und/oder undeutliche Sprache. Sie können möglicherweise nicht klar denken und Ihre Atmung kann deutlich langsamer sein, als das sonst bei Ihnen der Fall ist.“ Wenn Sie die Einnahme von Suboxone vergessen haben Informieren Sie baldmöglichst Ihren Arzt, wenn Sie eine Einnahme vergessen haben. Wenn Sie die Einnahme von Suboxone abbrechen Ohne vorherige Zustimmung Ihres behandelnden Arztes dürfen Sie die Behandlung auf keine Weise ändern oder abbrechen. Ein plötzlicher Abbruch der Behandlung kann zu Entzugssymptomen führen. Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker. Entnahme der Tablette aus der Blisterpackung 1 – Trennen Sie ein einzelnes Segment entlang der perforierten Linie von der Blisterpackung ab. 2 – Heben Sie die Versiegelung an der Ecke an und entfernen Sie dann die Folienabdeckung auf der Rückseite, um die Tablette zu entnehmen. 58 Falls die Blisterpackung beschädigt ist, entsorgen Sie die Tablette. 4. Welche Nebenwirkungen sind möglich? Wie alle Arzneimittel kann Suboxone Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Informieren Sie umgehend Ihren Arzt bzw. lassen Sie sich sofort notfallmäßig versorgen, wenn folgende seltene Nebenwirkungen bei Ihnen auftreten: • Schwellung von Gesicht, Lippen, Zunge oder Hals, wodurch Schluck- oder Atembeschwerden auftreten können, schwerer Hautausschlag/Nesselsucht. Dies könnten Anzeichen einer lebensbedrohlichen allergischen Reaktion sein. • Gefühl von Schläfrigkeit und Koordinationsstörungen, verschwommenes Sehen, undeutliche Sprache, beeinträchtigtes, unklares Denken oder Ihre Atmung ist deutlich langsamer, als das sonst bei Ihnen der Fall ist. Informieren Sie Ihren Arzt auch unverzüglich, wenn Sie an folgenden seltenen Nebenwirkungen leiden: • starke Müdigkeit, Juckreiz mit Gelbfärbung der Haut oder der Augen. Dies könnten Symptome einer Leberschädigung sein. • wenn Sie Dinge sehen oder hören, die in Wirklichkeit nicht da sind (Halluzinationen). Nebenwirkungen im Zusammenhang mit Suboxone Sehr häufige Nebenwirkungen (kann bei mehr als 1 von 10 Behandelten auftreten): Insomnie (Schlaflosigkeit), Obstipation, Übelkeit, Schwitzen, Kopfschmerzen, Arzneimittelentzugssyndrom Häufige Nebenwirkungen (kann bei bis zu 1 von 10 Behandelten auftreten): Gewichtsverlust, Schwellung (der Hände und der Füße), Müdigkeit, Schläfrigkeit, Angstgefühl, Nervosität, Kribbeln, Depressionen, verminderte Libido, erhöhte Muskelspannung, anomales Denken, vermehrte Tränenflüssigkeit (tränende Augen) oder andere Tränenflussstörungen, verschwommenes Sehen, Hitzegefühl, erhöhter Blutdruck, Migräne, laufende Nase, rauer Hals und Schmerzen beim Schlucken, verstärkter Husten, Magenverstimmung oder andere Magenprobleme, Diarrhoe, Leberfunktionsstörung, Appetitlosigkeit, Flatulenz, Erbrechen, Hautausschlag, Juckreiz, Nesselsucht, Schmerzen, Gelenkschmerzen, Muskelschmerzen, Krämpfe in den Beinen (Muskelkrampf), Schwierigkeiten, eine Erektion zu bekommen oder zu halten, Anomalie des Urins, Bauchschmerzen, Rückenschmerzen, Schwäche, Infektionen, Schüttelfrost, Schmerzen im Brustkorb, Fieber, grippeähnliche Symptome, allgemeines Unwohlsein, versehentliche Verletzungen aufgrund verringerter Aufmerksamkeit oder Koordination, Ohnmacht und Schwindel, Blutdruckabfall beim Aufstehen aus dem Sitzen oder dem Liegen. Gelegentliche Nebenwirkungen (kann bei bis zu 1 von 100 Behandelten auftreten): Schwellung der Drüsen (Lymphknoten), Agitiertheit, Zittern (Tremor), abnorme Träume, übermäßige Muskelaktivität, Depersonalisation (Entfremdungsgefühl), Arzneimittelabhängigkeit, Amnesie (Gedächtnisstörungen), Interessenverlust, übertriebenes Gefühl des Wohlbefindens, Konvulsion (Anfälle), Sprachstörungen, kleine Pupillen, Probleme beim Wasserlassen, Augenentzündungen oder -infektionen, beschleunigter oder verlangsamter Herzschlag, niedriger Blutdruck, Palpitationen, Myokardinfarkt (Herzanfall), Brustenge, Kurzatmigkeit, Asthma, Gähnen, Schmerzen und wunde Stellen im Mund, Zungenverfärbung, Akne, Hautknoten, Haarausfall, trockene oder schuppige Haut, Gelenkentzündungen, Harnwegsinfektion, abnorme Blutbefunde, Blut im Urin, anomale Ejakulation, Menstruationsoder Vaginalprobleme, Nierensteine, Wärme- oder Kälteempfindlichkeit, Hitzschlag, Feindseligkeit. Seltene Nebenwirkungen(kann bei bis zu 1 von 1.000 Behandelten auftreten): 59 Verlangsamte Atmung oder Atemnot, Leberschädigung mit oder ohne Gelbsucht, Halluzinationen, Schwellung von Gesicht und Hals oder lebensbedrohliche allergische Reaktionen. Nicht bekannt(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar): Plötzlich auftretendes Entzugssyndrom in Folge einer zu frühen Anwendung von Suboxone nach dem Gebrauch illegaler Opioide, Arzneimittelentzugssyndrom bei Neugeborenen. Bei einer missbräuchlichen Anwendung dieses Arzneimittels mittels Injektion kann es zu Entzugssymptomen, Infektionen, anderen Hautreaktionen und potentiell schweren Leberproblemen kommen (siehe Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“). Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker. Meldung von Nebenwirkungen Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.Sie können Nebenwirkungen auch direkt über das in Anhang V aufgeführte nationale Meldesystem anzeigen.Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden. 5. Wie ist Suboxone aufzubewahren? Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. Suboxone kann für Personen von Interesse sein, die mit verschreibungspflichtigen Arzneimitteln Missbrauch betreiben. Daher sollte es diebstahlsicher aufbewahrt werden. Bewahren Sie dieses Arzneimittel für Kinder und andere Personen in Ihrem Haushalt unzugänglichauf. Buprenorphin kann bei Kindern und nicht abhängigen Personen bei versehentlicher oder absichtlicher Einnahme zu einer schweren, möglicherweise tödlichen Atemdepression führen. Bewahren Sie die Blisterpackung an einem sicheren Ort auf. Öffnen Sie die Blisterpackung nie im Voraus. Nehmen Sie dieses Arzneimittel nie vor Kindern ein. Bei versehentlicher Einnahme oder Verdacht auf Einnahme ist umgehend ein Notdienst zu verständigen. Sie dürfen Suboxone nach dem auf dem Umkarton angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats. Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft die Umwelt zu schützen. 6. Inhalt der Packung und weitere Informationen Was Suboxone enthält - Die Wirkstoffe sind Buprenorphin und Naloxon. Eine Sublingualtablette Suboxone 8 mg/2 mg enthält 8 mg Buprenorphin (als Hydrochlorid) und 2 mg Naloxon (als Hydrochlorid-Dihydrat). 60 - Die sonstigen Bestandteile sind Lactose-Monohydrat, Mannitol (Ph.Eur.), Maisstärke, Povidon K30, wasserfreie Citronensäure, Natriumcitrat, Magnesiumstearat (Ph.Eur.), Acesulfam-Kalium und natürliches Citronen- und Limonen-Aroma. Wie Suboxone aussieht und Inhalt der Packung Suboxone-Sublingualtabletten 8 mg/2 mg sind weiße, sechseckige, bikonvexe, 11 mm große Tabletten mit einem eingeprägten Schwert-Logo auf der einen Seite und der Einprägung „N8“ (8 mg) auf der anderen Seite. Abgepackt in Packungen mit 7 bzw. 28 Tabletten Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. Pharmazeutischer Unternehmer und Hersteller Pharmazeutischer Unternehmer: RB Pharmaceuticals Limited 103-105 Bath Road Slough Berkshire SL1 3UH Vereinigtes Königreich Tel. + 800 270 81 901 Hersteller: Reckitt Benckiser Healthcare (UK) Ltd, Dansom Lane, Hull, East Yorkshire HU8 7DS, Vereinigtes Königreich. Falls weitere Informationen über das Arzneimittel gewünscht werden, setzen Sie sich bitte mit dem Pharmazeutischen Unternehmer in Verbindung. België/Belgique/Belgien, България, Česká republika, Danmark, Deutschland, Eesti, Ελλάδα, España, France, Hrvatska, Ireland, Ísland, Italia, Κύπρος, Latvija, Lietuva, Luxembourg/Luxemburg, Magyarország, Malta, Nederland, Norge, Österreich, Polska, Portugal, România, Slovenija, Slovenská republika, Suomi/Finland, Sverige, United Kingdom. RB Pharmaceuticals Limited Tel. +800 270 81 901 (Diese Telefonnummer gilt für den gesamten europäischen Raum.) E-Mail: [email protected] Diese Gebrauchsinformation wurde zuletzt überarbeitet im Ausführliche Informationen zu diesem Arzneimittel sind auf der Website der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. 61