Nutzen der molekularen Erregerdiagnostik zur Aufklärung schwerer
Werbung

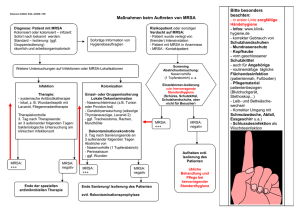
Nutzen der molekularen Erregerdiagnostik zur Aufklärung schwerer Infektionen/Ausbrüche am Beispiel MRSA Birgit Strommenger, PhD Robert Koch Institut, Bereich Wernigerode Incidence of MRSA in German hospitals (results from multicentric studies of Paul Ehrlich Society; Knote et al. 1996; Kresken and Hafner 1996, 1998, 2002; Voss et al. 1994) % % of of strains strains 25 20.3 20 15.2 15 10 8.7 6.0 4.6 2.4 2001 1998 1995 1994 1993 1992 1989 1989 1988 1987 1986 1985 1984 1983 1991 1.7 0.8 1982 1980 1979 0.4 2.6 1981 2.2 1.6 1978 1977 0 1976 1.4 1.9 1990 5 Epidemic MRSA in Central Europe the the "classical" "classical" strains strains (clonal (clonal group group III III of of S. S. aureus) aureus) (mecI (mecI --,, mecRC mecRC --,, mecRB mecRB ++,, mecA mecA ++)) l l northern northern German German Epidemic Epidemic MRSA MRSA PEN, PEN, OXA, OXA, GEN, GEN, ERY, ERY, CLI, CLI, OTE, OTE, SXT, SXT, CIP, CIP, RAM, RAM, (FUS) (FUS) O O Hannover Hannover area area epidemic epidemic MRSA MRSA [kb] [kb] PEN, PEN, OXA, OXA, GEN, GEN, ERY, ERY, CLI, CLI, OTE, OTE, SXT, SXT, CIP CIP ∅ ∅ south-western south-western GermanGermanwestern western Austrian Austrianepidemic epidemic MRSA MRSA 673.7 673.7 PEN, PEN, OXA, OXA, GEN, GEN, ERY, ERY, CLI, CLI, OTE, OTE, SXT, SXT, CIP CIP ** 361.0 361.0 324.0 324.0 282.0 282.0 208.0 208.0 175.0 175.0 135.0 135.0 117.0 117.0 90.0 90.0 36.0 36.0 9.0 9.0 Southern Southern German GermanEpidemic Epidemic MRSA MRSA (mecI-, (mecI-,mecRC-, mecRC-,mecRB+, mecRB+, mecA+) mecA+) PEN, PEN, OXA, OXA, (GEN), (GEN), ERY, ERY, CLI, CLI, (OTE), (OTE), CIP, CIP, SXT SXT the the new new emerging emerging strains strains (mecI (mecI --,, mecRC mecRC ++,, mecRB mecRB ++,, mecA mecA ++)) ss Berlin Berlin epidemic epidemic MRSA MRSA (clonal (clonal group group V) V) PEN, PEN, OXA, OXA, CIP, CIP, (ERY, (ERY, CLI, CLI, GEN) GEN) ⊕ ⊕ Barnim Barnim epidemic epidemic MRSA MRSA (clonal (clonal group group II) II) PEN, PEN, OXA, OXA, CIP, CIP, ERY, ERY, CLI CLI l lO O∅ ∅S S ss ⊕ ⊕ SS SS == S. S. aureus aureus 8325 8325 Regionale Verteilung bestimmter MRSAEpidemiestämme und anderer MRSA in Deutschland im Jahr 2001 + T + SS süddeutscher süddeutscher Epidemiestamm Epidemiestamm T + + +x T T x Berliner Berliner Epidemiestamm Epidemiestamm Hannoverscher Hannoverscher Epidemiestamm Epidemiestamm • + x ++ andere andere MRSA MRSA T + x + + + x T + +T + + + +T + x ++ + + T+ + T x + + + T x T+ + + x • +T + + + +• + + + Tx ++ + T+ x + +T x xT xT • x T ++ xT x T + + Tx + ++ T + xT + x T + x + x T+ x T +T x +x + T x+ x T+ x + T + + T +T x + x + ++ Tx T T + x T +x T x T+ + +T T+ + T T + + + T+ x x ++ + + + x + x x x + + T + + T• + + + T T +T + + T x + Tx T T + +T x + + T x T + +x x + Wiener Wiener Epidemiestamm Epidemiestamm Barnimer Barnimer Epidemiestamm Epidemiestamm Rhein-Hessen Rhein-Hessen Epidemiestamm Epidemiestamm Tx x T x T x +x T+ x T T ++ + +x + + T +T + T + + +T + T+ +x •+ ++ norddeutscher norddeutscher Epidemiestamm Epidemiestamm + + + + + x + + + + • T+ + T data from EARSS Frequencies of MRSA from systemic infections in Europe (EARSS) Strategien zum Zurückdrängen von MRSA - Ignorieren des Problems - Maßnahmen einleiten, wenn Inzidenzdichte > 03. oder 0.75 percentile des Berichtszeitraumes überschritten -aktive, wöchentliche surveillance-Kulturen bei allen Patienten einer Station/ Abteilung oder wenigstens bei Patienten mit Risiko für MRA -Aufnahmescreening für MRSA bei allen Patienten, „Quaratäne“ bis erwiesen negativ oder saniert überwiegend in D Erfordert Schnelle Diagnostik !!! Schnelle Diagnostik auf Besiedlung / Infektionen mit MRSA und Hygienemaßnahmen: - klassische mikrobiologische Diagnostik erfordert 36 – 48 h, d.h. zwei zusätzliche „Übernachtungen“, ~ 360, - € - bei kulturellem Erregernachweis und Schnelldiagnostik auf Vorliegen von MRSA sind 12 – 24 h erforderlich, ~ 180, € - bei molekularem Nachweis direkt aus dem Untersuchungsmaterial entstehen keine „Übernachtungskosten“, Zeitaufwand von < 6 – 8 h ! Materialentnahme Primärkultur 1. Tag Ergebnis der Resistenzbestimmung 2.Tag Pneumonie - Erregerwechsel über die Zeit Pneumokokken Pneumokokken MRSA MRSA Mykoplasmen Mykoplasmen Haemophilus Haemophilus influenzae influenzae multiresistente multiresistente Enterobacteriaceae Enterobacteriaceae Staphylococcus Staphylococcus aureus aureus Pseudomonas Pseudomonas aeruginosa aeruginosa Escherichia Escherichia coli coli Stenotrophomonas Stenotrophomonas maltophilia maltophilia Klebsiella Klebsiella pneumoniae pneumoniae Acinetobacter Acinetobacter baumannii baumannii Tag 5 / 6 / 7 Zeit Ein Wechsel des Antibiotikums bei der Behandlung der Pneumonie im Falle des Vorliegens resistenter Erreger ist mit erhöhter Mortalität verbunden , die schnelle Diagnostik ist wichtig für die Auswahl des richtigen Antibiotikums ! Speziesdiagnostik bei Staphylokokken Bakterielle 16S rRNA Spezies Sequenz S. aureus CGAA CGG G ACG AGA A AGC TTG CTT T CTC T GAT S. epidermidis CGAA CAG ACG AGG AGC TTG CTC CTC T GAC S. capitis CGAA CAG ACG AGG AGC TTG CTC CTC T GAC S. warneri CGAA CAG ATA AGG AGC TTG CTC CTT T GAC S. haemolyticus CGAA CAG ATA AGG AGC TTG CTC CTT T GAC S. gallinarum S. saprohyticus S. xylosus S. cohnii S. haemolyticus S. hominis S. auricularis S. simulans S. carnosus S. condimenti S. piscifermentans S. saccharolyticus S. epidermidis S. capitis S. muscae S. hyicus S. aureus S. intermedius S. schleiferi S. chromogenes S. warneri S. felis S. sciuri S. lentus Phylogenetic Phylogenetic relationship relationship of of staphylococci staphylococci reflected reflected by by the the 16 16 SS rRNA rRNAbased based tree tree Speziesdiagnostik konventionell anhand biochemischer Reaktionen (Enzymnachweis, „Bunte Reihe“) • Metabolisierung v. Kohlehydraten, Alkoholen und org. Säuren • DNase, Koagulase (für S. aureus) molekular anhand speziesspezifischer Sequenzen • 16s rRNA (Sequenzierung) • andere spez. Sequenzen (PCR-Nachweis) für S. aureus z. B. femA, coa, Sau-spezifische Sequenz (Martineau et al.) Unterscheidung S. aureus - Koagulase -negative Koagulase-negative Staphylokokken + – ++ – PCR für: Sau-spez. Sequenz (Martineau et al.) DNase (+ bei S. intermedius) fem (A, B, C) + – (??? bei anderen als S. epidermidis) Schema der Wirkungsweise von β-Laktamantibiotika auf grampositive Bakterien und der Resistenz gegen β-Laktamaseantibiotika Zellwandbausteine mec associated DNA in ANS 46 45 45 kb kb ermA ermA on on Tn554 Tn554 mer mer tet tet IS 257 mec mec Bestimmung der Chemotherapeutikasensibilität Methode: Bestimmung der Empfindlichkeit des Stammes gegenüber Chemotherapeutika Ergebnis:Resistogramm /Antibiogramm Durchführung der Resistenzbestimmung 1. 1. Verdünnungsteste Verdünnungsteste 1.1. 1.1. Reihenverdünnungstest Reihenverdünnungstest 0,25 0,5 1 2 4 8 0 (Kontrolle) Konzentration des Chemother. [µg/ml] 0,25 0,5 1 2 4 8 Ø Kontrolle Vorgang: Vorgang: Beimpfen Beimpfen ↓↓ Bebrüten Bebrüten (16 (16 h, h, 37 37 °C) °C) ↓↓ Ablesen Ablesen MHK = 2 µg/ml MHK = Minimale Hemmhof-Konzentration Phänotypische Methoden Phoenix – Instrument Phänotypische Methoden Phoenix – Panels Phänotypische Methoden Vorteile einer schnellen Bakteriologie Befund gl. Tag (%) MicroScan Nachweiszeit (h) Mortalität (%) Aufenthaltsdauer (d) Kosten ($) Doern, G. et al. 1994 JCM 32: 1757-1762 Gruppe I (über Nacht) 0 19.6 15.3 kein Unterschied 19.256 Gruppe II (gl. Tag) keine Angaben (ca. 70%) 11.3 8.8 kein Unterschied 15.062 VITEK 2 (p<0.0005) Barenfanger K. et al. 1999 JCM 37: 1415-1418 Turnaround Time Gruppe III (währ. Arb.zeit) 60 44.4 9.04 12.6 15.622 Gruppe IV (Val. bis 20:30) 95 38.5 9.16 11.1 13.429 PCR-Prinzip 5‘ 3‘ 5‘ 5‘ 3‘ Ausgangs-DNA (template) Wärme-Denaturierung (72 °C) 3‘ 5‘ 5‘ 3‘ 3‘ 5‘ 5‘ 3‘ 3‘ 5‘ 5‘ 3‘ 3 Anlagern spezifischer primer (annealing; ≤ 55 °C üblicherweise) Synthese der komplementären DNA-Stränge (72 °C) weitere Zyklen mit Denaturierung, Annealing und Synthese führen zu einer Amplifikation des Genabschnitts in vielen Kopien (üblicherweise 30 Zyklen) „Klassische“ PCR zum Nachweis der Oxaillin-Resiszenz (Zeitdauer ausgehend von der Primärkultur: 6 – 8 h) mecA kodierte Oxaillin (Methicillin)-Resistenz bei S. aureus • Wachstum in TSB mit 2 mg/l Oxacillin und 2 % NaCl (Einsaat 107 cfu) • positive PCR für mecA 1,8 kb 1 2 3 1 PCR Produkt 2 AluI-digest des PCR Produktes 3 Mol. Masse-Standard Multiplex-PCR für Resistenzgene bei Staphylococcus aureus Auftrennen der PCR-Produkte in 30 min mittels Kapilarelektrophorese 1500 1500 500 500 300 300 100 100 100 100 50 50 ermC vatA vatB vatC Multiplex II Multiplex II mecA rpoB aacA-aphD ermA Multiplex I mecA ermC rpoB tetK aacA-aphD tetM ermA grlA Multiplex I (Bioanalyzer 7500 von Agilent Techn., Gesamtzeitdauer von Primärkultur: ~ 3 h !) Pfeile kennzeichnen spezifische Banden (Nachweis im Southern Blot). PCR-Produkte: mecA: 532 bp, erm C: 295 bp, rpoB: 271 bp, tetK: 360 bp, gen: 227 bp, tetM: 158 bp, ermA: 215 bp, grlA: 289 bp, vatA: 268 bp, vatB: 136 bp, vatC: 212 bp Array-Technologie - reverser Blot kurze capture probes PCR-Produkte (20 - 24 Nukleotide) ( 100-200 Basenpaare) probe spacer Matrix PCR-Produkte, x markiert (z. B. Fluoreszenz, Digoxigenin) PCR von Resistenzgenen und reverser blot, Makromaßstab Zeitdauer: von der Primärkultur ausgehend ~ 3h, Nachweis direkt aus Originalmaterial befindet sich gegenwärtig in Erprobung PCR PCR + reverser Blot • GenoType® MRSA (HAYN) • amplex Staphyloresist Testkit (BAG) HINWEIS : Bisher erhältliche Makro- und Mikroarrays detizieren mecA und die Species-spezifischen DNS-Sequenzen getrennt voneinander. Deshalb besteht bei Mischkulturen von S.aureus ohne mecA und von oxacilinresistenten KNS (auch hier mecA) die Möglichkeit des falsch positiven MRSA Nachweises, wenn direkt vom klinischen OriginalMaterial ausgegangen wird (Nachtestung aus in vitro Kultur !) Gemeinsamer Nachweis von S.aureus und von mecA (C.Cuny et al. ,Europäisches Patent angemeldet) rechtes inverted repeat begrenzter Polymorphismus bei verschiedenen SCCmec linkes inverted repeat ausgeprägter Polymorhismus bei verschiedenen SCCmec 2 ORFX mecA S.aureus, Chromosom 1 staphylococcal cassette chromosom mec (SCCmec), mindestens 4 verschiedene Typen PCR mit primern 1 und 2, primer 1 erfaßt sowohl SCCmec in einer weitgehend homlogen Sequenz als auch ORFX Prinzip der real time PCR (mit TacMan Polymerase) Zeitdauer für Nachweis von der Pimärkultur ausgehend: ~ 2 h Annealing, Polymerisierung Vorwärtsprimer 5‘ 3‘ 5‘ 3‘ 5‘ Abspaltung TacMan probe R Q Q 3‘ 5‘ 5‘ 3‘ Reverse primer R StrangverdrängungR 5‘ Q Polymerisierung beendet R Q 3‘ 5‘ 5‘ 3‘ 5‘ 3‘ 3‘ 5‘ = Fluorogene Gruppe, deren Anregung durch Q R unterdrückt wird, nach Abspaltung von R fluoresziert Q und zeigt damit eine DNA-Synthese in dem Sequenzbereich an, in dem die TacMan-Probe gebunden hatte. real time PCR ist kostenintensiv: benötigt werden primer und TacMan-probe. Chips sind in aller Munde! ray r a o Micr DN A- Chi ps Oligonu kleotid array te r e i s s i y r a u s t s minia erung sa si i d i r Hyb Hochdu rchsat zmetho de Expres sionsan alysen Dru g D isco very ion t a k i tif n e d i i es z e p S g n u r e i enz u q e S Resi s tenz gend etek Vir tion ule nz gen n det o i t ekt tek e ion D P N S Microarray - Was ist das? Glas-Slides • Amino-modifiziert • Aldehyd-modifiziert • Epoxy-modifiziert • Polylysin-beschichtet Amino-modifiziert Aldehyd-modifiziert DNA (Capture probes) • PCR-Produkte • Oligonukleotide (ggf. NH2-modifiziert) „Spotting“ MicroGrid II, Biorobotics Microarray - Wie geht das? Target DNA/RNA Fluoreszenzlabelling Hybridisierung Microarray mit Capture probes Waschen Reader ArrayWorx, Applied Precision Capture Probes • einheitliche Hybridisierungsbedingungen • optimale Länge für SNP-Detektion Arraydesign Das grundsätzliche Problem bei molekularer Diagnostik direkt vom Untersuchungsmaterial: Mischkulturen - bei ~ 30 % aller Proben aus Bonchialsekreten und Urinproben werden mehrere Erregerspecies isoliert, neben dem eigentlichen Erreger auch Besiedler, z.B. Koagulase-negative Staphylokokken und Enterokoken aus Bronchialsekret. deshalb: - Molekulares „Vorsortieren“ der Erreger durch Immuno-beads (begrenzte Anzahl an Species gleichzeitig separierbar) oder durch Polynukleotid-Sonden, die an r-RNA spezifisch binden Die Realität: Entwicklung von chips für klinisch wichtige Gruppen von Infektionen: Beispiele: • „Intensiv-Therapie chip“: Taxonomie der wichtigsten Erreger der nosokomialen Sepsis und der Beatmungspneumonie – Detektion von: MRSA (einschließl. Resistenzgenen, Gentamicin, Chinolone, Makrolide, Rifampicin) ESBL bei Gram-negativen, Chinolonresistenz Zink-Laktamasen (Carbapeneme) • „Ambulant-erworbene Pneumonie chip“: Taxonomie für St. pneumoniae, Haemophilus spp., Moraxella chattbarolis – Detektion von TEM-Laktamasen, PBPX-Mosaikgenen, mef, ermB, ere. Konsortium im cluster des BMBF-Projektes (Genomik) : Robert Koch Institut Bereich Wernigerode Christa Cuny, Christiane Kettlitz Birgit Strommenger, Guido Werner, Wolfgang Witte Institut für Techn. Biochemie Till Bachmann, Beate RössleUniversität Stuttgart Lorch, Rolf Schmid Robert Bosch Krankenhaus Suttgart Cornelius Knabbe, Milorad Susa Institut f. Mikrobiologie Universität München Kathrin Fichtl, Wolfgang Ludwig