NAHRUNGSMITTEL KREBSTHERAPIEN KOSMETIKA
Werbung

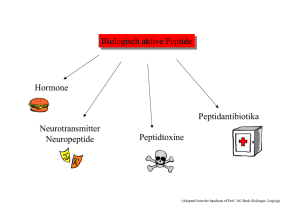
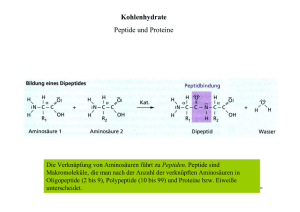
DIE WELT DER PEPTIDE WAS SIND PEPTIDE? Peptide sind Ketten von zwei bis zirka hundert Aminosäuren. Längere Ketten bezeichnet man als Proteine (Eiweissstoffe). Sie sind organische Verbindungen, die in lebenden Organismen aus natürlichen Aminosäuren aufgebaut werden. Ursprünglich aus biologischen Quellen isoliert, werden sie heute auf chemischem Weg synthetisiert. Die biologischen Eigenschaften von Peptiden hängen von der Anzahl der Aminosäuren und von ihrer Position in der Kette ab. Mit lediglich zwanzig natürlichen Aminosäuren ist eine unvorstellbar grosse Zahl von Peptiden möglich, jedes mit anderen physikalischen, chemischen und biologischen Eigenschaften. WO FINDEN PEPTIDE ANWENDUNG? Vor allem werden Peptide als hochaktive und spezifische Wirkstoffe in Medikamenten verwendet. Der Vielfalt ihrer biologischen Funktionen entsprechend werden sie in den verschiedensten Anwendungsgebieten eingesetzt. Krebstherapien, Diabetes und Fettleibigkeit sind drei prominente pharmazeutische Gebiete, in denen mit Peptiden Milliardenumsätze erwirtschaftet werden. Zur Behandlung kardio­ vaskulärer und neurodegenerativer Krankheiten, bei Niereninsuffizienz, als Antibiotika, in Vakzinen und in Arzneimitteln für seltene Krankheiten sind Peptide gefragte Wirkstoffe. WELCHE DARREICHUNGSFORMEN GIBT ES? Da Peptide nach einfacher oraler Verabreichung in der Regel schnell verdaut würden, könnten sie ihre Zielorgane kaum erreichen. Deshalb werden Peptidwirkstoffe meist parenteral verabreicht. Neben der herkömmlichen Injektion kommen vermehrt Depot­ formulierungen mit einer Wirkungsdauer von Tagen bis mehreren Monaten, aber auch Nasalapplikationen zum Einsatz. Sublinguale und transdermale Anwendungen sowie Verabreichung mit Hilfe von Nanopartikeln sind Gegenstand aktueller Forschung und Entwicklung. 4 Bachem Geschäftsbericht 2015 KOSMETIKA Peptidwirkstoffe finden Anwendung in hochwertigen kosmetischen Produkten, beispielsweise gegen altersbedingte Falten. NAHRUNGSMITTEL Der künstliche Süssstoff Aspartam ist ein Dipeptid mit gegenüber Haushalt­ zucker zweihundertfacher Süsskraft. Er spielt in der Diabetologie eine wichtige Rolle. KREBSTHERAPIEN Peptide werden in der Onkologie sowohl in der bildgebenden Diagnostik als auch in der Therapie mit Erfolg eingesetzt. 3NYJ, PDB ID 3NYJ: Crystal Structure Analysis of APP E2 domainhttp://www.rcsb.org/pdb/explore/explore.do?structureId=3NYJ Lee, S., Xue, Y., Hu, J., Wang, Y., Liu, X., Demeler, B., Ha, Y. (2011) The E2 Domains of APP and APLP1 Share a Conserved Mode of Dimerization. Biochemistry 50: 5453-5464 (PubMed ID 21574595) WEITERE ANWENDUNGSGEBIETE BACHEM FRÜHJAHRS­ SYMPOSIUM «AUF ERFOLG GETRIMMT: MODIFIZIERTE PEPTIDE» Beim Frühjahrssymposium haben PeptidExperten aus Industrie und Wissenschaft aktuelle Trends in der Forschung und Entwicklung von Peptiden präsentiert. Die Bedeutung der Chiralität von Proteinen, deren gefaltete Struktur die Wechselwirkungen mit anderen Mole­ külen bestimmt, wurde betont. Selektiv bindende Liganden können beispiels­ weise Proteine oder Peptide sein. Ein natürliches Protein ist ein Makromolekül aus L-Aminosäuren, das sich zu einer chiralen dreidimensionalen Struktur faltet. Ersetzt man die L-Aminosäuren durch D-Aminosäuren, entsteht bei Faltung das Spiegelbild des natür­lichen Moleküls. Um einen Liganden für ein natürliches Protein komplett aus D-Aminosäuren herzustellen, muss der L-Protein-Ligand ein zweites Mal gespiegelt werden. Das D-Analog des Zielproteins wird durch chemische Synthese hergestellt. Mittels Phagen-Display wird das L-Protein aus einer Bibliothek poten­ zieller Liganden ermittelt, das mit der höchsten Affinität an das D-Ziel bindet und das dem optimalen Liganden entsprechende All-D-Protein synthetisiert, welches an das ursprüngliche Zielprotein aus L-Aminosäuren bindet. Adapted from S.A. Funke and D. Willbold, Mol. Biosystems, 5 (2009) 783–786 Professor Stephen Kent (Universität Chicago), ein Pionier der chemischen Proteinsynthese, hat dieses Konzept in Zusammenarbeit mit dem von ihm mitbegründeten Unternehmen Reflexion Pharmaceuticals weiterentwickelt. Peptide und Proteine, die aus D-Amino- säuren bestehen, werden durch Proteasen nicht abgebaut. Bei Verwendung als Therapeutika haben sie eine längere Halbwertszeit und sind nicht immunogen. Als Beispiel für die Herstellung eines D-Protein-Liganden, der ein L-ProteinZiel erkennt, wurde der vaskuläre endotheliale Wachstumsfaktor Typ A (VEGF-A), ein Angiogenese-auslösendes Protein, das in Tumoren überexprimiert ist, als natürliches Zielmolekül gewählt. All-D-VEGF-A wurde synthetisch durch native chemische Ligation hergestellt. Die Gruppe von Professor Sachdev Sidhu (Universität Toronto) wählte All-D-VEGF-A als Zielmolekül für das Phagen-Display einer Bibliothek kleiner Proteinliganden. Ausgewählt wurde das L-Protein, das am effizientesten von All-D-VEGF-A gebunden wurde. Das entsprechende All-D-Protein wurde synthetisiert, band an natives VEGF-A und wirkte als VEGF-Rezeptor-Antagonist. Die Gruppe von Professor John Robinson (Universität Zürich) arbeitet an synthetischen Proteinepitop-Mimetika. Sie hat makrozyklische Peptide entwickelt, die eine -Hairpin-artige Struktur bilden. Ein L-Pro-D-Pro-Gerüst stabilisiert die Schleife. Bei einem -Hairpin-mimetischem Protegrin I-analog wurde ein starker Anstieg der antimikrobiellen Aktivität beobachtet. Das cyclische Tetradecapeptid zeigte sich besonders effektiv gegen Pseudomonas-Bakterien wie P. aeruginosa. Diese stellen ein grosses Problem dar, denn sie werden häufig in Kranken­ häusern nachgewiesen und haben eine Multiresistenz gegen Antibiotika entwickelt. Das von Polyphor entwickelte Peptid-Antibiotikum POL7080 ist das Ergebnis einer weiteren Optimierung der Struktur des Protegrin-Mimetikums. DAS PRINZIP DER PROTEINSPIEGELUNG VIA PHAGENDISPLAY CHEMISCHE SYNTHESE L-Zielmolekül D-Zielmolekül PHAGENDISPLAY SCREENING SPIEGEL CHEMISCHE SYNTHESE L-Zielmolekül D-Protein L-Protein D-Zielmolekül PRÄSENTIERTE PHAGEN L-Proteinbibliotheken SPIEGEL 5 Bachem Geschäftsbericht 2015