5.6 Anorektale Erkrankungen
Werbung

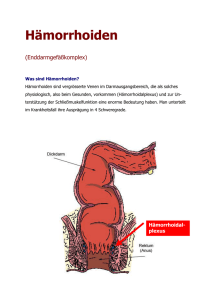
(aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5 Kolon und Rektum loskopie mit Stufenbiopsien (mindestens 4 Biopsien alle 10 cm) erfolgen. Bei eindeutiger und durch einen Referenzpathologen bestätigter hochgradiger intraepithelialer Neoplasie in flacher, nicht-entzündeter Schleimhaut ist dem Patienten die elektive, kontinenzerhaltende Proktokolektomie zu empfehlen. M. Crohn: Beim M. Crohn ist ebenfalls von einem erhöhten kolorektalen Karzinomrisiko auszugehen, allerdings existieren für Patienten mit M. Crohn keine Empfehlungen zur endoskopischen Überwachung. Toilettenpapier. Stärkere Blutungen sind nicht die Regel. Bei chronischem Verlauf kommen Sekretion und analer Juckreiz dazu. Die akute Form zeigt einen schmalen, länglichen Anodermdefekt von 0,5–2 cm Länge mit scharf begrenzten Wundrändern. Bei chronischer Veränderung findet man ein wulstiges, kallöses Ulkus mit den typischen Sekundärveränderungen (s.o.). Als Folgeveränderung treten inkomplette, subanodermale und intersphinktäre Abszesse und Fisteln auf. Diagnostik 5.6 Anorektale Erkrankungen A. HEROLD 5.6.1 Analfissur Analfissuren sind längsgerichtete Defekte im hochsensiblen Anoderm zwischen Linea dentata und Linea anocutanea. Primäre Fissuren entstehen auf nicht vorgeschädigtem Anoderm, sekundäre Fissuren im Rahmen anderer Vorerkrankungen (z.B. M. Crohn). Analfissuren sind mit dem Hämorrhoidalleiden die häufigsten Erkrankungen des Analkanals. Ätiopathogenese Die eigentliche Ursache ist wissenschaftlich noch nicht hinreichend bewiesen. In der Regel liegt eine multifaktorielle Genese zu Grunde, bei der der Sphinkterhypertonus eine zentrale Rolle einnimmt: Mikrotrauma (unter anderem bedingt durch mangelhafte Stuhlkonsistenz), Kontamination, oberflächliche Infektion (z.B. Kryptitis), Schmerz, reflektiver Hypertonus, dorsale Minderperfusion, chronische Fibrosierung und auch ein begleitend vorhandenes Hämorrhoidalleiden. 80–90% aller Fissuren finden sich in der hinteren Kommissur. Klinisches Erscheinungsbild Die akute Fissur besteht nur wenige Tage und zeigt keine Sekundärveränderungen, die chronische Fissur ist meist rezidivierend, besteht über mehr als 6 Wochen und zeigt als Sekundärläsionen Vorpostenfalte, Analfibrom, indurierte Ränder sowie einen freiliegenden und sklerosierten M. sphincter ani internus. Im Vordergrund steht ein fast immer defäkationsabhängiger, stechend, scharfer, brennender Schmerz, der über mehrere Minuten bis einige Stunden anhält. Meist ist dies kombiniert mit Blutspuren am 92 Anhand einer klassischen Anamnese lässt sich mit ausschließlicher Inspektion und Palpation sowie einer Proktoskopie die Diagnose zweifelsfrei stellen. Bei der Palpation findet sich meist in der dorsalen Zirkumferenz eine Induration mit oberflächlichen narbigen Veränderungen. Die Proktoskopie, z.B. auch mit einem Spreizspekulum, zeigt den Anodermdefekt. Ist diese Untersuchung aufgrund des Schmerzes nicht durchführbar, empfiehlt sich eine Abklärung in Lokalanästhesie oder in Narkose (mit der Option einer simultanen operativen Sanierung). Therapie Die Prophylaxe von Analfissuren besteht in einer physiologischen Defäkation. Die Therapie beinhaltet die Stuhlregulation, Anwendung von Lokaltherapeutika und operative Maßnahmen. Die akute Fissur heilt in 50% spontan, mit zusätzlichen Salben (Lokalanästhetika, Adstringentien, auch unspezifische Therapeutika) wird in 90% Heilung erreicht. In den letzten Jahren hat die Therapie mit Glycerintrinitrat (0,2%) eine wesentliche Verbesserung der konservativen Möglichkeiten bei chronischen Fissuren erreicht. Anfängliche Erfolgsraten bis zu 80% wurden in randomisierten Studien nicht erreicht. Mit 50–60% liegen sie aber signifikant über der Placebowirkung. Die Verwendung von Botulinumtoxin zeigt mit 70–80% gute Therapieergebnisse, ist jedoch eine teure Alternative (s. Kap. II.5.4.1). Die besten Ergebnisse in Bezug auf eine Abheilung hat die operative Therapie: Eine Fissurektomie ist einer Sphinkterotomie vorzuziehen, auch wenn letztere in den USA als Methode der Wahl angesehen wird. Für beide Techniken liegen die Erfolgsraten bei über 90%. Literatur Brühl W. Ätiologie und Therapie von Analfissuren. Coloproctology 1982; 4: 114–5. (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5.6 Anorektale Erkrankungen 5.6.2 Analfisteln und -abszesse Analfisteln und Analabszesse sind eng miteinander verbundene Krankheitsbilder und auf dasselbe Grundleiden zurückzuführen. Fast immer ist der Abszess das vorausgehende primäre Ereignis (akutes Stadium) und die Fistel eine sekundäre Folge (chronisches Stadium). Selten kommt es zum Auftreten perianaler Fisteln, ohne dass ein Abszess vorgelegen hätte. Ätiopathogenese Periproktale Abszesse sind meist auf eine Infektion der Proktodealdrüsen zurückzuführen. Diese kryptoglandulären Strukturen findet man am häufigsten im Bereich der hinteren Kommissur. Wenn sich die Entzündung ihren Weg entlang vorgegebener Spalträume submukös, subanodermal, intersphinktär oder transsphinktär bahnt, führt dies zum Auftreten eines Abszesses. Klinisches Erscheinungsbild Die Symptomatik der periproktalen Abszesse ist stark von deren Lokalisation abhängig. Anfangs kommt es zu einem unangenehmen Druck oder Fremdkörpergefühl, ehe sich mit zunehmender Ausdehnung starke Schmerzen, Fieber oder Schüttelfrost einstellen. Im Gegensatz zu den Abszessen ist die klinische Symptomatik perianaler Fisteln weniger dramatisch. Im Vordergrund steht die unterschiedlich starke Absonderung eines eitrig serösen Sekrets. Sekundär treten Juckreiz, Brennen und auch Blutspuren hinzu. Da diese Beschwerden meist subjektiv nicht sehr belästigend sind, wird dies nicht selten über lange Zeit toleriert. Meist erfolgt die Sekretion im Bereich der äußeren perianalen Region und hat nicht selten ausgeprägte Analekzeme zu Folge. Durch Epithelialisierung der äußeren Fistelöffnung ist ein vorübergehender Sekretverhalt möglich, ohne dass darunter aber eine Abheilung zu verstehen wäre. Im Allgemeinen erfolgt die Sekretion dann nach innen in den Analkanal, oder es ist nur eine Frage der Zeit, bis eine Fistel oder ein neuer Abszess auftritt. Einteilung Folgende Einteilung hat sich in der klinischen Praxis bewährt (Abb. I.5-22): M. sphincter ani internus pelvirektaler Abszess extrasphinktäre Fistel M. levator ani suprasphinktäre Fistel ischiorektaler Abszess transsphinktäre Fistel intersphinktärer subkutaner, Abszess subanodermaler Abszess subanodermale Fistel intersphinktäre Fistel Abb. I.5-22 Einteilung der Analfisteln und -abszesse. Abszesse ❚ Subanodermal/submukös/subkutan: Sie treten relativ selten auf und sind oberflächlich zwischen Sphinktermuskulatur und Anoderm bzw. Rektummukosa gelegen. Demnach unterscheidet man hierbei zwischen submukösen und subanodermalen Abszessen. Liegen sie ganz peripher, kommt eine rein subkutane Ausdehnung dazu. ❚ Intersphinktär: Zwischen den Sphinkteren lokalisierte Abszesse entleeren sich meist innerhalb kurzer Zeit über die Ausführungsgänge der infizierten Proktodealdrüsen und imponieren dann häufig als inkomplette innere Fisteln, aus denen sich z.B. bei der Untersuchung schwallartig Eiter entleert; andere perforieren nach distal. Durchaus können diese Abszesse aber auch in den suprasphinktären Bereich aszendieren und von dort zur Bildung supralevatorischer Fisteln führen. ❚ Ischiorektal: In der Ischiorektalregion gelegene Abszesse sind nach innen von der Sphinktermuskulatur, nach oben vom M. levator ani und nach 93 I GASTROINTESTINALE ERKRANKUNGEN Hyman N. Incontinence after lateral internal sphincterotomy: a prospective study and quality of life assessment. Dis Colon Rectum 2004; 47: 35–8. Lund J, Scholefield J. A randomised prospective doubleblind placebo-controlled trial of glycerin trinitrate ointment in the treatment of anal fissure. Lancet 1997; 349: 11–4. Jost W, Schimrigk K. Therapy of anal fissure using botulinum toxin and long-term results. Dis Colon Rectum 1997; 40: 1029–32. Notaras M. Lateral subcutaneus sphincterotomy for anal fissure: a new technique. Pro R Soc Med 1969; 62: 713. Nelson R. A systematic review of medical therapie for anal fissure. Dis Colon Rectum 2004; 47: 422–31. 5 (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5 Kolon und Rektum außen vom Sitzbein begrenzt. Wenn diese Abszesse dicht unter der Haut liegen, werden sie auch als perianale Abszesse bezeichnet. ❚ Pelvirektal: Diese Abszesse finden sich zwischen Rektumwand und Levatormuskulatur und werden auch als supralevatorische Abszesse bezeichnet. Gelegentlich liegen auch mehrere äußere Fistelöffnungen vor, die beiderseits des Afters auftreten können (z.B. Hufeisenfistel). Fisteln ❚ Subkutan / submukös / subanodermal: Sie verlaufen unter der Rektummukosa, dem Anoderm bzw. der äußeren Haut und sind häufig Folge eines lokalen Abszesses, einer Kryptitis oder einer Fissur. ❚ Intersphinktär: Die Gänge dieser Fisteln finden sich zwischen innerem und äußerem Schließmuskel. In der Mehrzahl handelt es sich um distale Verläufe, die nicht selten ursächlich auf Fissuren zurückzuführen sind. Sie können inkomplette Ausläufer im Intersphinktärraum nach proximal bis nach retrorektal haben. ❚ Transsphinktär: Diese Fisteln durchbohren sowohl den M. sphincter ani externus als auch internus, münden im Bereich der perianalen Haut nach außen. Auch hierbei finden sich zusätzlich inkomplette, vom Hauptgang abzweigende Nebengänge. ❚ Suprasphinktär: Der Verlauf dieser Fisteln ist im Intersphinktärraum aszendierend, umfasst den gesamten M. sphincter ani externus, um meist bogenförmig über die Puborektalisschlinge in die Fossa ischiorectalis zu gelangen und von dort zur äußeren Haut. ❚ Extrasphinktär: Extrasphinktäre Fisteln umgehen den gesamten Analkanal, münden im Rektum und haben keine Verbindung zum Analkanal in Höhe der Linea dentata. Ihr Verlauf führt von einer inneren Öffnung deutlich proximal der Linea dentata durch den M. levator ani zur äußeren Haut. Da hier keine kryptoglanduläre Verbindung besteht, sind sie ursächlich auf andere Erkrankungen (z.B. M. Crohn) zurückzuführen bzw. oft iatrogen verursacht. 85–95% aller Fisteln sind den inter- und transsphinktären Fisteln zuzuordnen und haben einen unkomplizierten Verlauf. Klinisches Erscheinungsbild Die Rückbildung eines periproktalen Abszesses ist nicht möglich. Wenn er durch operative Maßnahmen 94 nicht entlastet wird, kommt es in jedem Falle zu einer spontanen Perforation. Diese wird abhängig von der Lokalisation nach außen, in den Analkanal oder auch in das Rektum erfolgen. Damit ist eine schnelle Rückbildung der klinischen Symptomatik (Schmerzen, Fieber, Schüttelfrost, allgemeines Krankheitsgefühl) verbunden und eine folgenlose Abheilung möglich. Meist geht das akute Abszessstadium in das chronische Fistelstadium über. Die ständige Sekretion eines eitrig-serösen Sekrets ist Ausdruck einer im Fistelbereich nicht abklingenden Entzündung. Unbehandelt muss man mit einer Ausdehnung der Erkrankung in Form neu auftretender Abszesse oder weiterer Fisteln rechnen. Die Beeinträchtigung und Funktionseinschränkung des Kontinenzorgans ist eine zwangsläufige Folge. Bei immunologischen Störungen können massive Nekrosen mit lebensbedrohlichen Zuständen auftreten. Diagnostik Der Abszess ist mit Anamnese, klinischer Symptomatik, Inspektion und Palpation zu diagnostizieren. Abszesse im ischiorektalen Bereich führen bei oberflächlicher Lage meist zu einer rötlich lividen Verfärbung mit deutlich sichtbarer Prominenz. Im Frühstadium kann es Schwierigkeiten machen, pelvirektale, aber auch ischiorektale Abszesse sicher zu objektivieren. In solchen Fällen hilft die digitale rektale Untersuchung, bei der sich vom Analkanal oder unterem Rektum eine Schwellung und vermehrte Druckschmerzhaftigkeit feststellen lässt. Eine exakte Diagnostik perianaler Fisteln ist nur bei komplizierten Fisteln mit größeren Problemen verbunden. Die überwiegend vorkommenden interund transsphinktären Fisteln lassen eine meist gut sichtbare, unterschiedlich weit vom After entfernte äußere Fistelöffnung erkennen und im gleichen Sektor des Analkanals die innere Öffnung. Mit Knopfsonden lässt sich deren Verlauf gut verfolgen. Eine Sondierung sollte in keinem Fall erzwungen werden. Die röntgenologische Darstellung von Fisteln (Fistulographie) ist obsolet. Bei komplizierten Fisteln sind eine Endosonographie, die Computertomographie oder die Kernspintomographie hilfreich. Therapie Ein anorektaler Abszess wird grundsätzlich unverzüglich nach Diagnosestellung gespalten und ausreichend drainiert. Da immer die Gefahr einer Progression mit zunehmender Beteiligung umliegender (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5.6 Anorektale Erkrankungen 5 I b c d GASTROINTESTINALE ERKRANKUNGEN a Abb. I.5-23 Operationsschema: Plastischer Fistelverschluss (Flap-Technik). Strukturen besteht, ist ein zeitlicher Aufschub kontraindiziert. Die Therapie erfolgt durch breite trichterförmige Eröffnung der Haut und anschließende Sekundärheilung. Eine ergänzende Therapie mit Antibiotika ist nur in wenigen Fällen sinnvoll, z.B. bei immunsupprimierten Patienten, bei begleitender Weichteilphlegmone oder schwerer septischer Begleitreaktion. Bei der Operation eines anorektalen Abszesses sollte nach Möglichkeit in gleicher Narkose nach einer ursächlichen Fistel gefahndet werden. Lässt sich die Fistelverbindung zum Analkanal finden, wird die Fistel primär operiert oder mit einem Faden zur Drainage für einige Wochen angeschlungen und später dann definitiv chirurgisch versorgt. Ist bei der Revision eine Fistel primär nicht zu finden, sollte auf brüske Manipulation wegen der Gefahr einer Via falsa verzichtet werden. Eine symptomatische Analfistel stellt eine Indikation zur Operation dar. Das Ziel jeder Fistelchirurgie ist die Sanierung ohne Kontinenzeinbuße und ohne Rezidiv. Die operative Maßnahme orientiert sich am Verlauf der Fistel und somit an ihrem Bezug zum Sphinkterapparat. Subanodermale, submuköse, intersphinktäre und distale (tiefe) transsphinktäre Fisteln, die nur einen kleinen Anteil der Sphinktermuskulatur umfassen, können ohne Einschränkung der Kontinenz komplett gespalten werden. Die Rezidivrate liegt unter 10%, während die Kontinenzstörung direkt vom Ausmaß der Sphinkterbeteiligung abhängt. Hat man früher bis zu zwei Drittel der Muskelmasse durchtrennt, geht man heute zurückhaltender vor. In der Literatur wird die postoperative Kontinenzstörung mit 5–40% angegeben. Proximale (hohe) transsphinktäre, suprasphinktäre und extrasphinktäre Fistelgänge, die wesentliche Muskelanteile durchbohren, werden primär fadendrainiert und im nicht-entzündlichen Stadium in zweiter Sitzung exstirpiert und plastisch verschlossen (Abb. I.5-23). Hierzu wird nach kompletter Exstirpation des Fistelgangs insbesondere der kryptoglandulären Region eine direkte Naht der Sphinktermuskulatur durchgeführt und diese mit einem Verschiebelappen aus Mukosa oder Mukosa / Submukosa / Internus gesichert, somit die innere Fistelöffnung verschlossen. Eine unmittelbare Nahtinsuffizienz tritt in bis 95 (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5 Kolon und Rektum zu 10–25% auf, die Rezidivrate liegt zwischen 5 und 30%. In Einzelfällen können auch andere Techniken zum Einsatz kommen: eine direkte komplette Spaltung und ein- oder zweizeitiger Wiederaufbau der Muskulatur sowie auch die Interposition von Muskulatur (z. B. M. gracilis oder M. rectus abdominis), langzeitige Fadendrainage und Fibrinklebung. Eine Sonderform der anorektalen Fistel stellen die rekto- bzw. anovaginalen Fisteln dar. Aufgrund ihrer Lokalisation sind jedoch meist plastische Verfahren notwendig. Bedingt durch das in diesem Bereich fehlende umgebende Binde- und Muskelgewebe des Septum rectovaginale sind die Erfolgsraten schlechter als bei den anderen Anorektalfisteln. Anale Fisteln im Rahmen eines M. Crohn sind in 75% kryptoglandulären Ursprungs und folgen obigen Verläufen. Dagegen folgen 25% nicht den anatomischen Strukturen und durchdringen destruierend das Gewebe. Die Therapie folgt obigen Strategien. Eine kompetente konservative Therapie der Grunderkrankung ist Vorbedingung erfolgreicher chirurgischer Maßnahmen. Aufgrund der hohen Rezidivrate bei der Grunderkrankung können in vielen Fällen wiederholte chirurgische Eingriffe notwendig werden, die Schonung der Sphinktermuskulatur ist hier besonders wichtig. Vor einer operativ-rekonstruktiven Fistelsanierung muss die Grunderkrankung kontrolliert und die lokalen Verhältnisse müssen infektfrei sein. Bei komplexen Fisteln mit rezidivierenden Schüben ist die lockere Langzeitfadendrainage über Monate und Jahre eine vom Patienten i.d.R. sehr gut tolerierte Maßnahme, die die Stomaanlage verhindert oder zumindest verzögert. Literatur Buchmann P, Alexander-Williams J. Classification of perianal Crohn’s disease. Clin Gastroenterol 1998; 9: 323–30. Christiansen J, Ronholt C. Treatment of recurrent high anal fistula by total excision and primary sphincter reconstruction. Int J Colorect Dis 1995; 10: 207–9. Corman M. Anorectal abscess and anal fistula. In: Corman M (ed.). Colon and rectal surgery, 224–71. Lippincott-Raven Philadelphia 1998. 96 Gordon PH. Anorectal abscesses and fistula-in-ano. In: Gordon PH, Nivatvong S (eds.). Principles and Practice of the Surgery for the Colon, Rectum and Anus, 241–86. Quality Medical Publishing, St. Louis, 1999. Hoexter B, Labow SB, Moseson MD. Transanal rectovaginal fistola repair. Dis Colon Rectum 1985; 28: 572–5. Parks A, Gordon P, Hardcastle J. A classification of fistula-in-ano. Br J Surg 1976; 63: 1–12. Stelzner F. Die anorectalen Fisteln. Springer, Berlin, 1981. 5.6.3 Hämorrhoidalleiden Oberhalb der Linea dentata, unter der Rektumschleimhaut, findet sich ein zirkulär angelegtes arterio-venöses Gefäßkonglomerat, das Corpus cavernosum recti. Bei einer Hyperplasie dieser Gefäßstrukturen spricht man von Hämorrhoiden und bei zusätzlich auftretenden Beschwerden von einem Hämorrhoidalleiden. Entgegen der früheren Meinung ist heute wissenschaftlich belegt, dass es sich nicht um Venen handelt, sondern um arterio-venöse Schwellkörper mit typischen Prädilektionsstellen bei 3, 7 und 11 Uhr in Steinschnittlage, denen eine wichtige Funktion bei der Feinkontinenz zukommt. Ätiopathogenese So häufig diese Erkrankung auftritt, so unzureichend wissenschaftlich belegt ist ihre Ätiologie. Die Beschwerden und die damit verbundenen morphologischen Veränderungen können sowohl genetisch bedingt sein als auch Folge einer gestörten Defäkation bzw. mangelhafter Stuhlkonsistenz. Dies betrifft besonders Personen mit chronischer Verstopfung, die meist nur unter starkem Pressen harten Stuhl absetzen können. Das übermäßige Pressen führt im Verlauf von Jahren zur Vergrößerung und Dislokation des Hämorrhoidalgewebes nach distal. Auch nicht geformter, breiiger bis durchfallartiger Stuhl stellt eine unphysiologische Belastung der Hämorrhoidalkonvolute dar. Unter diesen Umständen erfolgt die Defäkation gegen den nicht ausreichend relaxierten Analsphinkter und die nur ungenügend entleerten Hämorrhoidalpolster. Klinisches Erscheinungsbild Die auf Hämorrhoiden zurückzuführenden Beschwerden sind uncharakteristisch und auch bei (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5.6 Anorektale Erkrankungen Tab. I.5-4 Stadieneinteilung der Hämorrhoiden. Charakteristikum 1 Proktoskopisch sichtbare Polster 2 Prolaps bei der Defäkation, retrahiert sich spontan 3 Prolaps bei der Defäkation, manuell reponibel 4 Prolaps fixiert, fibrosiert, thrombosiert, nicht reponibel vielen anderen proktologischen Erkrankungen in ähnlicher Weise vorhanden. Sie sind nicht von der Größe der Hämorrhoiden abhängig. Am häufigsten sind Blutungen. Typisch sind wechselnde Phasen: Blutungen, die täglich, bei jeder Defäkation auftreten und ohne besondere Behandlungsmaßnahmen über Wochen, aber auch Monate wieder verschwinden. Bei stark vergrößerten und prolabierenden Hämorrhoiden ist die Feinkontinenz gestört. Dies führt zu unterschiedlich starkem Nässen, Schmieren und stuhlverschmutzter Wäsche. Mit Juckreiz einhergehende Analekzeme sind eine indirekte Folge des Hämorrhoidalleidens. Hämorrhoiden machen in der Regel keine Schmerzen. Häufig sind Schmerzen auf synchron bestehende Fissuren zurückzuführen (bei Hämorrhoiden 2. Grades bis zu 70%). Starke Schmerzen finden sich dagegen beim inkarzerierten Hämorrhoidalprolaps. Klassifikation Beim Hämorrhoidalleiden wird der Lokalbefund in vier Stadien eingeteilt (Tab. I.5-4). Hämorrhoiden Grad 1 sind im Proktoskop zu erkennende wulstige, prall elastische, mit Schleimhaut bedeckte Knoten. Hämorrhoiden Grad 2 prolabieren bei der Defäkation, um sich anschließend spontan wieder zurückzuziehen. Bei den prolabierenden Knoten lässt sich zwischen solchen unterscheiden, die von Rektumschleimhaut bedeckt sind und solchen, die als pralle Schwellung unter dem Anoderm imponieren. Wenn Anoderm bei prolabierenden Hämorrhoiden außerhalb des Analkanals sichtbar wird, spricht man von einem Anodermprolaps (synonym: Analprolaps). Hämorrhoiden Grad 3 unterscheiden sich vom morphologischen Befund nicht von Hämorrhoiden Grad 2 und zeichnen sich nur dadurch aus, dass sie sich nach der Defäkation nicht spontan zurückziehen, sondern manuell reponiert werden müssen. Hämorrhoiden 4. Grades sind nicht mehr zu reponierende Knoten Diagnostik Nicht prolabierende Hämorrhoiden (Hämorrhoiden 1. Grades) sind nur proktoskopisch zu erkennen. Prolabierende Hämorrhoiden zeigen sich am deutlichsten nach der Defäkation. Außen fixierte und nicht mehr zu reponierende Hämorrhoiden (Hämorrhoiden 4. Grades) sind schon bei der Inspektion gut zu beurteilen. Weitere Untersuchungen sind zur Diagnostik eines Hämorrhoidalleidens nicht erforderlich. Differentialdiagnose Besonders von Laien werden Marisken gern mit Hämorrhoiden verwechselt. Häufig sind Hämorrhoiden mit Anodermprolaps und Marisken kombiniert. Auch bei perianalen Thrombosen handelt es sich nicht um Hämorrhoiden, sondern um Thrombosen in den subkutanen Analrandvenen. Verwirrend ist hier oft der Begriff von „äußeren Hämorrhoiden“ im angloamerikanischen Sprachraum. Therapie Von einer lokalen Behandlung mit Salben, Suppositorien oder Analtampons ist bei Beschwerden, die ausschließlich auf Hämorrhoiden zurückzuführen sind (z.B. Blutungen), kein Erfolg zu erwarten, da hier nur symptomatisch und nicht kausal eingegriffen wird. Allerdings können sie die bei Hämorrhoiden auftretenden, entzündlichen, ödematösen Begleitveränderungen günstig beeinflussen. Sklerosierungsbehandlung Die Sklerosierungstherapie ist die erste Wahl bei Hämorrhoiden 1. Grades (Abb. I.5-24). Bei der Blond-Methode wird die Sklerosierungslösung (z.B. Polidocanol, Thesit, Chinin, Calcium-Zinkchlorid) im Blond'schen Proktoskop tropfenweise zirkulär oberhalb der Linea dentata submukös injiziert. Dafür sind 0,5–1,0 ml Sklerosierungslösung ausreichend, die im Abstand von 8–14 Tagen 2- bis 3-mal verabreicht werden. 97 I GASTROINTESTINALE ERKRANKUNGEN Stadium 5 (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5 Kolon und Rektum eines speziellen Ligators werden im vorn offenen Proktoskop knotig vergrößerte Hämorrhoiden mit Hilfe von kleinen Gummiringen so abgeschnürt, dass sie innerhalb kurzer Zeit nekrotisieren und abfallen. Die Behandlungserfolge mit Gummiringligaturen bei Hämorrhoiden 2. Grades liegen zwischen 70 und 80%. Im Vergleich zur Sklerosierungsbehandlung und Infrarotkoagulation werden überwiegend bessere Resultate mitgeteilt. Die Rezidivrate liegt bei 25% in den ersten 4 Jahren. Abb. I.5-24 Sklerosierungstechnik nach Blond. Bei der Sklerosierungstechnik nach Blanchard bzw. Bensaude werden je 1–3 ml einer Phenol-Mandelöl-Lösung oder einer Phenol-Erdnussöl-Lösung in den Bereich der zuführenden Hämorrhoidalarterien bei 3, 7 und 11 Uhr in Steinschnittlage appliziert. Auch bei dieser Technik sind allenfalls 2 bis 3 Behandlungen im Abstand von 1–2 Wochen nötig. Der therapeutische Effekt ist auf eine Fixierung der Hämorrhoidalkonvolute oberhalb der Linea dentata zurückzuführen. Vergleichende Untersuchungen über die Wirksamkeit beider Methoden sprechen für eine bessere Effizienz des Blond’schen Verfahrens. Hämorrhoidale Beschwerden (Blutungen) sind mit dem Blond’schen Verfahren nach zwei Sklerosierungsbehandlungen schon in 70–80% abgeklungen. Langfristig ist mit einer hohen Rezidivquote zu rechnen, die nach drei Jahren bei 70% liegt. Infrarotkoagulation Die Infrarotkoagulation ist ein Therapieverfahren, das sich bei der Behandlung blutender Hämorrhoiden 1. Grades bewährt hat. Da heute andere Methoden favorisiert werden, ist die Infrarotkoagulation in den letzten Jahren deutlich in den Hintergrund getreten. Gummiringligatur Sie gilt als Therapie erster Wahl zu Behandlung von Hämorrhoiden 2. Grades (Abb. I.5-25). Mit Hilfe 98 Dopplergesteuerte Hämorrhoidalarterienligatur (HAL) Bei Hämorrhoiden 2. und 3. Grades lassen sich mit einem Spezialproktoskop, in das ein Dopplertransducer eingebaut ist, die zuführenden Hämorrhoidalarterien orten und gezielt ligieren. Innerhalb kurzer Zeit schrumpfen die Hämorrhoidalkonvolute. Dadurch soll nicht nur der Hämorrhoidalprolaps verschwinden, sondern auch die damit verbundenen Beschwerden. Diese Methode wird erst seit kurzer Zeit in wenigen Kliniken eingesetzt. Die wenigen Publikationen berichten einen Therapieerfolg in 50–90%. Eine abschließende Beurteilung der Effektivität ist noch nicht möglich. Operation Hämorrhoiden 3. Grades sind nur in Ausnahmefällen noch konservativ mit zufriedenstellendem Ergebnis therapierbar. Daher ist hier die Indikation zur Operation gegeben, für die verschiedene Verfahren angewandt werden können: ❚ Offene Hämorrhoidektomie nach Milligan-Morgan, ❚ geschlossene Hämorrhoidektomie nach Ferguson, ❚ submuköse Hämorrhoidektomie nach Parks, ❚ rekonstruktive Hämorrhoidektomie nach FanslerArnold, ❚ supraanodermale Hämorrhoidektomie nach Whitehead. ❚ supraanodermale Mukosektomie mit dem Stapler. Insbesondere bei segmentären Hämorrhoidalvorfällen sind die Verfahren nach Milligan-Morgan und Ferguson empfehlenswert (Abb. I.5-26). Die vergrößerten Hämorrhoidalknoten werden segmentär reseziert und ausreichend breite Brücken am Anoderm erhalten, um Stenosen und Kontinenzeinbußen vorzubeugen. Die Methode nach Milligan-Morgan belässt die so entstandenen Wunden im Anoderm zur (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5.6 Anorektale Erkrankungen 5 I b c d GASTROINTESTINALE ERKRANKUNGEN a Abb. I.5-25 Technik der Ligaturbehandlung. Sekundärheilung offen, während bei der Technik nach Ferguson etwas mehr Anoderm erhalten wird, um die Wunde durch Naht zu verschließen. Die Rezidivrate wird in der Literatur der letzten 20 Jahre zwischen 3 und 26% angegeben. Als subanodermale/ submuköse Resektion der Hämorrhoiden mit gleichzeitiger Reposition des dislozierten Anoderms – somit bei fortgeschritteneren Befunden zu bevorzugen – kommt alternativ die Operationstechnik nach Parks zur Anwendung. Die Hämorrhoidenoperation mit dem Zirkularstapler (Abb. I.5-27) gilt als das ideale Verfahren beim zirkulären Hämorrhoidalleiden 3. Grades. Mit Hilfe des Klammernahtgeräts sowie eines speziellen Einführungssets werden die prolabierenden Hämorrhoiden reponiert und das proximal liegende Mukosagewebe zirkulär reseziert. Hierdurch wird eine Fixation des vorfallenden Anoderms und Hämorrhoidalgewebes in seiner physiologischen intraanalen Position erreicht. Im weiteren Verlauf kommt es durch sekun- däre Umbauvorgänge zu einer Gewebsreduktion auf eine normale Größe. Da das Verfahren keine Wunde im sensiblen Anoderm setzt, hat es sich, bedingt durch den resultierenden höheren Patientenkomfort, zu einer effektiven Alternative entwickelt. Der Vorteil liegt insbesondere in den geringeren postoperativen Schmerzen. Ist der Hämorrhoidalprolaps nicht mehr reponibel, liegen Hämorrhoiden 4. Grades vor. Im Falle einer akuten Thrombosierung oder Inkarzeration ist die konservative Therapie mit Antiphlogistika, Analgetika und lokalen Maßnahmen zu bevorzugen. In erfahrenen Händen kann auch eine sofortige Operation zum Einsatz kommen. Hier ist vor allem die Gefahr einer postoperativen Stenose bedingt durch übermäßige Resektion im ödematösen Stadium zu berücksichtigen. Bei chronischen, fibrosierten, fixierten Befunden meist mit einem begleitenden zirkulären Anodermprolaps sind auch plastisch-rekonstruktive Verfahren sinnvoll. 99 (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5 Kolon und Rektum a c Abb. I.5-26 Operationstechnik der Hämorrhoidektomie nach Milligan-Morgan. Diese operativ-technisch und auch zeitlich wesentlich aufwändigere Technik (Operationszeit 30– 60 Minuten) erzielt neben der Resektion des hämorrhoidalen Gewebes mittels plastischer Verschiebelappen eine zirkuläre bzw. semizirkuläre komplette Rekonstruktion des Analkanals. Dies resultiert in einer hohen postoperativen Komplikationsrate von bis zu 20%. Bei allen Techniken liegt die Beschwerdefreiheit nach 2 Jahren über 90%. Rezidive nehmen im Zeitverlauf zu, sind aber meist mit konservativen Maßnahmen beherrschbar. Die Reoperationsrate liegt unter 5%. Literatur Barron J. Office ligation treatment for hemorrhoids. Dis Colon Rectum 1963; 6 : 109–13. Brühl W, Schmauz R. Injection Sclerotherapy and Bulk laxantive in Grade 1 Hemorrhoids. Coloproctology 2000; 22: 212–7. Ganio E, Altomare F, Gabrielli F, Milito G, Canuti S. Prospective randomised multicentre trial comparing 100 b d stapled with open hemorrhoidectomy. Br J Surg 2001; 88: 669–74. McRae H, McLeod R. Comparison of hemorrhoidal treatment modalities: a meta-analysis. Dis Colon Rectum 1995; 38: 687–94. Mehigan BJ, Monson JRT, Hartley JE. Stapling procedures for hemorrhoids versus Milligan-Morgan hemorrhoidectomy: randomised controlled trial. Lancet 2000; 355: 782–5. Poen A, Felt-Bersma R, Cuesta MA et al. A randomized controlled trial of rubber band ligation versus infrared coagulation in the treatment of internal hemorrhoids. Eur J Gastroenterol Hepatol 2000; 12(5): 535–9. Rosswell M, Bello M, Hemingway DM. Circumferential mucosectomy (stapled hemorrhoidectomy) versus conventional hemorrhoidectomy: randomised controlled trial. Lancet 2000; 355: 779–81. Senapati A, Nicholls R. A randomised trial to compare the results of injection sclerotherapy with a bulk laxative alone in the treatment of hemorrhoids. Int J of Colorect Dis 1988; 3: 124–6. Stelzner F, Staubesand J, Machleidt H. Das corpus cavernosum recti – die Grundlage der inneren Hämorrhoiden. Canterbeck’s Arch Chir 1962; 299: 302–12. (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5.6 Anorektale Erkrankungen 5 I b c d e f GASTROINTESTINALE ERKRANKUNGEN a Abb. I.5-27 Operationstechnik der Stapler-Hämorrhoidpexie. Walker A, Leicester R, Nicholls R et al. A prospective study of infrared coagulation, injection and rubber band ligation in the treatment of hemorrhoids. Int J Colorectal Dis 1990; 5: 113–6. 5.6.4 Analkanalkarzinom Tumoren des Analkanals entstehen im Bereich des Anoderms sowie der Transitionalzone. Analkanalkarzinome reichen somit von der Linea anocutanea nach proximal bis zum anorektalen Übergang. Ihre Einteilung erfolgt nach der TNM-Klassifikation (Tab. I.5-5) und der UICC-Stadieneinteilung (Tab. I.5-6). Tumoren distal der Linea anocutanea bis 5 cm lateral (entspricht der Perianalregion) werden als Analrandkarzinome bezeichnet. Diese werden den Tumoren der Haut zugeordnet und entsprechend den dortigen Empfehlungen therapiert. Epidemiologie Das Analkanalkarzinom ist ein seltener Tumor, der ca. 1% aller Malignome des Gastrointestinaltrakts ausmacht. Frauen sind auffällig häufiger betroffen als Männer. Die Inzidenz beträgt ca. 0,5 Neuerkrankungen pro 100 000 Einwohner und Jahr. Histologisch handelt es sich i.d.R. um Plattenepithelkarzinome, seltener um Basalzellkarzinome, infiltrierende Adenokarzinome oder maligne Melanome. Klinisches Erscheinungsbild Je nach Größe und Sitz des Tumors kann die Symptomatik variieren. Anamnestisch werden am häufigsten anale Blut- und Schleimabgänge angegeben, seltener oberflächliche Hautveränderungen, perianale Schmerzen, Fremdkörpergefühl, Juckreiz, Sekretion, Stuhlunregelmäßigkeiten, Kontinenzstörungen, Fistelbildungen und vergrößerte Leistenlymphknoten. 101 (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5 Kolon und Rektum Tab. I.5-5 TNM-Klassifikation bei Analkanalkarzinom. Tab. I.5-6 UICC-Klassifikation beim Analkanalkarzinom Charakteristikum Stadium Befund Stadium Tumorausbreitung T0 Kein Anhalt für Primärtumor Tis Lymphknotenmetastasen Fernmetastasen T L M 1 T1 N0 M0 Carcinoma in situ 2 T2, T3 N0 M0 T1 Tumor ≤ 2 cm 3a T4 N0 M0 T2 Tumor > 2 cm, ≤ 5 cm T1, T2, T3 N1 M0 T3 Tumor > 5 cm T4 N1 M0 T4 Infiltration in angrenzende Organe T1, T2, T3 N2, N3 M0 Jedes T Jedes N M1 N0 Keine regionären Lymphknotenmetastasen N1 Metastasen in perirektalen LK N2 Metastasen einseitig in inguinalen Lymphknoten oder an der A. iliaca interna einer Seite N3 Metastasen beidseitig in perirektalen, inguinalen oder iliakalen Lymphknoten M0 Keine Fernmetastasen M1 Fernmetastasen Diagnostik Durch Anamnese und klinische Untersuchung mit Inspektion und Palpation des Analkanals sowie Rektoskopie und Proktoskopie lässt sich der Primärtumor vermuten. Mit Hilfe einer Tumorbiopsie (kleine Tumoren < 1 cm sollten als Totalbiopsie komplett entfernt werden) wird die maligne Veränderung histologisch gesichert. Zur Beurteilung des Tumorstadiums sind CT oder MRT von Abdomen und Becken insbesondere zur Beurteilung der ilia- 102 TNM-Befund 3b 4 kalen, inguinalen und paraaortalen Lymphknoten hilfreich. Therapie Eine lokale Tumorexzision erfolgt bei Tumoren < 2 cm, die distal der Linea dentata gelegen sind und keine Metastasen zeigen. Aufgrund der sehr guten 5-Jahres-Überlebensrate von bis zu 80%, bei über 4 cm großen Tumoren bis 55%, bei gleichzeitiger Erhaltung der Kontinenz hat sich als Therapie der Wahl bei allen anderen Tumoren die primäre Radiochemotherapie gegenüber der Rektumexstirpation durchgesetzt. Ein etabliertes Therapieregime ist die kombinierte Radiochemotherapie mit Mitomycin C 10 mg/m2 Körperoberfläche an Tag 1 und Tag 30; 5-Fluorouracil 1000 mg/m2 Körperoberfläche pro 24 h in der 1. und 5. Woche kombiniert mit externer Bestrahlung 1,8 bis 2,0 Gy/Tag über 5 Wochen und zusätzlicher Bestrahlung der Leistenlymphknoten. Nur bei verbleibendem Resttumor 6 Wochen nach Ende der primären Radiochemotherapie oder im Fall eines Tumorrezidivs erfolgt die abdominoperineale Rektumexstirpation. Gegebenenfalls ist vor Radiochemotherapie im Falle eines hochgradig stenosierenden Tumors oder bei kompletter Inkontinenz ein Kolostoma notwendig. Bei der Mehrzahl der kurativ behandelbaren Patienten ist ein permanentes Kolostoma jedoch vermeidbar. (aus S. Kahl, G. Kähler, A. Dormann. Interventionelle Endoskopie, Elsevier, München 2007) 5.6 Anorektale Erkrankungen Notaras M. Lateral subcutaneus sphincterotomy for anal fissure: a new technique. Pro R Soc. William NS. Malignant tumours of the anal canal and anus. In: Keighley MRB, Williams NS (Hrsg.). Surgery of the anus, rectum and colon, pp. 1092–11. WB Saunders, London 1993. 103 I GASTROINTESTINALE ERKRANKUNGEN Literatur Greenall MJ, Quan SHQ, Stearns MW et al. Epidermoid cancer of the anal margin: pathological features, treatment and clinical results. Am J Surg 1985; 149: 95–101. Nigro ND: Multidisciplinary management of cancer of the anus. World J Surg 1987; 11: 446–51. Nivatvongs S. Perianal and anal canal neoplasms. In: Gordon PH, Nivatvongs S (Hrsg.). Principles and Practice of surgery for the Colon, Rectum and Anus, pp. 447–72. Quality Medical Publishing, St. Louis 1999. 5