Motor für ein zweites Leben
Werbung
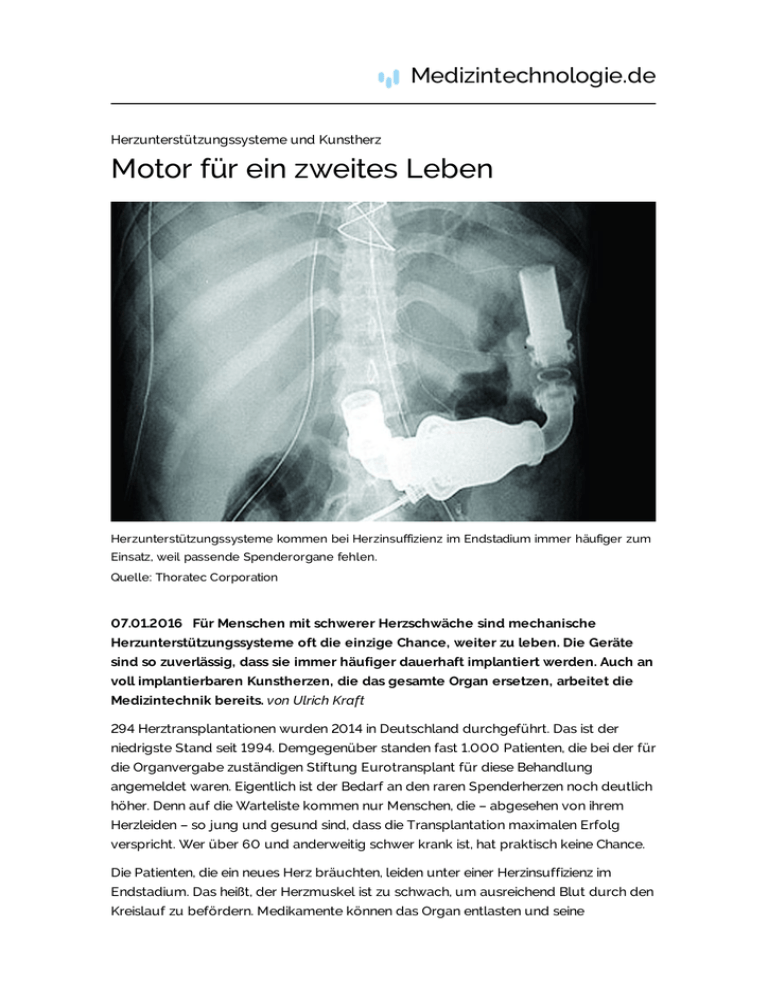
Medizintechnologie.de Herzunterstützungssysteme und Kunstherz Motor für ein zweites Leben Herzunterstützungssysteme kommen bei Herzinsuffizienz im Endstadium immer häufiger zum Einsatz, weil passende Spenderorgane fehlen. Quelle: Thoratec Corporation 07.01.2016 Für Menschen mit schwerer Herzschwäche sind mechanische Herzunterstützungssysteme oft die einzige Chance, weiter zu leben. Die Geräte sind so zuverlässig, dass sie immer häufiger dauerhaft implantiert werden. Auch an voll implantierbaren Kunstherzen, die das gesamte Organ ersetzen, arbeitet die Medizintechnik bereits. von Ulrich Kraft 294 Herztransplantationen wurden 2014 in Deutschland durchgeführt. Das ist der niedrigste Stand seit 1994. Demgegenüber standen fast 1.000 Patienten, die bei der für die Organvergabe zuständigen Stiftung Eurotransplant für diese Behandlung angemeldet waren. Eigentlich ist der Bedarf an den raren Spenderherzen noch deutlich höher. Denn auf die Warteliste kommen nur Menschen, die – abgesehen von ihrem Herzleiden – so jung und gesund sind, dass die Transplantation maximalen Erfolg verspricht. Wer über 60 und anderweitig schwer krank ist, hat praktisch keine Chance. Die Patienten, die ein neues Herz bräuchten, leiden unter einer Herzinsuffizienz im Endstadium. Das heißt, der Herzmuskel ist zu schwach, um ausreichend Blut durch den Kreislauf zu befördern. Medikamente können das Organ entlasten und seine Schlagkraft stärken, doch sie verhindern nicht, dass die Erkrankung stetig voranschreitet. Wenn die medikamentöse Behandlung an ihre Grenzen stößt und das Organ zu versagen droht, gibt es eine Alternative zur Transplantation, die sich mehr und mehr etabliert: mechanische Herzunterstützungssysteme. Deutliche Zunahme von Implantationen Fast 1.000 dieser so genannten Ventricular Assist Devices oder kurz VADs haben Chirurgen 2014 in Deutschland implantiert. Der Einbau dieser Geräte hat sich damit innerhalb von zehn Jahren verdreifacht. Denn im Jahr 2005 waren es 350 Implantationen von VADs. „Weil es an Spenderorganen fehlt, sind wir dringend auf die Herzunterstützungssysteme angewiesen“, sagt Jan Gummert, Direktor der Klinik für Thorax- und Kardiovaskularchirurgie am Herz- und Diabeteszentrum NRW in Bad Oeynhausen. Hinzu kommt, dass die Menschen immer älter werden. Damit wächst auch die Zahl der Patienten mit einer Herzinsuffizienz im Endstadium. Meist werden die VADs in die Wand der linken Herzkammer eingesetzt. Dort saugen sie das Blut ab, pumpen es weiter in die Aorta und übernehmen so die Funktion des Ventrikels. Auch an einem vollimplantierbaren Kunstherz, das beide Herzkammern ersetzt, tüfteln Medizintechniker bereits. 1 Vom Provisorium zur Dauerlösung Die Herzunterstützungssysteme haben in den vergangenen Jahren einen enormen Entwicklungssprung gemacht. Einst nur zur kurzfristigen Überbrückung bis zur Transplantation gedacht, gibt es inzwischen viele Patienten, die dauerhaft mit ihrem VAD leben. Die VADs der ersten Generation, die Mitte der 1990er zugelassen wurden, arbeiteten pulsatil, transportierten das Blut also Schlag für Schlag – wie das natürliche Herz. Die neueren Systeme erzeugen meist einen kontinuierlichen Blutstrom. Unterschieden wird dabei zwischen den Axialflusspumpen, in deren Inneren sich eine Turbine bis zu 10.000 Mal pro Minute dreht, und den Zentrifugalpumpen, die einen scheibenförmigen Rotor besitzen. „Die Qualität der Ventricular Assist Devices hat sich in den letzten Jahren enorm verbessert“, berichtet Jan Gummert. Zum einen werden sie immer kleiner. Das erleichtert dem Chirurgen die Implantation und macht den Eingriff schonender für die Patienten. Zum anderen sind die modernen Unterstützungssysteme vollkommen geräuschlos, während ihre pulsatilen Vorläufer „deutlich Krach machten“, wie der Bad Oeynhausener Herzspezialist sagt. „Für die Lebensqualität der Träger ist das sehr wichtig.“ Und sie verbrauchen wesentlich weniger Energie, so dass die Lithium-Ionen-Akkus, die die Stromversorgung gewährleisten, erst nach 12 bis 18 Stunden wieder geladen werden müssen. Ursprünglich waren die mechanischen Herzhelfer nur dazu gedacht, die Zeit bis zu einer Transplantation zu überbrücken. „Inzwischen sind sie längst zur Dauerlösung geworden, auch gezwungenermaßen, weil es eben zu wenig Spenderherzen gibt“, so Jan Gummert. Aber auch, weil die VADs kleiner und effizienter geworden sind. Erholung mit System Manche Patienten leben seit fast zehn Jahren mit einem Herzunterstützungssystem. Und manche sogar wieder ohne. So konnte bei fast zehn Prozent der 1.038 Herzkranken, die zwischen 1995 und 2011 am Deutschen Herzzentrum in Berlin ein VAD erhielten, die Pumpe entfernt werden, weil ihr Herz sich erholt hatte. In einer umfangreichen Studie wird derzeit geprüft, ob sich diese Rate durch eine frühzeitigere Implantation steigern lässt. Falls ja, könnten die Unterstützungssysteme auch für herzinsuffiziente Menschen, die sich noch nicht im Endstadium befinden, zur Therapieoption werden. Thrombose häufigste Komplikation Die US-amerikanischen Unternehmen HeartWare und Thoratec sind in dieser Technologie derzeit weltweit führend auf dem Markt. „Beide sind zuverlässige Systeme, die auf einem sehr hohen Niveau arbeiten“, sagt Gummert. 20.000 Thoratec-VADs wurden bis heute implantiert, davon mit Abstand am häufigsten das Modell HeartMate II. Die Pumpe geriet allerdings Ende Das Modell HeartMate II wurde mit Abstand am 2013 in die Schlagzeilen, weil an häufigsten bei Patienten eingepflanzt. amerikanischen Kliniken bei den Quelle: Thoratec Corporation Trägern ein abrupter Anstieg von Thrombosen beobachtet wurde. „Die Thrombosegefahr ist die häufigste und wichtigste Komplikation der Herzunterstützungssysteme“, berichtet Gummert. Verwirbelungen, Scherkräfte und der Kontakt mit dem körperfremden Material befördern die Bildung solcher Blutgerinnsel. Die Thromben können die Pumpe verstopfen und – wenn sie ins Blutgefäßsystem gelangen – so schwerwiegende Folgen wie einen Schlaganfall nach sich ziehen. Um dem zu begegnen, müssen die Patienten mit gerinnungshemmenden Medikamenten behandelt werden. Diese so genannten Antikoagulantien verstärken aber die zweite wichtige Komplikation der VADs, die erhöhte Blutungsneigung. Beim HeartMate III, den Nachfolgemodell des HeartMate II, bestehen die Oberflächen neuerdings aus gesintertem Titan – also einem speziell verdichteten Titan. Dadurch soll die Gefahr, dass dort Thromben entstehen, deutlich verringert werden. Darüber hinaus hat der magnetisch gelagerte Rotor größere Abstände zum Gehäuse. Das verbessert die Flussdynamik des Blutes, was ebenfalls dem Risiko thrombembolischer Komplikationen entgegen wirkt, so der Experte. Im Sommer 2014 wurde Heartmate III weltweit zum ersten Mail implantiert, an der Medizinischen Hochschule Hannover. Jan Gummert ist gespannt, wie sich HeartMate III bewährt. „Gelingt es, die Komplikationsrate weiter zu senken, wird die Zahl der Patienten, die ein Herzunterstützungssystem implantiert bekommen, noch sehr viel größer werden.“ 2 Vollständig implantierbare Kunstherzen Bislang ist nur ein System zugelassen, das das gesamte Herz ersetzen kann. Allerdings schränkt es die Lebensqualität der Patienten stark ein und birgt erhebliche Risiken. Deshalb wird intensiv an neuen vollimplantierbaren Kunstherzen gearbeitet. Ein deutsches Unternehmen mischt dabei ganz vorne mit. Wenn aber beide Herzkammern ihren Dienst versagen, erreichen die einseitigen Ventricular Assist Devices ihre Grenzen. Eine dann noch verbleibende Option, um das Überleben von Patienten zu sichern, bis ein Spenderorgan gefunden wird, kommt von der Firma SynCardia Systems in Arizona. Ihr Total Artificial Heart oder kurz TAH genanntes System ist bislang das einzige vollständige Kunstherz, das in den USA und Europa zugelassen ist. Laut Hersteller wurde es bereits über 1.400 Mal implantiert. Das TAH besteht aus zwei künstlichen Ventrikeln und vier Herzklappen, die die natürlichen Herzkammern und klappen ersetzen. Die Herzvorhöfe bleiben bei der Implantation intakt. In den Wänden der beiden Herzkammern befindet sich jeweils eine flexible Membran, die durch Druckluftpulse periodisch vorgewölbt wird. Auf diese Weise wird im steten Wechsel Blut in den Ventrikel eingesogen und wieder ausgeworfen. Bis zu 9,5 Liter pro Minute kann das Syncardia TAH so durch den Blutkreislauf befördern. Die beiden fingerdicken Druckluftschläuche, die die Pumpe im Brustkorb mit dem externen pneumatischen Antrieb verbinden, führen durch die Haut nach außen. Das bislang weltweit einzige voll implantierbare Dies birgt nicht nur eine erhebliche Kunstherz wird von der US-amerikanischen Firma Infektionsgefahr, sondern schränkt SynCardia hergestellt. zudem die Bewegungsfreiheit stark Quelle: SynCardia Systems Inc. ein. Dass die Patienten die rund sieben Kilo schwere Antriebseinheit, die auch die Steuerungselektronik und die Akkus zur Stromversorgung beherbergt, permanent mit sich führen müssen – entweder in einer Umhängetasche oder auf einem Wägelchen - begrenzt ihre Mobilität noch zusätzlich. Außerdem verursacht der Druckluftkompressor deutlich hörbare Geräusche, was die Lebensqualität ebenfalls mindert. Es habe zwar Defizite, urteilt Jan Gummert vom Herz- und Diabeteszentrum NRW über das Syncardia TAH, das in Bad Oeynhausen mehr als 150 Mal eingesetzt wurde. „Doch für manche Menschen ist es die einzige Möglichkeit, weiterleben zu können.“ Französisches Kunstherz setzt auf Biomaterialien Um die Nachteile des Systems auszugleichen, arbeitet die Medizintechnik an einem voll implantierbaren Kunstherz. Führend auf dem Gebiet ist derzeit das französische BiomedizinUnternehmen Carmat, das von Alain Carpentier mit gegründet wurde. Der Herzchirurg machte sich in den 1960er Jahren durch die Entwicklung und Implantation der ersten künstlichen Herzklappen aus Schweineknorpel einen Namen. An einem Kunstherz tüftelt er seit Ende der 1980er. Kooperationspartner war der Rüstungs- und Technologiekonzern Matra, der heute zur Airbus Group gehört. Matra unterstützte Carpentier nicht nur finanziell, sondern stellte ihm auch einige Ingenieure zur Verfügung. Der Investmentfond Truffle Capital übernahm dann 2008 die Mehrheit an Carmat und brachte es 2010 an die Börse. Weniger als 900 Gramm wiegt das Kunstherz der Franzosen inzwischen. Jede der beiden Herzkammern ist durch eine Membran in zwei Räume unterteilt. Auf der einen Seite befindet sich eine Hydraulikflüssigkeit, die von zwei Mini-Pumpen abwechselnd in die Ventrikel befördert und wieder abgezogen wird. Die daraus resultierenden Bewegungen der flexiblen Membranen treiben dann das sauerstoffarme Blut aus der rechten Kammer in die Lunge und das sauerstoffreiche aus der linken Kammer in den Körperkreislauf. Die Das französische Unternehmen Carmat erprobt sein Kunstherz bereits am Menschen. Quelle: Carmat Innenseite der Membranen ist mit Gewebe aus dem Herzbeutel von Kälbern überzogen, die Herzklappen sind ebenfalls aus Biomaterialien hergestellt. Das soll die Bildung gefährlicher Blutgerinnsel unterbinden und verhindern, dass die roten Blutkörperchen zerstört werden. Carmat-Herz wird in Frankreich bereits am Patienten erprobt Neben dem Antrieb enthält das Carmat-Herz Sensoren und einen Mikroprozessor. Diese Steuerungselektronik überwacht kontinuierlich die Druckverhältnisse in der Prothese und passt deren Leistung an die momentanen Bedürfnisse an. So erhöht sich beispielsweise der Blutfluss, wenn der Träger sich anstrengt. Im Dezember 2013 wurde das Kunstherz erstmals einem Menschen eingesetzt. Glückwünsche kamen sogar von Staatspräsident François Hollande: „ Frankreich darf auf diese sensationelle Leistung im Dienste der menschlichen Fortschritts sehr stolz sein“. Der 76-Jährige Mann verstarb allerdings nach zweieinhalb Monaten. Schuld war ein technischer Defekt des Implantats. Ein zweiter Patient starb nach neun Monaten. Der dritte Patient bekam das System am 8. April 2015 von den Herzspezialisten eingepflanzt und verstarb kurz vor Weihnachten. Nach Angaben des Unternehmens war die Todesursache allerdings nicht ein Geräteversagen. In der Machbarkeitsstudie sollen noch ein bis zwei weitere Patienten das Kunstherz erhalten. Anschließend plant Carmat dann eine klinische Studie mit 20 herzkranken Menschen. Deutsches Unternehmen entwickelt ein Kunstherz Soweit ist man bei der ReinHeart TAH GmbH noch nicht. Doch die Mitarbeiter verfolgen auch ein sehr ehrgeiziges Ziel: ein implantierbares Kunstherz als langfristige Lösung. „Wir möchten, dass es mindestens fünf Jahre arbeitet“, sagt Ingenieur Thomas Finocchiaro. Bei einer Herzfrequenz von 70 Schlägen in der Minute entspricht das fast 200 Millionen Schlägen, die rund 13 Millionen Liter Blut durch den Körper pumpen. Was das bedeutet, veranschaulicht der Vergleich mit einem Auto: Bei einer Geschwindigkeit von 50 Kilometer pro Stunde müsste der Wagen knapp 2,2 Millionen Kilometer ununterbrochen fahren – ohne Panne oder Werkstattbesuch. Um diese enorme Standfestigkeit zu erreichen, hat das am Institut für Angewandte Medizintechnik der RWTH Aachen entwickelte ReinHeart einen neuartigen elektromagnetischen Linearantrieb. Er besteht aus einem Permamagneten und einem Spulenträger, der im Magnetfeld auf einem axialen Gleitlager angebracht ist und auf beiden Seiten eine Druckplatte besitzt. Das Funktionsprinzip ähnelt dem eines Lautsprechers. Durch Dr.-Ing. Thomas Finocchiaro arbeitet am Institut für Anlegen eines oszillierenden Angewandte Medizintechnik der RWTH Aachen. Spulenstroms bewegt sich die Spule Quelle: Institut für Angewandte Medizintechnik/RWTH Aachen im Magnetfeld hin und her. Geht sie nach links, drückt die Druckplatte eine Membran in die linke Pumpkammer und treibt dort das Blut aus. Gleitet der Spulenträger nach rechts, stellt sich die Membran zurück, so dass die linke Kammer sich wieder füllen kann. Gleichzeitig wird das Blut aus der rechten Pumpkammer ausgeworfen. „Der Direktantrieb erzeugt die Kraft direkt in die Richtung, in der sie benötigt wird“, erläutert Finocchiaro. „Und es gibt nur ein bewegliches Bauteil, das nahezu reibungslos auf einer Gleitführung läuft.“ Lange Laufzeit bei minimalem Verschleiß – beschleunigte Ermüdungstests im Labor haben gezeigt, dass das System diese Anforderungen erfüllt. Außerdem arbeitet es sehr effizient. Denn während ein Lautsprecher nur Luft verdrängt, muss ReinHeart Kräfte von bis zu 70 Newton bereitstellen, bei möglichst geringem Energieverbrauch. „Unter 20 Watt wollten wir kommen, 12 Watt sind es jetzt“, freut sich Finocchiaro. Der Elektrotechniker hat das Kunstherzprojekt bereits an der Aachener Uni geleitet. Deutsches Kunstherz im Tierversuch erfolgreich Was die Entwickler unbedingt verhindern möchten, ist die Entstehung von Blutgerinnseln. Deshalb untersuchen sie mit Hochgeschwindigkeitskameras und Laserlicht, an welchen Stellen im Kunstherz der Blutfluss stockt und wo es Verwirbelungen gibt. Computersimulationen zeigen dann, wie die Form der Pumpkammern und der Ein- und Abflüsse idealerweise gestaltet sein sollte. „Je besser das Blut an den körperfremden Materialien vorbei fließ, desto geringer ist die Gefahr, dass sich Thromben bilden“, sagt Finocchiaro. Deshalb sei die strömungstechnische Optimierung sehr wichtig. Im Gegensatz zur französischen Konkurrenz besteht das ReinHeart ausschließlich aus Kunststoffen und Metall. Es gibt noch großes Entwicklungspotenzial, vor allem bei der Thromboseverhinderung durch Materialien, die möglichst biokompatibel sind. Finochario hofft auf Unterstützung von anderen Unternehmen aus Biomedizin und Medizintechnik. „Wenn Firmen hier Ihre Expertise einbringen würden, wäre das für uns von großem Interesse.“ In Tierversuchen hat das Der deutsche Prototyp eines vollständig Kunstherz bereits bewiesen, dass es implantierbaren Herzens wurde bereits erfolgreich die physiologische Blutzirkulation im Tierversuch getestet. vollständig übernehmen kann. „Der proof of principle ist erbracht“, sagt Quelle: Institut für Angewandte Medizintechnik/RWTH Aachen Finocchiaro. Vom Prototyp zum Produkt Deshalb wurde aus dem einst rein universitären Projekt im Juli 2015 eine GmbH ausgegründet. Denn jetzt möchten der Ingenieur und seine Kollegen die Entwicklung vom Prototyp zum Produkt vorantreiben – mit den entsprechenden Qualitätsanforderungen bei der Fertigung. Das ist Voraussetzung, um mit einer klinischen Studie am Menschen starten zu können. Außerdem soll das ReinHeart ein bisschen abspecken. Momentan liegen die Aachener noch 50 Gramm über dem Wunschgewicht von 800 Gramm. Eine weitere Herausforderung sind die Kosten. „Das Kunstherz soll von den Krankenkassen bezahlt werden können“, berichtet Finocchiaro. „Wir müssen bei unseren technischen Lösungen also auch immer eine kostengünstige Herstellung im Hinterkopf behalten.“ 50.000 bis 60.000 Euro sind avisiert. Das liegt etwa im Bereich eines Herzunterstützungssystems. Die Konkurrenten vom französischen Unternehmen Carmat veranschlagen für ihr Kunstherz weit über 100.000 Euro. 3 Entwicklung einer neuen Stromversorgung Bislang werden die Herzunterstützungssysteme und das Kunstherz über Kabel durch die Haut mit Strom versorgt. Eine bekannte Technologie könnte die Stromversorgung dieser Geräte revolutionieren. Bei den voll implantierbaren Kunstherzen erfolgt die Energieversorgung von außerhalb des Körpers. Der Patient trägt dazu einen Gürtel, an dem die Akkus angebracht sind. Die so genannte Driveline versorgt die Pumpe mit Strom. Sie läuft durch die Bauchdecke hindurch, was die Gefahr von Infektionen birgt. Damit keine Krankheitserreger in das Loch eindringen und das Kabel nicht verrutscht, muss die Stelle sauber gehalten und regelmäßig neu mit Pflaster verbunden werden. Zudem kann durch mechanische Beanspruchung die Driveline brechen. Großes Potenzial „Der Patient soll wieder ein möglichst normales, gutes Leben führen können“, sagt Thomas Finocchiaro. „Deshalb hat unser Kunstherz keine Drähte oder Schläuche, die nach außen führen.“ Der Träger kann duschen, ein Bad nehmen, es gibt keine Wunde, die versorgt werden muss, und – aus medizinischer Sicht am wichtigsten – das Infektionsrisiko ist gleich Null. „Die nicht-invasive transkutane Energieversorgung ist ein Punkt, an dem ich bei den VADs mit das größte Entwicklungspotenzial sehe“, sagt Jan Gummert vom Herz- und Diabeteszentrum NRW. Er verweist darauf, dass die zu übertragende Energiemenge wesentlich höher sei als beispielsweise bei einer elektrischen Zahnbürste. Eine weitere Schwierigkeit: Das System muss so zuverlässig arbeiten, dass Ausfälle Über Induktion soll die kabellose ausgeschlossen werden können. Energieversorgung des Kunstherzens der Gummert hofft, dass diese Hürden Reinheart TAH GmbH errmöglicht werden. bald überwunden sind. „Wenn die Quelle: Institut für Angewandte Medizintechnik/RWTH Aachen transkutane Energieübertragung möglich wird, könnte ich mir vorstellen, dass sehr viel mehr Patienten ein Herzunterstützungssystem bekommen werden.“ © medizintechnologie.de






