Nivolumab jetzt unabhängig von der NSCLC
Werbung

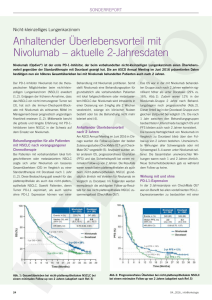
PharmaForum Neue Ära in der Therapie des nichtkleinzelligen Lungenkarzinoms (NSCLC) Nivolumab jetzt unabhängig von der NSCLC-Histologie als Zweitlinientherapie einsetzbar Weiterhin «medical need» beim NSCLC Schlechte Prognose und hohe Sterblichkeit beim NSCLC sind darauf zurückzuführen, dass die Mehrzahl der Tumore erst in fortgeschrittenen oder metastasierten, d.h. kurativ nicht mehr anzugehenden Stadien erkannt wird [5]. Bei den meisten betroffenen Patienten können derzeit leitliniengemäß nur Platindoubletten (+/- Bevacizumab) in der Erstlinientherapie eingesetzt werden. Bei der zytotoxischen Zweitlinientherapie – beispielsweise mit Docetaxel (ggf. mit Angiogenesehemmer) – sind oft therapiebegleitende Toxizitäten in Kauf zu nehmen [6], was ihren breiten Einsatz bei Patienten mit schlechtem Allgemeinzu- sches Signal übermittelt. So wird die Aktivität der T-Zelle herunterreguliert. Mit Nivolumab (Opdivo®) wurde ein Antikörper gegen PD-1 entwickelt, der die Interaktion des Rezeptors mit seinem Liganden verhindert [9]. Die aktivierte T-Zelle wird so bei der Erkennung der Tumorzelle nicht mehr in ihrer Funktion blokkiert – die Tumorzelle wird zerstört. Mit dieser neuen immunonkologischen Strategie ist ein Paradigmenwechsel in der Tumortherapie erfolgt: Greifen die bisherigen Therapeutika die Tumorzelle selbst an, so zielt der neue Ansatz auf die Immunzellen, um die Immunbremse gegenüber dem Tumor zu lösen. Paradigmenwechsel in der Tumortherapie Zwei positive Phase-III-Studien mit Nivolumab beim NSCLC Mit der Immun-Checkpoint-Blockade hat in den letzten Jahren ein innovativer Therapieansatz bei mittlerweile verschiedenen Tumorentitäten Erfolge gezeigt. Ziel dieser Strategie ist die Modulation der komplexen Mechanismen, mit deren Hilfe sich Tumoren der zellulären und humoralen Immunabwehr entziehen. Letztlich soll so die Immuntoleranz des Organismus gegenüber Tumorzellen ausgeschaltet werden. Wichtige Moleküle in diesem Prozess der «immune escape» sind der auf aktivierten T-Zellen exprimierte Rezeptor PD-1 und sein Ligand PD-L1 auf der Oberfläche von Tumorzellen [8]. Bei Interaktion zwischen Rezeptor und Ligand und damit direktem Kontakt zwischen T- und Tumorzelle wird ein inhibitori- Als erster PD-1-Inhibitor zeigte Nivolumab in einer Phase-III-Studie einen Überlebensvorteil bei vorbehandelten Patienten mit lokal fortgeschrittenem oder metastasiertem NSCLC mit Nicht-Plattenepithelhistologie im Vergleich zur Referenztherapie [1]. Die zulassungsrelevante Studie CheckMate 057 (CA209-057) umfasste 582 Patienten (Stadium IIIB/IV) mit Progress nach platinbasierter First-Line-Therapie. Sie wurden randomisiert dem Arm mit Nivolumab (3 mg/kg intravenös (i.v.) alle 2 Wochen) oder der Referenztherapie mit Docetaxel (75 mg/m² i.v. alle 3 Wochen) zugeteilt (Abb. 1). Beim Gesamtüberleben (primärer Endpunkt) erwies sich Nivolumab als signifikant überle- Patienten mit fortgeschrittenem nicht-plattenepithelialem NSCLC nach Versagen einer Platin-basierten Chemotherapie (n = 582) Haupteinschlusskriterien für die Patienten • nicht-plattenepitheliales NSCLC im Stadium IIIB/IV • nach Versagen einer Platin-basierten Chemotherapie • (archivierte oder frische) Gewebeproben vor Behandlung verfügbar • ECOG PS 0--1 • vorhergehende TKI-Therapie erlaubt (bei Patienten mit bekannter EGFRMutation oder ALK-Translokation) Nivolumab 3 mg/kg i.v. q2w PD oder inakzeptable Toxizität (n = 292) Docetaxel 75 mg/m2 i.v. q3w PD oder inakzeptable Toxizität (n = 290) Primärer Endpunkt: OS Sekundäre Endpunkte: ORR, PFS, Sicherheit, Wirksamkeit in Abhängigkeit von der PD-L1-Expression, Lebensqualität Stratifikation Vorherige Erhaltungstherapie Therapielinie (2. vs. 3.) Abb. 1. Design der Studie CheckMate 057, modifiziert nach [1]. PD = progrediente Erkrankung; OS = Gesamtüberleben; ORR = objektive Ansprechrate; PFS = progressionsfreies Überleben. © 2016 S. Karger GmbH, Freiburg Fax + 49 761 4 52 07 14 [email protected] www.karger.com Downloaded by: 88.99.70.242 - 11/1/2017 7:24:53 PM Das Lungenkarzinom ist mit 1,6 Millionen Todesfällen der Tumor mit der weltweit höchsten krebsbedingten Mortalität [2]. Auch in Deutschland gehört der Lungenkrebs mit rund 34 000 Neuerkrankungen bei Männern und 16 000 bei Frauen zu den häufigsten Krebserkrankungen, wobei die Fallzahlen bei Frauen wegen der veränderten Rauchgewohnheiten derzeit sogar noch steigen [3]. Häufigste histologische Subentität bei den Lungenkarzinomen ist mit rund 85% das NSCLC. Plattenepithelkarzinome und Adenokarzinome stellen hier den größten Anteil [4]. stand erschweren kann. Die personalisierte Therapie mit «small molecules» hat zwar das Management von Patienten mit Treibermutationen im EGF-Rezeptor oder mit EML4/ ALK-Fusionsgen verbessert. Diese definierten genetischen Anomalien sind jedoch nur bei maximal 20% aller NSCLC-Patienten nachweisbar [7]. Bei dem prognostisch ungünstigen fortgeschrittenen NSCLC besteht daher zweifellos weiterhin hoher therapeutischer Bedarf. Da es sich um eine palliative Therapie handelt, kommt dem Erhalt bzw. der Besserung der Lebensqualität in dieser Situation hohe Bedeutung zu. Randomisierung 1:1 Im April 2016 wurde die Indikation von Nivolumab beim NSCLC in der Europäischen Union (EU) auf die Behandlung lokal fortgeschrittener oder metastasierter Nicht-Plattenepithelkarzinome nach vorheriger Chemotherapie bei Erwachsenen ausgedehnt. Die Zulassungserweiterung stützt sich auf die Daten der Phase-III-Studie CheckMate 057, in der der Programmed Cell Death Protein 1 (PD-1)-Inhibitor zu einer signifikanten Verbesserung von Gesamtüberleben und Ansprechrate im Vergleich zu Docetaxel als Referenztherapie führte [1]. Bereits im Juli 2015 war Nivolumab für erwachsene Patienten mit lokal fortgeschrittenen oder metastasierten Plattenepithelkarzinomen der Lunge nach vorheriger Chemotherapie zugelassen worden. Damit kann der PD-1-Inhibitor jetzt unabhängig von der NSCLC-Histologie breit eingesetzt werden. Eine Testung auf die Expression des PD-1-Liganden (PD-L1) vor Therapiebeginn ist nicht erforderlich. PharmaForum 12-Monats-OS mOS, Monate 1-Jahres OS-Rate, % Nivo (n = 292) Doc (n = 290) Nivo (n = 292) Doc (n = 290) 12,2 9,4 12,2 9,4 51 39 51 39 39 23 18-MonatsOS-Rate, % HR (95%-KI) 80 60 0,73 (0,59–0,89) p = 0,0015 0,72 (0,60–0,88) Post-hoc p = 0,0009 51% Nivolumab Docetaxel 39% 40 39% 20 23% 0 0 3 6 9 12 15 18 Zeit, Monate 21 24 27 30 Anwendung unabhängig von der Histologie Das 18-Monats-Update zeigte ein unverändertes medianes Überleben (12,2 Monate mit Nivolumab vs. 9,4 Monate mit Docetaxel) Abb. 2. CheckMate 057: Anhaltende Verbesserung des Gesamtüberlebens durch Nivolumab vs. Docetaxel, modifiziert nach [10]. gen: Mit Docetaxel behandelte Patienten lebten median 9,4 Monate, die im Nivolumab-Arm dagegen 12,2 Monate. Der Unterschied entspricht einer signifikanten Reduktion des Mortalitätsrisikos um relativ 27% (Hazard Ratio (HR) 0,73; p = 0,002). Die 1-JahresÜberlebensrate wurde von 39% im Referenzarm auf 51% mit Nivolumab verbessert. Der Überlebensvorteil des PD-1-Inhibitors blieb auch bei längerem Follow-up erhalten: So lebten nach 18 Monaten noch 39% der mit Nivolumab behandelten im Vergleich zu 23% der mit Docetaxel behandelten Patienten (Abb. 2) [10]. Langfristig anhaltender Überlebensvorteil Besonders ausgeprägt profitierten Patienten mit starker PD-L1-Expression von Nivolumab [10]: Patienten mit ≥ 1%iger Expression überlebten median 17,7 Monate (Docetaxel: 9,0 Monate), die mit ≥ 5%iger Expression 19,4 Monate (Docetaxel 8,1 Monate) und die mit ≥ 10%iger Expression 19,9 Monate (Docetaxel 8,0 Monate). Bei Patienten mit geringer oder keiner PD-L1-Expression (< 1%) waren die Überlebenszeiten mit 10,5 Monaten im Nivolumab-Arm und 10,1 Monaten im Kontrollarm vergleichbar. Auch die Gesamtansprechrate konnte verbessert werden – von 12% mit dem Taxan auf 19% bei den mit Nivolumab behandelten Patienten (p = 0,02). Die Zeit bis zum Remissionseintritt war mit median 2,1 Monaten unter Ni- lumab, aber 15% mit Docetaxel. Damit kann das Sicherheitsprofil des PD-1-Inhibitors als günstiger im Vergleich zu Docetaxel gewertet werden. Auch stimmt es mit den Erfahrungen aus vorherigen Studien mit Nivolumab überein. Zu den für die Wirkklasse der ImmunCheckpoint-Blocker spezifischen Begleiterscheinungen gehören immunvermittelte Nebenwirkungen (z.B. Hautreaktionen, Hepatitis), die vermutlich auf die Modulation des Immunsystems zurückzuführen sind. Immunbedingte Nebenwirkungen Grad 3/4 waren jedoch mit Raten von maximal je 1% selten und können sich nach Einleiten der jeweils geeigneten Maßnahmen (siehe Therapiealgorithmen Fachinformation) zurückbilden. volumab und 2,6 Monaten mit dem Taxan ähnlich. Die Dauer des Ansprechens wurde durch den PD-1-Inhibitor etwa verdreifacht: Sie betrug unter Docetaxel median 5,6 Monate, unter Nivolumab dagegen 17,2 Monate. Besser verträglich als die Taxantherapie Zudem musste die bessere Wirksamkeit des PD-1-Inhibitors nicht mit vermehrten Nebenwirkungen erkauft werden – im Gegenteil: schwerwiegende therapiebedingte Nebenwirkungen (alle Grade) waren unter Nivolumab mit 7% seltener als unter dem Taxan mit 20%. Gleiches gilt für Therapieabbrüche aufgrund von Nebenwirkungen mit 5% unter Nivo- Aufgrund der positiven Ergebnisse der Studie CheckMate 057 wurde die Indikation von Nivolumab beim lokal fortgeschrittenen oder metastasierten NSCLC nach vorheriger Chemotherapie im April 2016 erweitert: Der PD-1-Inhibitor kann jetzt in der Zweitlinientherapie bei erwachsenen Patienten unabhängig von der zugrunde liegenden Tumorhistologie – d.h. bei Plattenepithel- und Nicht-Plattenepithelkarzinomen der Lunge – eingesetzt werden. Eine Testung auf die PD-L1-Expression vor Therapiebeginn ist nicht erforderlich. Doch sind bereits diagnostische Antikörper für die immunhistochemische Testung auf PD-L1 vorhanden. So stehen das in den Studien mit Nivolumab benützte Kit PharmDx DAKO 28-8 bzw. der Antikörper Abcam 28-8 zur Verfügung. Derzeit erfolgt im Rahmen eines deutschen Ringversuches eine Harmonisierung und Zertifizierung der PD-L1-Testung. Mit Nivolumab steht somit ein neuer Ansatz in der Zweitlinientherapie nach Versagen der Chemotherapie in der ersten Linie zur Verfügung. NSCLC mit plattenepithelialer Histologie, Stadium IIIb/IV 1 vorherige platinbasierte Chemotherapie, ECOG PS 0–1, n = 272 Nivolumab 3 mg/kg i.v. q2w n = 135 Bis PD oder inakzeptable Toxizität Randomisierung 1:1 Stratifizierungsfaktoren: Region, vorherige Behandlung mit Paclitaxel Docetaxel 75 mg/m2 i.v. q3w n = 137 Bis PD oder inakzeptable Toxizität Primärer Endpunkt: OS Zusätzliche Endpunkte: ORR (Investigator-bestimmt), PFS (Investigator-bestimmt), Korrelation zwischen PD-L1-Expression und Wirksamkeit, Sicherheit, Lebensqualität (LCSS) Abb. 3. Design der Studie CheckMate 017, modifiziert nach [12]. © 2016 S. Karger GmbH, Freiburg Fax + 49 761 4 52 07 14 [email protected] www.karger.com Downloaded by: 88.99.70.242 - 11/1/2017 7:24:53 PM 100 Gesamtüberleben (OS), % der Patienten 18-Monats-OS mOS, Monate (95%-KI) 100 90 80 70 60 50 40 30 20 10 0 Nivolumab n = 135 Docetaxel n = 137 9,2 (7,33–12,62) 6,0 (5,29–7,39) 103 122 Ereignisse Langfristige Überlegenheit von Nivolumab HR = 0,62 (0,48–0,081); P = 0,0004 12-Monats-OS-Rate = 42% 18-Monats-OS-Rate = 28% 12-Monats-OS-Rate = 24% 0 3 Anzahl der Patienten Nivolumab 135 113 Docetaxel 137 104 6 9 Nivolumab Docetaxel 18-Monats-OS-Rate = 13% 12 15 18 21 24 27 30 33 Zeit, Monate 86 69 69 57 51 37 25 14 6 46 33 22 17 11 7 3 Mindest-Follow-up zum Überleben: 18 Monate 0 1 0 0 Abb. 4. CheckMate 017: Verlängerung des Gesamtüberlebens durch Nivolumab vs. Docetaxel, modifiziert nach [12]. Fortschritt beim Lungenkarzinom mit Plattenepithel-Histologie Bereits seit Juli vergangenen Jahres ist Nivolumab in der EU für die Behandlung des lokal fortgeschrittenen oder metastasierten NSCLC mit Plattenepithelhistologie nach vorheriger Chemotherapie bei Erwachsenen zugelassen. Die Zulassung der European Medicines Agency stützte sich auf die unverblindete Studie CheckMate 017 (CA209-017), die weitestgehend das identische Design besitzt wie CheckMate 057 [11]. Sie umfasste 272 vorbehandelte Patienten, die in randomisierter Zuordnung mit Nivolumab oder Docetaxel behandelt wurden (Abb. 3). Primärer Endpunkt war wiederum das Gesamtüberleben; als sekundäre Endpunkte waren u.a. progressionsfreies Überleben und Gesamtansprechrate definiert. Für CheckMate 017 konnten Patienten ebenfalls unabhängig vom PD-L1-Expressionsstatus rekrutiert werden. Die Anteile von Teilnehmern mit PD-L1negativen und -positiven Tumoren in CheckMate 017 waren ausgewogen. Auch in dieser Studie belegte Nivolumab seine Überlegenheit gegenüber dem bisherigen Therapiestandard: Während mit Docetaxel behandelte Teilnehmer median 6,0 Monate überlebten, erstreckte sich das Gesamtüberleben im Nivolumab-Arm auf 9,2 Monate. Die 1-Jahres-Überlebensrate stieg von 24% mit dem Taxan auf 42% bei den mit Nivolumab behandelten Patienten. Damit reduzierte der PD-1-Inhibitor das Sterberisiko signifikant um relativ 41% (HR 0,59; p < 0,001). Auch aus CheckMate 017 liegen bereits positive 18-Monats-Daten vor, die für die anhaltende Überlegenheit des ImmunCheckpoint-Inhibitors im Vergleich zur Zweitlinien-Chemotherapie sprechen: Die 18-Monats-Überlebensrate im NivolumabArm beträgt 28% und ist damit mehr als doppelt so hoch wie bei den mit Docetaxel behandelten Patienten mit 13% (Abb. 4) [12]. Es fällt auf, dass sich die Überlebenskurve des Nivolumab-Arms praktisch von Beginn an von der im Docetaxel-Arm trennte. Von der Therapie hatten Patienten fast aller vorab definierten Subgruppen einen Überlebensvorteil, unabhängig von der Art der Vortherapie, dem Eastern Cooperative Oncology Group (ECOG) Performance-Status (PS), Zentralnervensystem (ZNS)-Metastasen und Raucherstatus. mPFS, Monate (95%-KI) progressionsfreies Überleben (PFS), % der Patienten Die Option einer weiteren Chemotherapie in der dritten Linie bleibt bestehen. Auch beim progressionsfreien Überleben zeigte sich ein deutlicher Benefit für Nivolumab: Mit dem PD-1-Inhibitor behandelte Patienten lebten median 3,5 Monate ohne Progress, die mit Docetaxel behandelten 2,8 Monate (HR 0,62; p < 0,001) [11]. Die 1-Jahres-Rate für das progressionsfreie Überleben wurde mehr als verdreifacht: von 6,4% im Referenzarm auf 21% mit Nivolumab. Nach 18 Monaten lag die Rate im Nivolumab-Arm bei 17% und unter Docetaxel bei 2,7% (Abb. 5) [12]. Die Responserate wurde etwa verdoppelt: Auf Nivolumab sprachen 20% der Studienteilnehmer, auf Docetaxel dagegen 9% an (p = 0,008). Wiederum war die Zeit bis zum Ansprechen bei beiden Therapien mit 2,2 Monaten für Nivolumab und 2,1 Monaten für das Taxan vergleichbar. Erneut aber zeigte sich ein deutlicher Unterschied in der Remissionsdauer: Sie beträgt bei den mit Docetaxel behandelten Patienten 8,4 Monate. Bei Respondern auf Nivolumab ist der Median in der Ansprechdauer dagegen noch nicht erreicht (2,9 bis 20,5+). Der Expressionslevel von PD-L1 (1%, 5%, 10%) in der Studie CheckMate 017 erwies sich weder als prognostisch noch als prädiktiv [12]: Patienten mit ≥ 5%iger Expression überlebten unter der Nivolumab-Therapie median 10,0 Monate (Docetaxel: 6,4 Monate). Bei geringerer Expression von PD-L1 (< 5%) betrug die Überlebenszeit unter Nivolumab median 8,5 Monate, unter Docetaxel median 6,1 Monate. Auch bei der Verträglichkeit punktete Nivolumab erneut: Therapiebedingte Nebenwirkungen (Grad 3–5) traten bei 8% der Studien- 100 90 80 70 60 50 40 30 20 10 0 Ereignisse Nivolumab n = 135 Docetaxel n = 137 3,5 (2,14–5,06) 2,8 (2,14–3,52) 105 122 HR = 0,63 (0,48–0,83); P = 0,0008 12-Monats-PFS-Rate = 21% 12-Monats-PFS-Rate = 6,4% 18-Monats-PFS-Rate = 17% Nivolumab 18-Monats-PFS-Rate = 2,7% 0 3 6 9 12 Anzahl der Patienten Nivolumab 135 68 Docetaxel 137 62 48 27 33 10 24 8 15 18 Zeit, Monate 20 3 16 1 Docetaxel 21 24 27 30 12 1 8 0 2 0 30 0 Mindest-Follow-up zum Überleben: 18 Monate Abb. 5. CheckMate 017: Verlängerung des progressionsfreien Überlebens durch Nivolumab vs. Docetaxel, modifiziert nach [12]. © 2016 S. Karger GmbH, Freiburg Fax + 49 761 4 52 07 14 [email protected] www.karger.com Downloaded by: 88.99.70.242 - 11/1/2017 7:24:53 PM Gesamtüberleben (OS), % der Patienten PharmaForum 10 Docetaxel MID 0 í10 í20 í30 a a,b a,b a a,b Nivolumab a aP < 0,05 vs. Ausgangswert bP < 0,05 für Nivolumab vs. Docetaxel 12 24 30 29 47 9 29 5 29 MID í40 Docetaxel (n = 89) Nivolumab (n = 97) 36 42 Zeit, Woche 5 20 4 17 48 54 60 4 12 2 12 1 8 Abb. 6. CheckMate 017: Verbesserung der Symptomlast durch Nivolumab vs. Docetaxel, modifiziert nach [13]. MID = Minimal Important Difference. teilnehmer auf, wurden im Docetaxel-Arm dagegen in 58% der Fälle dokumentiert [12]. Auch starben 2% der mit dem Taxan behandelten Patienten therapiebedingt, während unter Nivolumab kein derartiger Todesfall verzeichnet wurde. Behandlungsabbrüche wegen therapiebedingter Nebenwirkungen (Grad 3–5) waren im Docetaxel-Arm mit 7% mehr als doppelt so häufig wie unter Nivolumab mit 3%. Abnahme der Symptomlast und verbesserte Lebensqualität Hohe Effektivität und gute Verträglichkeit von Nivolumab äußerten sich zudem in einer Verbesserung der mit der Lung Cancer Symptom Scale (LCSS) ermittelten Symptomlast [13]: Während sich diese im Docetaxel-Arm im Studienverlauf allmählich verschlechterte, war bei den mit Nivolumab behandelten Patienten eine Verbesserung festzustellen (Abb. 6). Ab Studienwoche 30 war der Unterschied zu Docetaxel signifikant (p < 0,05). Deutlich vorteilhaft war der PD-1-Inhibitor insbesondere bei den Symptomen Anorexie, Fatigue, Dyspnoe und Schmerzen. Eine symptomatische Verschlechterung trat bei den mit Nivolumab behandelten Patienten erheblich später auf als unter der Docetaxel-Therapie. Ein ähnliches Bild zugunsten von Nivolumab ergab sich auch bei der Ermittlung der Lebensqualität mithilfe des Fragebogens EQ-5D VAS. Neu in der Onkopedia-Leitlinie der DGHO Aufgrund der positiven Daten der Studie CheckMate 017 zu Effektivität und Verträglichkeit wurde die Zweitlinientherapie mit Nivolumab bereits in die Onkopedia-Leitlinie der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO) aufgenommen [14]. Der PD-1-Blocker sollte danach bei Patienten mit lokal fortgeschrittenem oder metastasiertem NSCLC mit Plattenepithelhistologie eingesetzt werden, die nach platinhaltiger Kombinationschemotherapie einen Progress erleiden. Die bisherigen Zweitlinienoptionen Docetaxel und Erlotinib sind in die dritte Therapielinie gerückt. Der Gemeinsame Bundesausschuss (G-BA) hat für die Patienten, die für Docetaxel geeignet sind, Nivolumab beim Plattenepithelkarzinom der Lunge einen Hinweis auf einen beträchtlichen Zusatznutzen attestiert. Laut G-BA handelt es sich «um eine bisher nicht erreichte deutliche Verbesserung des therapierelevanten Nutzens, insbesondere da eine moderate Verlängerung der Lebensdauer sowie eine bedeutsame Verringerung von schwerwiegenden Nebenwirkungen und anderen Nebenwirkungen erreicht wird.» Bei Patienten, die nicht für Docetaxel geeignet sind und bei denen Nivolumab gegenüber Best-Supportive-Care zu vergleichen war, wurde aufgrund fehlender Daten kein Zusatznutzen festgestellt [15]. Fazit: Neue Säule in der Krebstherapie Mit Nivolumab steht damit jetzt eine effektive und verträgliche Zweitlinientherapie für NSCLC-Patienten im Stadium IIIB und IV nach Progress unter platinbasierter Chemotherapie unabhängig von der Tumorhistologie zur Verfügung. Eine Testung auf die PD-L1-Expression ist nicht nötig, sodass der Arzt in seiner Therapiewahl frei ist. Positive Daten zur Immun-Checkpoint-Blockade liegen inzwischen nicht nur beim Melanom und NSCLC, sondern auch beim Nierenzellkarzinom vor. Die immun- © 2016 S. Karger GmbH, Freiburg Fax + 49 761 4 52 07 14 [email protected] www.karger.com Dr. Katharina Arnheim, Freiburg i.Br. Literatur 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Borghaei H et al.: N Engl J Med 2015; 373:1627–1639. www.dgvn.de/meldung/welt-krebs-bericht-2014. www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/krebsarten/definition/lunge-seite-1. html. Hammerschmidt S, Wirtz H: Dtsch Arztebl Int 2009;108:809–820. Molina JR et al.: Mayo Clin Proceed 2008;83:584–594. Garassino MC: ASCO 2015; Lung Cancer Track: Immunotherapy in Lung Cancer: A Paradigm Shift. Pao Wet al.: Lancet Oncol 2011;12:175–180. Postow MA et al.: J Clin Oncol 2015;33:1974–1982. Wang C et al.: Cancer Immunol Res 2014;2:846–856. Horn L et al.: Ann Oncol 2015;26(suppl 6):abstr 3010. Brahmer J et al.: N Engl J Med 2015;373:123–135. Reckamp K et al.: J Thorac Oncol 2015;10(suppl): Vortrag und abstr 02.01. Gralla RJ et al.: J Thorac Oncol 2015;10(suppl):abstr 943. Griesinger F et al.: Onkopedia-Leitlinie, unter www. dgho-onkopedia.de, Version 02/2016. https//:www.g-ba.de/downloads/92-975-922/2015-08-12_ Modul1_Nivolumab.pdf. Clinical Cancer Advances 2016: ASCO’s Annual Report on Progress Against Cancer. Impressum Neue Ära in der Therapie des nicht-kleinzelligen Lungenkarzinoms (NSCLC) Nivolumab jetzt unabhängig von der NSCLC-Histologie als Zweitlinientherapie einsetzbar PharmaForum in ONCOLOGY RESEARCH AND TREATMENT 39 l 6 l 16 © 2016 by S. Karger Verlag für Medizin und Naturwissenschaften GmbH Wilhelmstraße 20A 79098 Freiburg, Deutschland Mit freundlicher Unterstützung durch Bristol-Myers Squibb GmbH & Co. KGaA Verlag, Herausgeber, Redaktion und Verlagsgeschäftsführung übernehmen keine Verantwortung für den Inhalt dieser Rubrik. Downloaded by: 88.99.70.242 - 11/1/2017 7:24:53 PM 20 onkologische Therapie ist damit auf gutem Wege, sich zu einer weiteren Säule in der Krebstherapie – neben Chirurgie, Strahlenund Chemotherapie sowie zielgerichteter Therapie – zu entwickeln. Von der American Society of Clinical Oncology (ASCO) wurde der Aufstieg der Immuntherapie kürzlich in ihrem Jahresreport 2016 als «ASCO’s Advance of the Year» bewertet [16]. Die ASCO erwartet, dass die Immuntherapie nach dem Melanom auch das Outcome für Patienten mit Karzinomen von Lunge, Blase, Leber, Niere sowie Kopf-Hals-Tumoren und NonHodgkin-Lymphomen verbessern wird. 1506DE16PR05551-01 30 Schlechter 40 Besser LCSS: Durchschnittliche Abweichung des Symptomlastindex vom Ausgangswert PharmaForum