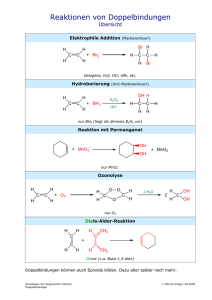
FETTSÄUREBIOSYNTHESE
Werbung

FETTSÄUREBIOSYNTHESE Im Folgenden geht es um einige speziellere Beispiele aus dem Bereich der Fettsäurebiosynthese. Wie wir gerade am Beispiel der Palmitatsynthese gesehen haben, werden hierzu 8 Moleküle AcetylCoA, 14 Moleküle NADPH und 7 Moleküle ATP benötigt. Hier besteht nun ein räumliches Problem, da die Fettsäuren im Cytosol synthetisiert werden, das AcetylCoA aber in den Mitochondrien (aus Pyruvat) entsteht. ÎDas bedeutet, dass AcetylCoA zur Fettsäurebiosynthese ins Cytosol hintransportiert werden muss. Nun sind Mitochondrien aber nicht frei permeabel für AcetylCoA, sodass zum folgenden Vehikel gegriffen werden muss: Durch Kondensation von AcetylCoA und Oxalacetat entsteht in der mitochondrialen Matrix Citrat. Die oben genannte Barriere AcetylCoA für die Mitochondrien wird nun durch dieses Citrat umgangen, das seinerseits Acetylgruppen durch die innere Mitochondrienmembran transportiert. Liegt Citrat in hoher Konzentration vor, so wird es ins Cytosol transportiert und dort wiederum durch die ATP-Citrat-Lyase gespalten. (Lyasen sind Enzyme, die die Spaltung von C-C-, C-O-, oder C-N-Bindungen durch Eliminierung katalysieren. Hier entsteht jeweil eine Doppelbindung.) Citrat + ATP + CoA + H2O AcetylCoA + ADP + Pi + Oxalacetat Das Oxalacetat, das im Cytosol ja lediglich als „Hilfsagens“ zur Citratsynthese beigetragen hat, muss in die Mitochondrien zurücktransportiert werden. Das ist allerdings nicht ganz so einfach, da die innere Mitochondrienmembran für Oxalacetat undurchlässig ist. Wiederum ist es also notwendig, dass Umgehungsreaktionen diesen Weg gangbar machen: Auf diese Weise wird übrigens der Großteil der für die Fettsäuresynthese erforderlichen Menge NADH erzeugt! 1. Oxalacetat + NADH + H+ 2. Malat + NADP+ Malat + NAD+ (Kat. Malat-Dehydrogenase im Cytosol) Pyruvat + CO2 + NADPH (Oxidative Decarboxylierung durch NADP+-abhängiges Malat-Enzym (malic enzyme) 3. Pyruvat + CO2 + ATP + H2O Oxalacetat + ADP + Pi + 2 H+ (Pyruvat- Carboxylase) Summe: NADP+ + NADH + ATP + H2O NADPH + NAD+ + ADP + Pi + H+ Für jedes AcetylCoA entsteht demnach ein Molekül NADPH. Damit werden 8 Moleküle NADPH gebildet, am Beispiel der Palmitat-Synthese. Die fehlenden 6 Moleküle NADPH stammen aus dem Pentosephosphatweg (über den wir bereits etwas erfahren haben). Diese Bereitstellung der Vorstufen der Fettsäuresynthese dient als exzellentes Beispiel für die Koordination mehrerer Prozesse, um einem biochemischen Zweck zu dienen. Citratzyklus, Subzelluläre Kompartimentierung, Pentosephosphatweg sorgen für die Kohlenstoffatome und die Reduktionskraft. - Glykolyse oxidative Phosphorylierung sorgen für das ATP, das für die Fettsäuresynthese benötigt wird. Ggf. Fettsäure-Synthase-Inhibitoren und Polyketid- und nichtribosomale Peptidsynthetasen Die Acetyl CoA-Carboxylase spielt eine Schlüsselrolle bei der Kontrolle des Fettsäure-Stoffwechsels Synthese und Abbau von Fettsäuren reagieren extrem empfindlich auf veränderte Stoffwechselbedürfnisse. Hier hat das Enzym Acetyl-CoA-Carboxylase eine Schlüsselrolle inne. Es katalysiert die Bildung des Malonyl CoA, also die wesentliche, geschwindigkeitsbestimmende Reaktion der Fettsäure-Synthese. Selbst wird es von Glucagon, Adrenalin und Insulin gesteuert, wobei Insulin die Fettsäure-Synthese stimuliert, die Carboxylase also aktiviert, Glucagon und Adrenalin jedoch umgekehrt wirken (die Fettsäure-Synthese also blockieren und die Carboxylase deaktivieren). Ebenso aktiviert Citrat die Carboxylase (sein Vorhandensein zeigt eine ausreichende Versorgung mit Bausteinen und Energie an). Sind jedoch Palmitoyl-CoA und AMP vorhanden, so hemmen sie. Dieses überaus wichtige Enzym wird also sowohl lokal, als auch übergeordnet reguliert. 1. übergeordnete Regulation Durch Phosphorylierung kann die AcetylCoA-Carboxylase abgeschaltet, und umgekehrt durch Dephosphorylierung aktiviert werden. Durch eine AMP-abhängige Proteinkinase (AMPK) wird ein Serinrest modifiziert und somit die Carboxylase in ihre inaktive Form überführt. Der gegenläufige Weg erfolgt durch die Entfernung der Phosphorylgruppe durch Proteinphosphatase 2A von der Carboxylase. Die Phosphorylierung durch AMPK wird durch AMP aktiviert, durch ATP deaktiviert. Das heißt: Ist wenig Energie vorhanden, wird die Carboxylase inaktiviert Æ der FettsäureAufbau wird eingestellt. Gleichzeitig wird die Phosphatase 1A gehemmt, um AcetylCoA-Carboxylase im phosphorylierten Zustand zu halten. Die Hormone Adrenalin und Glucagon aktivieren ebenfalls wieder die Proteinkinase A, die auch die Phosphatase durch Phosphorylierung hemmt. Î Ausschaltung der Fettsäure-Synthase durch Erhaltung der Carboxylase im phosphorylierten Zustand. Die Aktivierung bzw. Dephosphorylierung erfolgt mittels Insulin; die Carboxylase wird stimuliert. 2. lokale Regulation Durch Citrat wird AcetylCoA-Carboxylase allosterisch aktiviert. D.h. Citrat hebt die Hemmung durch Phosphorylierung z. T. wieder auf. Die inaktive AcetylCoA-Carboxylase liegt als Oktamer vor. Citrat nun macht die Polymerisierung der inaktiven Oktamere zu aktiven möglich. viel AcetylCoA + viel ATP Î viel Citrat Ist viel Citrat vorhanden, so weist das auf viele vorhandene C2-Einheiten und ATP hin; die Fettsäure-Synthese kann starten. Liegt allerdings viel Palmitoyl-CoA vor, hebt dies den stimulierenden Effekt auf die Carboxylase auf; die aktiven Filamente werden zu inaktiven Oktameren aufgetrennt. Das heißt: Ist viel Produkt bereits vorhanden, so wird die Synthese gar nicht erst gestartet. Synthese und Abbau von Fettsäuren kommen nie gleichzeitig vor; ihre Regulation erfolgt reziprok. Wie wir bereits wissen, steigt im Hungerzustand der Gehalt des Blutes an freien Fettsäuren an, da Glucagon und Adrenalin die Lipasen der Fettzellen stimulieren. Insulin hingegen hemmt die Lipolyse. Auch die AcetylCoA-Carboxylase reguliert hier: Stehen energiereiche Brennstoffmoleküle zur Verfügung, ist MalonylCoA in großer Menge vorhanden. (Zur Erinnerung: der geschwindigkeitsbestimmende Schritt der FettsäureSynthese) Î Die Carnitin-Acyltransferase I wird gehemmt; dadurch wird verhindert, dass CoAgebundene Fettsäuren in „fetten“ Zeiten in die Mitochondrien-Matrix gelangen. Sie ist besonders effektiv in Geweben, die selbst nur in sehr geringem Umfang Fettsäure-Synthese betreiben können, wie Herz und Muskeln. Die Aktivität der Enzyme der Fettsäure-Synthese (AcetylCoA-Carboxylase und FettsäureSynthase) steigt im Tierversuch nach einer Fastenperiode wieder deutlich an, wenn die Tiere kohlenhydratreiche und fettarme Nahrung erhalten. Man spricht hier von adaptiver Kontrolle. Verlängerung der Fettsäuren und Einführung von Doppelbindungen Das Hauptprodukt in der Fettsäure-Synthase-Reaktion ist Palmitat. Darüber hinaus benötigte längere Fettsäuren entstehen bei Eukaryoten durch Kettenverlängerungsreaktionen, die auf der cytosolischen Seite der Membran des endoplasmatischen Reticulums von Enzymen katalysiert werden. Die Verlängerung geschieht immer in Form von C2-Einheiten (Malonyl-CoA), die an das Carboxylende von gesättigten und ungesättigten CoA-gebundenen Fettsäuren angefügt werden. Hier treibt die Decarboxylierung des Malonyl-CoA die Kondensation dieser Einheiten an. Ungesättigte Fettsäuren werden durch membrangebundene Enzyme erzeugt In langkettige AcylCoAs werden im Endoplasmatischen Retikulum Doppelbindungen eingeführt. Beispielsweise fügt eine Oxygenase eine cis-∆9-Doppelbindung in StearoylCoA ein – und es ensteht OleoylCoA. Hierbei wird molekularer Sauerstoff und NADH (oder NADHP) verwendet. StearoylCoA + NADH + H+ + O2 OleoylCoA + NAD+ + 2 H2O Drei membrangebundene Enzyme katalysieren diese Reaktion: • • • NADH-Cytochrom-b5-Reduktase Cytochrom b5 Desaturase Zunächst werden Elektronen von NADH auf den FAD-Teil der NADH-Cytochrom-b5Reduktase übertragen. - Cytochrom b5 besitzt Hämeisen, das zur zweiwertigem Eisen reduziert wird. - Nun wird das Nicht-Häm-Eisenatom der Desaturase ebenfalls in die zweiwertige Form überführt, der damit eine Wechselwirkung mit Sauerstoff und dem CoA-Derivat der gesättigten Fettsäure ermöglicht wird. - Somit entsteht eine Doppelbindung in der Fettsäure und es werden 2 Moleküle Wasser frei. Zwei der benötigten Elektronen stammen vom NADH, zwei aus der Einfachbindung der ursprünglichen Fettsäure. Weitere ungesättigte Fettsäuren können aus Oleat durch Kombinationen von Verlängerung und Einführung von Doppelbindungen gebildet werden. Beispielsweise können durch Einführung weiterer Doppelbindungen carboxylwärts im Divinylmethanrhythmus (also durch isolierte Doppelbindungen) und Kettenverlängerung viele verschiedene Polyensäuren entstehen. Da Doppelbindungen im menschlichen und tierischen Organismus niemals zwischen der durch ∆9-Desaturase eingeführten ∆9-Doppelbindung und dem Methylende, sondern immer nur carboxylwärts eingebaut werden können, sind Linolsäure und Linolensäure essentielle Nahrungsbestandteile und ihre Folgeprodukte – durch weitere Desaturierung und Kettenverlängerung – sind essentielle Metabolite, die ihrerseits ganz bestimmte biologische Funktionen haben. Kleiner Exkurs in die Ernährungswissenschaft: Linolsäure – als Ethyllinolat, ist beteiligt an der Regulation der Permeabilität der Haut für Wasser. Ihre Folgeprodukte, insbesondere Arachidonsäure, sind essentielle Bestandteile von Lipiden in biologischen Membranen (spielt gleich auch noch eine Rolle!) Bei Linolsäuremangel werden Linolsäureabkömmlinge durch andere Fettsäuren ersetzt, was zu einer Änderung von Membraneigenschaften führt. Zeichen eines Linolsäuremangels sind trockene, schuppende Hautausschläge mit Zunahme der Wasserverdunstung durch die Haut, Nierenveränderungen mit Hämaturie und Fertilitätsstörungen. Der Bedarf an Linolsäure wird beim Erwachsenen auf etwa 10g/Tag geschätzt. Bis zum Auftreten von Mangelerscheinungen kann eine beträchtliche Zeitspanne vergehen, weil im Fettgewebe – abhängig von der Vorernährung – große Mengen an Linolsäure gespeichert sein können. Bei parenteraler Ernährung mit glucosehaltigen Lösungen kann ein Patient, durch die glucosebedingte Insulinstimulierung (und damit Lipolysehemmung) von seinem Fettgewebe isoliert, schon in wenigen Tagen einen Linolsäuremangel entwickeln. Eicosanoidhormone leiten sich von mehrfach ungesättigten Fettsäuren ab Die wichtigste Vorstufe einiger Gruppen von Signalmolekülen, nämlich der Prostaglandine, der Prostacycline, Thromboxane und Leukotriene, ist Arachidonat, eine 20:4-Fettsäure. Ein Prostaglandin ist eine Fettsäure mit 20 Kohlenstoffatomen und einem Ring aus fünf CAtomen. Reduktasen und Isomerasen bilden viele unterschiedliche Prostaglandine; man bezeichnet die Hauptklassen als PGA bis PGI, wobei ein Index die Anzahl Kohlenstoff-Atome außerhalb des Ringes beziffert. Hat ein Prostaglandin zwei Doppelbindungen (PGE2), so ist es aus Arachidonat entstanden. Die anderen beiden Doppelbindungen sind bei der Synthese des fünfgliedrigen Ringes verlorengegangen. Prostacyclin und Thromboxane gehen aus einer Zwischenstufe der Prostaglandinsynthese hervor, und sind demnach miteinander verwandt. Prostacyclin- bzw, Thromboxan-Synthasen sind für ihre Bildung verantwortlich. Leukotriene wiederum werden aus Arachidonat durch Lipoxygenase gebildet. Zuerst wurden sie in Leukozyten entdeckt; da sie 3 konjugierte Doppelbindungen enthalten, entstand ihr Name. Prostaglandine, Prostacycline, Thromboxane und Leukotriene enthalten 20 Kohlenstoffatome und werden daher als Eicosanoide bezeichnet (eikosi = zwanzig). Es handelt sich hierbei um lokale Hormone, die kurzlebig sind. Sowohl die Aktivität der Zellen, in denen sie synthetisiert werden, als auch die ihrer Nachbarzellen, werden verändert, indem sie an 7TM-Rezeptoren binden. Im Gegensatz zu übergeordneten Hormonen wie Insulin und Glucagon variieren die Effekte dieser lokalen Hormone von Zelltyp zu Zelltyp. Prostaglandine stimulieren Entzündungsreaktionen regulieren den Blutfluss zu bestimmten Organen kontrollieren den Ionentransport durch Membranen modulieren die synaptische Übertragung lösen den Schlaf aus kleiner Exkurs in die Pharmakologie: Aspirin blockiert den Zugang zum aktiven Zentrum des Enzyms, das Arachidonat in Prostaglandin H2 umwandelt. Weil Prostaglandin H2 die Vorstufe für weitere Prostaglandine, Prostacyclin und Thromboxane darstellt, wirkt sich die Blockierung dieses Schrittes auf viele Signaltransduktionswege aus. Hier liegt die Grundlage für die umfangreiche Wirkungsweise von Aspirin und verwandten Verbindungen bei Entzündungen, Fieber, Schmerzen sowie auf die Blutgerinnung.