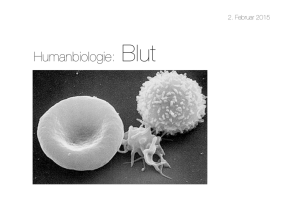
Produkteeigenschaften und Einsatz von Ek, Tk und FGP
Werbung

OPTIMALER EINSATZ VON BLUT ZUSAMMENFASSUNGEN DER PRODUKTEIGENSCHAFTEN Der Text wurde mit der Genehmigung des Europarates übersetzt. Die Verantwortung für die Übersetzung trägt Swissmedic. Das Copyright der englischen Version gehört ausschliesslich dem Europarat Council of Europe on publication in English. This translation is published by arrangement with the Council of Europe and is the sole responsibility of Swissmedic. The copyright for the original version is held by the Council of Europe exclusively: Council of Europe on publication in English. Einleitung Die europäischen Blutspendedienste verfügen über einen hervorragenden Leistungsausweis bezüglich der Optimierung der Qualität und Sicherheit von Blut und Blutkomponenten sowie im Bereich der Blutgruppenbestimmung und der prätransfusionellen Testung zur Kompatibilitätbestimmung zwischen Blutpräparat und Empfänger. Unterstützt werden diese Bemühungen um eine kontinuierliche Verbesserung auch durch die regelmässig aktualisierten Richtlinien des Europarats Guide to the preparation, use and quality assurance of blood components, die inzwischen als «Goldstandard» der Transfusionsmedizin gelten. Um die Sicherheit von Blutprodukten weiter zu erhöhen, braucht es Verbesserungen im letzten Teil der Transfusionskette – bei der Verabreichung der Blutpräparate an die Patienten. Bereits vorhandene wichtige Beiträge sind die Empfehlung des Europarats Council of Europe Recommendation (2002)11 on the hospital’s and clinician’s role in the optimal use of blood and blood products sowie der Empfehlung Recommendation on teaching transfusion medicine to nurses. Die Monographien zu den Blutkomponenten und ihren Merkmalen der Expertengruppe SP-HM des Europarats (Council of Europe Committee of Experts in Blood Transfusion) wurden gezielt zur Unterstützung der Bemühungen um eine weiter optimierte Sicherheit und Qualität des letzten Teils der Transfusionskette erarbeitet. Die Monographien sollen die Mitgliedsstaaten bei der Umsetzung der Empfehlung des Europarats (2002)11 sowie der Empfehlung Recommendation on teaching transfusion medicine to nurses erwähnten Schulungen unterstützen. Die Monographien werden als Richtlinien empfohlen und können europaweit in allen Spitälern verwendet werden. Zudem können sie als Packungsbeilagen eingesetzt werden. Die vorliegenden Monographien umfassen Texte über Erythrozyten, Thrombozyten, gefrorenes Frischplasma und Granulozyten. Die Expertengruppe SP-HM will diese Auswahl in Zukunft überprüfen, aktualisieren und erweitern. - 2 - ERYTHROZYTEN Zusammenfassung der Eigenschaften von Erythrozytenkonzentraten 1. Definition Erythrozyten, in additiver Lösung oder in Plasma suspendiert. (Anmerkung: In der Schweiz werden homolog ausschliesslich Erythrozytenkonzentrate (EK) in additiver Lösung, leukozyten-depletiert, hergestellt). Die Erythrozytenkonzentrate können aus einer Vollblutspende (450-500 ml) oder aus einer Erythrozytapherese hergestellt werden. 2. Physiologie und Eigenschaften Erythrozyten oder rote Blutkörperchen sind kernlose Zellen, die in hoher Konzentration Hämoglobin enthalten, welches Sauerstoff für den Transport von den Lungen in die peripheren Gewebe und Kohlendioxid für den Transport in umgekehrter Richtung bindet. Hämoglobin Das Hämoglobin-Molekül besteht aus vier Peptidketten. Jede Kette trägt ein Häm-Molekül, das ein Sauerstoffmolekül (O2) binden kann. Die Bindung eines Sauerstoffmoleküls beeinflusst die räumliche Anordnung der Ketten im Hämoglobin-Protein und begünstigt dadurch die Bindung weiterer Sauerstoffmoleküle. Auf diese Weise wird ein Verhältnis zwischen Sauerstoffkonzentration (PO2) und Sauerstoffsättigung des Hämoglobins (SO2) erreicht, das die Freisetzung des Sauerstoffs vom Blut in die Körpergewebe unterstützt. Die Bindung von Sauerstoff an Hämoglobin bei den in Gewebe und peripheren Blutgefässen vorherrschenden Sauerstoffkonzentrationen wird durch folgende Faktoren beeinflusst: - Konzentration von 2,3-Diphosphoglycerat (DPG). Eine sinkende Konzentration fördert die Bindung von Sauerstoff an Hämoglobin, eine steigende Konzentration dagegen verringert die Bindungsstärke. Bei einer normalen Sauerstoffaufnahme über die Lunge wird dadurch die Freisetzung von Sauerstoff in den Geweben mit Sauerstoffbedarf gefördert. - Ein niedriger pH und erhöhter PCO2 führen unabhängig voneinander zu einer schlechteren Bindung von Sauerstoff, wodurch die Freisetzung von Sauerstoff in den Geweben mit Sauerstoffbedarf erleichtert wird. Blutgruppenantigene Erythrozyten tragen die genetisch festgelegten Blutgruppenantigene, auf denen die 27 Blutgruppensysteme beruhen. Wenn der Empfänger einer Erythrozytentransfusion spezifische Antikörper gegen Blutgruppenantigene der transfundierten Erythrozyten entwickelt, kann dies zu einer hämolytischen Transfusionsreaktion führen. Mütterliche IgG-Antikörper gegen Blutgruppenantigene des Fötus können zu hämolytischen Erkrankungen des Fötus oder des Neugeborenen führen. - 5 - Das ABO-System ist das wichtigste Blutgruppensystem im Zusammenhang mit Transfusionen. Normalerweise sind bei Personen, deren Erythrozyten keine Aoder B-Antigene aufweisen, Antikörper gegen diese Antigene vorhanden (Ausnahme: Neugeborene). Für die Transfusion vorgesehene Erythrozyten dürfen deshalb keine ABO-Antigene aufweisen, gegen die es im Empfängerblut Antikörper gibt. Die Transfusion von ABO unverträglichen Erythrozyten kann eine akute, schwerwiegende oder tödliche hämolytische Reaktion zur Folge haben. Ausserhalb des ABO-Systems ist das Rhesus D Antigen des Rhesus Blutgruppensystems stark immunogen. Rh(D)-Antikörper entstehen aber nur, wenn eine Rhesus(D)-negative Person mit Rhesus(D)-positiven Zellen in Kontakt kommt und so zur Bildung von Anti-D stimuliert wird. Anti-D-Antikörper können transfundierte Rhesus (D) positive Erythrozyten lysieren, wobei die Immunreaktion jedoch meist weniger heftig als bei Anti-A- oder Anti-BReaktionen verläuft. Wenn während der Schwangerschaft Anti-D-Antikörper im mütterlichen Blut vorhanden sind, kann dies eine schwerwiegende chronische Hämolyse der Erythrozyten des Fötus zur Folge haben. Aus diesem Grund wird bei Spender und Empfänger stets ein Rh(D)-Test durchgeführt, und ein Kontakt eines Rhesus(D)-negativen Empfängers mit Rhesus(D)-positiven Erythrozyten vermieden, insbesondere bei Mädchen und Frauen im gebärfähigen Alter. Weitere Blutgruppenantigene werden vor einer Transfusion in der Regel nicht bestimmt. Blutproben des Patienten werden jedoch auf „irreguläre“ Antikörper untersucht. Wenn klinisch relevante Antikörper im Blut des Empfängers nachgewiesen werden, müssen Erythrozyten ohne die entsprechenden Antigene zur Verfügung gestellt werden. 3. Gewinnung und Aufbereitung Erythrozyten werden von Personen gewonnen, welche die anerkannten Kriterien zum Blutspenden erfüllen. Es wird vom Spender Vollblut gewonnen und mittels Zentrifugation in Blutkomponenten aufgetrennt. Für Erythrozytenkonzentrate wird das Plasma zum Grossteil entfernt (womit das Blut bis zu einem Hämatokritwert von etwa 70 % konzentriert wird), oder das Plasma wird nahezu vollständig entfernt und dann Additivlösung – normalerweise 80 - 110 ml – zugegeben, womit ein Hämatokritwert von 50 – 70 % erreicht wird. Die Erythrozyten können auch durch Apherese gewonnen werden, bei der die Erythrozyten abgetrennt und in Additivlösung suspendiert werden. Bei Spendern mit geeignetem Blutvolumen und günstiger Hämoglobinkonzentration können in einer Sitzung zwei Transfusionseinheiten von Erythrozyten gewonnen werden. (Die übrigen Blutbestandteile werden dem Spender normalerweise zurückgegeben. Alternativ können aber zusätzlich zu den Erythrozyten auch Plasma oder Thrombozyten gewonnen werden.) Die Additivlösung enthält Nährstoffe, Salze und Wasser. Glucose und Adenin sind für die Aufrechterhaltung des Erythrozytenstoffwechsels und die Überlebensfähigkeit der Erythrozyten nach erfolgter Transfusion erforderlich, Phosphat kann zur Beschleunigung der Glykolyse verwendet werden, und zur Verhinderung einer In-vitro-Hämolyse können weitere Substanzen eingesetzt werden. Zur Einstellung der richtigen osmotischen Bedingungen der Additivlösung kann Natriumchlorid beigefügt werden. - 6 - Die Aufbereitungsmethoden umfassen normalerweise eine Reduktion der Leukozytenzahl: - teilweise durch Entfernung der Leukozytenschicht («buffy coat»), wobei 50 – 80 % der Leukozyten entfernt werden, oder - weitgehend durch Leukozytendepletion, wobei mehr als 99,95 % der Leukozyten durch Filtration der Erythrozyten oder des Vollbluts entfernt werden. Durch die Leukozytendepletion wird das Risiko der Übertragung bestimmter mit Leukozyten assoziierten Viren wie CMV minimiert, ebenso wie das Risiko immunologischer Komplikationen oder Veränderungen im Zusammenhang mit Leukozyten-Antigenen oder -Funktionen. In verschiedenen europäischen Staaten (u.a. Schweiz) ist die Leukozytendepletion aller zur Transfusion vorgesehenen Blutkomponenten heute vorgeschrieben. Folgende zusätzlichen Verfahren kommen in Frage: - Das Waschen der Erythrozyten um Plasmaproteine so vollständig wie möglich zu entfernen. - Bestrahlung (25-50 Gy) zur Inaktivierung der restlichen SpenderLymphozyten, die eine Graft-Wirt-Reaktion verursachen könnten, namentlich bei immunsupprimierten Patienten und Patienten, die Blutkomponenten von Spendern erhalten, die homozygot bezüglich eines HLA-Haplotypen des Empfängers sind (Verwandte). - Einfrieren der Erythrozyten in Glycerol bei -80 °C oder kälter, z.B. zur langfristigen Lagerung und Vorratsbildung von Erythrozytenmit seltenen Blutgruppen. Speziell aufbereitet werden Erythrozyten für den pränatalen und neonatalen Einsatz. Dazu gehören Erythrozyten, die zur intrauterinen Transfusion eingesetzt werden sollen, und Blut für die Austauschtransfusion bei Neugeborenen. 4. Beschriftung Folgende Informationen sind auf der Etikette aufzuführen: - Identifikation des Herstellers; - eindeutige Identifikationsnummer; - ABO-Blutgruppe und Rh(D)-Faktor; - Spendedatum (optional); - Art des Blutpräparates; - zusätzliche Informationen zum Bestrahlung (falls zutreffend); - Verfalldatum; - Zuordnung nach zusätzlichen Blutgruppensystemen (optional); - Art und Volumen zugegebener Antikoagulanzien und Additivlösungen; - Volumen oder Gewicht des Blutpräparates; Blutpräparat: - 7 - Leukozytendepletion, - Lagerungstemperatur. 5. Lagerung und Stabilität Erythrozytenkonzentrate sind bei 2-6 °C zu lagern. Die zulässige Frist für die Lagerung beträgt zwischen 35 und 49 Tage, je nach Additivlösung. Bei diesen Bedingungen bleiben die Erythrozyten stabil, so dass keine bedeutende Hämolyse stattfindet. Bestrahlte Erythrozyten setzen schneller Kalium und Hämoglobin frei und können höchstens 28 Tage gelagert werden. Die Zahl überlebensfähiger transfundierter Erythrozyten sinkt mit zunehmender Dauer der Lagerung. Nicht überlebensfähige Erythrozyten werden innerhalb weniger Stunden nach der Transfusion entfernt. Danach werden die überlebenden Erythrozyten langsam, mit nahezu normaler Geschwindigkeit eliminiert. Die geltenden Grenzwerte für die Dauer der Lagerung sind so gewählt, dass sich mindestens 75 % der transfundierten Erythrozyten 24 Stunden nach der Transfusion noch im Kreislauf befinden sollten. Die Zweckmässigkeit dieser Grenzwerte wurde bisher nicht ernsthaft in Frage gestellt. Während der Lagerung sinkt die Konzentration von Adenosintriphosphat (ATP) innerhalb der Erythrozyten. Die Zellen verlieren einen Teil ihrer Membran, werden starrer und verändern sich vermutlich so, dass sie bei ihrer Passage durch die Milzkapillaren eher zurückbehalten werden. Die Überlebensfähigkeit der Erythrozyten nach der Transfusion nimmt ab, wenn die ATP-Konzentration unter den Normalwert sinkt. Während der Lagerung fällt auch die Konzentration von 2,3-Diphosphoglycerat (2,3-DPG) innerhalb von 10-15 Tagen kontinuierlich auf unter 10 % des ursprünglichen Wertes und dadurch werden die Sauerstoffmoleküle stärker ans Hämoglobin gebunden. Nach der Transfusion steigt die 2,3-DPG-Konzentration der gelagerten Erythrozyten in einem oder wenigen Tagen auf den normalen Wert. Die tiefe Lagerungstemperatur (2-6 °C) hemmt die Aktivität der Natrium-KaliumPumpe und Kalium–Ionen treten langsam aus den Zellen aus. Die K+Konzentration in der Stabilisatorlösung steigt dadurch bis zum Ende der Lagerung kontinuierlich auf etwa 60 mmol/l, d.h. auf 6 mmol pro Erythrozytenkonzentrat. Die Natrium-Kalium-Pumpe wird nach der Transfusion wieder aktiv und die K+-Konzentration in den Erythrozyten nimmt innerhalb weniger Tage wieder den Normalwert an. 6. Qualitätssicherung Bei jeder Spende durchgeführte Tests: - ABO und RhD - Anti-HIV 1+2, HBsAg und Anti-HCV. In einigen europäischen Mitgliedsländern müssen zusätzlich Tests auf AntiHTLV I+II, Anti-HBc, HIV NAT, HCV NAT und Syphilis für jede Spende durchgeführt werden, in anderen Ländern werden diese Tests nur bei Erstspendern oder überhaupt nicht verlangt. Die nationalen Bestimmungen sehen teilweise Anti-HBc- und Anti-CMV-Tests in bestimmten Fällen vor. - 8 - Anforderungen an die Qualitätskontrolle, zufällige Stichproben: Eine Reihe von Variablen (Volumen der Blutpräparates, Hämoglobin- und Leukozytengehalt, Hämolyse am Ende der Haltbarkeit) werden stichprobenmässig kontrolliert. Die Häufigkeit der Stichprobenuntersuchung wird mit statistischer Prozesssteuerung festgelegt. Die Ergebnisse der Kontrollen müssen sich innerhalb der Grenzwerte bewegen, die je nach Art des Erythrozytenkonzentrats festgelegt werden. Folgende Anforderungen müssen erfüllt werden: - Hämoglobin-Gehalt: mindestens 40-45 g je nach Aufbereitungsmethode; - Hämolyse am Ende der Haltbarkeit: weniger als 0,8 %; - Leukozyten-Gehalt: weniger als 1,2 x109 pro EK, ohne Buffy coat, und weniger als 1,0 x106 pro EK bei durchgeführter Leukozytendepletion. Die Blutspendedienste sind für Qualitätskontrolle verantwortlich. die Durchführung der Tests zur 7. Transport Die Bedingungen während Transport und Verteilung von Blut und Blutkomponenten dürfen die Qualität des Produkts nicht beeinträchtigen. Erythrozytenpräparate sind in Behältern zu transportieren, die eine Temperatur von 2-6 °C gewähren. Ein Temperaturanstieg auf 10 °C für einige Stunden ist akzeptabel. Es wird empfohlen, Temperaturindikatoren oder Geräte zur Temperaturüberwachung zu verwenden, die belegen, dass die Anforderungen bezüglich Transporttemperatur eingehalten wurden. 8. Wirksamkeit Bei einem Patienten mit normalem Blutvolumen, der 70 kg wiegt und nicht blutet, sollte durch die Transfusion einer Einheit Erythrozyten die HämoglobinKonzentration um 7-10 g/l ansteigen. Die positive Wirkung einer Erythrozytentransfusion bei chronischer Anämie ist häufig auf ein paar Wochen beschränkt, unabhängig davon, ob gleichzeitig zwei oder mehr Einheiten verabreicht wurden. Der verminderte DPG-Gehalt, wie er bei gelagerten Erythrozyten häufig anzutreffen ist, führt zu einer eingeschränkten Sauerstofffreisetzung bei den in Geweben üblichen Sauerstoffkonzentrationen. Die Bedeutung dieses DPGAbfalls ist klinisch schwierig zu evaluieren. Der durch die Lagerung bedingte Effekt dürfte nur bei Massivtransfusionen von klinischer Bedeutung sein, insbesondere bei schwer kranken Patienten mit hohem Sauerstoffbedarf und bei Austauschtransfusionen von Neugeborenen. 9. Hinweise zur Anwendung Das Ziel einer Erythrozytentransfusion besteht in einer ausreichenden Versorgung von Organen und Geweben mit Sauerstoff. Mögliche Ursachen eines unzureichenden Sauerstofftransports sind ein akuter, vorübergehender oder chronischer Blutverlust sowie Erkrankungen, welche die Produktion von - 9 - Erythrozyten und/oder Hämoglobin oder die Herz- und/oder Lungenfunktion beeinträchtigen. Die zur Aufrechterhaltung einer ausreichenden Sauerstoffversorgung von Organen und Geweben erforderliche Hämoglobin-Konzentration ist je nach Patient und klinischer Situation recht unterschiedlich. Akuter Blutverlust Die Sofortmassnahmen bei akutem Blutverlust zielen darauf ab, die Blutung zu stoppen (in erster Linie durch chirurgische und mechanische Massnahmen) und die ausreichende Durchblutung der lebenswichtigen Organe aufrecht zu erhalten (durch die Infusion von Lösungen mit kristallinen Substanzen und/oder Kolloiden). Falls die Sauerstoffversorgung von Organen und Gewebe kritisch beeinträchtigt erscheint, werden Erythrozyten transfundiert, um die Sauerstofftransportkapazität zu verbessern. Die Notwendigkeit einer Erythrozytentransfusion ist bei jedem Patienten individuell zu evaluieren und eine entsprechende Entscheidung sollte auf Grund der klinischen Zeichen und einer kritischen Prüfung von Laborergebnissen gefällt werden. Bei einer anderweitig gesunden Person, die ruht, nicht blutet und mit normalem Blutvolumen, bleibt eine ausreichende Sauerstoffversorgung der Gewebe normalerweise bis zu einem Hämatokritwert von rund 25 % (HämoglobinKonzentration 70-80 g/l) erhalten. Dies ist zum Teil durch die bessere Mikrozirkulation infolge einer verringerten Viskosität des Blutes bedingt. Voraussetzung ist jedoch die Fähigkeit zu einer entsprechenden Erhöhung der Herzleistung. Bei einer anderweitig gesunden Person, bei normalem Blutvolumen, besteht deshalb in der Regel keine Indikation für eine Erythrozytentransfusion, bevor die Hämoglobin-Konzentration auf unter 70-80 g/l sinkt. Einige Kliniker setzen den Schwellenwert (Transfusion Trigger) für eine Transfusion bei 60-70 g/l. Im Falle ungenügender Kompensationsmechanismen auf Grund z.B. einer Herzund/oder Lungeninsuffizienz oder einer Blutvergiftung, kann ein höherer Schwellenwert von z.B. 100 g/l angebracht sein. Akute autoimmunhämolytische Anämie. Chronische Anämie Die Behandlung einer chronischen Anämie sollte in erster Linie auf die Beseitigung der Ursache der Anämie ausgerichtet sein. So ist z.B. bei einem Eisenmangel normalerweise eine Behebung des Mangelzustands ausreichend, und es ist selten eine Erythrozytentransfusion erforderlich. Falls Behandlungsmethoden zur Beseitigung der Ursache der Anämie nicht vorhanden oder nicht ausreichend sind, können regelmässige Bluttransfusionen notwendig sein, z.B. bei einer Thalassämie. Bei anderweitig gesunden Personen hat der Körper eine beträchtliche Fähigkeit zur Anpassung an eine schwere Anämie, falls sich diese langsam entwickelt, und als allgemeine Regel gilt, dass die Hämoglobin-Konzentration auf dem niedrigsten Wert gehalten wird, bei dem sich der Patient noch relativ gut fühlt. Die moderne Forschung hat jedoch zu einer Neueinschätzung der chronischen Anämie geführt. Bei chronischen Krankheiten wie Urämie und bei bösartigen Erkrankungen besteht ein signifikanter Zusammenhang zwischen einer fortschreitenden Anämie und - 10 - zunehmender Müdigkeit, was das körperliche Wohlbefinden und die Lebensqualität des Patienten substanziell beeinträchtigt. Gemäss neuer Richtlinien sollte die Behandlung einer chronischen Anämie im Falle einer bösartigen Erkrankung bei einem Hämoglobinwert von unter 100-110 g/l in Betracht gezogen werden. Eine Behandlung mit Erythropoietin zur Aufrechterhaltung einer Hämoglobinkonzentration von bis zu 120 g/l ist normalerweise wirksam im Rahmen einer Behandlung der Anämie bei Patienten mit Nierenversagen, aber nicht alle Patienten mit bösartigen Erkrankungen sprechen auf die Erythropoietin-Behandlung an. Ein ausgedehnterer Einsatz der ErythropoietinBehandlung bei chronischer Anämie wird von einer weiteren Evaluation der Kostenwirksamkeit abhängen. Falls eine Erythropoietin-Behandlung nicht wirksam oder nicht anwendbar ist, kann eine Erythrozytentransfusion in Betracht gezogen werden. Eine regelmässige Therapie mit einer Transfusion von 1-2 Einheiten Erythrozyten jede zweite Woche hat verschiedene Nachteile: Die Wirkung ist kurzlebig und die Hämoglobin-Konzentration nicht stabil, ausserdem besteht das Risiko einer Eisenüberladung und von Organschädigungen nach der Transfusion von 50-80 Einheiten Erythrozyten. Eine Transfusionsbehandlung bei bösartigen Erkrankungen zielt normalerweise darauf ab, die Hämoglobin-Konzentration zwischen 80-100 g/l zu halten, während bei gewissen Patienten eine Konzentration von >100 g/l erforderlich sein kann, um einer Angina pectoris oder einem Herversagen vorzubeugen. Die Notwendigkeit einer Transfusion muss individuell für jeden Patienten evaluiert werden. Dabei ist der Tatsache Rechnung zu tragen, dass individuelle Hämoglobin-Konzentrationen für Patienten benötigt werden, damit soziale Aktivitäten, die körperliche Leistungsfähigkeit und Lebensqualität in einem zufrieden stellenden Zustand erhalten bleiben. In speziellen, lebensbedrohlichen Situationen kann es notwendig sein, Transfusionen durchzuführen, obwohl die Tests zur Blutgruppenverträglichkeit positiv ausgefallen sind, zum Beispiel bei Patienten mit autoimmunhämolytischer Anämie und sehr tiefen Hämoglobin-Werten. 10. Vorsichtsmassnahmen Transfusionen dürfen nur von Personen vorgenommen werden, die über eine spezielle Ausbildung in Transfusionsmedizin mit Leistungsnachweis verfügen. Für die Transfusion sollte stets ein Arzt verantwortlich sein. Angaben zur Transfusion sind in den Patientendossiers zu dokumentieren. Die transfundierten Erythrozyten müssen hinsichtlich des ABO- und des RhSystems mit der Blutgruppe des Patienten verträglich sein. Diese Kompatibilität sollte vor der Transfusion mit einem Test sichergestellt werden. Nur in extremen Notfällen dürfen Rhesus(D)-negative Erythrozyten der Blutgruppe O ohne der Transfusion vorangehende Tests verabreicht werden. In der klinischen Einrichtung sind folgende Vorsichtsmassnahmen zu treffen: - Identität des Empfängers feststellen. - 11 - - Überprüfen, ob die Bluteinheit zur Transfusion für diesen Empfänger vorgesehen ist. - Überprüfen, ob vor der Transfusion die Tests zur Blutgruppenkompatibilität durchgeführt wurden und sicherstellen, dass die Erythrozyten hinsichtlich des ABO- und des Rh-Systems mit der Blutgruppe des Empfängers kompatibel sind. - Sicherstellen, dass das Blutpräparat und dessen Eigenschaften den Anforderungen der Verordnung entsprechen. - Sicherstellen, dass das Haltbarkeitsdatum der Blutpräparates noch nicht überschritten ist. - Blutpräparat visuell kontrollieren: Der Blutbeutel muss dicht sein, es darf keine sichtbare Hämolyse oder Verfärbung vorliegen, es dürfen keine anderen ungewöhnlichen Veränderungen des Inhalts sichtbar sein. Die Blutkomponenten müssen durch einen Filter der Porengrösse 170-200 m verabreicht werden. Die Transfusion sollte innerhalb einer festgelegten Zeitdauer vorgenommen werden, und wenn möglich nicht länger als 6 Stunden dauern. Ein Blutwärmegerät sollte nur bei Massivtransfusionen verwendet werden, und falls erforderlich, in speziellen Fällen um Reaktionen mit Kälteagglutininen zu vermeiden. Der Patient sollte auf Anzeichen von Schüttelfrost, Fieber, Blutdruckveränderungen und Atembeschwerden beobachtet werden. Transfusionsreaktionen sind sofort dem verantwortlichen Arzt und der Blutbank des Spitals zu melden. Die Wirkung einer Erythrozytentransfusion kann klinisch evaluiert und dokumentiert werden, indem die Hämoglobin-Konzentration eine Stunde nach der Transfusion gemessen wird. Es sollte sorgfältig beobachtet werden, ob die erwartete Verbesserung bezüglich Sauerstoffversorgung des Gewebes erreicht wird. Falls die Hämoglobin-Konzentration nicht ansteigt, ist die Ursache abzuklären bevor weitere Transfusionen in Betracht gezogen werden. Bei Massivtransfusionen von Neugeborenen – z.B. im Rahmen einer Austauschtransfusion oder einer intrauterinen Bluttransfusion – müssen frische Erythrozytenpräparate (die weniger als 5 Tage alt sind) verwendet werden, da die Kalium Konzentration in gelagerten Erythrozytenkonzentraten stark zunimmt. Schwer immunsupprimierten Patienten sollten bestrahlte Erythrozytenkonzentrate verabreicht werden, d.h. Patienten, welche mit Immunsuppressiva behandelt werden, Kindern mit schweren Immundefekten sowie Neugeborenen mit niedrigem Geburtsgewicht. Ebenfalls bestrahlt werden sollten Erythrozyten, wenn sie für intrauterine Bluttransfusionen bestimmt sind und für Transfusionen zwischen Familienmitgliedern. In speziellen Situationen sollten Erythrozytenpräparate, welche CMV Antikörper und Parvovirus B19 negativ sind, verwendet werden - 12 - 11. Mögliche Nebenwirkungen - Kreislaufüberlastung; - hämolytische Transfusionsreaktion; - nicht-hämolytische Transfusionsreaktion (vor allem Schüttelfrost, Fieber); selten bei Transfusion von leukozyten-depletierten Erythrozytenkonzentraten - Alloimmunisierung gegen HLA- und Erythrozyten-Antigene; - Sepsis als Folge einer bakteriellen Kontamination; - Transfusionsassoziierte akute Lungenschädigung (TRALI); - posttransfusionelle Purpura; - Stoffwechselprobleme bei Massivtransfusionen, z.B. Hyperkalämie; - Übertragung von Viren (Hepatitis, HIV usw.) und Protozoen (z.B. Malaria) – kann äusserst selten trotz sorgfältiger Spenderauswahl und ScreeningVerfahren vorkommen; - Syphilis könnte übertragen werden, wenn das Erythrozytenkonzentrat weniger als 4-5 Tage bei +4 °C gelagert wurde; - Übertragung anderer Pathogene, gegen die keine Tests durchgeführt werden oder die noch nicht bekannt sind. Das Hauptrisiko bei der Erythrozytentransfusion besteht in hämolytischen Transfusionsreaktionen. Solche Reaktionen können hyperakut sein und tödlich verlaufen, aber auch verzögert auftreten und schwach ausgeprägt sein, abhängig in erster Linie vom betroffenen Blutgruppensystem. Die Prävention solcher Reaktionen besteht in der sicheren Identifizierung von Patient, Blutprobe und Blutprodukt, in der Einhaltung der Guten Laborpraxis und in der sorgfältigen Durchführung der Blutgruppenbestimmungs - und Kompatibilitätstests. Eine seltene Komplikation bei der Bildung von Alloantikörpern gegen Blutgruppen-Antigene ist die gleichzeitige Auslösung von Autoimmunreaktionen. Dies kann z.B. bei Thalassämie-Patienten selbst in jüngeren Altersgruppen vorkommen. Trotz aller Bemühungen um eine Risikominimierung bezüglich der Übertragung von Infektionskrankheiten besteht bei Transfusionen ein äusserst geringes Restrisiko für eine Übertragung von HIV, HBV, HCV und anderen Infektionserregern einschliesslich Bakterien und Protozoen. Bei nicht durch Leukozytendepletion behandelten Blutpräparaten besteht das Risiko einer Immunisierung gegenüber Leukozytenantigenen, was Fieberreaktionen nach der Transfusion auslösen kann und überdies dazu führt, dass auf Transfusionen von nicht typisierten Thrombozyten verzichtet werden muss. Es besteht zudem das Risiko einer Übertragung bestimmter mit Leukozyten assoziierten Viren wie CMV. Bei immungeschwächten Patienten und wenn der Empfänger Blutpräparate von einem Spender mit enger genetischer Verwandtschaft erhält, kann eine GraftWirt-Reaktion auftreten. Diese Reaktion ist auf das Vorhandensein lebensfähiger Spender-Lymphozyten zurückzuführen und lässt sich durch eine - 13 - Bestrahlung von Blutkomponenten mit einer Dosis von 25-50 Gy vermeiden. Bei einer Transfusion von Erythrozyten werden beträchtliche Mengen von Eisen zugeführt. Da der Körper jedoch über kein wirksames System zur Ausscheidung von Eisen verfügt, kommt es bei wiederholten Transfusionen über längere Zeit zwingend zu einer Hämosiderose. Dies ist ein weiterer Grund, weshalb die Hämoglobin-Werte im Fall von Transfusionen auf dem tiefsten akzeptablen Niveau zu halten sind. Bei Kindern ist dies eine besonders schwerwiegende, irreversible Komplikation, weshalb der Einsatz von EisenChelatbildnern in Betracht gezogen werden sollte. Literatur 1. Guide to the preparation, use and quality assurance of blood components, 10. Aufl., Strassburg, Council of Europe Publishing, 2004. 2. Guidelines for the Blood Transfusion Services, 6th edition 2002, and Handbook of Transfusion Medicine, 3. Aufl. 2001. UK blood Transfusion & Tissue Transplantation Guidelines. (http://www.transfusionguidelines.org.uk) 3. Guidelines for the clinical use of red cell transfusions. British Committee for Standards in Haematology, Blood transfusion Task Force. Brit. J. Haematol. 2001;113:24-31. (http://www.bcshguidelines.com/pdf/bjh2701.pdf) 4. Leitlinien zur Therapie mit Blutkomponenten und Plasmaderivaten, 3. Auflage. Vorstand und Wissenschaftlicher Beirat der Bundesärztekammer Deutscher Ärzte-Verlag, Köln 2003. 5. Högman CF, Meryman HT. Storage parameters affecting red blood cell survival and function after transfusion. Transfus. Med. Rev. 1999;13:27596. 6. Spahn DR. Perioperative Transfusion Triggers for Red Blood Cells. Vox Sang. 2000;78 Suppl 2:163-6. 7. Hebert PC. Red cell transfusion strategies in the ICU. Transfusion Requirements in Critical Care Investigators and the Canadian Critical Care Trials Group. Vox Sang. 2000;78 Suppl 2:167-77. 8. Engelfriet CP, Reesink HW, McCullough J. Perioperative triggers for red cell transfusions. Vox Sang. 2002 May;82(4):215-26. 9. Cella D, Kallich J, McDermott A, Xu X. The longitudinal relationship of hemoglobin, fatigue and quality of life in anemic cancer patients: results from five randomized clinical trials. Ann Oncol. 2004;15:979-86. 10. Ludwig H, van Belle S, Barrett-Lee P, Birgegard G, Bokemeyer C, Gascon P, Kosmidis P, Krzakowski M, Nortier J, Olmi P, Schneider M, Schrijvers D. The European Cancer Anaemia Survey (ECAS): A large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur J Cancer. 2004;40:2293306. - 14 - THROMBOZYTEN Zusammenfassung der Eigenschaften von Thrombozytenkonzentraten 1. Definition Bei Thrombozytenpräparaten handelt es sich um Thrombozyten (Blutplättchen), die in Plasma oder in Plasma und Additivlösung suspendiert sind. Die verfügbaren Produkte werden aus Vollblutspenden (450-500 ml) gewonnen oder durch Thrombozytapherese hergestellt. Anschliessend wird in der Regel eine Leukozytendepletion und eventuell Bestrahlung vorgenommen. Gelegentlich kann ein „Waschen“ der Thrombozyten zur Entfernung von Plasmaproteinen erforderlich sein. 2. Eigenschaften Thrombozyten sind kleine Zellen ohne Zellkern, die im Knochenmark durch Fragmentierung von Megakaryozyten entstehen. Sie können während rund zehn Tagen im peripheren Blut zirkulieren. Bei gesunden Personen beträgt die Thrombozyten-Konzentration im peripheren Blut (Thrombozytenzahl) zwischen 150 und 370 x 109/l. Die Hauptfunktion der Thrombozyten ist primär die Hämostase. Die Thrombozyten reagieren auf eine Gefässwandverletzung durch Adhäsion ans Endothelgewebe, gefolgt von einer lokalen Aggregation der aktivierten Thrombozyten und Bildung eines Thrombus. Dieser Prozess aktiviert die Gerinnung. Thrombozyten tragen Antigene des ABO-Blutgruppensystems, HLA-Antigene der Klasse I und thrombozytenspezifische HPA-Antigene. 3. Gewinnung und Aufbereitung Thrombozyten werden von Personen gewonnen, welche die anerkannten Kriterien zum Blutspenden erfüllen. Thrombozytenkonzentrate werden aus plättchenreichem Plasma (PRP) bzw. dem thrombozytenhaltigen Buffy-Coat (BC) mehrerer Vollblutkonserven „gepoolt“ oder durch Thrombozytapherese von einem einzelnen Spender gewonnen. Aus Vollblut gewonnene Thrombozyten Die durchschnittliche Anzahl Thrombozyten, die aus einer einzigen Vollblutspende hergestellt werden, sollte 60 x10 9 betragen (Bandbreite: 45-85 x109). Die Thrombozyten werden in 50-70 ml Plasma oder Plasma + Additivlösung aufgenommen. Die aus 4-6 Vollblutspenden gewonnenen Thrombozyten werden gepoolt. Dieser Pool entspricht einer Behandlungseinheit für Erwachsene. Je nach verwendetem Protokoll ergeben sich normalerweise Endvolumina von 250 bis 400 ml. PRP-Methode. Vollblut, das während bis zu 24 Stunden bei 20-24ºC gelagert wurde, wird bei niedriger Geschwindigkeit zentrifugiert, sodass die meisten - 15 - Thrombozyten im Plasma bleiben. Die Thrombozyten werden nun aus dem plättchenreichen Plasma (PRP) durch Zentrifugation bei hoher Umdrehungszahl sedimentiert. Der Überstand, der aus plättchenarmem Plasma besteht, wird entfernt und nur 50-70 ml mit den Plättchen belassen. Die Blutplättchen werden nach einer Ruhephase resuspendiert. Buff-Coat Methode. Vollblut wird bei 20-24ºC während bis zu 24 Stunden gelagert, und anschliessend mit hoher Geschwindigkeit zentrifugiert, sodass sich die Thrombozyten zusammen mit den Leukozyten in einer Schicht – dem Buffy-Coat (BC) – sammeln. Diese Schicht wird abgetrennt und weiter verarbeitet. BC eines einzelnen Spenders oder gepooltes BC wird dazu mit Plasma oder einer geeigneten Additivlösung verdünnt. Nach sorgfältigem Mischen wird diese Suspension zentrifugiert, dass die Rest-Erythrozyten und Leukozyten sedimentiert werden, während die Thrombozyten im Überstand bleiben. Der Überstand mit den Thrombozyten wird nun in einen Beutel zur Lagerung der Thrombozyten übertragen. Thrombozytapherese bei Einzelspendern Von einem Einzelspender können in einer Thrombozytapherese-Sitzung je nach Thrombozytenzahl des Spenders und angewendeter Apheresetechnik 240 bis 800 x109 Thrombozyten gewonnen werden. Somit lassen sich aus einer Spende eine, zwei oder drei Behandlungseinheiten für Erwachsene zu >200 x109 Thrombozyten gewinnen. Die Thrombozyten einer Behandlungseinheit für Erwachsene werden normalerweise in 200-300 ml Plasma oder Plasma + Additivlösung suspendiert (>40 ml pro 60 x109 Thrombozyten). Weitere Verfahren Die Leukozytendepletion besteht darin, die Thrombozytenkonserve einen Filter passieren zu lassen, der mehr als 99,5 % der Leukozyten zurückhält. Eine weitere Möglichkeit zur Leukozytendepletion ist die Verwendung einer „Leukozyten-Falle“ während der Apherese. Die Leukozytendepletion von Thrombozytenkonserven ist in verschiedenen Staaten Europas vorgeschrieben. Bestrahlung von Thrombozyten: Die Minimaldosis im bestrahlten Feld beträgt 25 Gy, wobei kein Bereich mehr als 50 Gy erhalten soll. Waschen der Thrombozyten mit Kochsalzlösung oder gepufferter Salzlösung zur Entfernung von Plasmaproteinen. Für Patienten mit Anti-IgA-Antikörpern muss der Reinigungsprozess ev. auf drei Zyklen erweitert werden, damit der Plasmaproteingehalt im Überstand um mindestens 3 Grössenordnungen sinkt. 4. Beschriftung Folgende Informationen sind auf der Etikette aufzuführen: - Identifikation des Herstellers; - eindeutige Identifikationsnummer*; - ABO-Blutgruppe und Rh(D)-Faktor; - Spendedatum (optional); - Art der Thrombozytenkonserve; - 16 - - zusätzliche Informationen zur Bestrahlung (falls zutreffend); Blutkonserve: Leukozytendepletion, - Verfalldatum; - HPA- und HLA-Antigene (optional); - Art und Volumen zugegebener Antikoagulanzien und Additivlösungen; - Anzahl Thrombozyten (Durchschnitt oder tatsächlicher Wert); - Lagerungstemperatur. * Im Falle gepoolter Thrombozyten müssen die ursprünglichen Spender rückverfolgt werden können. Werden von einem Spender durch Apherese in einer Sitzung zwei oder mehr Einheiten gewonnen, dann müssen diese eindeutig gekennzeichnet werden, z.B. mit “Apherese-Einheit 1”, “Apherese-Einheit 2” (usw.). 5. Lagerung und Stabilität Die Thrombozyten müssen bei 20-24ºC gelagert und ständig geschwenkt werden. Damit die Sauerstoffversorgung der Thrombozyten gewährleistet ist, werden spezielle gasdurchlässige Beutel eingesetzt. Die zulässige Lagerungsdauer beträgt 5 Tage und bis zu 7 Tage, falls mit einem validierten Testsystem sichergestellt wird, dass keine bakterielle Kontamination vorliegt. Tiefgekühlte Thrombozyten werden bei < –80ºC (bis zu 24 Monate) oder bei < – 150 °C (mehr als 24 Monate) gelagert. Nach dem Auftauen müssen die Thrombozyten sofort verwendet werden. Falls nach dem Auftauen ein kurze Aufbewahrung notwendig ist, sind die Thrombozyten bei 20-24ºC und gleichförmiger Bewegung zu lagern. 6. Qualitätssicherung Anforderungen bezüglich durchzuführender Tests, bei jeder Spende: - ABO und Rh(D) Erythrozyten); (wegen der - Anti-HIV 1+2, HBsAg und Anti-HCV. unvermeidbaren Kontamination mit In einigen Mitgliedsländern der Europäischen Union müssen zusätzlich Tests hinsichtlich Anti-HTLV I+II, Anti-HBc, HIV NAT, HCV NAT und Syphilis für jede Spende durchgeführt werden, in anderen Ländern werden diese Tests nur bei Erstspendern oder überhaupt nicht verlangt. Die nationalen Bestimmungen sehen teilweise Anti-HBc- und Anti-CMV-Tests in bestimmten Fällen vor. Anforderungen an die Qualitätskontrolle, zufällige Stichproben: Volumen der Konserve, Thrombozyten- und Leukozyten-Gehalt und pH am Ende der Haltbarkeit werden stichprobenmässig kontrolliert. Die Häufigkeit der Stichprobenuntersuchung wird gemäss statistischer Prozesssteuerung festgelegt. Die Ergebnisse der Kontrollen müssen sich innerhalb der Grenzwerte bewegen, die je nach Art des Thrombozytenpräparates festgelegt - 17 - sind. Folgende Anforderungen müssen erfüllt werden: - Volumen: > 40 ml pro 60 x109 Thrombozyten; - Thrombozyten: > 200 x109 pro Transfusionseinheit für Erwachsene; - Leukozyten: < 1 x106 pro Transfusionseinheit für Erwachsene im Falle einer Leukozytendepletion (bei Thrombozyten ohne Leukozytendepletion sind 250 - 1000 Mal höhere Leukozyten-Werte zulässig); - pH (bei 22 °C), gemessen am Ende der empfohlenen Haltbarkeit, sollte 6,4 – 7,4 betragen. Visuelle Kontrolle Jede Thrombozyten-Einheit muss während der Verarbeitung und vor der Verabreichung visuell geprüft werden. Bei Anzeichen eines undichten, beschädigten oder fehlerhaften Beutels, sichtbaren Verklumpungen, Verfärbungen oder beim Fehlen der typischen Wolkenbildung ("Swirling") ist auf die Verwendung der Konserve zu verzichten. (Das Swirling-Phänomen beruht auf der Lichtstreuung von Thrombozyten normaler Morphologie, die bewegt werden. Es verschwindet, wenn die normalerweise scheibenförmigen Thrombozyten eine kugelförmige Gestalt annehmen). 7. Transport Die Bedingungen während Transport und Verteilung von Blut und Blutkomponenten dürfen die Qualität des Produkts nicht beeinträchtigen. Während des Transports muss die Temperatur so nahe wie möglich bei Raumtemperatur gehalten werden (20-24 °C). Falls Transport oder Lagerung mehr als einige Stunden dauern, sollte das Produkt vor der Verabreichung erneut bewegt werden. 8. Wirksamkeit Nach der Transfusion der Thrombozyten befinden sich 60-70 % im peripheren Blut, und rund ein Drittel der Thrombozyten sammelt sich in der Milz. Der Prozentsatz der transfundierten Thrombozyten im peripheren Blut ist häufig niedriger oder sogar wesentlich niedriger bei Bedingungen, die zu einem erhöhten Verbrauch führen, z.B. in Folge einer Sepsis, einer Verbrauchskoagulopathie oder des Vorliegens von Antikörpern gegen Antigene der Thrombozytenoberfläche (HLA-I, HPA). Durch eine Lagerung der Thrombozyten während 5-7 Tagen kann die Wiederfindungsrate (Recovery) nach der Transfusion im Vergleich mit frischen Thrombozyten um 30-50 % niedriger sein. Die Wirksamkeit einer Thrombozytentransfusion lässt sich anhand eines Blutungstops und auf Grund eines geschätzten Corrected Count Increment (CCI) bei 1 und 24 Stunden beurteilen. 9. Hinweise zur Anwendung Die Transfusion von Thrombozyten ist grundsätzlich indiziert zur Prävention und - 18 - Behandlung von Hämorrhagien bei Patienten mit Thrombozytopenie oder mit Funktionsstörungen der Thrombozyten. Die Entscheidung, Thrombozytenkonzentrate zu verabreichen, sollte jedoch auf Grund der individuellen klinischen Situation des Patienten und nicht nur auf Grund der Plättchenzahl getroffen werden. Bei diesem Entscheid ist auch eine Nutzen-Risiko-Evaluation einzubeziehen. Falls Zweifel bezüglich der klinischen Anwendung bestehen, sollte ein Transfusionsmediziner konsultiert werden. Indikationen für bestrahlte Thrombozyten Die in Thrombozytenpräparaten auch nach einer Leukozytendepletion noch vorhandenen lebensfähigen Lymphozyten können bei immungeschwächten Empfängern (z.B. Empfänger von Knochenmark oder peripheren Blutstammzellen, Patienten nach einer Hochdosis-Chemotherapie, Patienten mit Hodgkin-Krankheit, Neugeborene, welche eine Massivtransfusion oder eine extrakorporale Membranoxygenation erhalten, Neugeborene mit niedrigem Geburtsgewicht) eine schwere Graft-Wirt-Reaktion auslösen. Zur Vermeidung dieses Risikos müssen die Thrombozyten bestrahlt werden, falls sie zur Verabreichung an immungeschwächte Patienten oder zur intrauterinen Transfusion vorgesehen sind, und auch falls der Thrombozyten-Spender ein naher genetischer Verwandter des Empfängers ist. Indikationen für gewaschene Thrombozyten Gewaschene Thrombozyten können erforderlich sein für Patienten, bei denen es zu allergischen oder anaphylaktischen Reaktionen nach einer Thrombozytentransfusion gekommen war und/oder bei denen Anti-IgAAntikörper nachweisbar sind, falls keine Thrombozyten von einem Spender mit IgA-Mangel verfügbar sind. Unter bestimmten Umständen sollten Präparate verwendet werden, bei denen die Tests für CMV-Antikörper und Parvovirus B19 negativ ausgefallen sind. 9.1 THROMBOZYTOPENIE Vor dem Entscheid für eine Thrombozytentransfusion müssen die Ursachen der Thrombozytopenie abgeklärt werden. Thrombozytentransfusionen sind nicht in allen Fällen von Thrombozytopenie indiziert und können unter bestimmten Umständen kontraindiziert sein. Thrombozytopenie auf Knochenmarkinsuffizienz. Grund von primärer oder sekundärer Eine Thrombozytentransfusion kann im Rahmen einer Behandlung oder einer Prophylaxe erfolgen. Eine Transfusionsbehandlung ist angezeigt bei Patienten mit aktiver Blutung im Zusammenhang mit einer Thrombozytopenie. Es werden normalerweise prophylaktische Transfusionen verwendet, falls der Thrombozytenwert weniger als 5 – 10 x109/l erreicht und keine Anzeichen einer Blutung oder einer anderen Ursache für den gesteigerten Verbrauch bestehen. Im Falle von Fieber, lokalen Verletzungen, Gerinnungsstörungen und anderen ungünstigen Symptomen kann zum Erhalt einer Plättchenzahl von > 15 x109/l eine prophylaktische Transfusion erforderlich sein. Bei einem chronischen Versagen der Bildung von Thrombozyten infolge einer - 19 - aplastischen Anämie oder Myelodysplasie wird wegen der Gefahr einer Alloimmunisierung und eines Refraktärzustandes mit Vorteil auf langfristige prophylaktische Transfusionen verzichtet. Bei vielen Patienten kommt es bei einer Plättchenzahl zwischen 10 und 5 x109/l noch zu keinen ernsthaften Blutungen. Falls Thrombozytentransfusionen notwendig sind, muss der Zeitraum zwischen den Transfusionen individuell festgelegt werden. Dieser kann auf bis zu einer Woche oder länger ausgedehnt werden. Therapeutische Thrombozytentransfusionen sind indiziert, falls der Patient von einer aktiven Blutung oder einer Infektion betroffen ist. Thrombozytopenie und chirurgische oder invasive Eingriffe Prophylaktische Thrombozytentransfusionen sind in folgenden Fällen indiziert: - vor chirurgischen und grösseren invasiven Eingriffen wie Lumbalpunktion, Epiduralanästhesie, Gastroskopie und Leberbiopsie oder einer transbronchialen Biopsie, falls die Thrombozytenzählung einen Wert von <50 x109/l ergab; - während neurochirurgischen und ophthalmologischen Eingriffen sollte die Thrombozytenzahl bei zwischen 70 und 100 x109/l gehalten werden. Nach dem Eingriff sollte die Thrombozytenzahl während mehrerer Tage, am Besten bis zur Wundheilung, bei über 50 x109/l gehalten werden. 9.2 THROMBOZYTENFUNKTIONSSTÖRUNGEN Patienten mit Thrombozytenfunktionsstörungen benötigen selten Thrombozytentransfusionen. Die Ursachen der Funktionsstörungen sollten identifiziert und wenn möglich vor chirurgischen oder anderen invasiven Eingriffen beseitigt werden. Thrombozytentransfusionen sind lediglich in Notfällen indiziert (chirurgischer Eingriff oder starke Blutung) und falls der Defekt nicht anders korrigiert werden kann, z.B. bei hereditärer Thrombasthenie oder beim Bernard-Soulier-Syndrom. In diesen Fällen sollte Rücksprache mit dem Transfusionsmediziner genommen werden. 9.3 MASSIVTRANSFUSION, INTRAVASALE GERINNUNG KARDIOPULMONALER BYPASS UND DISSEMINIERTE Vor der Transfusion sollten Untersuchungen zur Thrombozytenzahl und zur Gerinnung durchgeführt werden, damit die geeignete Therapie bestimmt werden kann. Während eines chirurgischen Eingriffs an Patienten mit quantitativen oder qualitativen Beeinträchtigungen der Thrombozyten sollte die Gerinnung des Patienten auf Grund der mikrovaskulären Blutung evaluiert werden. Die disseminierte intravasale Gerinnung (DIC) sollte möglichst vor der Verabreichung von Thrombozyten behandelt werden. - 20 - 9.4 ANDERE THROMBOZYTOPENIEN Autoimmunthrombozytopenie – Thrombozytentransfusionen ausschliesslich bei lebensbedrohlichen Blutungen indiziert. Thrombotisch-thrombozytopenische sollten vermieden werden. Purpura – sind Thrombozytentransfusionen Neonatale Alloimmunthrombozytopenie – in diesem Fall sollte so rasch als möglich eine Thrombozytentransfusionen vorgenommen werden. Die Thrombozytenkonzentrate müssen von ausgewählten Spendern stammen und kompatibel sein oder mütterlichen Ursprungs sein, wobei das mütterliche Plasma durch AB-Plasma oder Elektrolytlösung zu ersetzen ist. 9.5 EMPFOHLENE DOSIS UND BEHANDLUNG Die therapeutische Dosis einer Thrombozytentransfusion für Erwachsene umfasst 200-400 x109 Thrombozyten, je nach Thrombozytenzahl des Spenders und Aufbereitungsmethode. Eine Behandlungsdosis für Erwachsene mit Thrombozyten sollte <1,0 x106 Leukozyten enthalten. leukozytendepletierten Aus einer Vollblutspende lassen sich 60-80 x109 Thrombozyten gewinnen. Dies reicht für einen kleinen Patienten mit 10-15 kg Körpergewicht aus. Bei Kleinkindern und Neugeborenen wird eine Thrombozytenkonzentration von 10-15 ml pro kg empfohlen. Die für einen ausreichenden Thrombozytenanstieg Thrombozytenmenge lässt sich mit folgender Formel berechnen: erforderliche Erforderliche Thrombozyten (x109) = angestrebter Thrombozytenanstieg (x109) x Blutvolumen (l) x F-1 Der Faktor F wird bei Patienten mit normaler Milz üblicherweise auf 0,67 festgelegt, für Patienten mit Splenomegalie wird ein Wert von 0,4 oder tiefer und für splenektomierte Patienten ein Wert im Bereich von 1 gewählt. 10. Vorsichtsmassnahmen Bei der Auswahl von Thrombozyten sollte die ABO-Blutgruppen-Kompatibilität berücksichtigt werden. Die Verabreichung von ABO nicht identischen Thrombozyten ist zulässig bei Lieferengpässen und falls HLA-Antigen kompatible Thrombozyten erforderlich sind. Falls HLA- oder thrombozytenspezifische Antikörper (HPA) vorliegen, müssen die Thrombozyten aus Einzelspenden gewonnen werden, die bezüglich der entsprechenden Antigene negativ sind. Es gibt keine zuverlässigen Routinetests zur Kompatibilitätbestimmung für die Auswahl der Thrombozytenpräparate. Bei Rhesus(D)-negativen Mädchen und Frauen im gebärfähigen Alter sollten keine Thrombozyten-Präparate von Rhesus(D)-positiven Spendern verabreicht werden. Falls dies unvermeidlich ist, kann zur Vermeidung einer Immunisierung prophylaktisch Anti-D-Immunoglobulin i.v. verabreicht werden. Im Allgemeinen - 21 - ist es nicht notwendig, Patienten mit Leukämien Anti-D zu verabreichen. Die Transfusion von Thrombozyten in ABO inkompatiblem Plasma ist bei Kindern mit weniger als 25 kg Körpergewicht zu vermeiden (das Plasmavolumen der Thrombozytenpräparate kann reduziert oder durch ABPlasma oder eine Elektrolytlösung ersetzt werden). Zur Vermeidung des Risikos einer transfusionsassoziierten Graft-Wirt-Reaktion (TA-GvHD) sollten die Thrombozyten bestrahlt werden, falls sie zur Transfusion bei schwer immungeschwächten Patienten wie Patienten mit immunosuppressiver Therapie, Kindern mit schweren Immundefekten und Neugeborenen mit niedrigem Geburtsgewicht oder für intrauterine Transfusionen vorgesehen sind. Ebenfalls bestrahlt werden sollten die Präparate, falls bezüglich HLA-Antigenen übereinstimmende Thrombozyten transfundiert werden und falls der Empfänger Thrombozyten eines genetisch nahe verwandten Familienmitglieds erhält. Vor der Verabreichung des Thrombozytenpräparates sollte die Einheit auf Unversehrtheit der Verpackung, Anzeichen ungewöhnlicher Verfärbung oder Trübheit untersucht werden. Thrombozytenkonzentrate sollten über einen Filter mit einer Porengrösse von 170-200 m verabreicht werden. Die Transfusion sollte langsam beginnen, während der Patient unter Beobachtung steht und innerhalb von 30 Minuten abgeschlossen werden. Bei Kindern entspricht dies ungefähr einem Wert von 20-30 ml/kg/Stunde. 11. Mögliche Nebenwirkungen - Nicht-hämolytische Transfusionsreaktion (vor allem Schüttelfrost, Fieber), sehr selten bei der Transfusion leukozytendepletierter Thrombozyten; - allergische Reaktionen; - Alloimmunisierung gegen HLA-Antigene, selten bei der Transfusion leukozytendepletierter Thrombozyten; - Sepsis auf Grund einer ungewollten Kontamination mit Bakterien; - transfusionsassoziierte akute Lungeninsuffizienz (TRALI) kann auftreten, falls die Thrombozyten in Plasma suspendiert sind; - posttransfusionelle Purpura; - transfusionsassoziierte Graft-Wirt-Reaktion (TA-GvHD), falls nicht-bestrahlte Thrombozyten einem immungeschwächten Patienten verabreicht werden und das Immunsystem des Patienten die verabreichten lebensfähigen Lymphozyten nicht als Fremdzellen erkennt; - Übertragung von Viren (Hepatitis, HIV usw.), Syphilis und Protozoen (z.B. Malaria) kann trotz sorgfältiger Spenderauswahl und Screening-Verfahren vorkommen; - Übertragung anderer Pathogene, für die keine Tests durchgeführt werden oder die noch nicht bekannt sind. Thrombozytentransfusionen sind bei thrombotisch-thrombozytopenischer Purpura (TTP), heparininduzierter Thrombozytopenie (HIT) und bei - 22 - posttransfusioneller Purpura (PTP) ausser bei lebensbedrohlichen Blutungen kontraindiziert, da sie in diesen Fällen mit einer verstärkten Blutungsneigung in Zusammenhang gebracht worden sind. Literatur 1. Guide to the preparation, use and quality assurance of blood components, 10. Aufl.: Strassburg, Council of Europe Publishing, 2004. 2. Guidelines for the use of platelet transfusions. British Committee for Standards in Haematology, Blood Transfusion Task Force. British Journal of Haematology 2003; 122, 10-23. (www.bcshguidelines.com/pdf/platelettrans040703.pdf) 3. Vorstand und Wissenschaftlicher Beirat der Bundesärztekammer. Leitlinien zur Therapie mit Blutkomponenten und Plasmaderivaten, 2. Auflage, Deutscher Ärzte-Verlag, Köln 2001. 4. Sagmeister M, Oec L, Gmür J. A restrictive platelet transfusion policy allowing long-term support of outpatients with severe aplastic anemia. Blood 1999; 93(9):3124-3126. 5. Rebulla P. Trigger for platelet Transfusion. Vox Sang. 2000, 78 (Suppl. 2). 6. Schiffer CA, Anderson KC, Bennett CL et al. Platelet transfusion for patients with cancer: Clinical practice guidelines of the American Society of Clinical Oncology (ASCO). Journal of Clinical Oncology, 2001; 19: 1519-1538 7. Lightfoot T. A communications update for transfusion medicine professionals. Transfusion Medicine Quarterly, issue 2. American Red Cross, September 2001. 8. Wandt H, Ehringer G, Gallmeier WM. New strategies for prophylactic platelet transfusion in patients with hematologic diseases. The Oncologist 2001. 9. Warkentin TE, Chong BH, Greinacher A. Heparin-induced thrombocytopenia: towards consensus. Thrombosis and Hemostasis 1998; 79, 1-7 10. Chevuru SC, Sola MC, Theriaque DE, et al. Multicenter analysis of platelet transfusion usage among neonates on extracorporeal membrane oxygenation. Pediatrics 2002; 109(6): e89. - 23 - GEFRORENES FRISCHPLASMA Zusammenfassung der Eigenschaften 1. Definition Bei gefrorenem Frischplasma handelt es sich um eine Blutkomponente, die entweder aus Vollblut oder durch Apherese gewonnen wird und die innerhalb eines Zeitraums und bei einer Temperatur eingefroren wird, so dass Plasmaproteine einschliesslich labiler Gerinnungsfaktoren weitgehend und in funktionstüchtigem Zustand erhalten bleiben. 2. Eigenschaften Gefrorenes Frischplasma (frisch gefrorenes Plasma, FGP) enthält die in normalem Blutplasma vorhandenen Plasmaproteine. Die Konzentration der einzelnen Proteine hängt von den Konzentrationen im Plasma des jeweiligen Spenders ab. Durch Gefrieren, Auftauen und weitere Manipulationen des Plasmas können die Konzentrationen empfindlicher Proteine wie des Gerinnungsfaktor VIII (F VIII) deutlich sinken, während die Konzentrationen von robusteren Gerinnungsfaktoren, Inhibitoren, Albumin und Immunglobulinen nur unwesentlich beeinträchtigt werden. FGP enthält Blutgruppenantikörper/Hämolysin gegen ABO-Antigene, die im Spender nicht vorhanden sind. Zur Transfusion vorgesehenes FGP sollte keine ungewöhnlichen, klinisch relevanten Antikörper enthalten. FGP besteht aus 80-92 % Spenderplasma und 8-20 % Zitrat-Stabilisatorlösung, je nach Art der Spende (Vollblutspende oder Plasmaspende mittels Apherese) und teilweise auch je nach Hämatokritwert des Spenders. Wenn gefrorenes Frischplasma als Ausgangsmaterial zur Herstellung von Arzneimitteln verwendet werden soll, ist die Monographie der Europäischen Pharmakopöe zur Auftrennung von Plasma und Anhang 14 des EU-Leitfadens für die Gute Herstellungspraxis (Herstellung von Arzneimitteln aus menschlichem Blut oder Blutplasma) zu berücksichtigen. 3. Gewinnung und Aufbereitung Gefrorenes Frischplasma wird von Personen gewonnen, welche die anerkannten Kriterien zum Blutspenden erfüllen. Es wird vom Spender Vollblut gewonnen und mittels Zentrifugation in Plasma und Blutzellen aufgetrennt. Das Plasma wird dann in einen Transferbeutel für das Einfrieren und die Lagerung übertragen. Mittels zusätzlicher Zentrifugation oder durch Filtration kann eine Leukozytendepletion vorgenommen werden (bis zu einer Leukozytenkonzentration von <1 x106/Konserve). FGP kann auch durch Plasmapherese gewonnen werden. Dabei wird Plasma abgetrennt und die übrigen Bestandteile des Blutes werden dem Spender reinfundiert. Plasma, das durch maschinelle Plasmapherese gewonnen wird, ist normalerweise leukozytendepletiert. FGP kann auch aus plättchenreichem Plasma (PRP) hergestellt werden, das - 23 - bei der Gewinnung von Thrombozyten aus Vollblut anfällt, oder durch Zellseparatoren für Multikomponentenspenden. Die Protokolle verschiedener Länder sehen vor, dass das Plasma innert 6, 8, 15 oder 18 Stunden nach der Gewinnung des Blutes oder Plasmas eingefroren wird. Plasma kann auch von Vollblut abgetrennt werden, das unmittelbar nach der Spende unter Verwendung einer speziellen Vorrichtung schnell abgekühlt und stabil auf einer Temperatur zwischen +20C und +24C für bis zu 24 Stunden gehalten wird. Das Einfrieren sollte in einem System erfolgen, das ein vollständiges Gefrieren innerhalb einer Stunde auf eine Temperatur von unter 30C ermöglicht. Zusätzliche Aufbereitungsverfahren Obwohl durch eine sorgfältige Spenderauswahl und verschiedene Tests das Risiko einer Übertragung von Viren und anderen Krankheitserregern minimal gehalten werden kann, bleibt ein geringes Restrisiko bestehen. Es wurden verschiedene Abläufe und Methoden entwickelt, um dieses Risiko praktisch vollständig auszuschalten: Quarantäneplasma und virusinaktiviertes Plasma. Solche Abläufe und Methoden sind in einigen europäischen Staaten gesetzlich vorgeschrieben. Bei Quarantäneplasma handelt es sich um gefrorenes Frischplasma, das 6 Monate gelagert wird (oder 4 Monate, wenn ein HCV NAT-Test durchgeführt wurde) und das nach Ablauf dieser Frist nur dann für eine Transfusion freigegeben wird, wenn die Virus-Screening-Tests einer neuen Blutprobe des betreffenden Spenders negative Ergebnisse geliefert haben. Virusinaktiviertes Plasma. Gegenwärtig werden zwei Methoden zur Virusinaktivierung von Plasma angewendet: das Methylenblau-Verfahren (MBVerfahren) und das Solvent-Detergent-Verfahren (SD-Verfahren). Das MBVerfahren wird zur Behandlung einzelner Plasmaeinheiten verwendet, während das SD-Verfahren zur Virusinaktivierung von bis zu 2500 gepoolten aufgetauten FGP-Einheiten eingesetzt wird. Durch beide Verfahren werden die Konzentrationen empfindlicher Gerinnungsfaktoren aber verringert, das SDVerfahren reduziert zusätzlich bestimmte Inhibitoren der Fibrinolyse und Gerinnung. Durch Bestrahlung (25-50 Gy) werden Lymphozyten des Spenders inaktiviert, die bei immungeschwächten Patienten transfusionsassoziierte Graft-WirtReaktionen auslösen könnten. Die Zweckmässigkeit der Bestrahlung von leukozytendepletiertem gefrorenem Frischplasma ist umstritten. Deshalb wird in einigen europäischen Staaten auf die Bestrahlung verzichtet. 4. Beschriftung Folgende Informationen sind auf der Etikette aufzuführen: - Identifikation des Herstellers; - eindeutige Identifikationsnummer*; - Art des Präparates; - ABO-Blutgruppe und Rh(D)-Faktor**; - Spendedatum (optional); - 24 - - zusätzliche Informationen zum Blutpräparat: Leukozytendepletion, Bestrahlung, Quarantäne oder Virusinaktivierung (falls zutreffend); - Verfalldatum; - Volumen oder Gewicht des Blutpräparates; - Art und Volumen zugegebener Antikoagulanzien; - Lagerungstemperatur. * Werden von einem Spender durch Apherese in einer Sitzung zwei oder mehr Einheiten gewonnen, dann müssen diese eindeutig gekennzeichnet werden, z.B. mit “Apherese-Einheit 1”, “Apherese-Einheit 2” (usw.). ** Die Rh(D)-Angabe kann weggelassen werden, wenn auf Grund der verwendeten Methoden die Erythrozytenkonzentration im Plasma nachgewiesenermassen weniger als 0,1 x109/l beträgt. 5. Lagerung und Stabilität Qualitätsveränderungen während der Lagerung von FFP hängen von der Lagerungstemperatur ab. Die optimale Lagerungstemperatur ist -30C oder niedriger. Folgende Lagerungsfristen und -temperaturen sind üblicherweise zulässig: - 24 Monate bei unter -25C; - 3 Monate bei -18C bis -25C. Durch die tiefe Lagerungstemperatur wird die Stabilität der Kunststoffbeutel beeinträchtigt. Deshalb müssen die gefrorenen Beutel besonders sorgfältig behandelt werden. 6. Qualitätssicherung Eine Reihe von Variablen sind strichprobenmässig zu prüfen. Die Häufigkeit der Stichprobenuntersuchung wird gemäss statistischer Prozesssteuerung festgelegt. Die Ergebnisse sollten sich innerhalb festgelegter Grenzen bewegen. Anforderungen: - Volumen: innerhalb festgelegter Grenzen, normalerweise 180-300 ml (Einheiten für Kinder 50-100 ml); - Erythrozyten-Gehalt: < 6 x109 /Liter; - Leukozyten-Gehalt: < 0,1 x109 /Liter; wenn leukozytendepletiert: < 1,0 x106 pro Einheit; - Thrombozyten-Gehalt: < 50 x109 /Liter; - Gerinnungsfaktor VIII: > 70 % des Gehalts vor dem Einfrieren; für virusinaktiviertes Plasma gilt eine niedrigere Grenze von 50 %. Für pharmazeutische Unternehmen, die FFP als Ausgangsmaterial für die Herstellung von Arzneimitteln weiterverarbeiten, kann ein Plasmaproteingehalt von > 50 g/l erforderlich sein. Die Einrichtungen, die Blut entnehmen oder Blutprodukte herstellen, sind für die - 25 - Durchführung der Tests zur Qualitätskontrolle verantwortlich. 7. Transport Die Lagerungstemperatur muss auch während des Transports aufrechterhalten werden. Das Spital, das die Konserven in Empfang nimmt, sollte sicherstellen, dass die Beutel während des Transports gefroren blieben. Wenn die Konserven nicht für den sofortigen Gebrauch bestimmt sind, sollten die Beutel unmittelbar nach der Entgegennahme bei der empfohlenen Temperatur gelagert werden. Die Kunststoffbeutel mit dem gefrorenen Plasma sind bei niedrigen Temperaturen spröde und müssen vorsichtig gehandhabt werden. 8. Wirksamkeit Die klinische Wirksamkeit von FGP-Transfusionen ist oft schwierig abzuschätzen. Es gibt aber klinische Anhaltspunkte für die Wirksamkeit von FGP-Transfusionen, insbesondere bei Patienten mit Blutungen. Wenn FGP zur Normalisierung von Variabeln des Hämostasesystems transfundiert wird, sollte als Entscheidungsgrundlage für eine Fortführung der Behandlung die Wirkung genau beobachtet werden. 9. Hinweise zur Anwendung Gefrorenes Frischplasma kann bei Gerinnungsstörungen eingesetzt werden, insbesondere bei komplexen Störungen des Hämostasesystems. Wenn die Gerinnungsstörung bekanntermassen auf einen einzelnen Gerinnungsfaktor zurückzuführen ist, sollte FGP nur verwendet werden, wenn kein geeignetes virusinaktiviertes Produkt mit dem spezifischen konzentrierten Gerinnungsfaktor zur Verfügung steht. Blutverlust bei chirurgischen Eingriffen und Massivtransfusionen Als Massivtransfusion wird der Ersatz des gesamten Blutvolumens des Patienten mit Spenderblut in weniger als 24 Stunden bezeichnet, oder der Ersatz von 50 % des Blutvolumens innerhalb von 3 Stunden oder eine Transfusion, die einen Blutverlust von mehr als 150 ml pro Minute kompensiert. Wie viel und wann FGP zur Behandlung von starkem Blutverlust eingesetzt wird, sollte auf der Beobachtung der klinischen Zeichen und auf geeigneten Gerinnungstests beruhen. Die Transfusion von FGP kann erfolgen, um die PTund aPTT-Ratio bei einem Wert von höchstens 1,5 und die Plasmakonzentration von Fibrinogen über 1,0 g/l zu halten. Komplexe Störungen des Hämostasesystems und disseminierte intravasale Gerinnung An der Aktivierung von Gerinnungs- und Fibrinolysesystem sind Gerinnungsproteine und -hemmer, Fibrinogen und Thrombozyten beteiligt. Klinische Manifestationen von Störungen reichen von starken Blutungen ev. mit thrombotischen Ereignissen bis zu einem unauffälligen kompensierten Zustand, der nur auf Grund von Labortests nachgewiesen werden kann. Eine akute DIC (disseminierte intravasale Gerinnung(Coagulation)) tritt am ehesten auf, wenn das Gerinnungssystem (und Fibrinolysesystem) durch eine - 26 - Sepsis, eine Massivtransfusion, schwere und ausgedehnte Gefässverletzungen oder pankreatische Enzyme oder Toxine sehr stark aktiviert wird und wenn die natürlichen Inhibitoren die starke Aktivierung nicht ausgleichen können. Eine DIC kann auch bei starken Blutungen im Zusammenhang mit Schwangerschaft und Geburt auf Grund einer vorzeitigen Plazentalösung, einer Fruchtwasserembolie und eines intrauterinen Fruchttods auftreten. Eine Meningokokkensepsis kann eine schwere akute DIC auslösen und zu einer Thrombose in grossen Gefässen der Extremitäten führen. Eine Intensivtherapie in einer spezialisierten Einrichtung ist in diesem Fall entscheidend. Es muss die Ursache der DIC behandelt werden. Es kann eine unterstützende Behandlung mit FGP, Thrombozyten und Kryopräzipitat erforderlich sein, begleitet von entsprechenden Labortests. Wenn zu erwarten ist, dass die Laborergebnisse nicht rechtzeitig eintreffen, ist es angebracht, gefrorenes Frischplasma nach dem Austausch eines Blutvolumens zu verabreichen, bis die Ergebnisse vorliegen. Üblich ist eine Anfangsdosis von 15 ml/kg, d.h. 8001200 ml FGP bei einer erwachsenen Person. Eine schwere akute DIC bei einem blutenden Patienten kann zusätzlich die Verabreichung von aus Plasma gewonnenen oder rekombinant hergestellten Gerinnungsfaktoren oder hemmern sowie eine Behandlung in der Intensivstation erfordern. Durch die Überwachung verschiedener Variablen des Hämostasesystems kann die Wirkung der Unterstützung überprüft und die Auswahl von zu verabreichenden Blutkomponenten bestimmt werden, sie sollte jedoch die anfängliche Gabe von FGP nicht verzögern. Wenn aber keine Blutungen vorliegen, ist die Transfusion von Blutpräparaten gewöhnlich nicht angezeigt. Ein chronische DIC steht normalerweise in Zusammenhang mit einer Tumorerkrankung und kann eine Behandlung mit Heparin erfordern. Blutprodukte sollten vorsichtig eingesetzt werden. Lebererkrankungen Bei Vorliegen einer Blutungsneigung oder einer um mindestens 50 % erhöhten Prothrombinzeit wird FGP oft vor chirurgischen Eingriffen wie z.B. einer Leberbiopsie eingesetzt. Es ist jedoch nicht vorhersehbar, wie ein Patient mit einer Lebererkrankung auf das FGP anspricht, und es wird nicht immer eine Normalisierung des Hämostasesystems erreicht. Der routinemässige Einsatz von FGP in diesen Fällen wurde deshalb in Frage gestellt. Wenn FGP verabreicht wird, sollten wiederholt Tests zur Gerinnung durchgeführt und die Ergebnisse bei Entscheidungen zur Fortführung der Behandlung berücksichtigt werden. Erworbene Mangelzustände der Faktoren II, VII, IX und X Durch die Behandlung mit Antikoagulanzien (Warfarin) verursachte Blutungen oder Blutungsneigungen werden vorzugsweise mit ProthrombinkomplexKonzentrat behandelt, der aus den Faktoren II, VII, IX und X besteht. Wenn kein Prothrombinkomplex-Konzentrat zur Verfügung steht, kann bei Blutungen, die auf eine übermässige Wirkung einer Warfarin-Behandlung zurückzuführen sind, FGP verabreicht werden. Die empfohlene Dosis beträgt 15 ml/kg. - 27 - Mangelzustände einzelner Gerinnungsfaktoren FGP sollte nur eingesetzt werden, wenn kein spezifisches Präparat mit dem betroffenen Faktor für die Substitutionstherapie zur Verfügung steht. Heute dürfte dieser Fall hauptsächlich beim seltenen vererbten Faktor-V-Mangel eintreten. Thrombotisch-thrombozytopenische Purpura (TTP) Ein Plasmaaustausch, bei dem Plasma des Patienten mit Spenderplasma ersetzt wird, sollte so früh als möglich erfolgen, vorzugsweise innerhalb von 24 Stunden nach Auftreten der Krankheitssymptome. Bis mindestens zwei Tage nach der Remission sollte täglich ein Plasmaaustausch vorgenommen werden. Unter bestimmten Umständen sollten Präparate verwendet werden, bei denen Tests für CMV-Antikörper und Parvovirus B19 negativ ausgefallen sind. Ungeeignete Verwendung von Plasma Plasma ist nicht angezeigt zur Volumenersatztherapie, zur Anhebung des kolloidosmotischen bzw. onkotischen Drucks, zur Substitution von Immunglobulinen oder für die parenterale Ernährung. 10. Vorsichtsmassnahmen Es sollte hinsichtlich des ABO-Blutgruppensystems kompatibles Plasma eingesetzt werden. FGP kann kleine Mengen von Erythrozyten-Stroma enthalten. Um das theoretisch bestehende Risiko einer Rh(D)-Immunisierung auszuschliessen, wird manchmal die Verwendung von Plasma Rh(D)-negativer Spender bei Rh(D)-negativen Empfängern empfohlen, insbesondere bei Mädchen und bei Frauen im gebärfähigen Alter, obwohl diese Notwendigkeit noch geprüft wird.(Anmerk: Anti-D Prophylaxe) FGP sollte nicht eingesetzt werden, wenn ein geeignetes virusinaktiviertes oder rekombinant hergestelltes Konzentrat eines spezifischen Gerinnungsfaktors zur Verfügung steht. FGP sollte nicht bei Patienten mit bekannter Überempfindlichkeit gegenüber Plasmaproteinen eingesetzt werden. Personen mit selektivem IgA-Mangel, die Anti-IgA-Antikörper entwickelt haben, können an einer schweren Anaphylaxie erkranken, wenn sie FGP-Transfusionen erhalten. Falls eine Plasmatransfusion unvermeidbar ist, darf diesen Personen ausschliesslich Plasma von Spendern mit gesichertem IgA-Mangel verabreicht werden. Während der Lagerung und nach dem Auftauen nehmen die labilen Gerinnungsfaktoren kontinuierlich ab. Gemäss aktuellen Empfehlungen sollte FGP sobald wie möglich oder innerhalb von 6 (bis 24) Stunden nach dem Auftauen verabreicht werden, obwohl Studien darauf hinweisen, dass bis mindestens 72 Stunden nach dem Auftauen die vorgesehene klinische Wirkung erzielt wird. FGP darf nicht erneut eingefroren werden. Vor der Verwendung muss das Produkt bei genau überwachten Bedingungen aufgetaut werden, und es muss geprüft werden, ob die Verpackung - 28 - unbeschädigt und dicht ist. Nach dem Auftauen darf kein unlösliches Kryopräzipitat zu sehen sein. FGP muss bei der Transfusion einen Filter mit der Porengrösse 170-200 m passieren. 11. Mögliche Nebenwirkungen - Herzdekompensation Lungenödemen). (Warnung: es besteht die Gefahr von - Es kann eine Zitratintoxikation auftreten, falls umfangreichere Transfusionen rasch durchgeführt werden. - Nicht-hämolytische Transfusionsreaktionen (vor allem Urticaria, allergische und anaphylaktoide Symptome). - Bei Patienten mit IgA-Mangel, die Anti-IgA-Antikörper entwickelt haben, kann es zu einer schweren Anaphylaxie kommen. - Transfusionsassoziierte akute Lungenschädigung (TRALI). - Sepsis auf Grund einer ungewollten Kontamination mit Bakterien. - Übertragung von Viren (Hepatitis, HIV usw.), kann trotz sorgfältiger Spenderauswahl und Screening-Verfahren vorkommen. - Übertragung anderer Pathogene, für die keine Tests durchgeführt werden oder die noch nicht bekannt sind. Literatur 1. Guide to the preparation, use and quality assurance of blood components, 10. Auflage. Strassburg, Council of Europe Publishing, 2004. 2. Guidelines for the use of Fresh Frozen Plasma, Cryoprecipitate and Cryosupernatant. British Committee for Standards in Haematology, Blood Transfusion Task Force. British Journal of Haematology 2004; 126, 11-28. (http://www.bcshguidelines.com/pdf/freshfrozen_280604.pdf) 3. Leitlinien zur Therapie mit Blutkomponenten und Plasmaderivaten, 2. Auflage. Vorstand und Wissenschaftlicher Beirat der Bundesärztekammer. Deutscher Ärzte-Verlag, Köln 2001. 4. Williamson LM, Cardigan R, Prowse Ch. Methylene blue-treated freshfrozen plasma: what is its contribution to blood safety? Transfusion 2003;43:1322-9. 5. Guidelines for the Blood transfusion Services, 6. Auflage 2002, und Handbook of Transfusion Medicine, 3. Auflage 2001. UK blood Transfusion & Tissue Transplantation Guidelines. (http://www.transfusionguidelines.org.uk) - 29 - GRANULOZYTEN, APHERESE Zusammenfassung der Eigenschaften der Blutkomponente 1. Definition Bei Granulozytenpräparaten handelt es sich um Granulozyten, die in Plasma suspendiert sind und die durch Apherese von einem einzelnen Spender gewonnen wurden. 2. Eigenschaften Die Hauptfunktion der Granulozyten besteht in der Phagozytose von Bakterien. Der Vorgang der Phagozytose lässt sich in folgende Schritte unterteilen: - Die Granulozyten wandern an die Infektionsstelle auf Grund einer Stimulierung durch chemotaktische Stoffe oder durch Bindung an Adhäsionsmoleküle, die durch aktivierte Endothelzellen den zirkulierenden Leukozyten präsentiert werden. - Aufnahme von Mikroorganismen - Degranulation - Respiratory Burst - Produktion von und Wechselwirkungen mit Cytokinen Gesunde Personen produzieren täglich rund 100 x10 9 Granulozyten. Granulozyten können im Blut während bis zu 10 Stunden zirkulieren und im Gewebe mehrere Tage überleben. Die Granulozyten im Knochenmark werden bei Bedarf mobilisiert. 3. Gewinnung und Aufbereitung Granulozyten werden durch Leukopherese gewonnen. Dabei werden durch einen Zellseparator im kontinuierlichen oder unterbrochenen Blutfluss Granulozyten mittels Zentrifugation abgetrennt. Granulozyten werden von Personen gewonnen, welche dieselben Kriterien erfüllen, wie sie für Vollblutspenden gelten. Bei Patienten, für die eine allogene Transplantation hämatopoetischer Vorläuferzellen in Frage kommen könnte, sollten keine Familienmitglieder als Spender gewählt werden. Die Ausbeute lässt sich verbessern, indem Sedimentationsbeschleuniger wie hochmolekulare Hydroxyethylstärke, niedermolekulares Dextran oder modifizierte Gelatine beigegeben werden. Es wird empfohlen, pro Jahr und Person nicht mehr als vier Granulozyten-Spenden vorzunehmen. Eine Vorbehandlung der Spender mit Kortikosteroiden und G-CSF (Granulozyten-Kolonie-stimulierender-Faktor) kann erforderlich sein, damit eine ausreichende Menge von Granulozyten zur Behandlung einer erwachsenen Person produziert wird. Von einer routinemässigen Vorbehandlung wird jedoch abgeraten, bis zur Spendersicherheit im Zusammenhang mit einer solchen Behandlung weitere Erkenntnisse vorliegen. Falls eine solche Vorbehandlung durchgeführt wird, sind die im Addendum beschriebenen Vorsichtsmassnahmen zu treffen. - 30 - 4. Beschriftung Folgende Informationen sind auf der Etikette aufzuführen: - Identifikation des Herstellers; - eindeutige Identifikationsnummer; - ABO-Blutgruppe und Rh(D)-Faktor; - Spendedatum (optional); - Art des Blutpräparates; - zusätzliche Informationen zum Blutpräparat: Bestrahlung (falls zutreffend); - Verfalldatum (und -zeit, falls erforderlich); - HLA-Typ, falls bekannt (optional); - Anzahl Granulozyten; - Art und Volumen zugegebener Antikoagulanzien und Additivlösungen; - Lagerungstemperatur. 5. Lagerung und Stabilität Aufgrund der Neigung neutrophiler Granulozyten zur Autolyse eignet sich dieses Präparat nicht zur Lagerung und sollte nach der Gewinnung so bald wie möglich verabreicht werden. Falls eine vorübergehende Lagerung während einiger Stunden unumgänglich ist, sollten die Granulozyten ohne Schwenken bei +20 ºC bis +24 ºC gehalten werden. 6. Qualitätssicherung Anforderungen bezüglich durchzuführender Tests, bei jeder Spende: - ABO und Rh(D), - Anti-HIV 1+2, HBsAg und Anti-HCV. Bei CMV-seronegativen Patienten und Neugeborenen sollten Granulozytenpräparate von CMV-seronegativ getesteten Spendern eingesetzt werden. In einigen Mitgliedsländern der Europäischen Union müssen für jede Spende zusätzlich Tests für Anti-HTLV I+II, Anti-HBc, HIV NAT, HCV NAT und Syphilis durchgeführt werden, in anderen Ländern werden diese Tests nur bei Erstspendern oder überhaupt nicht verlangt. Die Zahl der Zellen in jedem Granulozytenkonzentrat sollte bestimmt und festgehalten werden und im Falle einer Dosis für Erwachsene vorzugsweise > 20 x109 Granulozyten betragen. Volumen des Produktes < 500ml. Die Einrichtungen, die Blut entnehmen oder Blutprodukte herstellen, sind für die Durchführung und die Dokumentierung der Tests zur Qualitätskontrolle verantwortlich. - 31 - 7. Transport Die Einheit sollte bis zum Ort der Verwendung in einem geeigneten Behälter bei einer Temperatur zwischen +20ºC und +24ºC transportiert werden. 8. Wirksamkeit Der Nutzen einer Granulozytentransfusion ist schwierig abzuschätzen, und um die Wirksamkeit nachzuweisen, sind kontrollierte Versuche erforderlich. Es liegen jedoch Hinweise dafür vor, dass Granulozytentransfusionen in geeigneter Dosis sinnvoll sein können bei Patienten mit schwerer reversibler Neutropenie oder schwerer Funktionsstörung neutrophiler Granulozyten und bei Patienten mit Bakterien- oder Pilzinfektionen, welche auf konventionelle Behandlungen nicht ansprechen. Der Anteil von Patienten mit Alloimmunisierung gegen HLA-Antigene wie auch gegen granulozytenspezifische Antigene ist hoch. Diese Reaktionen beeinträchtigen die Wirksamkeit der verabreichten Granulozyten und haben zur Folge, dass weniger verabreichte Zellen überleben und zur Infektionsstelle wandern. 9. Hinweise zur Anwendung Das Produkt sollte nur Patienten mit schwerer Neutropenie und nachgewiesener Sepsis verabreicht werden, die eine geeignete Antibiotikabehandlung erhalten. Namentlich: - Patienten jeden Alters mit einer komplizierten oder lebensbedrohlichen Infektion, welche nicht auf Antibiotika anspricht, und mit einer Neutropenie von < 0,5 x109/l infolge von Knochenmarkinsuffizienz z.B. auf Grund des aplastischen Syndroms oder einer Knochenmarkaplasie nach einer Chemooder Strahlentherapie; - Patienten mit schwerer Funktionsstörung der Granulozyten und mit starkem Verdacht auf bzw. erbrachtem Nachweis für eine lebensbedrohliche Bakterien- oder Pilzinfektion, die während mindestens 48 Stunden nicht auf eine geeignete Behandlung mit Antibiotika resp. Antimykotika angesprochen hat, wenn starke Anzeichen dafür bestehen, dass die Knochenmarkfunktion reversibel beeinträchtigt ist und sich innerhalb von zwei Wochen erholen wird; - Neugeborene mit fulminanter Sepsis und einer relativen Neutropenie von < 3 x109/l in der ersten Lebenswoche oder < 1x 109/l nach der ersten Lebenswoche. Prophylaktische Granulozytentransfusionen werden nicht empfohlen. Unter bestimmten Umständen sollten Präparate verwendet werden, für die hinsichtlich CMV-Antikörpern und Parvovirus B19 negative Testergebnisse vorliegen. Empfohlene Dosis und Behandlung Die angestrebte Menge verabreichter Granulozyten beträgt > 20 x10 9 pro Tag bis zum Erreichen eines Behandlungseffekts. Bei Neugeborenen beträgt die empfohlene Dosis 1 x109/kg, in einem Volumen von 15 ml/kg. - 32 - 10. Vorsichtsmassnahmen Im Falle einer erheblichen Kontamination mit Erythrozyten sind Kompatibilitätstests bezüglich ABO- und Rh-Blutgruppen und AntikörperScreening-Tests erforderlich. Aufgrund des Risikos einer transfusionsassoziierten Graft-Wirt-Reaktion (TAGvHD) muss das Produkt mit Gamma-Strahlung bei einer Dosis von mindestens 25 Gy bestrahlt werden. Bei nicht alloimmunisierten Empfängern sind keine Kompatibilitätstests für Granulozyten erforderlich. Zur Identifizierung kompatibler Granulozyten kann bei alloimmunisierten Empfängern die Kreuzprobe durchgeführt werden. Bei CMV-seronegativen Patienten oder Neugeborenen sollten Granulozytenpräparate von CMV-seronegativ getesteten Spendern eingesetzt werden. Die durch Apherese gewonnenen Granulozyten müssen bei der Transfusion einen Filter mit der Porengrösse 170-200 m passieren. Die durch Apherese gewonnenen Granulozyten sind langsam zu verabreichen; es wird eine Transfusion über einen Zeitraum von zwei Stunden empfohlen. Die Transfusion sollte gut überwacht werden. Auf allfällige unerwünschte Wirkungen sollte sofort reagiert werden. Im Falle einer schweren Reaktion ist die Infusion zu unterbrechen. Es können Antipyretika, Antihistamine und Kortikosteroide eingesetzt werden. Eine Vorbehandlung mit Antihistaminen und Kortikosteroiden verringert tendenziell die Gefahr von akuten nicht-hämolytischen, nicht-infektiösen Transfusionskomplikationen. 11. Mögliche Nebenwirkungen - Es kann zu nicht-hämolytischen Transfusionsreaktionen kommen (Fieber, Schüttelfrost und Urticaria); - es kann zu einer Alloimmunisierung gegen HLA- und ErythrozytenAntigene kommen; - Sepsis auf Grund einer ungewollter Kontamination mit Bakterien. - posttransfusionelle Purpura; - transfusionsassoziierte akute Lungeninsuffizienz (TRALI); - Akkumulation von Hydroxyethylstärke nach wiederholter Exposition Übertragung latenter Viren (CMV, EBV usw.) - Übertragung von Syphilis; - Übertragung von Protozoen (z.B. Malariaerreger) in seltenen Fällen; - Übertragung von Viren (Hepatitis, HIV usw.), kann trotz sorgfältiger Spenderauswahl und Screening-Verfahren vorkommen; - Übertragung anderer Pathogene, für die keine Tests durchgeführt werden oder die noch nicht bekannt sind. - 33 - Für alloimmunisierte Patienten besteht ein höheres Risiko, dass eine ernsthafte Lungenreaktion mit Fieber, Schüttelfrost, Dyspnoe, Engegefühl in der Brust und Hypoxie auftritt als bei nicht alloimmunisierten Patienten, deshalb ist für manche Autoren eine Granulozytentransfusion kontraindiziert, wenn keine HLAkompatiblen Spender verfügbar sind. Die gleichzeitige Verabreichung von Amphotericin B und Granulozyten muss wegen der Gefahr einer pulmonalen Transfusionsreaktion vermieden werden. ADDENDUM Granulozyten-Mobilisierung beim Spender und Spendersicherheit In einigen Zentren werden rekombinanter G-CSF und Kortikosteroide zur Mobilisierung von Granulozyten beim Spender eingesetzt. In diesen Fällen ist eine schriftliche Einwilligung des Spenders erforderlich, mit ausdrücklicher Zustimmung zu allen bei diesem Verfahren verwendeten Arzneimitteln. Die Einzelheiten der Spende sind im Hinblick auf ein langfristiges Follow-up des Spenders und die wissenschaftliche Auswertung der Daten zu dokumentieren. Je nach nationaler Gesetzgebung ist die Zustimmung einer lokalen Ethikkommission erforderlich und die Anwendung von G-CSF nur im Rahmen klinischer Versuche zulässig. Durch Leukopherese können auch bei der Verwendung von Sedimentationsbeschleunigern oder Kortikosteroiden von normalen Spendern nicht mehr als 520 x109 Granulozyten zur Transfusion gewonnen werden. Das aktuelle Schema zur Granulozyten-Mobilisierung besteht in einer Kombination von rekombinant hergestelltem G-CSF, 5-10 μg/kg und Dexamethason, 8 mg oral, 12-24 Std. vor der Apherese verabreicht. Durch diese Vorbehandlung des Spenders können in einer Sitzung mindestens 40 x109 Granulozyten gewonnen werden. Hinsichtlich der kurzfristigen Nebenwirkungen (die normalerweise auf Sedimentationsbeschleuniger, Kortikosteroide und G-CSF zurückzuführen sind) wird diese Behandlung von gesunden Spendern gut vertragen. Mögliche Nebenwirkungen sind Gewichtszunahme, Kopfschmerzen, periphere Ödeme, Schlaflosigkeit, grippeähnliche Symptome, Knochenschmerzen, Schwitzen, Übelkeit, Flush. Eine längerfristige Verabreichung von G-CSF bei Patienten mit Neutropenie oder auch bei Spendern peripherer Blutstammzellen (PBSC) wurde mit schwerwiegenden Nebenwirkungen wie Splenomegalie oder Milzruptur, SweetSyndrom, leukozytoklastische Vaskulitis und Leck-Syndrom in Zusammenhang gebracht. Langfristige Nebenwirkungen wurden nicht beobachtet. Aus diesem Grund ist ein ausgedehnteres Follow-up erforderlich. Es besteht keine Einigkeit über die Häufigkeit von Spenden. Gewisse Experten setzen denselben Spender wiederholt ein, andere in Abständen von mindestens 4 Wochen oder nur ein einziges Mal. Merkmale von G-CSF-mobilisierten Spender-Granulozyten In-vitro- und In-vivo-Assays mit Granulozyten, die durch den GranulozytenKolonie-stimulierenden-Faktor (G-CSF) induziert wurden, zeigen verschiedene - 34 - funktionelle und phänotypische Veränderungen. Funktionelle Veränderungen umfassen eine höhere Produktion von Sauerstoffradikalen (Reactive Oxygen Intermediates, ROI), eine gesteigerte Adhäsion, Phagozytose, Abtötung von Bakterien und Antikörper-vermittelte zelluläre Zytotoxizität (ADCC) sowie eine geringere chemotaktische Aktivität. Verschiedene Granulozyten-Antigene werden in G-CSF-mobilisierten Granulozyten verstärkt hergestellt. Die Genexpression normalisiert sich bei den meisten dieser Antigene relativ bald, mit Ausnahme der beiden wichtigen Antigene FcγRIII (CD32) und L-Selectin (CD62L), deren Expression anhaltend verringert wird. Die Wiederfindungsrate neutrophiler Granulozyten nach der Transfusion ist zwar geringer, wenn der Spender zur Granulozytenmobilisierung behandelt wurde, die Granulozyten haben aber eine wesentlich längere Überlebenszeit in den Gefässen. Abschliessend lässt sich sagen, dass die funktionalen Merkmale von Granulozyten, die nach einer Behandlung des Spenders mit G-CSF mit oder ohne Einsatz von Kortikosteroiden gewonnen werden, auf Grund der Erkenntnisse von Chemolumineszenz-Assays oder von Assays zur bakteriziden Wirkung normal zu sein scheinen. Studien mit Indiummarkierten Zellen weisen auf eine normale Beweglichkeit und Wanderung zu Entzündungs- und Infektionsstellen hin. Literatur 1. Guide to the preparation, use and quality assurance of blood components, 10. Aufl., Strassburg, Council of Europe Publishing, Januar 2004. 2. Technical Manual, 13. Aufl., American Association of blood banks, 1999. 3. International Forum. Granulocyte Transfusions. Vox Sang. 2000;79:5966. 4. Klein HG, Strauss RG, Schiffer CA. Granulocyte Transfusion Therapy. Seminars in Hematology 1996;33:359-368. 5. Klein HG, Price TH, Strauss RG, Stroncek D. Granulocyte Transfusion Redux. Education Program of the ASH 1997:138-145. 6. Newburger PE, Parmley RT. Neutrophil Structure and Function, in: Hoffman R (Hrsg.): Hematology Basic Principles and Practice, 2. Aufl., S. 738-750. 7. Strauss RG. Principles of White Blood Cell Transfusion, in: Hoffman R (Hrsg.): Hematology Basic Principles and Practice, 2. Aufl., S. 20062010. 8. Spiekermann K, Roesler J, Emmendoerffer A, Elsner J, Welte K. Functional features of neutrophils induced by G-CSF and GM-CSF treatment: differential effects and clinical implications. Leukemia 1997;11:466-478. 9. Caspar CB, Seger RA, Burger J, Gmur J. Effective Stimulation of Donors for Granulocyte Transfusions with Recombinant Methionyl Granulocyte Colony-Stimulating Factor. Blood 1993;81:2866-2871. 10. Stroncek DF, Yau YY, Oblitas J, Leitman SF. Administration of G-CSF plus dexamethasone produces greater granulocyte concentrate yields - 35 - while causing no more donor toxicity than G-CSF alone. Transfusion 2001;41:1037-1044. 11. Bux J, Cassens U, Dielschneider T, et al. Tolerance of granulocyte donors towards granulocyte colony-stimulating factor stimulation and of patients towards granulocyte transfusions: results of a multicentre study. Vox Sang. 2003;85:322-325. - 36 -