Blut
Werbung

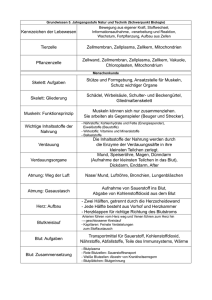
07.05.2006 Melanie Thompson Tierphysiologisches Praktikum Sommersemester 2006 - Versuch IV: Blut, durchgeführt am 03.05.2006 Gruppe XII Mittwoch morgens Einleitung In diesem Versuch geht es um die Bestandteile und Aufgaben des Blutes, sowie das Kennenlernen entscheidender Parameter und Anwendungen in der medizinischen Diagnostik. Beim Menschen macht das Blut ca. 7-8% des Körpergewichts aus. Dies entspricht durchschnittlich 5-7Litern Blut. Das Blut besitzt eine Reihe von Aufgaben, angefangen von Transportaufgaben bezogen auf den Gasaustausch (O2, CO2) und natürlich auf die Nährstoffversorgung einzelner Gewebe und Zellen, über kommunikativen Aufgaben mit Hilfe von Hormonen bis hin zu Schutz- und Abwerfunktionen durch die Blutgerinnung bzw. die humorale und zelluläre Abwehr. Des Weiteren übernimmt das Blut Speicherfunktion bezüglich Proteinen und Wasser und dient der Homoiostase, dem Aufrecht erhalten eines konstanten Milieus, der pH-Pufferung, dem Ionenausgleich über Wärmetransport bis hin zum Temperaturausgleich. Auch als Überträger von Kraft kann das Blut angesehen werden, dies bspw. bei der Häutung von Crustaceen oder der Bewegung bei Spinnen und Anneliden. Das Blut setzt sich zusammen aus flüssigen bzw. gelösten Bestandteilen – dem Blutplasma ca. 55% des Gesamtblutvolumens – sowie festen, nicht zu einem Gewebe gehörigen Bestandteilen – den Blutzellen ca. 45% des Gesamtblutvolumens. Das Blutplasma besteht zum überwiegenden Teil aus Wasser (ca. 90%) und einer geringen Konzentration anorganischer Ionen (bspw. Na+, Ca2+, Cl-, HCO3-) und Proteinen. Im Plasma transportierte Bestandteile stellen u.a. Glucose, Fette, Lipide und Stickstoffverbindungen dar, nach Muskelarbeit auch Milchsäure. Die im Plasma enthaltenen Proteine teilen sich in zwei Gruppen: Albumine, dienen der Proteinreserve, dem kolloidosmotischen Druck, dem Wassertransport durch Membranen und dem Fettsäuretransport im Blut; sowie Globuline, die Metallionen, Hormone und Vitamine transportieren, sowie an der Gerinnung und der Immunabwehr beteiligt sind. Die festen Bestandteile des Blutes lassen sich anhand von Funktion und Form in verschiedene Gruppen gliedern: Erythro-, Thrombo- und Leukozyten im Verhältnis 1000 : 100 : 1. Die im roten Knochenmark gebildeten Erythrozyten, gemeinhin: Rote Blutkörperchen, sind mit durchschnittlich 5-6 Millionen pro Kubikmilliliter die am häufigsten vorkommenden Zellen im Blut. Ihre Form lässt sich als bikonkave Scheibe oder „Drop“ mit einem Durchmesser von ca. 78,5m beschreiben. Durch ihre geringe Größe und ihre bikonkave Form wird eine große Oberfläche für die Sauerstoffdiffusion geschaffen, die Hauptaufgabe der Roten Blutkörperchen. Bei Säugetieren sind die Erythrocyten sekundär kernlos, dies bietet den Vorteil, dass mehr Platz für das eisenhaltige Protein Hämoglobin gehalten wird, welches essentiell für den Sauerstofftransport ist und das sie gleichzeitig sehr elastisch werden, was das Gleiten auch durch sehr feine Blutkapillaren ohne weiteres möglich macht. Leukozyten, oder auch Weiße Blutkörperchen, wiederum, lassen sich in drei weitere Unterklassen differenzieren: Monocyten, Granulocyten (darunter eosinophile, basophile und neutrophile) sowie Lymphocyten. Genau wie die Thrombocyten dienen sie der Immunabwehr, die sich in zwei Bereiche teilen lässt: humoral und zelluläre Abwehr. Humorale Abwehr beschreibt die Art der Abwehr, die über gelöste Substanzen von Statten geht, zelluläre Abwehr, auf der anderen Seite, beschreibt eben diese Art der Abwehr, die an Zellen gebunden ist. Die Immunabwehr über Granulozyten, Thrombozyten und Monozyten wäre in diesen Fall also eine zelluläre Abwehr. Lymphocyten können sowohl zellulär durch Phagozytose oder humoral über die Produktion von Antikörpern Krankheitserreger abwehren, zählen also zu beiden Abwehrarten dazu. Die Immunabwehr lässt sich jedoch nicht nur in zelluläre und humorale Abwehr, sondern auch in unspezifische und spezifische Abwehr aufteilen. Die unspezifische Abwehr beschreibt hierbei, die genetisch festgelegte Abwehr, die auch ohne vorherigen Kontakt mit dem Fremdkörper wirksam ist. Die spezifische Abwehr ist die „erlernte“ oder „erworbene“ Immunantwort, die einen vorhergehenden Kontakt mit einem Fremdköper notwendig macht. Durchführung und Material Die in den einzelnen Versuchsteilen verwendeten Materialien sind alle im Skript aufgeführt und werden hier nicht weiter erläutert. Die Durchführungen erfolgten in leicht veränderter Reihenfolge zu der im Skript angegebenen. 1. Blutgruppenbestimmung und Bestimmung des Rhesus-Faktors Erste Transfusionsversuche brachten oft nur minderen Erfolg, da sie häufig zu Agglutination (Verklumpung) oder Hämolyse (Auflösung) der Roten Blutkörperchen führten. Den Grund für diese Misserfolge fand man in der Immunreaktion zwischen den auf den Erythrocyten befindlichen Antigenen und den, gegen diese Antigene gerichteten, im Plasma befindlichen Antikörpern. Neben verschiedenen anderen immunologisch Wirksamen Merkmalen, hat sich in der Praxis jedoch das AB0-System durchgesetzt. Diese umfasst die Blutgruppen A, B, AB und 0. Man kann nun anhand eines verhältnismäßig einfachen Experimentes die Blutgruppe eines Menschen bestimmen. Hierbei mischt man die zu untersuchende Blutprobe mit verschiedenen Antiseren (Anti-A und Anti-B), die die verschiedenen Antikörper enthalten. Anhand der auftretenden oder ausbleibenden Agglutination kann man nun auf die Blutgruppe des Probanden schließen. Neben dem AB0-System gibt es noch ein weiteres, in der Praxis bedeutsames System: das Rhesus-System, wobei das Antigen D die größte Wirksamkeit besitzt und auch in diesem Versuchsteil untersucht wird. Besitzt ein Erythrocyt das Antigen D, so bezeichnet man die Blutgruppe als Rhesus-positiv (Rh), fehlt im das Antigen D, so findet die Bezeichnung Rhesus-negativ (rh) Verwendung. Diese Antigene sind jedoch nicht immer im Blut vorhanden, sondern bilden sich erst nach Kontakt mit Rh-positivem Blut. Wichtig wird dies bei Schwangerschaften, bei denen sich der Rhesus-Faktor der Mutter zu dem des Fötus unterscheidet, da diese Antigene die Plazentaschranke passieren und einen Antikörper-Produktion damit anregen können, was bei weiteren Schwangerschaften mit ebenfalls unterschiedlichem Rhesus-Faktor zu Problemen führen könnte. In diesem Versuchsteil wird nun die Blutgruppe und auch der Rhesus-Faktor der Kursteilnehmer nach oben genanntem Verfahren ermittelt. 2. Differentialblutbild des Menschen Bei einem Differentialblutbild werden Blutausstriche angefärbt und mikroskopisch untersucht. Um ein Differentialblutbild zu erzeuge wird zunächst ein Blutstropfen auf einen Objektträger gebracht, anschließend gleichmäßig und fein ausgezogen und an der Luft getrocknet. Danach wird dieser Ausstrich angefärbt, indem er drei Minuten in May-Grünwald-Lösung, eine Minute in 50%iger May-Grünwald-Lösung und schlussendlich 15 Minuten in 5%iger GiemsaLösung (Verdünnung 1:20) gebracht wird. Der Ausstrich wird dann mit Aqua dest. abgespült und luftgetrocknet. Anschließend wird der Ausstrich mäanderförmig abgegangen und es werden 100 Leukozyten ausgezählt, wobei die einzelnen Leukozytentypen prozentual festgehalten werden. 3. Bestimmung der Erythrozytenzahl Etwas Blut wird mit Hilfe einer Hayem’schen Lösung auf das 1 : 200-fache verdünnt und ein Tropfen dieser Verdünnung auf eine Zählkammer aufgebracht. Die Zählkammer enthalt ein Zählkreuz, welches Großquadrate bestehend aus 4x4 Kleinquadraten zeigt. Ein Kleinquadrat hat ein Volumen von 1 mm 3 , es werden 80 Kleinquadrate bzw. 5 4000 Großquadrate ausgezählt, womit insgesamt ein Volumen von 1 mm3 bestimmt wird. 50 Die ermittelte Erythrocytenzahl wird anschließend auf 1mm3 hochgerechnet, indem man die ausgezählten Erythrocyten durch 1 mm3 teilt und anschließend mit 200 multipliziert, da eine 50 1 : 200-fache Verdünnung besteht. 4. Photometrische Hämoglobinbestimmung In diesem Versuchsteil wird die Hämoglobinkonzentration des Blutes mit Hilfe eines Photometers bestimmt. Oxigeniertes und desoxygeniertes Hb besitzen jedoch unterschiedliche Absorptionsmaxima und müssen daher durch eine Reagenzlösung über Methhämoglobin in Cyanhämoglobin mit einem einheitlichen Absorptionsmaximum bei 546nm überführt werden. Das Mischen von Blut und Reagenz führt zu einer Hämolyse, die Erythrocyten platzen und das Hämoglobin wird freigesetzt. Ergebnisse 1. Blutgruppenbestimmung und Bestimmung des Rhesus-Faktors Praktikant Blutgruppe Jan 0 (neg.) Katharina 0 (pos.) Antje A (pos.) Caro A (pos.) Kerstin B (pos) Melanie 0 (neg.) 2. Differentialblutbild des Menschen Granulocyten Monocyten Lymphocyten neutrophile eosinophile basophile Verteilung beim gesunden Menschen Kerstin Antje Melanie Katharia Caro Jan 60-65 2-4 1 3-8 20-35 55 0 0 1 44 18 54 57 20 5 4 3 11 20 4 1 5 5 3 3 7 52 35 36 57 3. Bestimmung der Erythrocytenzahl Praktikant (Geschlecht) Ery [ 10 6 ] mm 3 Weibl. Durchschnitt: 4,0-5,5 Kerstin 7,31 Antje 4,28 Melanie 5,37 Katharina 4,49 Caro 4,61 Männl. 4,5-6 Jan 6,25 4. Photometrische Hämoglobinbestimmung Praktikant Extinktion HB [%] g/100ml MCH [pg] 12-16 29-31 (Geschlecht) Weibl. Kerstin 0,253 9,31 12,7 Antje 0,35 12,92 30,14 Melanie 0,18 6,624 12,3 Katharina 0,367 13,5 30,1 Caro 0,394 14,5 31,45 14-18 29-31 12,51 20,0 Männl. Jan 0,34 Die Hämoglobinkonzentration im Blut bezügl. g/ml, wird anhand folgender Formel berechnet: Hb-Konzentration = Extinktion (546nm) . 36,8g Hb/100ml. Die MCH-Konzentration berechnet sich mit Hilfe folgender Formel: MCH [ pg ] pg ] mm3 Erythrozyten mm3 Hämoglobin [ Die Hb-Konzentration muss also von g/100ml in pg/mm3 umgerechnet werden, dies ergibt eine Umrechnungsfaktor von 1012 von g auf pg und von 105 bezogen auf 100ml auf mm3. Damit muss die ermittelte Hb-Konzentration also mit 107 multipliziert und durch die Erythrozytenanzahl pro mm3 geteilt werden. Diskussion und Fehlerbetrachtung 1. Blutgruppenbestimmung und Bestimmung des Rhesus-Faktors Die Blutgruppenbestimmung erfolgte, wie oben erwähnt, durch das Mischen der Probe mit Testseren Anti-A, Anti-B und Anti A+B. Das Testserum Anti-A entspricht dem Serum eines Menschen mit der Blutgruppe B, einfach zu verstehen, da ein Mensch mit Blutgruppe B Antikörper gegen die Blutgruppe A in seinem Serum mit sich führt. Der Test ging also ähnlich dieses Bildes von Statten: Zu erkenn ist, dass bei den Praktikanten mit Blutgruppe 0 keinerlei Verklumpung vor sich ging, da die Erythrocyten der Blutgruppe 0 keinerlei Antigene tragen. Dies führt dazu, dass man Probanden mit der Blutgruppe 0 als „Universalspender“ bezeichnen könnte, da sie, zumindest in geringen Mengen, von jeder anderen Blutgruppe toleriert werden können. Genauso ist zu erkennen, dass Menschen mit Blutgruppe AB als „Universalempfänger“ bezeichnet werden können, da sie, in begrenztem Maße, Blut aller Blutgruppen empfangen können, ohne, dass es zu einer Verklumpung kommt. Sicherlich sei hier noch zu erwähnen, dass natürlich auch der Rhesus-Faktor keine unerhebliche Rolle bei Bluttransfusionen spielt. Alles in allem betrachtet waren unter den sechs Praktikanten drei, deren Blutgruppe bekannt war, und die somit als Kontrollgruppe fungierten. Die Blutgruppenbestimmung war alles in allem recht genau, die Bestimmung des RhesusFaktors war jedoch schwierig, weshalb diese Ergebnisse sicherlich nicht zu 100% genau sind. 2. Differentialblutbild des Menschen Besieht man sich die hier ermittelten Ergebnisse, so liegen die Werte von Katharina und Caro im Rahmen, und auch die Werte von Kerstin sind, bis auf die erhöhten Lymphocyten-Werte (vermutlich zurückzuführen auf eine, während des Versuches vorhandene Erkältung) noch annehmbar. Die Werte von Jan fallen, genau wie die Werte von Melanie, vollkommen aus dem Rahmen. Bei Jan scheint eine Infektion mittlerer oder schwerer Art vorzuliegen, da seine Lymphocyten doch deutlich im Vergleich zum Normwert von 20-35% erhöht sind. Auch seine basophilen und eosinophilen Granulozyten sind stark erhöht, was auf eine bestehende Allergie hinweist und unter Umständen mal gegengeprüft werden sollte. Ähnliches gilt für Melanie, hier sind die Werte für Lymphocyten und basophile Granulocyten enorm erhöht, zurückzuführen auf eine bestehende oder gerade abklingende Infektion und eine schwere Allergie. Die stark erniedrigten Werte für die neutrophilen Granulocyten lassen sich vermutlich auf die Einnahme von Antihistaminika zurückführen, jedoch kann hierüber schlussendlich nichts genaues ausgesagt werden. Fehler könnten natürlich auch bei der Auszählung der Leukocyten entstanden sein, da die Anfärbung leider nicht zu aller Zufriedenheit funktioniert hat, was das Unterscheiden der einzelnen Leukocyten-Typen nicht wirklich vereinfachte. 3. Bestimmung der Erythrocytenzahl Die Erythrocytenanzahl könnte Rückschlüsse auf die Sauerstoffversorgung des Blutes bzw. der Gewebe zulassen. Dies ist auch der Grund, warum die Erythrocytenanzahl bei Sportlern im Vergleich zum Durchschnittsmenschen leicht bis stark erhöhlt ist. Dies könnte eine Erklärung für Kerstins erhöhten Erythrocytenwert geben, da sie im Vergleich zu den anderen Praktikanten als Leistungssportlerin gewertet werden könnte. Alle anderen Werte lagen weitestgehend im Rahmen. Fehler könnten natürlich bei der Auszählung, aber auch bei der ungleichmäßigen Verteilung der Erythrocyten in der Zählkammer entstanden sein. 4. Photometrische Hämoglobinbestimmung Hämoglobin besteht aus einem Proteinanteil, dem Globin und der Sauerstoff-bindenden HämGruppe im Erythrocyten. Das Hämoglobin wird in den Lungenbläschen mit Sauerstoff beladen und von dort aus durch die Erythrocyten im ganzen Körper verteilt. Gleiches gilt umgekehrt für das CO2, es wird aus den Geweben aufgenommen und über die Lungenbläschen abgegeben. Ca. 90% der Trockenmasse eines Erythrocyten wird durch das Hämoglobin ausgemacht, welches neben der Sauerstoff/Kohlendioxid-Transportfunktion gleichzeitig eine Pufferwirkung im Blut ausüben kann. Wie zu erkennen ist, liegen alle Werte, abgesehen der von Kerstin, Melanie und Jan weitestgehend im Normbereich. Bei den genannten drei Praktikanten liegt die Hämoglobinkonzetration unter dem durchschnittlichen Wert für das jeweilige Geschlecht. Diese Werte lassen bei allen dreien auf einen Eisenmangel hindeuten, der zumindest bei Melanie durch fleischlose Kost zu erklären wäre. Weiterhin könnten natürlich systematische Fehler aufgetreten sein, die zu diesen abweichenden Werten führten. Literatur Skript „Tierphysiologischer Kurs“ SS 2006, Zoologisches Institut der JWGUniversität Skript „vegetative Tierphysiologie“ WS2003/2004, AK Stoffwechselphysiologie, Zoologisches Institut der JWG-Universität dtv-Atlas zur Biologie, Band 2 1995 Vergleichende Tierphysiologie, Heldmaier und Neuweiler, 2004 im Springer Verlag Biologie, Neil A. Campbell/ Jane B. Reece, 2003 im Spektrum Verlag