Die Resorcin (Seliwanoff) Probe
Werbung

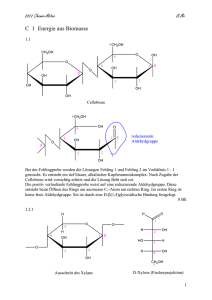
Qualitative und quantitative Analyse von Nährstoffen I) Kohlenhydrate: Nachweis der Formyl-/Aldehydgruppe (CHO) in reduzierenden Zuckern – Die Fehling’sche Probe: „Fehling I“ ist eine verdünnte Kupfer(II)-sulfat-Lösung. „Fehling II“ ist eine Lösung des Kalium-/Natriumsalzes der Weinsäure welche durch Zugabe von Natronlauge stark alkalisch ist. Das Kaliumnatriumtartrat reagiert mit dem Cu2+-Ion und es entsteht ein Di-tartratocuprat(II)-Komplex, der das Cu2+-Ion in Lösung hält. Cu2+ + 2 C4H4O6 + 2 OH- Cu [(C4H3O6)2]4- (blau) + 2 H2O Der gelöste Kupferkomplex vermag nun im basischen Milieu reduzierende Zucker zu oxidieren, wobei das Cu 2+-Ion selbst zu Cu1+ reduziert wird. Die Aldehydgruppe des Zuckers wird zur Carbonsäure oxidiert. Bei Glucose und Fructose (Aldehydgruppe wird in Lösung „intermediär“ gebildet) ist der Nachweis positiv, bei der Saccharose hingegen negativ. Saccharose ist ein Disaccharid welches so verknüpft ist, dass es keine freie Aldehydgruppe intermediär bilden kann. Selektiver Nachweis von Glucose – Der Glucose-Oxidase-Test (GOD): Er dient vor allem in der Medizin um Diabetes nachzuweisen, da bei der dieser Erkrankung ein ungewöhnlicher hoher Glucosegehalt im Harn vorhanden ist. Glucose-Oxidase ist ein Enzym, welches die Oxidation der β- Glucose mit Luftsauerstoff zum Gluconolacton katalysiert. Bei dieser Reaktion wird Wasserstoffperoxid gebildet. O2 + + H2O2 Um den Nachweis nun sichtbar zu machen, bedient man sich einer gekoppelten Reaktion mittels des Redox-Indikators o-Tolidin. Das Wasserstoffperoxid (wird selbst zu Wasser reduziert) oxidiert dabei das farblose o-Tolidin zum Tolidinblau. Nachweis der Stärke – Die Lugol-Probe (Iod-Kaliumiodidlösung): Die Lugol-Lösung besteht aus Iod (I2) in Kaliumiodid (KI) gelöst. Dabei entstehen Polyiodidionen, wie I3-, I5-…Diese lagern sich in die Helix des Stärkemoleküls ein und bilden einen blauen, blauvioletten…Komplex. Schülerausarbeitung 8A/B 2008 korrigiert von A. Schrafl & E. Klemm 1 II) Proteine: Nachweis der Peptidgruppe (NHCO) in Proteinen – Die Biuretreaktion: Die Biuretreaktion (Name kommt von Urea=Harnstoff, wobei zwei (=bi) Harnstoffmoleküle unter Ammoniakabspaltung kondensieren) beruht auf der Komplexbildung von Kupfer(II)sulfat mit den Peptidgruppen des Proteins. Der Komplex wird nur im basischen Milieu gebildet, weshalb man Kali- oder Natronlauge zur Kupfer(II)-sulfatlösung hinzugeben muss. Das Kupferion fungiert als Zentralatom und insgesamt vier Peptidgruppen dienen als Liganden. Dabei stammen je zwei Peptidgruppen vom selben Protein. Durch Zugabe der Lauge wird je eine Peptidgruppe pro komplexbildenden Protein deprotoniert (siehe Formel) Nachweis der Proteine / Aminosäuren – Die Ninhydrinreaktion: Ein Ninhydrinmolekül reagiert im ersten Schritt in einer Additionsreaktion mit der Aminosäure unter der Abspaltung von CO2. Dabei wird die Aminogruppe der Aminosäure auf das Ninhydrinmolekül übertragen und die Aminosäure zum Aldehyd umgewandelt. Das so gebildete Molekül reagiert mit einem weiteren freien Ninhydrinmolekül in einer „Kopplungsreaktion“ zum violetten Farbstoff, auch „Ruhemanns Violett“ genannt. Ausfällung von Proteinen mittels Trichloressigsäure (TCA): Durch die Veränderung des pH-Wertes und durch die Eigenschaft der TCA, hygroskopisch (wasseranziehend) zu sein, flocken die Proteine aus. Die Proteine sind zunächst kolloidal gelöst. Dies ist nur möglich, da das Protein „kugelförmig“ ist und so leichter durch das Wasser hydratisiert werden kann. Durch die TCA wird einerseits die Hydrathülle entzogen und andererseits die „Kugelstruktur“ (so genannte Tertiärstruktur), welche durch Wasserstoffbrücken, van-der-Waals-Kräfte und Disulfid-Brücken (Bindungen zwischen Schwefelatomen) hervorgerufen wird, zerstört. Das Protein entfaltet sich mehr und mehr, die angesprochenen Anziehungen und Bindungen werden gelöst und die Proteine werden unlöslich, flocken aus. Die Peptidkette wird nicht zerstört!!! Schülerausarbeitung 8A/B 2008 korrigiert von A. Schrafl & E. Klemm 2 Andere Methoden der Ausfällung sind Aussalzen, Dialyse von Proteinen, isoelektrische Fällung und Ausfällung mit organischen Lösungsmitteln. „Denaturierung“ beschreibt die Veränderung der natürlichen Struktur von Proteinen, welche meist irreversibel ist und mittels Lösungsmitteln, Salzen, Säuren und extremen Temperaturen erfolgt. III) Fette und Fettsäuren: Nachweis der Kohlenstoff-Doppelbindung/en in ungesättigten Fettsäuren und Fetten mit ungesättigten Fettsäuren: Bei der Bromaddition wird die C=C Doppelbindung von Fetten nachgewiesen. An der Kohlenstoffdoppelbindung wird durch die Zugabe von Bromwasser (gelöstes Br2) das Brom „addiert“, man spricht von „elektrophiler Addition“. Durch die Addition des Broms an das Fettsäure-/Fettmolekül wird das Brom, welches das Bromwasser braun färbt, aus der wässrigen Lösung entfernt. Dadurch tritt die Entfärbung der wässrigen Phase ein. IV) Vitamine: Nachweis von Vitamin C - Tillmann’s Reagenz (2,6-Dichlorphenolindophenol / DCPIP): Diese Entfärbung beruht darauf, dass sich von den Ascorbinsäuremolekülen jeweils zwei Wasserstoffatome abspalten (Oxidation) welche dann von den DCPIP-Molekülen aufgenommen werden (Reduktion). DCPIP ist ein so genannter Redoxindikator. Dies funktioniert jedoch nur solange, bis alle Ascorbinsäuremoleküle oxidiert sind, weshalb ein quantitativer Nachweis ebenso möglich ist. Ascorbinsäure(Vitamin C) V) 2,6-Dichlorphenolindophenol Mineral- & Spurenstoffe: Zweiwertiges Calcium und Magnesium - Komplexometrische Titration: Schülerausarbeitung 8A/B 2008 korrigiert von A. Schrafl & E. Klemm 3 Diese Titration ist ein quantitativer Nachweis von Magnesium und Calcium Ionen in einer wässrigen Lösung. Wichtig dabei ist, dass es kein Nachweis von dem Verhältnis der beiden Atome ist, sondern eine gemeinsame Anzahl der Ionen. Durch Zugabe von Eriochromschwarz T zu der Versuchsprobe kommt es zu einer Rotfärbung. Nun wird mit der EDTA-Lösung (Ethylendiamintetraessigsäure) titriert. Da die EDTA ein stärkerer Komplexbildner ist als das Eriochromschwarz T werden nun dem Eriochromschwarz T-Komplex die Metallionen Mg2+ und Ca2+ entzogen. Da das nicht komplexierte Eriochromschwarz T selbst grün ist, und der EDTA-Komplex farblos ist, kann der Farbumschlag von Rot nach Grün beobachtet werden. Dreiwertiges Eisen: Thiocyanate, oder auch Rhodanide, sind die anorganische Salze der Thiocyansäure (HSCN). Der Name „Rhodanid“ leitet sich vom griechischen "rhodos" für "rot" ab, da das Salz Eisen(III)-thiocyanat eine tiefrote Farbe besitzt. Die Nachweiswirkung beruht auf einer Reaktion, in der Fe3+-Ionen von Thiocyanat-Ionen und Wassermolekülen komplexiert werden. Die Stöchiometrie des Komplexes ist dabei nicht eindeutig, jedoch ist das Eisen(III)-Ion immer oktaedrisch komplexiert (6 Liganden). Alle diese Komplexe zeigen die typisch rote Färbung, je mehr SCN- koordinieren, desto dunkler ist der Komplex. Eine Beispielrektion: Sind alle Koordinationsstellen mit SCNHexathiocyanidoferrat(III)-Ion [Fe(SCN)6]3-. besetzt, Schülerausarbeitung 8A/B 2008 korrigiert von A. Schrafl & E. Klemm kommt man zum blutroten 4