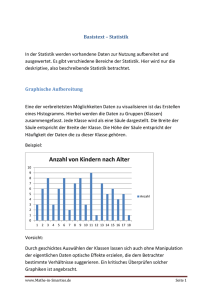
Median - Qucosa
Werbung

Aus der Medizinischen Tierklinik der Veterinärmedizinischen Fakultät der Universität Leipzig Untersuchungen zu der Entwicklung der Körperkondition, dem peripartalen Stoffwechsel und der Morbidität von Hochleistungskühen Inaugural-Dissertation zur Erlangung des Grades eines Doctor medicinae veterinariae (Dr. med. vet.) durch die Veterinärmedizinische Fakultät der Universität Leipzig eingereicht von Gunter Hädrich aus Bad Salzungen Leipzig, 2007 Mit Genehmigung der Veterinärmedizinischen Fakultät der Universität Leipzig Dekan: Prof. Dr. med. vet. Karsten Fehlhaber Betreuer: apl. Prof. Dr. med. vet. Manfred Fürll Gutachter: apl. Prof. Dr. med. vet. Manfred Fürll, Medizinische Tierklinik, Veterinärmedizinische Fakultät der Universität Leipzig Prof. Dr. med. vet. Klaus Eulenberger, Zoologischer Garten Leipzig, Leipzig Prof. Dr. med. vet. Rudolf Staufenbiel, Klinik für Klauentiere, Freie Universität Berlin, Fachbereich Veterinärmedizin Tag der Verteidigung: 12.12.2006 Inhaltsverzeichnis 1 Einleitung.......................................................................................................................... 1 2 Literaturübersicht .............................................................................................................. 2 2.1 Stoffwechsel der Milchkuh ....................................................................................... 2 2.1.1 Auswirkungen der Stoffwechsellage ante partum auf Gesundheit, Fruchtbarkeit und Leistung der Milchkuh in der Frühlaktation ....................... 2 2.1.2 Stoffwechselsituation und Körperkonditionsentwicklung im Laktationsverlauf ..................................................................................... 4 2.2 Ausgewählte klinisch-chemische Blutparameter ...................................................... 6 2.3 Bedeutende Erkrankungen im ersten Laktationsdrittel und Zwillingsträchtigkeit bei Milchkühen ....................................................................... 10 2.3.1 Dislocatio abomasi ..................................................................................... 10 2.3.2 Gebärparese .............................................................................................. 13 2.3.3 Endometritis ............................................................................................... 16 2.3.4 Retentio secundinarum............................................................................... 18 2.3.5 Mastitis ....................................................................................................... 19 2.3.6 Klauenerkrankungen .................................................................................. 21 2.3.7 Ovarialzysten ............................................................................................. 23 2.3.8 Früh-, Schwer-, Totgeburten....................................................................... 24 2.3.9 Zwillingsträchtigkeit .................................................................................... 25 2.4 Referenzwerte der Stoffwechselparameter ............................................................... 27 3 Tiere, Material und Methoden ......................................................................................... 28 3.1 Tiere, Haltung und Fütterung ................................................................................. 28 3.2 Messung der Rückenfettdicke ................................................................................ 31 3.3 Probenentnahme, -aufbereitung und –verwahrung ................................................ 31 3.4 Bestimmungsmethoden ......................................................................................... 31 3.5 3.4.1 Klinisch-chemische Parameter ................................................................... 31 3.4.2 Insulin, Östradiol und IGF-1 ........................................................................ 33 3.4.3 NSBA-Bestimmung .................................................................................... 33 Biostatistische Auswertung .................................................................................... 34 I 4 Ergebnisse ................................................................................................................... 35 4.1 Klinische Untersuchung und Begleiterkrankungen ................................................. 35 4.2 Veränderungen der Körperkondition vom Zeitpunkt des Trockenstellens bis 4 Monate nach der Kalbung ................................................................................... 38 5 4.3 Gesamtleukozytenzahl ........................................................................................... 40 4.4 Klinisch-chemische Parameter ............................................................................... 42 4.4.1 Parameter des Energie- und Fettstoffwechsels .......................................... 42 4.4.2 Parameter des Eiweißstoffwechsels ........................................................... 52 4.4.3 Leberfunktionsparameter ............................................................................ 55 4.4.4 Parameter des Mineralstoffwechsels .......................................................... 59 4.4.5 Weitere labordiagnostische Parameter ....................................................... 65 4.4.6 Endokrine Parameter.................................................................................. 69 4.5 Gesamtübersicht .................................................................................................... 71 4.6 Harnuntersuchung ................................................................................................. 72 Diskussion ................................................................................................................... 73 5.1 Klinische Untersuchung ......................................................................................... 73 5.2 Körperkondition ...................................................................................................... 74 5.3 Leukozytenzahl ...................................................................................................... 77 5.4 Klinisch-chemische Parameter ............................................................................... 78 5.4.1 Energie- und Fettstoffwechsel .................................................................... 78 5.4.2 Eiweißstoffwechsel ..................................................................................... 81 5.4.3 Leberfunktionsparameter ............................................................................ 82 5.4.4 Mineralstoffwechsel .................................................................................... 83 5.4.5 Creatinkinase, Alkalische Phosphatase ...................................................... 84 5.5 Endokrine Parameter ............................................................................................. 85 5.6 Harnuntersuchung ................................................................................................. 86 5.7 Wesentliche Stoffwechselbefunde ausgewählter Gruppen ..................................... 87 5.8 Auswertung der Fütterung...................................................................................... 91 5.9 Schlussfolgerungen ............................................................................................... 92 6 Zusammenfassung ......................................................................................................... 93 7 Summary 8 Literaturverzeichnis ........................................................................................................ 97 ................................................................................................................... 95 Anhang Danksagung II Abkürzungsverzeichnis Abb. Abbildung AP Alkalische Phosphatase a.p. ante partum AST Aspartat-Amino-Transferase BCS Body Condition Score BHB ß-Hydroxy-Butyrat BHV Bovine Herpesvirus Ca Calcium CK Creatinkinase Cl Chlorid d Tag(e) DCAD dietary cation-anion difference En/Lo Endometritis/Lochiometra EZ Entnahmezeitpunkt(e) Fe Eisen FE fraktionierte Elimination FFS Freie Fettsäuren FG Frühgeburt FMS Fettmobilisationssyndrom FSH Follikelstimulierendes Hormon ges. gesund GGT γ-Glutamyl-Transferase GLDH Glutamat-Dehydrogenase GP Gebärparese HDL high density lipoprotein IGF-1 Insulin-like growth factor-1 IGFBP Insulin-like growth factor binding protein K Kalium KG Krankheitsgruppe(n) Kl Klauenerkrankung(en) LDL low density lipoprotein LH luteinisierendes Hormon LMV Labmagenverlagerung III M Mastitis MDK Magen-Darm-Kanal Mg Magnesium min Minute(n) MVA Milchviehanlage n/N Anzahl Na Natrium NEFA nonesterified fatty acids NEL Nettoenergie Laktation NSBA Netto-Säuren-Basen-Ausscheidung OZ Ovarialzyste(n) Pi anorganisches Phosphat p.p. post partum r Korrelationskoeffizient RFD Rückenfettdicke RNB ruminogene Stickstoffbilanz R.s. Retentio secundinarum RZ Rastzeit SG Schwergeburt Tab. Tabelle TG Totgeburt TM Trockenmasse TMR totale Mischration VK S Variationskoeffizient in der Serie VK T Variationskoeffizient von Tag zu Tag x̃ Medianwert XP Rohprotein ZTZ Zwischentragezeit ZW Zwillingsträchtigkeit IV Einleitung 1 Einleitung Durch züchterische Selektion und Intensivierung der Fütterung (KNIGHT 2001) sind die Milchleistungen und somit die Anforderungen an die schwarzbunten Milchkühe in Deutschland in den letzten Jahren deutlich angestiegen (ENGELHARDT 2003). Die Gewährleistung der stabilen Tiergesundheit in den Hochleistungsherden stellt eine große zu bewältigende Herausforderung dar (JÄKEL 2005b). Besonders das Problem einer zu stark ausgeprägten negativen Energiebilanz steht in Verbindung mit umfangreichen Körpermasseverlusten in der Frühlaktation (ROSSOW 2001, DRACKLEY 2002) und ist assoziiert mit dem Auftreten von Erkrankungen peri- und post partum (FÜRLL 2002a), welche die Produktivität der Milchkuh entscheidend beeinflussen (DRACKLEY 2004). Die Beurteilung der Körperkondition mittels sonographischer RFD-Messung ist auf Herdenbasis als ein wichtiges Kontrollinstrument zur Überwachung der Mobilisation von Körperfettreserven nach der Abkalbung zu verstehen (SCHROEDER 2000, STAUFENBIEL et al. 2004, SCHROEDER u. STAUFENBIEL 2006). Die Erkennung von Abweichungen frühdiagnostischer Parameter vor dem Auftreten einer Erkrankung bietet Potenzial zu Ansätzen prophylaktischer Behandlungsmöglichkeiten. Die Zielstellung vorliegender Arbeit war eine deskriptive Bestandsuntersuchung anhand der Auswertung von charakteristischen Parametern des Stoffwechsels im peripartalen Zeitraum. Weiterhin stand die Frage im Vordergrund, welche Veränderungen im frühen Stoffwechsel ante partum bzw. kurz nach der Kalbung den jeweiligen Krankheiten vor deren klinischer Manifestation vorausgehen und ob das Risiko des Auftretens postpartaler Erkrankungen bereits während der Trockenstehperiode erkennbar ist. Zur Beantwortung sollte die Auswertung einer repräsentativen Tierzahl in den jeweiligen Gruppen zur Verfügung stehen. Weiteres spezielles Augenmerk der vorliegenden Untersuchung galt der Stoffwechselsituation von Kühen mit Zwillingsträchtigkeiten und der Fragestellung, ob und wann eine Vorhersage der Verlagerung des Labmagens möglich ist. 1 Literaturübersicht 2 Literaturübersicht 2.1 Stoffwechsel der Milchkuh Gesundheit und Leistung sind an einen ausgeglichenen und stabilen Stoffwechsel gebunden (FÜRLL 2002b). Zum besseren Verständnis von Stoffwechselerkrankungen, schlechten Fruchtbarkeitsleistungen und hohen Gewichtsverlusten post partum ist eine genaue Kenntnis der peripartalen Stoffwechselabläufe der Milchkuh erforderlich (BELL 1995, GOFF u. HORST 1997, DRACKLEY et al. 2001). 2.1.1 Auswirkungen der Stoffwechsellage ante partum auf Gesundheit, Fruchtbarkeit und Leistung der Milchkuh in der Frühlaktation „Der sensibelste Zeitraum für die Entstehung von Stoffwechselstörungen bei Hochleistungskühen ist die Frühlaktation, die Weichen für die Störungen werden allerdings schon während der Trockenstehphase gestellt“ (FÜRLL 2002a). Somit ist das Management und die Ernährung während des Zeitraumes vor der Kalbung von eminenter Bedeutung und die richtige Fütterung der hochträchtigen Kuh liefert die Grundlage für einen erfolgreichen Übergang in die Laktation (DRACKLEY 2002). Nach ROSSOW (2001) und STAUFENBIEL (2005) liegt der Schlüssel für eine hohe Tiergesundheit der Milchkuh in einer optimal beschaffenen Körperkondition, beginnend im letzten Laktationsdrittel der vorangegangenen Laktation mit Fortsetzung in die Trockenstehphase hinein. Werden die Kühe in dieser Zeitspanne energetisch überversorgt, mobilisieren diese überkonditionierten Tiere im späten Abschnitt des Trockenstehens und in der ersten Phase der Frühlaktation vermehrt Körperfett (NEWBOLD 2005). Es kommt zum Fettmobilisationssyndrom, verbunden mit fettiger Leberdegeneration (KANEENE et al. 1997, HERDT 2000, FÜRLL 2002a, ROSSOW 2003b, BOBE et al. 2004). Die wesentlichen Ursachen des Fettmobilisationssyndroms mit den daraus resultierenden Komplikationen sind in der Trockenstehphase mit einer nicht bedarfsgerechten Fütterung zu suchen (KIM u. SUH 2003, DRACKLEY 2004). Schon MORROW (1975) beschrieb unter dem Begriff „fat cow syndrome“, dass überkonditionierte Kühe für Stoffwechselstörungen und Infektionserkrankungen prädisponiert sind. 2 Literaturübersicht Nach FÜRLL (2002) stellen sich die Grundzüge des Fettmobilisationssyndroms (FMS) wie folgt dar: Verfettung während der Trockenstehperiode Einschränkung des Futteraufnahmevermögens und damit verbunden eine ungenügende Energieaufnahme bereits vor der Kalbung, u. a. gefolgt vom Anstieg der freien Fettsäuren- sowie der Ketonkörperkonzentration Körperfettabbau bereits vor sowie dessen Verstärkung um und nach dem Kalbezeitraum Verfettung der Körperorgane und somit deren Funktionseinschränkung, insbesondere der Leber ↔ dies führt zu einem deutlich veränderten Verhältnis der verschiedenen Leberfettsäuren zueinander (SATO et al. 2003) Fettanreicherung im Blut und deshalb Verminderung der Bindung, des Abbaus und der Ausscheidung von Endotoxinen Anreicherung von freien Endotoxinen im Blut mit den Folgen: leichtere Passage von Krankheitserregern aus dem Gastrointestinaltrakt in das Blut und damit in die Körperorgane (u.a. Euter, Uterus, Lunge, Leber) lokale Durchblutungsstörungen in Organen, infolge dessen entstehen Entzündungen, wie z.B. Klauenentzündungen (Klauenrehe) Verminderung der Muskelkontraktion und damit u.a. reduzierte Darm- bewegungen mit der Folge von z.B. Labmagenverlagerungen und peripartaler Wehenschwäche Fieberreaktionen schwere Perfusionsschäden mit Organausfall (Endotoxinschock) Einschränkung der Körperabwehr durch geringere Leistung der Abwehrzellen im Blut, verminderte Bildung von Immunglobulinen und somit größere Anfälligkeit für Infektionen innerhalb des ersten Laktationsdrittels (besonders als Faktorenkrankheiten) Daraus ist ersichtlich, dass das FMS eine fundamentale Bedeutung für die Entstehung periund postpartaler Erkrankungen sowie Fruchtbarkeitsproblemen im Bestandsmaßstab aufweist und damit die Produktivität der Milchkuh entscheidend beeinflusst. Aufgrund der unzureichenden Futteraufnahme post partum zur Deckung des benötigten Energiebedarfes zur Erhaltung sowie zur Laktation (GOFF u. HORST 1997, HERDT 2000, GRUMMER 2004) kommt es insbesondere bei vor der Kalbung überkonditionierten Kühen zur übersteigerten Lipolyse (McNAMARA 2000) und somit zu einer massiven Anflutung von freien Fettsäuren zur Leber (FÜRLL 2000), welche diese nicht in ausreichendem Maße verstoffwechseln kann und als Triacylglyceride speichert. Dies führt zwangsläufig zur Ausbildung einer Fettleber (OIKAWA et al. 1997, OHTSUKA et al. 2001, FÜRLL 2002a), hauptsächlich innerhalb der ersten 4 Wochen post partum (GRUMMER 1993), was mit einem metabolischen Funktionsverlust einhergeht (GRUMMER 1993, DRACKLEY 1999). 3 Literaturübersicht Wie DRACKLEY et al. (2001) feststellten, „befindet sich die Leber an den Schnittstellen des Stoffwechsels“ und nimmt mit ihren zahlreichen Funktionen eine zentrale Stellung im Stoffwechsel ein (LOTTHAMMER 1974). Das Problem der Fettleber geht somit mit einer Reihe klinischer Krankheitszustände einher, oder ist ursächlich beteiligt (HEUER 2000). Dies gilt unter anderem für Ketose, Dislocatio abomasi, Gebärparese, Metritis, Mastitis und anderen Ausfallerscheinungen (RUKKWAMSUK et al. 1999). Folgen sind steigende Behandlungskosten, längere Zwischentragezeiten, abnehmende Milcherträge und erhöhte Reproduktionsraten (WENSING et al. 1997, MARKUSFELD 2003, BOBE et al. 2004). JORRITSMA et al. (2001) haben bei Untersuchungen von frühlaktierenden Milchkühen in 9 niederländischen Betrieben bei über 50% der Rinder eine Fettleber nachgewiesen (Schwellenwert 50 mg Triacylglycerol/g Leberfrischmasse). Eine eindeutige Diagnose der Fettleber kann nur mittels Leberbiopsie gestellt werden (FÜRLL 2000, BOBE et al. 2004). 2.1.2 Stoffwechselsituation und Körperkonditionsentwicklung im Laktationsverlauf Unter der Transitphase beim Rind versteht man die Zeitspanne zwischen 3 Wochen ante partum und 3 Wochen post partum (ROSSOW 2001). In diesem Zeitraum der Spätträchtigkeit, Kalbung und Frühlaktation unterliegt die Kuh aufgrund massiver körperlicher Umbauvorgänge sehr hohen Stoffwechselbelastungen (DRACKLEY 1999, GRUMMER 2004). Während der Gravidität befindet sie sich noch in einer anabolen Stoffwechselsituation (McNAMARA 1991). Um den Bedürfnissen der Kühe gerecht zu werden, wird die Trockenstehperiode in der modernen Fütterungspraxis in 2 verschiedene Fütterungsphasen eingeteilt (Vorbereitung 1, Vorbereitung 2), wobei besonders kurz vor der Kalbung in der Vorbereitungsphase 2 die anabole in eine katabole Stoffwechsellage umschlägt (ROSSOW 2001, JÄKEL 2005a). Aufgrund einer begrenzten Trockenmasseaufnahme (FÜRLL 2002a, GRUMMER et al. 2004) vor der Kalbung und mit einsetzender Laktation befindet sich die Kuh individuell unterschiedlich stark in einer negativen Energie- (RUKKWAMSUK et al. 1999, FÜRLL 2000, HERDT 2000, ROSSOW 2001, DRACKLEY 2004) und Proteinbilanz (GRUMMER 1995, FÜRLL 2000). Bei Unterkonditionierung fehlen adäquate Fettreserven zur Kompensation des Energiedefizits mit der Folge einer negativen Auswirkung auf Milchleistung, Fruchtbarkeit und Gesundheit der Milchkuh (STAUFENBIEL et al. 1991,1992, STAUFENBIEL et al. 2004, SCHROEDER u. STAUFENBIEL 2006). Überkonditionierung hingegen geht mit einer geringeren Futteraufnahme nach der Kalbung und einer stärker ausgeprägten negativen Energiebilanz in Verbindung mit umfangreichen Körpermasseverlusten (STAUFENBIEL et al. 1991, KNIGHT 2001, DRACKLEY 2002). 4 einher Literaturübersicht Abb. 2.1: Nettoenergiebilanz einer Hochleistungskuh; schematisch nach ROSSOW (2001) A= Initial- oder Anpassungsphase (1. Woche a.p. – 3. Wochen p.p.) B= Hauptphase der negativen Energiebilanz (4. Wochen p.p. – 8. Woche p.p.) C= Endphase der negativen Energiebilanz (9. Woche p.p. – 12./16. Woche p.p.) Diese Phase der negativen Energiebilanz sollte nach ROSSOW (2001) bis zur 12. – 16. Laktationswoche überwunden sein (Abb. 2.1) und wird durch Mobilisierung der körpereigenen Energiereserven (Fett, Protein und im geringem Maße Glykogen) ausgeglichen. Dabei ist für die Gesundheit und Fruchtbarkeit der Kühe nicht die absolute Körperfettmenge entscheidend, sondern vielmehr der Zeitraum und die Abbaugeschwindigkeit, welche 1 kg Fett/Tag nicht überschreiten sollte (ROSSOW 2001), wobei die täglichen Mobilisierungsraten tierindividuell stark streuen (JÄKEL 2005a). Die Körperkondition lässt sich entweder mittels Body Condition Score (BCS) oder mit der sonographischer Rückenfettdickenmessung beurteilen (ROSSOW 2001). Die Veränderung der Körperkondition im Laufe der Laktation nach ROSSOW (2001) verdeutlicht die Abb. 2.2. Abb. 2.2: Körperkondition im Laktationsverlauf mittels BCS-Noten und RFD (mm) nach ROSSOW (2001) 5 Literaturübersicht In der Phase nach dem Laktationspeak versucht die Milchkuh, in Abhängigkeit von Dauer und Tiefe der negativen Energiebilanz in eine positive Bilanz umzusteuern. Erst mit Beginn der positiven Energiebilanz kommt sie in die Lage, ihre Reserven wieder aufzufüllen. Dauer und Ausmaß dieses Zustandes hängen neben genetischen und endokrinen Einflüssen weitestgehend von der aufgenommenen Nettoenergie und der zur Milchbildung benötigten Energie ab (McNAMARA 1991, KNIGHT 2001, ROSSOW 2001). 2.2 Ausgewählte klinisch-chemische Blutparameter ß-Hydroxy-Butyrat (BHB) zählt neben Acetacetat und Aceton zu den Ketonkörpern und wird aus messtechnischen Gründen bevorzugt bestimmt. Sie dient dem Nachweis von Ketosen (Hyperketonämie) und der Interpretation des Energiestoffwechsels (FÜRLL 2002a). Diagnostisch ist eine alimentäre Ketose abzuklären. Man unterscheidet zwischen primärer und sekundärer Form, welche klinisch manifest oder subklinisch ablaufen können. Die primäre Form entsteht durch das peripartale Energiedefizit (ROSSOW 2002) und wird von VAN SAUN (2002) in Typ 1 (Ergebnis einer Glucosemangelsituation) und Typ 2 (Bestandteil des FMS) unterteilt. Beide Typen lassen sich demnach anhand der Blutglucosekonzentration und der Therapierbarkeit unterscheiden. Eine sekundäre Ketose entsteht durch ein aus anderen Grunderkrankungen resultierendem Energiedefizit (FÜRLL 2002a). Eine Erhöhung der Ketonkörperkonzentration ante partum findet man bei Kühen, welche in der Trockenstehphase energetisch überversorgt worden sind (FÜRLL 2000, HERDT 2000). GRÖHN et al. (1989), PAAPE et al. (1994), HOEBEN et al. (1997) sowie DUFFIELD (2000) sehen einen Zusammenhang zwischen einer erhöhten BHB-Konzentration post partum und einer gesteigerten Anfälligkeit für infektiöse Erkrankungen nach der Kalbung. Aus dem Körperfett freigesetzte freie Fettsäuren (FFS) zirkulieren in nicht veresterter Form (nonesterified fatty acids = NEFA) und stellen für die Milchkuh post partum eine wichtige Energiequelle dar (STEVENS u. OLSON 1984, DRACKLEY 2002). Der Spiegel dieser Fettsäuren im Blut reflektiert dabei das Ausmaß der Fettmobilisierung (PULLEN et al. 1989) und dient der Frühdiagnostik von mit dem FMS vergesellschafteten Erkrankungen (KANEENE et al. 1997, FÜRLL 2002a). Der Anstieg der FFS weist auf einen akuten (FÜRLL et al. 1992), der Anstieg der Ketonkörper dagegen auf einen manifesten Energiemangel hin (SCHOLZ 1990). Cholesterol wird unter anderem in der Leber synthetisiert, sezerniert und teilweise im Darm rückresorbiert (FÜRLL 2000) und ist ein wesentlicher Bestandteil der Lipoproteine, so dass LDL- und HDL-Konzentrationsänderungen eng mit denen des Cholesterols korrelieren (FÜRLL et al. 1998a). Es dient als wichtiger Parameter zur Erkennung von Verdauungsstörungen (FÜRLL 2002a) und eignet sich neben der Messung der CK-Aktivität und der 6 Literaturübersicht Bilirubinkonzentration gut als Screening für nach der Abkalbung krankheitsgefährdeter Kühe (FÜRLL u. KLEISER 1998b). Bilirubin ist der Hauptgallenfarbstoff und entsteht zum überwiegenden Teil durch Abbau von Hämoglobin. Bilirubin 1 wird an Albumin gebunden, zur Leber transportiert und dort glukoronidiert, wobei wasserlösliches Bilirubin 2 entsteht (KRAFT u. DÜRR 2005). Bilirubinkonzentrationen von bis zu 20 μmol/l sprechen für einen Inanitionsikterus, welcher bei zu geringer Nahrungsaufnahme durch die Konkurrenz von Metaboliten der Lipolyse mit Bilirubin um die Transportproteine erklärbar ist (NAYLOR et al. 1980, FÜRLL u. SCHÄFER 1992). Erst Werte über dieser Grenze sprechen für Leberbelastungen/-schädigungen. Die GLDH wird in der Labordiagnostik als leberspezifisches Enzym betrachtet (FÜRLL 1989, GRÜNDER 1991) und ist in der Mitochondrienmatrix der Hepatozyten im zentrolobulären Raum der Leber lokalisiert (KRAFT u. DÜRR 2005). Da die GLDH sehr sensitiv ist, geht man von schweren Leberschädigungen erst dann aus, wenn der Referenzwert deutlich (dreifach über der oberen Grenze) überschritten ist (KRAFT u. DÜRR 2005). Nach Untersuchungen von FÜRLL und HIEBL (2002b) tritt die GLDH auch in beträchtlichen Mengen in der Niere auf (GLDH-Aktivität Niere 35% der GLDH- Aktivität der Leber). Dies lässt den Schluss zu, dass funktionelle Nierenstörungen auch Einfluss auf die im Serum messbare Enzymaktivität haben können. Die GGT ist an Membranstrukturen gebunden und ein leberspezifisches Enzym (FÜRLL 1989), welches mit Aktivitätsänderungen relativ träge reagiert (KRAFT u. DÜRR 2005). Das bedeutet, bei Leberzellschädigungen ist mit einer Erhöhung der GGT-Aktivität erst nach einigen Tagen zu rechnen, zeitversetzt zu anderen Leberenzymen. Die AST gilt als nicht organspezifisch, hohe Aktivitäten wurden aber in der Muskulatur und der Leber nachgewiesen (FRAHMEN et al. 1978, GRÜNDER 1991). Das Enzym kommt intrazellulär im Zytoplasma und in den Mitochondrien vor. Eine Aktivitätserhöhung beim Rind resultiert aus Skelett-, Herzmuskel- und Leberschädigungen (FÜRLL 1997) sowie, von SATTLER und FÜRLL (2002) beschrieben, aus Uterusschädigungen. Bei Belastungen des Leberstoffwechsels steigt die AST-Aktivität später als die Bilirubinkonzentration an, verbleibt aber länger auf erhöhtem Niveau. Die CK ist ein Enzym, welches zur Diagnose von Muskelerkrankungen herangezogen wird. Es existieren folgende 3 Isoenzyme: CK-MM (skelettmuskelspezifisch), CK-MB (herzmuskelspezifisch), CK-BB (gehirnspezifisch). Nach Untersuchungen von FÜRLL und NAURUSCHAT (2002e) ließen sich im Rinderserum hauptsächlich die CK-MM und eine atypische CK messen. Die CK-MM kommt vor allem in der Skelettmuskulatur vor, die CK-BB konnte in Organen mit glatter Muskulatur (z.B. Uterus, Abomasum), des Weiteren auch in Niere und Lunge messbar nachgewiesen werden (FÜRLL et al. 2002e). Die CK-Aktivität ist bei Kühen mit LMV und bei Kühen mit Endometritis erhöht (SATTLER u. FÜRLL 2002). 7 Literaturübersicht Die Phosphatasen hydrolysieren Phosphorester und bilden dabei anorganisches Phosphat. Klinisch werden je nach pH-Wert-Optimum Alkalische Phosphatasen (AP) und Saure Phosphatasen unterschieden. Die AP ist in unterschiedlichen Aktivitäten in fast allen Geweben nachzuweisen und an Zellmembranstrukturen gebunden (KRAFT u. DÜRR 2005). Nach Untersuchungen von FÜRLL et al. (1993) sinkt die AP-Aktivität bei stärkeren Darmalterationen (z.B. in Folge von Diarrhöe oder Azidose) deutlich ab. Mit Ausnahme der Immunglobuline werden fast alle Proteine in der Leber synthetisiert. Die Eiweißbestimmung dient nicht primär diagnostischen Zwecken, sondern vielmehr zur Ermittlung der Auswirkung einer bereits diagnostizierten Hepatopathie (KRAFT u. DÜRR 2005). Die Serumproteinkonzentration setzt sich beim Rind zum großen Teil (51-59%) aus Albumin, des Weiteren aus der Globulinfraktion, welche elektrophoretisch getrennt werden kann, zusammen. In älteren Literaturangaben findet man die Albuminkonzentration als wichtigen Parameter zur Einschätzung der Leberfunktion (TSCHUDIE 1983, FÜRLL 1989), da schwere Hepatopathien mit Synthesefunktionsstörungen einhergehen. Nach heutiger Ansicht werden vor allem Niereninsuffizienzen (FÜRLL 1997, CASTELLINO u. CATALIOTTI 2002, KRAFT u. DÜRR 2005 ) und Darmerkrankungen (FÜRLL 1997, Kraft u. DÜRR 2005) als Ursachen für Hypalbuminämien angesehen. Auch kommt es im Rahmen von Entzündungsreaktionen zu einem Rückgang der Albuminkonzentration (ALSEMGEEST 1994). Während des Harnstoffzyklus wird in der Leber aus dem Eiweißabbauprodukt Ammoniak Harnstoff synthetisiert, welcher als sensibler Indikator für den Eiweißstoffwechsel gilt (LOTTHAMMER 1981). Zu niedrige Serumgehalte weisen demnach auf eine verminderte Futteraufnahme hin, zu hohe Werte zeigen einen absoluten oder im Verhältnis zur Energieversorgung bestehenden Eiweißüberschuss an (LOTTHAMMER 1981). Beim Rind sind Harnstoffkonzentrationssteigerungen fast ausschließlich prärenal durch Kreislaufstörungen bedingt (KRAFT u. DÜRR 2005). FÜRLL (1989) wies nach, dass im peripartalen Zeitraum die Harnstoffkonzentrationen mit den Ketonkörper-, Glucose- und Bilirubinkonzentrationen korrelieren. Das Insulin ist ein Proteohormon, welches aus Peptidketten besteht (LÖFFLER u. PETRIDES 1998) und abhängig von der extrazellulären Glucosekonzentration freigesetzt wird. Synthese, Speicherung und Sekretion laufen im endokrinen Teil des Pankreas (ßZellen der Langerhans` Inseln) ab. Die wichtigste Wirkung des Insulins liegt in der Reduktion des Blutzuckerspiegels durch Steigerung der Glucoseaufnahme in die Zelle und Steigerung der Glykogensynthese sowie einer Förderung des Umbaus von Glucose zu Fettsäuren. Insulin nimmt eine zentrale Stellung in der Metabolitenverteilung für die Milch- und Fruchtbarkeitsleistung sowie der Gesundheit generell ein (STAUFENBIEL et al. 2005). Im peripartalen Zeitraum kommt es zu einer Sensitivitätsabnahme des Muskel- und Fettgewebes auf das Proteohormon in Verbindung mit erniedrigten Insulinserumkonzentrationen 8 Literaturübersicht (BELL 1995, VERNON 2002). Dieser Zustand wird als „relativer Diabetes der Milchkuh“ bezeichnet (FÜRLL 1997, STAUFENBIEL et al. 2005). Eine negative Energiebilanz reduziert die basale, glucosestimulierte Insulinsekretion um mehr als die Hälfte, die Empfindlichkeit der Gewebe gegenüber Insulin nimmt zusätzlich ab (STANGASSINGER 1985). Dies führt zu starken Lebendmassenverlusten durch Abbau von Depotfett und Muskelprotein mit den damit verbundenen Problemen (ROSSOW 2002). Bei dem Zytokin IGF-1 handelt es sich um ein monomeres Protein, welches unter anderem von der Leber produziert wird (LÖFFLER u. PETRIDES 1998). Bei niedriger Insulinkonzentration wirken die insulinähnlichen Wachstumshormone am Fettgewebe und führen als regulative Maßnahme zum Ausgleich der negativen Energiebilanz (DRACKLEY 2002) zur Steigerung der Lipolyse (DOMINCI u. TYRIN 2002). Die insulinähnlichen Wachstumsfaktoren nehmen somit eine zentrale Rolle im peripartalen Stoffwechselgeschehen ein (RADCLIFF et al. 2003) und korrelieren direkt mit der Energiebilanz (McCAFFERY et al. 2000, VAN DEN HURK u. ZHAO 2005). Die IGF-1 Konzentration ist abhängig von Alter (KERR et al. 1991), Rasse sowie Laktationsstadium (ABRIBAT et al. 1990) und wird durch exogene Medikamentengaben beeinflusst. Sie unterliegt keinen deutlichen Schwankungen in Hinblick auf Futteraufnahme oder Harnabsatz (RONGE et al. 1988), eignet sich somit gut als Indikator des Ernährungszustandes (TAYLOR et al. 2004). Am Ovar hat der insulinähnliche Wachstumsfaktor eine gonadotrope Wirkung, führt zur Verstärkung der FSH- und LHWirkung auf das Wachstum und die Differenzierung der Follikel (LUCY 2000), beeinflusst die Konzeption und die Erhaltung der Trächtigkeit (TAYLOR et al. 2004). Für die biologische Wirkung ist neben der IGF-1 Plasmakonzentration auch die Zahl der IGFBP entscheidend (SPICER et al. 1992, COMIN et al. 2002). TAYLOR et al. (2004) zeigten in einem Versuch mit 150 Färsen und 188 Kühen, dass hohe Milcherträge im Zusammenhang mit niedrigen IGF-1 Serumkonzentrationen nach dem Kalben standen und somit ein verspätetes Einsetzen der ovariellen Zyklustätigkeit und verlängerte Zwischentragezeiten zur Folge hatten. Das Steroidhormon Östradiol gehört zu den Östrogenen, welche am Ende der Synthesekette der Sexualsteroide stehen. Die Granulosazellen der ovariellen Follikel wandeln während des Zyklus Androgene unter FSH Einfluss in Östrogene um, während der Trächtigkeit werden Östrogene auch in der Plazenta synthetisiert (SCHNURRBUSCH et al. 2003). Die Wirkung der Hormone liegt unter anderem am Uterus, wo die Proliferationsphase während des Zyklus ausgelöst, die Kontraktilität des Myometriums gesteigert und die Zervixöffnung mit verursacht werden (SCHNURRBUSCH et al. 2003). Weitere Wirkungen sind Intensivierung des Stoffwechsels an den Zielorganen, verstärkte Blutzufuhr, tube locking der Eileiter, Ausbildung der sekundären weiblichen Geschlechtsmerkmale und ein anaboler Effekt auf den gesamten Organismus (SCHNURRBUSCH et al. 2003). 9 Literaturübersicht 2.3 Bedeutende Erkrankungen im ersten Laktationsdrittel und Zwillingsträchtigkeit bei Milchkühen 2.3.1 Dislocatio abomasi Bei der Dislocatio abomasi handelt es sich um eine multifaktorielle Erkrankung (MARTENS 1998). Als Hauptfaktoren für die Entstehung sind eine gestörte Labmagenmotorik und Gasansammlung im Labmagen anzusehen (DIRKSEN 1961), wie aus Tab. 2.1 ersichtlich ist. Die geburtsnahe Labmagenverlagerung steht in enger Beziehung zur negativen Energiebilanz (HEUER 2000) und wird als Teil des Fettmobilisationssyndroms betrachtet (FÜRLL 1997). Somit ist häufig das Krankheitsbild mit einer Leberverfettung verbunden (STAUFENBIEL 2002, VAN WINDEN et al. 2003). Von einer Dislocatio abomasi sind hauptsächlich Hochleistungsmilchkühe betroffen (GEISHAUSER et al. 1995). Durch eine starke Leistungssteigerung in enger Beziehung zu Stresseinflüssen und dem Gesundheitsstatus hat die Erkrankung an Bedeutung gewonnen (POIKE 2000). Die durchschnittliche Inzidenz der Labmagenverlagerung in deutschen Milchviehbeständen liegt zwischen 2 und 8% mit jahreszeitlicher Häufung im Frühjahr (FÜRLL 1997). Bei der Dislocatio abomasi handelt es sich um eine vorwiegend peripartal auftretende Erkrankung (WOLF et al. 2001). Sie tritt hauptsächlich 3 Wochen vor bis 4 Wochen nach dem Kalben auf (FREITAL 2003), dabei ist die Häufigkeit ante partum gering (PEHRSON u. SHAVER 1992). Man unterscheidet nach DIRKSEN (1961) zwischen der linksseitigen Labmagenverlagerung, mit partieller oder vollständiger Verlagerung des Organs nach kaudodorsal zwischen Pansen und linke Bauchwand (Dislocatio abomasi ad sinistrum) und der rechtsseitigen Labmagenverlagerung, mit Aufstieg des Organs zwischen Darmscheibe und rechter Bauchwand (Dislocatio abomasi ad dextrum). Die rechtsseitige Verlagerung kann dabei mit oder ohne Verdrehung (sine/cum torsione) des Labmagens ablaufen (GEISHAUSER et al. 1995), wobei überwiegend eine linke Torsionsrichtung auftritt (DIEDERICHS 1995). Tab. 2.1: Mögliche Ursachen der Dislocatio abomasi nach DIRKSEN (1995) Gestörte Labmagenmotorik Hypotonie - hohe abomasale FFSKonzentrationen - Hypocalcämie - Hyperketonämie - Hyperinsulinämie - Hypergastrinämie - Alkalämie - Endotoxämie Dilatation - Histaminfreisetzung - Adrenalinfreisetzung - duodenale Säuerung - Prostaglandin E2 - vergrößertes Abomasumvolumen im Alter oder bei bestimmten Futtermitteln 10 Gasansammlung - Transportbehinderung durch gestörte Labmagenmotorik - gestörte Entleerung via Abomasuskanal - erhöhte Gasproduktion - gestörte Absorption/ Diffusion im Labmagen Literaturübersicht Mögliche Mechanismen der Pathogenese dieser geburtsnahen Labmagenverlagerung sind in der folgenden Abbildung 2.3 dargestellt: (Leber-) Verfettung vor der Geburt negative Energiebilanz Geburtsstress MDK Endotoxine / Fettsäuren Durchlässigkeit VFA - Resorption Lipolyse / Leberverfettung Endotoxinausscheidung Endotoxin Muskelentspannung (Antrum pylori) Haltung Kuhkomfort Witterung Sympatikotonus Schließmuskeldruck Ca K Mg gestörte Labmagenentleerung + mechanische Einflüsse Gas im Labmagen Pansenfüllung Art des Liegen Labmagenverlagerung Abb. 2.3: Entstehung der geburtsnahen Labmagenverlagerung nach FÜRLL (2000) Häufig ist das Krankheitsbild der Labmagenverlagerung mit weiteren Erkrankungen vergesellschaftet (SUSTRONCK 1998). Dazu zählen Retentio secundinarum, Endometritis, Klauenerkrankungen, Mastitiden und weitere (GYANG et al. 1986, ERB u. GRÖHN 1988, FÜRLL 1997). Begleiterkrankungen verschlechtern die Prognose der erkrankten Kühe erheblich (GYANG et al. 1986). Nach Untersuchungen von FÜRLL und KLEISER (1998b) gehen der klinischen Diagnose einer Dislocatio abomasi erhöhte Ketonkörperkonzentrationen und verminderte Kaliumsowie Leukozytenwerte voraus. Abzüglich der bei der Blutentnahme am 3. d p.p. bekannten geburtsnahen Störungen (Schwer- und Totgeburten, Gebärparese, Retentio secundinarum) ergab sich für ein daraus abgeleitetes Screening eine Spezifität von 34,3% und eine Sensitivität von 100% der innerhalb der ersten 4 Wochen post partum aufgetretenen Labmagenverlagerungen. Weiterhin konnten in dieser Verlaufsuntersuchung der Erkrankung vorausgehend erhöhte AST-, CK-Aktivitäten, sowie erhöhte FFS-, Bilirubinkonzentrationen 11 Literaturübersicht und erniedrigte Cholesterolkonzentrationen von 12 an Labmagenverlagerung erkrankten Kühen, im Vergleich zu 141 gesunden Tieren der Kontrollgruppe, nachgewiesen werden. Dies spricht laut FÜRLL und KLEISER (1998b) deutlich für eine Belastung des Energiestoffwechsels (FFS, BHB, Bilirubin, Cholesterol) mit Beeinträchtigung der Leberfunktion (AST, Cholesterol, Bilirubin). Die Ergebnisse unterstützen die These, dass eine schon im Zeitraum ante partum vorhandene Überkonditionierung in Verbindung mit späteren Geburtsstressoren als ein wesentlicher Prädispositionsfaktor für die Entstehung einer geburtsnahen Dislocatio abomasi anzusehen ist. Dies entspricht Beobachtungen von FREITAL (2003). Nach seinen Angaben spielt wesentlich die Optimierung der Körperkondition trockenstehender Kühe und somit die Fütterung der hochträchtigen Kuh sowie die Fütterung im peripartalen Zeitraum eine entscheidende und zugleich zentrale Rolle in der Genese des verlagerten Labmagens. Jüngsten Untersuchungen von LeBLANC (2005) an 53 mit Labmagenverlagerung erkrankten Kühen zufolge weichen die FFS-Konzentrationen dieser Kühe schon 14 Tage vor der Kalbung von der gesunden Kontrollgruppe ab. Im Stoffwechsel ante partum geht eine FFSKonzentrationserhöhung mit der späteren Labmagenverlagerung einher. Nach seinen Angaben führen NEFA-Konzentrationen ≥0,5 mEq/l (entspricht: FFS-Konzentration ≥500 μmol/l) in der letzten Woche vor der Kalbung zu einer 3,6fach höheren Wahrscheinlichkeit des Auftretens einer Dislocatio abomasi. Retentio secundinarum, Endometritis und steigende Blutkonzentrationen von BHB und FFS innerhalb 1. bis 7. d p.p. erhöhen das Risiko eines verlagerten Labmagens zusätzlich. So sind Kühe mit einer in diesem Zeitraum gemessenen BHB-Konzentration von ≥1,2 mmol/l einer 8fach größeren Wahrscheinlichkeit einer Labmagenverlagerung ausgesetzt (LeBLANC 2005). Laut Untersuchungen von VAN WINDEN et al. (2003), welche sich besonders auf den Zeitraum 10 Tage vor der klinischen Diagnose einer Dislocatio abomasi ad sinistrum konzentriert hatten, zeigten Kühe mit Labmagenverlagerung signifikant niedrigere Futteraufnahme und Milchproduktion im Vergleich zu gesunden Kontrolltieren. An Veränderungen der Blutparameter waren besonders signifikant niedrigere Calcium-, Glucose- und Insulinkonzentrationen sowie eine Erhöhung der FFS-, BHB-Konzentrationen und AST-Aktivitäten auffällig. Die Erhöhung der Enzymaktivität und Anstieg der Ketonkörperkonzentration decken sich mit Ergebnissen von GEISHAUSER et al. (2000) und ØSTERGAARD und GRÖHN (2000). VAN WINDEN et al. (2003) sieht dabei als zentralen Faktor die sinkende Futteraufnahme, welche mit verminderter Pansenfüllung, Reduktion der Calcium-, Glucoseund Insulinkonzentration (HERDT 2000, ØSTERGAARD u. GRÖHN 2000) sowie mit steigender Ketonkörperkonzentration (ROSSOW 2001) im Blut verbunden ist. 12 Literaturübersicht Die Labmagenmotilität hängt neben der Futteraufnahme auch vom Tonus des Nervus vagus ab (VAN WINDEN et al. 2003). Dieser wiederum korreliert positiv mit der Glucose- und Insulinkonzentration im Blut (KOVACS et al. 1995). Das bedeutet, eine verminderte Blutglucose-/-insulinkonzentration führt zu einem herabgesetzten Tonus des Nervus vagus und somit zu abnehmender Labmagenmotilität und reduzierter Magensäuresekretion (LAM et al. 1997). Daneben unterstützen niedrige Calcium-Konzentrationen im Blut die Verminderung der Magensäuresekretion (PUSCAS et al. 2001), woraus eine gesteigerte Gasproduktion resultiert (VAN WINDEN et al. 2003). Somit ist neben der Möglichkeit einer Positionsveränderung des Abomasum durch reduzierte Pansenfüllung, verminderter Labmagenmotilität auch mit der erhöhten Gasproduktion das dritte Kriterium der Erkrankung nach DIRKSEN (1961) erfüllt. 2.3.2 Gebärparese Die Gebärparese des Rindes wird häufig auch als puerperales Festliegen, Milch- oder Kalbefieber bezeichnet und stellt eine akut verlaufende Störung im Mineralstoffwechsel dar. Die Gebärparese im eigentlichem Sinne ist eine peripartale Erkrankung und tritt somit im Zeitraum 1 Tag vor bis maximal 3 Tage nach der Kalbung auf (STAUFENBIEL 2002). Die Morbidität der Erkrankung liegt bei 2-5% (FÜRLL 2002a), in einzelnen Betrieben kann diese Zahl deutlich überschritten werden. Im peripartalen Zeitraum kommt es häufig auch bei klinisch unauffälligen Tieren zu einem temporären Rückgang der Calcium- und anorganischen Phosphatkonzentration (KLEE 2004), sowie zu einer geringfügigen Erhöhung der Magnesiumkonzentration im Blut (BOSTEDT u. BLESS 1993). Zu niedrige Calciumkonzentrationen im Blut führen ab einem gewissen Grade zur zunehmenden Lähmung sowohl der quergestreiften als auch der glatten Muskulatur (HOUE et al. 2001) und somit zum Festliegen der Kuh. Als prädisponierende Faktoren für eine Gebärparese gelten (FÜRLL et al. 2002a): exzessive Ca (>80 g/d) und/oder P (>50 g/d) Versorgung in der Trockenstehphase Alkaliüberschuss im Futter der Trockensteher (>100 mEq/kg TS) überkonditionierte Kühe (BCS >4,0; RFD >30 mm) hohe Milcheinsatz- und Milchfettleistung zunehmendes Alter (>3. Laktation) vorangegangene Erkrankung(-en) an Gebärparese 13 Literaturübersicht Neben dem „hypocalcämischen Festliegen“ wird in älterer Literatur eine atypische Form als „hypophosphatämisches Festliegen“ beschrieben (SEIDEL u. SCHRÖTER 1976). STAUFENBIEL (2002, 2005a) versteht die Gebärparese ätiologisch als eine durch Hypocalcämie hervorgerufene Erkrankung, welche regelmäßig (85%) von einer Hypophosphatämie begleitet wird. Deshalb sollte nach seiner Auffassung nicht von einer atypischen (durch Hypophosphatämie hervorgerufene) Erkrankung gesprochen werden. Auch KLEE (2004) fand in einer Untersuchung mit 394 festliegenden Kühen keine kausale Bedeutung von Hypophosphatämien bei dem Krankheitskomplex der Gebärparese. Übersteigt das nach der Kalbung verschobene Elektrolytgleichgewicht die regulierenden Mechanismen der Calciumhomöostase im Organismus, kommt es zu klinisch sichtbaren Erscheinungen (BOSTEDT u. BLESS 1993). In der folgenden Abbildung 2.4 sind die 3 klinischen Stadien der Gebärparese dargestellt. Als unmittelbare Folge des Festliegens können ischämiebedingte Muskel- und Nervenschädigungen zum „Downer-cow-Syndrom“ führen (COX et al. 1982). Stadium 1 Ca P Kuh noch stehend ataktischer Gang Tremor Stadium 2 Ca P Kuh in Brustlage festliegend ohne Störung des Sensoriums Stadium 3 Ca P Kuh in Seitenlage festliegend mit Störung des Sensoriums 22,8% 62,2% 12,2% Abb. 2.4: Beziehungen zwischen der Ca-/P-Konzentration im Serum und dem klinischem Bild an Gebärparese erkrankter Kühe (n=180); nach STAUFENBIEL (2002) Bei ihren Untersuchungen stellten FÜRLL und HOOPS (2000) fest, dass bei später festliegenden Kühen bereits während der Trockenstehphase Belastungen und Entgleisungen des Energiestoffwechsels und des Säure-Basen-Haushaltes bestanden hatten, wie Tab. 2.2 verdeutlicht. Tab. 2.2: Stoffwechselparameter bei Kühen am 10. d a.p. (FÜRLL 2002a) gesund n=25, GP n=5 NSBA FE K Bilirubin FFS gesund Gebärparese BHB (mmol/l) (%) (µmol/l) (µmol/l) (mmol/l) 103 70 1,8 146 0,43 4 52 4,1 497 0,56 14 Literaturübersicht ECKERMANN und FÜRLL (2005) beobachteten eine niedrigere Aktivität der Alkalischen Phosphatase und eine erhöhte Proteinkonzentration im Blutserum ante partum von 53 festliegenden Kühen im Vergleich zur gesunden Kontrollgruppe gleicher Tierzahl. Als prophylaktische Maßnahmen zur Verhinderung der Gebärparese gelten orale peripartale Calciumsubstitutionen (JÄKEL u. FÜRLL 2002) und Vitamin D3-Injektionen vor der Kalbung (ZEPPERITZ 1994). Des Weiteren kommt eine besondere Bedeutung der calciumrestriktiven Fütterung in der Trockenstehphase zu (ROSSOW u. HORVATH 1988, RICKEN 2005), wie aus Abb. 2.5 ersichtlich ist. Calcitonin Calcitonin Resorption Blut – Ca MDK Knochen Blut – Ca MDK Parathormon Milch Harn Fetus Knochen Parathormon Kot Milch Ca-reiche Fütterung a.p. Harn Fetus Kot Ca-restriktive Fütterung a.p. führt zu einer dynamischen Anpassung des CaRegulationssystems Abb. 2.5: Einfluss des Ca-Gehaltes der Trockenstehfütterung Regulationssystem; modifiziert nach ROSSOW und HORVATH (1988) auf das Ca- In einer intensiv bewirtschafteten MVA mit Gülledüngung ist die Kaliumbelastung des Bodens und somit des Grundfutters hoch (JÄKEL 2005a). Da Kalium ein einwertiges Kation ist, führt dies zu einer alkalischen Belastung des Futters in der Trockenstehration, welche als prädisponierender Faktor für die Gebärparese gilt (FÜRLL et al. 2002a). Ein Überwiegen der Anionen dagegen führt durch den Effekt einer subklinisch kompensierten Azidose im Organismus zu einer Stabilisierung der Calciumhomöostase mit Freisetzung von Calcium aus den Knochen und reduziert somit signifikant das Festliegerisiko (OETZEL 1993, STAUFENBIEL 2005b). Auf dieser Tatsache beruht das DCAD- (dietary cation-anion difference) Konzept (BEEDE u. WANG 1992) in der Trockenstehfütterung, dem folgende Gleichung zu Grunde liegt: DCAD (mEq/kgTS) = (mEq Na+ + mEq K+) – (mEq Cl- + mEq S2-). Dabei werden der Trockensteherration so viel Anionen (z.B. durch Chlorid- oder Sulfatsalze) zugesetzt, bis der optimale DCAD Bereich von –10 bis –15 mEq/100g TS erreicht ist (BEEDE u. WANG 1992). 15 Literaturübersicht 2.3.3 Endometritis Bei der Endometritis handelt es sich um eine Entzündung der Uterusschleimhaut infektiöser oder nicht infektiöser Genese (z.B. durch Uterusinstillation von gewebsreizenden Lösungen). Ursache für die infektiöse Endometritis sind zum einen obligat pathogene Keime, wie unter anderem Hämophilus somnus, Campylobacter fetus und Tritrichomonas fetus. Zum anderen stellen fakultativ pathogene Keime (z.B. grampositive Kokken, Escherichia coli, Mykoplasmen und Chlamydien) ursächlich den Hauptanteil an der Erkrankung dar (TENHAGEN 2001). Häufig handelt es sich um Mischinfektionen. Nach Angaben von ROSSOW (2003) sollte die Endometritisinzidenz bei intensiv gehaltenen Milchkühen unterhalb von 10% liegen. Endometritiden können zu verminderter Fruchtbarkeit, in nicht wenigen Fällen zur Infertilität führen (SHELDON 2004), was enorme wirtschaftliche Verluste beinhaltet (TENHAGEN 2001). Die Unfruchtbarkeit rangiert mit 25% bei den Abgangsursachen in Milchviehbeständen an erster Stelle (De KRUIF 1999). Als Periode post partum bezeichnet SHELDON (2004) den Zeitraum von der Kalbung bis zur vollständigen Uterusinvolution um den 40. d p.p. In dieser Zeit kommt es nach seinen Angaben im physiologischem Sinne neben der Involution des Uterus und der Rückkehr der ovariellen Zyklustätigkeit vor allem zur Regeneration des Endometriums und der Elimination der bakteriellen Kontamination. Nach Erfahrungen von SHELDON et al. (2002) können in den meisten Fällen aus dem Uteruslumen post partum Escherichia coli, Streptokokken, Arcanobacterium pyogenes, Bacillus licheniformes, Prevotella (früher Bacteroides) spp. und Fusobacterium necrophorum isoliert werden. Normalerweise verfügt der Organismus über zahlreiche Mechanismen zur Erregerabwehr. Diese Barrieren zur Ausbildung der Immunität stellen neben den anatomischen Gegebenheiten mit Vulva, Vestibulum, Vagina und Zervix zum Schutz des Uteruslumen und neben der Gebärmuttermotorik vor allem die Emigration neutrophiler Leukozyten, saures pH-Wert-Milieu sowie epitheliale und glanduläre Sekrete dar (SHELDON 2004). Sind die Mechanismen der Erregerabwehr überfordert, kommt es zu Entzündungserscheinungen. Als prädisponierende Faktoren hierfür gelten massive Keiminokulationen infolge von Verschlussinsuffizienzen (Vulva, Hymenalring, Zervix), unhygienischer Geburtshilfe, Retentio secundinarum, Geburtswegverletzungen durch Schwergeburten, Aborte und des Weiteren Stoffwechsel-/Allgemeinerkrankungen, schlechte Ernährung und Haltung der Tiere (AURICH et al. 1996). 16 Literaturübersicht AURICH et al. (1996) teilten klinisch die Endometritis in verschiedene Grade ein. Da eine Endometritis häufig mit Vestibulitis, Vaginitis und Zervizitis vergesellschaftet ist, werden bei dieser Einteilung die entzündlichen Alterationen unter dem Begriff Genitalkatarrh (GK) zusammengefasst. Danach gilt: GK I. Grades Endometritis catarrhalis; Ausfluss: rauchig getrübter, dünnflüssiger Schleim; rektale Untersuchung: ohne besonderen Befund GK II. Grades Endometritis muco-purulenta; leichte entzündliche Rötung der Uterusschleimhaut, vermehrte Sekretion; Ausfluss: schleimig-eitriges Sekret; rektale Untersuchung: ohne besonderen Befund GK III. Grades Endometritis purulenta; Ausfluss: eitrig, entzündlich gerötete Portio vaginalis cervicis mit geöffnetem Zervikalkanal, Eiteransammlungen am Scheidenboden; rektale Untersuchung: zum Teil Uterusvergrößerungen mit Gebärmutterwand- verdickungen GK IV. Grades Pyometra; Eiteransammlung in der Gebärmutter bei geöffneter oder geschlossener Zervix; rektale Untersuchung: deutlich vergrößerter atonischer Uterus mit fluktuierendem Inhalt Je nach Zeitpunkt des Auftretens der Endometritis spricht man von Endometritis puerperalis, - postpuerperalis, - postinseminationem, - postcoitum, - intraöstrum oder - postöstrum. Der Begriff Lochiometra charakterisiert eine Uterusatonie mit pathologischer Vermehrung der Lochialflüssigkeit (AURICH et al. 1996). Voraussetzung für den vollständigen Lochialausstoss ist dabei eine intakte Uterusinvolution (EULENBERGER 1993). SATTLER und FÜRLL (2002) beschreiben einen engen Zusammenhang zwischen CK- und AST-Aktivität im Blutserum von Kühen im Verhältnis zu deren Uteruszustand. Eine Reizung der Uterusschleimhaut mit Uterofertil® provoziert nach ihren Beobachtungen bei klinisch gesunden Kühen einen Anstieg der CK-Aktivität im Blutserum. Nach dem Ausschluss von Muskulaturschädigungen und Hypocalcämien kann ein Anstieg dieser Enzymaktivität als Screeningparameter für die Erkennung einer Endometritis genutzt werden (SATTLER u. FÜRLL 2004). 17 Literaturübersicht 2.3.4 Retentio secundinarum Das Rind besitzt eine Placenta epitheliochorialis cotyledonaria (SCHNORR et al. 2001). Bei Kühen bilden sich als Besonderheit Chorionzottenfelder (sogenannte Kotyledonen) aus, welche zusammen mit den Uteruskarunkeln Placentome bilden. Diese fetomaternalen Kontaktstellen dienen dem Stoffaustausch und somit der Ernährung des Fetus. Neben den Schutzfunktionen vor mechanischen Einflüssen und Infektionen übernimmt die Plazenta auch endokrine Funktionen (KURTH 2001). Bei der Kalbung löst sich der fetale Plazentaanteil als Nachgeburt. Dieser Abgang der Eihäute vollzieht sich normalerweise innerhalb von 6 Stunden p.p. Der physiologische Abgang der Nachgeburt nach Sheldon (2004) umfasst 3 wesentliche Komponenten: plazentare Reifung ist assoziiert mit endokrinen Veränderungen (nach GRUNERT et al. [1989] vor allem mit dem Östrogenanstieg ante partum) in der späten Trächtigkeit und um den Kalbezeitraum Blutungen auf der fetalen Plazentaseite führen bereits vor der Kalbung zur Lösung der fetalen Zotten aus den Krypten uterine Kontraktionen während der Wehen bedingen die Lockerung und schließlich (während der Nachgeburtswehen) die Trennung der Plazentome Ist die Nachgeburt nach 24 Stunden noch mit dem Uterus verbunden, spricht man von einer teilweisen oder vollständigen Nachgeburtsverhaltung (Retentio secundinarum partialis/totalis) (SHELDON 2004). Andere Autoren sehen ein Zurückbleiben der Secundinae ab 12 Stunden p.p. als pathologisch an (GRUNERT 1983, KINZEL 1996, BOSTEDT 2003). Die Retentio secundinarum ist eine der bedeutendsten Krankheiten des Rindes im Puerperium (KURTH 2001, SOBIRAJ 2001). Die durchschnittliche Erkrankungsinzidenz liegt zwischen 6-8%, bei Kühen mit Zwillingsträchtigkeiten deutlich höher (SHELDON 2004). ZEBERLE (1996) spricht neben Mehrlingsträchtigkeiten auch von einer Häufung des Krankheitsbildes infolge von Schwer- und Totgeburten. Laut einer Studie von SOBIRAJ et al. (2001) ist das Krankheitsbild der Retentio secundinarum mit einer deutlich ausgeprägten Leukopenie (im Vergleich zu Kühen mit normalem Nachgeburtsabgang) verbunden. GRUNERT et al. (1996) sehen die Ursachen für eine Störung des Lösungsvorganges in den Plazentomen als vielfältig an: bakterielle Infektionen (neben pyogenen Keimen, wie Arcanobacterium pyogenes, grampositive Kokken und weitere; auch Erreger anzeigepflichtiger Krankheiten, wie der Brucellose) hormonelle Störungen (Östrogenmangel, erhöhter Abkalbung, chronischer Progesteronmangel ante partum) Haltungsmängel 18 Progesteronspiegel während Literaturübersicht einseitige, nicht wiederkäuergerechte Fütterung inklusive Vitamin-, Mineralstoff-, Spurenelementmangel toxische und allergische Einflüsse traumatische Faktoren Uterusatonie unphysiologische Trächtigkeitsdauer Eine Nachgeburtsverhaltung führt häufig zu einer verzögerten Uterusinvolution (NAKAO et al. 1997). Rund 90% der Kühe entwickeln nach einer Retentio secundinarum eine milde Endometritis, welche bei Übersteigung der Uterusselbstreinigungskraft und einer Nichtelimination der Erreger in eine akute und bei ausbleibender Heilung in eine chronische Endometritis übergeht (LARVEN u. PETERS 1996, LEWIS 1997, KURTH 2001). Die Nachgeburtsverhaltung führt somit durch tierärztliche Behandlungskosten, verringerte Milch-/ Fruchtbarkeitsleistungen und erhöhte Abgangsraten zu erheblichen finanziellen Verlusten (LARVEN u. PETERS 1996, SOBIRAJ 2001). Häufig begleitet das Krankheitsbild der Retentio secundinarum niedrige Blutserumkonzentrationen von Oxytocin (SHELDON 2004), Prostaglandin F2α (HEUWIESER et al. 1993) und Ergometrin (SHELDON 2004). EULENBERGER et al. (1993) konnten mit der Injektion eines synthetischen Oxytocin-Analogons innerhalb der ersten 6 Stunden p.p. den Nachgeburtsabgang beschleunigen. Dieser Effekt ist durch eine Zunahme der Kontraktionsfrequenz und Steigerung der Kontraktionsdauer des Myometriums infolge einer Oxytocinsubstitution zu erklären (EULENBERGER et al. 1986). 2.3.5 Mastitis Als Mastitis wird die Entzündung der Milchdrüse einhergehend mit Störung der Milchbildung, -speicherung und der Funktionstüchtigkeit ableitender Abschnitte bezeichnet. In erster Linie verursacht eine bakterielle Erregerbesiedlung die Erkrankung, aber auch Pilze (Hefen) und Algen (Prototheken) spielen ätiologisch im Krankheitsgeschehen eine Rolle. Als häufigste bakterielle Erreger kommen Escherichia coli, Staphylococcus aureus, Streptococcus agalactiae und Streptococcus dysgalactiae in Frage (MERLE 2003). Die Erreger gelangen über den galaktogenen, hämatogenen oder lymphogenen Infektionsweg in die Milchdrüse. Die Erkrankung kann in eine klinische Form mit Allgemeinstörung (apostematöse, phlegmonöse, gangränöse Mastitis) und ohne Allgemeinstörung (katarrhalische Mastitis) sowie in eine klinisch inapparente Form eingeteilt werden (SOBIRAJ 2005). Dabei verursacht vor allem die subklinische Form immense finanzielle Kosten. Nach Schätzungen von SOBIRAJ (2005) entstehen durch Milchmengenreduktion und Veränderung der Milchzusammensetzung (Fett, Eiweiß) Verluste über 1 Mrd. Euro pro Jahr. 19 Literaturübersicht WOLTERS et al. (2002) sprechen sogar von dem „verlustreichsten singulären Krankheitskomplex weltweit in Gebieten mit intensiver Milchproduktion“. Dabei besteht nach ihren Angaben neben finanziellen Einbußen auch eine erhebliche Bedeutung im Sinne des Verbraucherschutzes, da einige Erreger als humanpathogen gelten und medikamentöse Rückstände nach therapeutischer Behandlung sowie Verbraucherverunsicherung eine große Rolle spielen. Weiterhin gilt die Euterentzündung neben der Infertilität als Hauptabgangsursache in Milchviehbeständen (WOLTERS et al. 2002, SOBIRAJ 2005). Die Mastitis ist eine multifaktoriell bedingte Erkrankung (HAMANN 2002), wobei Stress, Haltungs- und Fütterungsfehler, mangelnde Melkhygiene, starker Keimdruck und andere Faktoren eine entscheidende Rolle spielen (HAMANN u. FEHLINGS 2002). Als prädisponierende Faktoren zur Beeinträchtigung der Eutergesundheit gelten neben Allgemeinstörungen mit Immunsuppression, Futterbelastungen (nach WENDT et al. (1998) zählen dazu besonders Protein-/Kohlenhydratüberschuss, Rohfasermangel, ß-Carotin-/ Vit. E-/ Selenmangel, Phytöstrogen-/Mykotoxinbelastung) und Zitzenverletzungen vor allem Stoffwechselstörungen. Als wissenschaftlich erwiesen gilt, dass Imbalancen im Energiestoffwechsel von Kühen das Erkrankungsrisiko einer bakteriell bedingten Mastitis aufgrund einer beeinträchtigen Abwehrlage deutlich erhöhen (JANOSI et al. 2003). So beschreiben FÜRLL et al. (2002b) einen deutlichen Einfluss der Stoffwechsellage ante partum auf die Eutergesundheit und sehen in der Vermeidung des Fettmobilisationssyndroms (MORROW 1975) eine gute Prophylaxe von Mastitiden. Therapieresistente subklinisch erkrankte wie auch Kühe mit chronisch rezidivierenden therapieresistenten Mastitisformen sind zu merzen und metaphylaktische sowie therapeutische Maßnahmen greifen nur bei gleichzeitiger und konsequenter Überwachung des Umfeldes (SOBIRAJ 2005). Regelmäßige Mastitiskontrollen, strenge Melkhygiene, Vakzination mit bewährten Mastitis-Impfstoffen und Optimierung des Umfeldes gelten als beste Möglichkeiten zur Verringerung des Erkrankungsrisikos (BURTON u. ERSKINE 2003). 20 Literaturübersicht 2.3.6 Klauenerkrankungen Der Begriff Klauenerkrankung beinhaltet verschiedene einzelne Erkrankungsbilder. FIEDLER und MAIERL (2004) erstellten bei Klauenkrankheiten folgende Einteilung: Klauenrehe (Pododermatitis aseptica diffusa, Laminitis) diffuse, aseptische Entzündung der Lederhaut verbunden mit Gewebsnekrose; Folge einer Mikrozirkulationsstörung mit Beeinträchtigung des Hornwachstums; multifaktorielle Erkrankung: „Fütterungs-“/„Belastungs-“/„Geburtsrehe“ Beispiele: Weiße Linie Defekt, Sohlenwandgeschwür, doppelte Sohle Ballenhornfäule (Erosio ungulae, Ballenhornerosionen) Zersetzung des Ballenhornes als Sekundärerkrankung der Klauenrehe; verminderte Hornqualität führt zu erhöhter Anfälligkeit gegenüber chemischen und bakteriellen Noxen Klauenfäule (Dermatitis interdigitalis) oberflächliche bis tiefgreifende eitrig-nekrotisierende Entzündung des Zwischenklauengewebes, Erregereintritt nach Läsionen oder infolge chronischer Reizung durch mangelnde Stallhygiene Mortellarosche Krankheit (Dermatitis digitalis) oberflächliche Hautentzündung oberhalb des Kronsaumes, multifaktoriell bedingt mit infektiöser Komponente Phlegmone diffus-eitrige Entzündung des Unterhautgewebes Beispiele: Zwischenzehenphlegmone, Kronsaumschwellung Sohlengeschwüre (Pododermatitis solearis circumscripta) umschriebene Entzündung der Lederhaut infolge übermäßiger Belastungen Beispiele: Steingalle, Rusterholzsches -, Sohlenspitzen-, Klauensohlengeschwür Zwischenklauenwulst (Hyperplasia interdigitalis, Limax, Tylom) subakute bis chronische Entzündung der Haut/Unterhaut im Bereich der Zwischenklauen mit reaktiver Gewebszubildung; Folge fehlerhaften Klauenschnitts oder verursacht durch mechanische, chemische, bakterielle Reizungen Hornspalt/Hornkluft (Fissura ungulae) Zusammenhangstrennung der Hornwand parallel zur Dorsalwand/Kronsaum Sonstiges Beispiele: Deformationen des Hornschuhes, Gelenksentzündungen, Verletzungen, Frakturen, Nervenlähmungen, Missbildungen u.a. 21 Literaturübersicht Insbesondere am Beispiel der Laminitis zeigt sich, dass der Kalbezeitraum eine risikoreiche Phase in Hinblick auf die Krankheitsentstehung darstellt. Endotoxämien (z. B. durch Endometritis puerperalis oder infolge von Geburtskomplikationen) führen durch direkte Schädigung der Gefäßendothelien zu Durchblutungsstörungen und somit zur Klauenrehe (MGASA 1987). HOOPS und FÜRLL (2002) beobachteten eine positive Korrelation von Klauenerkrankungen mit Belastungen des Energiestoffwechsels und des antioxidativen Status. Nach KÜMPER (2000) gehören Klauen- und Gliedmaßenerkrankungen zu den wichtigsten Bestandsproblemen in der modernen Milchrinderhaltung und Probleme der Klauengesundheit führen zu deutlichen wirtschaftlichen Ertragsminderungen. Die Häufigkeit von Klauenkrankheiten ist in den letzten 20 Jahren überproportional gestiegen (DISTL 1996), zwischen 6% und 40% der Kühe in Milchviehbeständen sind von Klauenproblemen unterschiedlicher Art betroffen, durchschnittlich 18% der Milchkühe werden mindestens einmal jährlich wegen Lahmheit behandelt (KÜMPER 2000). Gründe hierfür sind in geänderten Nutzungsansprüchen inklusive Leistungssteigerung und veränderten Haltungsbedingungen zu sehen (FIEDLER u. MAIERL 2004). Neben dem wirtschaftlichen Aspekt besitzt die adäquate Behandlung und (besser) die Prophylaxe von Klauenschädigungen auch eine erhebliche tierschutzrelevante Bedeutung (KÜMPER 2000, BENZ 2003). Voraussetzung für ein natürliches Laufverhalten der Kühe sind gute Klauengesundheit und ein Laufkomfort, welcher den Bedingungen im ursprünglichen Lebensraum des Rindes nahe kommt (BENZ 2003). Fortbewegung (nach BRADE 2002 Lokomotionsverhalten eines auf Weide gehaltenen Rindes bis zu 12 km/d bei 3-4 km/h) fördert dabei die notwendige Durchblutung und Mikrozirkulation der Klauen und beugt Durchblutungsstörungen vor (BENZ 2003). Somit liegen in der tiergerechten Gestaltung des Untergrundes, einem fachgerechten orthopädisch-korrekten Klauenschnitt sowie einem einheitlichen Klauenpflegezustand der gesamten Herde, der Anwendung von Klauenbädern (z. B. 5% Kupfersulfat, 10% Zinksulfat, 3-5% Formalin) bei gesunden Kühen und regelmäßiger Futteranalyse (Ausschluss chronisch latenter Pansenazidose und Vitamin E-/Selenmangel) optimale prophylaktische Möglichkeiten zur Verminderung von Klauenerkrankungen (KÜMPER 2000). 22 Literaturübersicht 2.3.7 Ovarialzysten Um den 12. d p.p. beginnt physiolgischerweise das Wiedereinsetzen der zyklischen Ovaraktivität (EULENBERGER et al. 1986, SHELDON 2004). Unter Ovarialzysten versteht man eine Zyklusblockade durch entartete Ovarfollikel, die weder ovulieren noch atresieren (AURICH et al. 1996). Der Grund liegt in einem nicht ausreichendem präovulatorischem LHPeak (OBRITZHAUSER et al. 2004). Daneben werden Entwicklung und Wachstum der Follikel auch von der IGF-1-Konzentration beeinflusst (TAYLOR et al. 2004). Man unterscheidet zwischen Follikel-Thekazysten und Follikel-Luteinzysten (AURICH et al. 1996): Thekazysten: - ca. 80% der Ovarialzysten - dünnwandig, mit farbloser Flüssigkeit gefüllt - höherer Östrogen- als Progesterongehalt Luteinzysten: - ca. 20% der Ovarialzysten - verdickte, luteinisierte Zystenwand - hoher Progesterongehalt, durch Luteingewebe gebildet. Eine sichere Unterscheidung der beiden Zystenarten liefert nur die sonographische Ovaruntersuchung. Weiterhin spricht man von kleinzystischen Ovardegenerationen, wenn der Eierstock mit vielen, linsengroßen Zysten bedeckt ist, so dass eine brombeerartige Ovaroberfläche entsteht (AURICH et al. 1996). KELTON et al. (1998) ermittelten eine durchschnittliche Erkrankungsinzidenz von 8%. Als Ursache für zystöse Ovarveränderungen spielen sowohl exogene als auch endogene Faktoren eine wichtige Rolle. So gehören Fütterungsmängel (schlechte Grundfutterqualität, Energiemangel, Kaliumüberschuss, ß-Karotinmangel, Phytöstrogene), Stallhaltung mit wenig Licht und Bewegungsmangel, eine nicht abgeschlossene Uterusinvolution und Allgemeinerkrankungen zu begünstigenden Faktoren (LOPEZ-GATIUS et al. 2002). Dies gilt ebenfalls für hohe Milchleistungen, weil diese eine starke Belastung des Stoffwechsels durch sprunghaft ansteigenden Protein- und Energiebedarf für die Milchsynthese darstellt. Da in der Frühlaktation die Laktationsleistung eine höhere Priorität besitzt als die Fortpflanzungsleistung, sinkt letztere (ROSSOW 2003a). Auch besteht eine Altersdisposition und zum Teil eine genetische Prädisposition in der Entstehung von Ovarialzysten (KIRK et al. 1982). ZEHRUN (2002) wies in ihren Untersuchungen nach, dass eine latent azidotische sowie ketotische Stoffwechsellage zystischen Ovardegenerationen vorausgeht und belegte die Bedeutung der Lipidmobilisation für die Pathogenese der Erkrankung. Bei einem Vergleich der Körperkondition mit der Häufigkeit des Auftretens von Ovarialzysten bei klinisch gesunden Braunviehkühen konnten bei 12 von 25 peripartal überkonditionierten Kühen sonographisch Ovarialzysten festgestellt werden (HASLER 2003). In der Kontrollgruppe von 25 normal konditionierten Kühen trat lediglich 1 Ovarialzyste auf. 23 Literaturübersicht Dies gleicht Beobachtungen von MORROW et al. (1979) und MÖSENFECHTEL et al. (2000), nach welchen bei peripartal verfetteten Kühen vermehrt Ovarialzysten und Fertilitätsprobleme beobachtet wurden. HASLER (2003) folgert, dass die optimale Körperkondition bereits zum Abkalbezeitpunkt vorhanden sein muss, um bei leistungsbezogener Fütterung den physiologischen Ovarialzyklus in Gang zu setzen. Somit ist ersichtlich, dass die Stoffwechselsituation kurz vor der Kalbung einen wesentlichen Einfluss auf die spätere Fruchtbarkeit ausübt. Da Ovarialzysten im unterschiedlichem Maße Östrogen produzieren, können die Kühe in kurzen Intervallen wiederkehrende oder dauerhafte (Nymphomanie), mehr oder weniger stark ausgeprägte Brunstsymptome aufweisen, verbunden mit rauchiggetrübtem Vaginalausfluss (OBRITZHAUSER et al. 2004). Als Folge der Eierstockzysten resultiert nach Angaben von FOURICHON et al. (2000) eine Verlängerung der ZTZ um 20-30 Tage (normale ZTZ nach ROSSOW [2003] 85-115 Tage) und die Erkrankung führt somit zu bedeutenden wirtschaftlichen Verlusten. Ziel der intensiven Milchrinderhaltung muss demnach ein optimales Management sein, welches das Ausmaß und die Intensität der negativen Nettoenergiebilanz post partum und den damit verbundenen metabolischen Stress reduziert (ROSSOW 2003a) und somit gute Fruchtbarkeitsergebnisse gewährleistet. 2.3.8 Früh-, Schwer-, Totgeburten Als Geburt wird die Austreibung von Frucht, Fruchtwasser und Fruchthüllen aus dem Geburtsweg bezeichnet. Dies läuft in einem Öffnungs-, Aufweitungs-, Austreibungs- und Nachgeburtsstadium ab (GRUNERT et al. 1996). Kommt es dabei zu gravierenden Störungen des physiologischen Geburtsablaufes, spricht man von einer Schwergeburt. Schwergeburten gehen häufig mit Verletzungen im Bereich der Geburtswege, des Uterus, der Eileiter und Ovarien oder der Adnexe einher. Oft sind Färsen im Zuge einer ungenügenden Weitung des Geburtsweges betroffen (OBRITZHAUSER et al. 2004). Geburtsstörungen können nach GRUNERT und ANDRESEN (1996) von seiten des Muttertieres und/oder von seiten der Frucht ausgehen. Bei dem Muttertier sind dabei besonders Allgemeinerkrankungen, Störungen der Wehentätigkeit (primäre oder sekundäre Wehenschwäche, übermäßig starke Wehen), Einengungen des knöchernen Geburtsweges, Einengungen des weichen Geburtsweges, Vaginalprolaps und Torsio uteri als Ursachen für Schwergeburten anzusehen. Geburtskomplikationen von seiten der Frucht resultieren aus Missbildung, absolut oder relativ zu großer Frucht, abgestorbener Frucht, emphysematöser Frucht und aus fehlerhafter Lage, Stellung und Haltung der Frucht. Als tierärztliche geburtshilfliche Maßnahmen gelten neben Stellungs-/Haltungsberichtigungen und Auszugshilfe die Fetotomie und die Sectio caesarea. 24 Literaturübersicht Zur perinatalen Sterblichkeit gehören neben eigentlichen Totgeburten auch Nichtlebensfähigkeit wegen Missbildungen und Entwicklungsstörungen, Mortalität infolge von Asphyxie und Absterben von Früchten bei geburtshilflichen Eingriffen. Die Totgeburtenrate bei Abkalbungen von Färsen liegt im Vergleich zu Kühen höher (SORGE u. STAUFENBIEL 2005). Bei den totgeborenen Kälbern unterscheidet man zwischen frischtoten und länger abgestorbenen Früchten. Letztere können emphysematöse Veränderungen aufweisen, was in der Regel mit einer Störung des Allgemeinbefindens des Muttertieres verbunden ist und die Gefahr einer Septikämie birgt. Des Weiteren kann eine früh abgestorbene Frucht mumifizieren oder mazerieren. Beim Schwarzbunten Milchrind ist eine Tragezeit von 275-285 Tage als physiologisch anzusehen (GRUNERT et al.1996). Die Autoren sprechen von einer pathologischen Frühgeburt, wenn die Tragezeit erheblich verkürzt ist und mit Auswurf einer lebensfähigen (oft aber geschädigten oder toten) unreifen Frucht endet. Anzeichen einer ausgereiften Frucht sind das Erreichen des rassetypischen Kälbergeburtsgewichtes und der Nackensteißlänge, dichte Körperbehaarung und Durchbruch der Schneide- und inneren Mittelzähne. Ursachen von Fehl-/ Frühgeburten sind nach De KRUIF (1993) infektiöser (bakteriell, viral, mykotisch) oder nichtinfektiöser Art (Intoxikationen, physikalisch z. B. traumatisch, durch tierärztliche Maßnahmen, medikamentös). Zur forensischen Feststellung des Alters eines abortierten Fetus ist nach GRUNERT et al. (1996) folgende Formel von Bedeutung: Nackensteißlänge in cm: M x (M+1) M = Trächtigkeitsmonat beispielsweise: 56 cm: 7 x (7+1) M = 7. Monat 2.3.9 Zwillingsträchtigkeit Die Zwillingsträchtigkeit des Rindes ist natürlich ausdrücklich nicht als Erkrankung zu bewerten, soll in diesem Kapitel aber mit beschrieben werden. Da es sich bei der Kuh um ein unipares Tier handelt, ovuliert in der Regel nur ein Follikel. Mehrlingsträchtigkeiten entstehen entweder durch Mehrfachovulationen (zweieiige Zwillinge) oder durch Trennung der Embryonalanlagen (eineiige Zwillinge) (SCHNORR et al. 2001). Bei der Zwillingsgravidität des Rindes erfolgt in den meisten Fällen (>90%) eine Verschmelzung der beiden Fruchtsäcke. Liegen beide Früchte in einem Uterushorn, können bei Verschmelzung der beiden Amnionblasen große Gefäßanastomosen entstehen, was bei getrenntgeschlechtlichen Zwillingen die Bildung von Zwicken (Freemartins) zur Folge hat (SCHNORR et al. 2001). Dabei kommt es beim weiblichen Zwilling zu einer unterschiedlich starken Maskulinisierung in Verbindung mit Unfruchtbarkeit durch A- oder Hypoplasie des Genitale (AURICH et al. 1996). 25 Literaturübersicht Die durchschnittliche Rate von Zwillingsträchtigkeiten liegt zwischen 2,5% (EDDY et al. 1991) und 5% der Abkalbungen (JOHANSON et al. 2001). Die Überlebensrate von Einzelkälbern ist deutlich höher (13%) als die von Zwillingskälbern (GREGORY et al. 1996). Nach Angaben von ROSSOW (2003) macht bei Zwillingen das Geburtsmassegewicht 9-11% (zum Teil noch höher) der Körpermasse des Muttertieres aus. Die Folgen sind nach SCHULZ und ILCHMANN (2002): erhöhter Nährstoffanspruch der Feten an das hochtragende Muttertier Futteraufnahmevermögen und Sauerstoffversorgung des Muttertieres sind noch stärker eingeschränkt Stoffwechselstörungen, insbesondere Leberfunktionsstörungen, die sich bei der Kuh mit einer Frucht in der Frühlaktation klinisch auswirken, zeigen sich bei der Kuh mit Zwillingen bereits vor bzw. während der Kalbung (Appetitmangel, Festliegen, Wehenschwäche) deutliche Verkürzung der Trächtigkeitsdauer mit der damit verbundenen Neigung zur Nachgeburtsverhaltung vermehrt geburtshilfliche Eingriffe und Puerperalbehandlungen Nach FÜRLL (2002) stellt die Zwillingsgravidität „einen Sonderfall erhöhten Energiebedarfes“ dar und derartige Kühe befinden sich besonders zum Ende der Trockenstehperiode in einer subklinischen Ketose. Prophylaktische Maßnahmen in Form einer der Zwillingsmutter angepassten Trächtigkeitsernährung (hohe Energiedichte bei wiederkäuergerechter Rationsgestaltung, Supplementierung der Ration mit Mineralstoffen und Vitaminen) können wirksam sein; sind jedoch nur praktikabel, wenn Zwillinggraviditäten bereits frühzeitig erkannt werden (SCHULZ u. ILCHMANN 2002, LEONARD 2004). 26 Literaturübersicht 2.4 Referenzwerte der Stoffwechselparameter In Tab. 2.3 sind die Referenzwerte der Medizinischen Tierklinik Leipzig aufgeführt. Tab. 2.3: Referenzwerte für verschiedene Blutparameter nach FÜRLL (2005) ¹ = 3. d p.p. Parameter ReferenzParameter ReferenzEinheit Einheit bereiche bereiche BHB mmol/l <0,6;<0,85¹ Protein g/l 60-80 FFS µmol/l <350; <600¹ Albumin g/l 30-39 Glucose mmol/l 2,2-3,3 Harnstoff mmol/l 2,5-5 Cholesterol mmol/l >2,5 Creatinin µmol/l 55-150 Bilirubin µmol/l 2-5 Ca mmol/l 2,3-2,8 GLDH U/l <30 Pi mmol/l 1,55-2,29 GGT U/l <50 Mg mmol/l 0,9-1,32 AST U/l <80;<100¹ Na mmol/l 135-157 CK U/l <100;<200¹ K mmol/l 3,9-5,2 AP U/l 40-122 Cl mmol/l 96-110 mmol/l 0,5-2,0 Fe µmol/l 13-33 Lactat Davon abweichend geben KRAFT und DÜRR (2005) folgende Referenzbereiche an: Cholesterol >2,0 mmol/l; Bilirubin <5,0 µmol/l (1. - 7.d p.p. <8,5 µmol/l); AP <300 U/l; Albumin 30 - 42 g/l; Harnstoff 3,3 - 5,0 mmol/l; Creatinin 88 - 177 µmol/l. STAUFENBIEL (2001) setzt den oberen Referenzbereich von BHB bei 1,0 mmol/l fest. ROSSOW (2002) wertet die BHB-Konzentration <0,96 mmol/l als normal, von 1,05 - 3,26 mmol/l subklinisch ketotisch und Werte >3,36 als klinisch manifeste Ketose. LOTTHAMMER (1981) begrenzte die Bilirubinkonzentration unter 5,1 µmol/l, (innerhalb der ersten 2 Wochen p.p. unter 7,7 µmol/l). Des Weiteren stufte er die AST-Aktivität <35 U/l (innerhalb der ersten 2 Wochen p.p. <45 U/l) und die GLDH-Aktivität <10 U/l bei einer Enzymbestimmungstemperatur von 25° C als physiologisch ein. Der Referenzbereich der Harnstoffkonzentration lag laut seinen Angaben bei 4,0 – 5,0 mmol/l, der Referenzbereich der anorganischen Phosphatkonzentration bei 1,6 - 2,1 mmol/l (innerhalb der ersten Woche p.p. 1,1-1,7 mmol/l). SATTLER (2002) legte die obere Grenze für die CK-Aktivität am 3. d p.p. bei 200 U/l, 1 Woche p.p. bei 125 U/l und ab 3 Wochen p.p. bei 100 U/l fest. TEUFEL (1999) beschrieb die Proteinkonzentration innerhalb des Referenzbereiches von 71,8 - 93,2 g/l. 27 Tiere, Material und Methoden 3 Tiere, Material und Methoden 3.1 Tiere, Haltung und Fütterung Die vorliegenden Untersuchungen wurden von Anfang April 2004 bis Ende April 2005 in einer MVA mit 1200 Milchkühen, 300 Färsen (Eigenaufzucht und Zukauf) sowie 140 Kälbern durchgeführt. Es handelt sich dabei um einen BHV-1 Impfbestand. Die Milchleistung lag 2004 im Jahresmittel bei 8950 kg Milch/Kuh (Milchinhaltsstoffe 4,2% Fett; 3,3% Eiweiß). Es wurden insgesamt 969 Tiere der Rasse Schwarzbuntes Milchrind mit Einkreuzung HolsteinFriesian, davon 707 Kühe und 262 Färsen im Rahmen der Studie erfasst und beprobt. Aus dieser Tierpopulation wurde eine Gruppe von 25 gesunden Tieren ausgewählt, welche alle die vorgegebenen Kriterien (mindestens 4 Monate nach der Kalbung frei von klinischen Krankheitssymptomen; Leukozytenzahl an allen 4 Kontrollzeitpunkten <10 G/l; Rückenfettdicke ante partum ≤27 mm; ≠ BHV 1/Paratuberkulose positiv) erfüllten. Demgegenüber stehen je 25 erkrankte Tiere der jeweiligen Krankheitsgruppen (Tabelle 3.1). Die Einteilung erfolgte nach eindeutigen Befunden durch eigene klinische Untersuchungen zu den Beprobungszeitpunkten und weiterhin nach Diagnosestellung des betreuenden Bestandstierarztes vor Ort. Die Krankheitsgruppen entsprechen der bestandsspezifisch wichtigsten Bedeutung. Des Weiteren wurden Zwillingsträchtigkeiten (3,5%; n=25) sowie Frühgeburten (1,2%; n=12) als separate Gruppen erfasst. Tab. 3.1: Morbiditätsrate unter 969 kontrollierten Kühen sowie die Anzahl klinisch-chemisch ausgewerteter Tiere pro Krankheitsgruppe Krankheitsgruppen Morbiditätsrate in % (n=969) Tieranzahl n Mastitis 17,2 25 Retentio secundinarum 14,0 25 Klauenerkrankungen 8,2 25 Endometritis/Lochiometra 5,5 25 Ovarialzysten 4,9 25 Totgeburten 3,9 25 Dislocatio abomasi 3,0 25 Gebärparese 2,8 25 Schwergeburten 2,6 25 Die Kühe wurden in Gruppen zu ca. 50 Tieren im Boxenlaufstall mit Spaltenboden gehalten und über computergesteuerte Hochbandfütterung mit einer totalen Mischration (TMR) 8-10 x pro Tag versorgt. Je nach Laktationsstadium wurden 5 verschiedene Rationen verabreicht, deren Zusammensetzung in Tab. 3.2 und deren Inhaltsstoffe sowie Kennzahlen in Tab. 3.3 zusammengestellt sind. 28 Tiere, Material und Methoden Tab. 3.2: Tagesrationen in den verschiedenen Produktionsstadien (Stand April 2004) Trocken1. Futtermittel (kg) 2.-9. 6.-11. Laktations- Laktations- Laktationsmonat monat monat steher1/ Trocken- tragende steher 2 Färsen (3.-0. (8.-4. Wo a.p.) Wo a.p.) Luzerneheu 1,30 0,70 Weizenstroh 0,50 0,50 1,00 2,50 0,50 Silomais 13,00 14,00 14,00 7,00 10,00 Anwelksilage 5,00 6,00 7,00 4,00 4,00 4,00 6,00 10,00 1,20 Gerstenpflanzensilage 1,30 Pressschnitzel 3,50 5,00 4,00 1,00 GRTMBM* 4,50 5,00 3,00 2,00 Melasse 1,40 1,50 1,60 0,50 Sojaextraktionsschrot 1,00 1,00 1,00 Ausgleichfutterfutter 1,25 3,00 2,00 Kraftfutter 1,00 0,40 0,50 Vorbereitungsfutter 1,50 Viehsalz 0,02 Minerale 0,10 0,03 0,03 0,05 0,20 Summe 32,77 0,05 0,05 Harnstoff Propylenglykol 0,05 0,10 0,15 40,73 *GRTMBM = G (Gerste/Triticale) R (Rapsextraktionsschrot) T (Trockenschnitzel) M (Mais) B (Biertreber) M (Maiskleberfutter) 29 39,73 25,33 21,5 Tiere, Material und Methoden Tab. 3.3: Futterinhaltsstoffe und Futtermittelkennzahlen der Rationen in den verschiedenen Produktionsstadien (Stand April 2004) TrockenTrocken1. 2.-9. 6.-11. steher1/ steher 2 Laktations- Laktations- Laktationstragende (3.-0.Wo monat monat monat Färsen a.p.) (8.-4.Wo a.p.) Inhaltsstoffe Trockenmasse (kg) 18,21 21,66 20,08 12,34 11,77 TM/kg TMR (kg) 0,55 0,53 0,51 0,49 0,54 NEL (MJ) 129,23 149,88 133,99 68,23 79,71 Rohprotein (g) 2925,88 3443,92 3050,23 1487,09 1748,73 Rohfett (g) 630,70 749,75 622,25 279,50 447,16 Rohfaser (g) 2909,09 3651,01 3704,40 3278,09 2157,19 Rohasche (g) 1473,17 1758,14 1600,53 926,02 922,87 Stärke (g) 3538,55 4164,32 3565,62 1805,37 2156,59 Zucker (g) 1028,60 1148,51 1091,31 237,11 548,54 NXP 2988,78 3530,84 3210,31 1724,11 1728,03 RNB -39,03 -10,95 -32,93 -39,12 -47,35 Ca (g) 176,65 159,43 130,70 39,82 95,52 P (g) 80,34 83,59 70,64 36,27 51,69 NEL je kg TM (MJ) 7,10 6,92 6,67 5,53 6,77 Rohprotein i. TM (%) 16,07 15,90 15,19 12,05 14,86 Rohfett i. TM (%) 3,46 3,46 3,10 2,26 3,80 Rohfaser i. TM (%) 15,98 16,86 18,45 26,56 18,33 Ca:P (... : 1) 2,00 1,91 1,85 1,10 1,85 Na:K (1: …) 4,27 4,76 5,22 5,29 3,95 Milch-NEL (kg) 30,05 35,85 28,24 9,49 12,85 Milch-XP 30,13 35,59 28,65 11,56 14,51 Milch-nXP 31,31 36,93 30,71 14,88 14,84 Kennzahlen Die Fütterung ab Dezember 2004 sowie deren Inhaltsstoffe und Kennzahlen ist tabellarisch im Anhang (Tab. A.1-A.2) aufgeführt. Die Wasseraufnahme erfolgte ad libitum über Selbsttränkeautomaten. Die Kühe wurden 3-mal täglich im rotierenden Fischgrätenmelkstand gemolken mit einer Zwischenmelkzeit von 8 Stunden. 30 Tiere, Material und Methoden 3.2 Messung der Rückenfettdicke Bei allen Tieren wurde insgesamt zu 7 verschiedenen Zeitpunkten (56. d a.p., 28. d a.p., 10. d a.p., 3. d p.p., 28. d p.p., 56. d p.p., 120. d p.p.) die Rückenfettdicke nach STAUFENBIEL und SCHROEDER (2004) mittels Ultraschallgerät PU-400 der Firma PROXIMA® WEIL AM RHEIN mit einem Linearscannerschallkopf 5 MHz gemessen. Der Messpunkt lag im caudalen Drittel einer gedachten Linie zwischen Tuber coxae und Tuber ischiadicum, als Kopplungsmittel diente eine 70 %ige Alkohollösung. 3.3 Probenentnahme, -aufbereitung und -verwahrung Die Blutproben wurden von den im Versuch aufgenommenen Tieren mittels Einmalkanülen aus der Vena coccygea am 28. d a.p., am 10. d a.p., am 3. d p.p. und am 28. d p.p. entnommen. Die gewonnenen Blutproben blieben 1 Stunde bei Raumtemperatur zur vollständigen Blutgerinnung stehen. Anschließend wurden diese mittels der Zentrifuge EBA12 der Firma HETTICH® TUTTLINGEN 10 Minuten bei 5340 Umdrehungen/Minute und 3800 g zentrifugiert, das gewonnene Serum abpipettiert und bei –18°C in Eppendorfgefäßen der Firma TH. GEYER® HAMBURG bis zur Analyse gelagert. Die Leukozytenbestimmung fand innerhalb von 24 Stunden mittels Hämatologieautomaten (Tabelle 3.4) statt, nachdem das Blut in SARSTEDT-EDTA-Röhrchen der Firma HEILAND VET GmbH® HAMBURG aufgefangen worden war. Die Harnentnahme erfolgte mittels Katheter am 10. d a.p. und am 28. d p.p. Der direkt aus der Blase entnommene Urin diente zum einen zur pH-Wert Messung mittels Messgerät pHMeter pH330 der Firma WTW ® WEILHEIM (Eichung 1 x monatlich mit Eichlösung von Sensortechnik MEINSBERG GmbH® MEINSBERG; pH 8,00; pH 4,01; pH 6,86) und zum anderen der Bestimmung der Netto-Säuren-Basen-Ausscheidung nach KUTAS (1966). Beide Werte wurden vor Ort ermittelt. 3.4 Bestimmungsmethoden 3.4.1 Klinisch-chemische Parameter Klinisch-chemisch wurden bei jedem Tier die Parameter ß-Hydroxy-Butyrat (BHB), freie Fettsäuren (FFS), Glucose, Cholesterol, Bilirubin, Glutamat-Dehydrogenase (GLDH), γGlutamyl-Transferase (GGT), Aspartat-Amino-Transferase (AST), Creatinkinase (CK), Alkalische Phosphatase (AP), Lactat, Protein, Albumin, Harnstoff, Creatinin, Calcium (Ca), anorganisches Phosphat (Pi), Magnesium (Mg), Natrium (Na), Kalium (K), Chlorid (Cl) und Eisen (Fe) bestimmt. Die einzelnen Methoden zur Bestimmung der Metaboliten und Enzyme sind in Tabelle 3.4 aufgeführt. 31 Tiere, Material und Methoden Alle Messungen erfolgten mit dem Laborautomaten Hitachi 912 bei 37°C. Es handelt sich dabei um standardisierte und international etablierte Labormethoden. Die täglichen Präzisionskontrollen wurden laborintern mittels PRECINORM und PRECIPATH (ROCHE DIAGNOSTICS GmbH® MANNHEIM) sowie mit Kontrollseren von der Firma RANDOX LABORATORIES® KREFELD durchgeführt. Tab. 3.4: Methoden und Variationskoeffizienten der klinisch-chemischen Untersuchungen sowie der Leukozytenzählung Material Parameter Bestimmungsmethoden EDTA Vollblut Serum Leukozyten Hämatologieautomat Technicon H1C® BHB BERGMEYER/BERNT(1965) A® Serum FFS Serum Glucose Einheit VK S (%) VK T (%) G/l 1,30 2,32 mmol/l 4,31 1,57 Hitachi 912 Enzymatischer Farbtest A® µmol/l 0,38 2,57 Hitachi 912 Hexokinase-Methode B® mmol/l 0,65 1,15 Serum Cholesterol Hitachi 912 CHOD-PAP-Methode B® mmol/l 0,76 1,28 Serum Bilirubin µmol/l 0,50 2,14 Serum GLDH U/l 0,50 2,07 Serum GGT Hitachi 912 nach JENDRASSIK und GROFF (1938) A® Hitachi 912 optimierte StandardMethode der DGKC B® Hitachi 912 Methode nach SZASZ B® U/l 0,91 3,37 Serum AST U/l 0,43 2,31 Serum CK U/l 0,49 1,64 Serum AP U/l 0,58 2,88 Serum Lactat mmol/l 0,64 1,84 Serum Protein Hitachi 912 optimierte StandardMethode der IFCC B® Hitachi 912 optimierte StandardMethode der DGKC B® Hitachi 912 p-Nitrophenyl-phosphat Methode der IFCC B® Hitachi 912, enzymatische UV-Methode B® Hitachi 912 nach Biuret-Methode B® g/l 0,35 1,90 Serum Albumin Hitachi 912 Bromcresolgrünmethode B® g/l 0,36 0,84 Serum Harnstoff Hitachi 912 kinetischer UV-Test B® mmol/l 2,63 3,63 Serum Creatinin Hitachi 912 Methode nach JAFFE B® µmol/l 2,07 3,57 mmol/l 0,41 1,21 ® Serum Ca Hitachi 912 mit o-Kresolphthalein B Serum Pi Hitachi 912 Molybdat-Reaktion B® mmol/l 0,60 1,75 Serum Mg Hitachi 912 mit Xylidylblau B® mmol/l 0,98 2,85 Serum Na Hitachi 912, ionensensitive Elektrode mmol/l 0,31 0,76 Serum K Hitachi 912, ionensensitive Elektrode mmol/l 0,59 1,45 Serum Cl Hitachi 912, ionensensitive Elektrode mmol/l 0,22 1,12 Serum Fe Hitachi 912 mit Ferrozin B® µmol/l 0,60 2,23 A® = Firma RANDOX LABORATORIES KREFELD B® = Firma ROCHE DIAGNOSTICS GmbH MANNHEIM C® = Firma BAYER DIAGNOSTIC FERNWALD DGKC = Deutsche Gesellschaft für klinische Chemie IFCC = International Federation of Clinical Chemistry 32 VK S (n=10) VK T (n>30) Tiere, Material und Methoden 3.4.2 Insulin, Östradiol und IGF-1 Des Weiteren wurden die Konzentrationen des Insulin-like growth factor-1 (IGF-1) sowie die von Insulin und Östradiol aus dem Serum der auf –18°C tiefgefrorenen Proben ermittelt (gesunde Tiere n=25; Krankheitsgruppen n=20; Frühgeburten n=12; Zwillingsgraviditäten n=20). Insulin wurde mittels des Radioimmunoassay INS-IRMA der Firma BIOSOURCE EUROPE S. A. ® bestimmt (VK S=4,5%, n=20; VK T=12,2%, n=16). Die IGF-1 Bestimmung erfolgte durch einen Enzymimmunoassay unter Verwendung von biotinyliertem IGF-1 der Firma IBT® REUTLINGEN mit einer Sensitivität >10 ng/ml (VK S=16,8%, VK T=18,1%, n=20). Die Östradiolkonzentration wurde mittels eines nach GOTTSCHALK (1999) modifizierten 3H-Radioimmunoassay bestimmt (VK S=12,5%, n=10; VK T=15,8%, n=10). 3.4.3 NSBA-Bestimmung Die Harnproben wurden vor Ort im Verfahren nach KUTAS (1966) analysiert. Dazu wurden je 10 ml des aufgetauten Harns in ein Becherglas gegeben und so viel 1 normale HCl in 0,5 ml Schritten zugefügt, bis der pH-Wert unter 4 lag. Dies wurde mit Stuphanindikatorpapier geprüft. Anschließend wurde der angesäuerte Harn einige Sekunden gekocht, damit die enthaltene Kohlensäure entweichen konnte, danach etwas abgekühlt und mit 10ml Formalin und 5 Tropfen Phenolrotlösung versetzt. Die nun zitronengelbe Lösung wurde so lange mit 0,1 normaler NaOH titriert, bis der Farbumschlag nach rot-orange einsetzte. Das Formalin hat die Funktion, Ammoniumionen in Hexamethylentetramin zu überführen, welches eine titrierbare Verbindung darstellt (Formoltitration). Gemäß der Mengen der verbrauchten HCl– und NaOH-Lösungen ließ sich anhand folgender Formel die Netto-SäureBasen-Ausscheidung des Harns als Bilanzwert berechnen. Berechnung: 10 x (10 x ml HCl – ml NaOH) = NSBA (mmol/l) Der VK S beträgt 2,90% (n=10). 33 Tiere, Material und Methoden 3.5 Biostatistische Auswertung Die vorliegenden Ergebnisse wurden mit dem Statistikprogramm SPSS 11.5.1 statistisch bearbeitet. Die Prüfung auf Normalverteilung der Werte erfolgte mittels SHAPIRO-WILKTest. Für die deskriptive Statistik wurden aufgrund der überwiegend signifikanten Abweichungen von der Normalverteilung der arithmetische Mittelwert ( x ), die Standardabweichung (±s), der Medianwert (M), das 1. und 3. Quartil sowie das Minimum und Maximum berechnet. Die Signifikanzprüfung der untersuchten Parameter zwischen den Entnahmen erfolgte durch Paarvergleich mit dem verteilungsunabhängigen WILCOXONTest. Mittels U-Test nach MANN-WHITNEY erfolgte die Signifikanzprüfung auf Unterschiede der jeweiligen Krankheitsgruppen zu den gesunden Tieren. Korrelative Zusammenhänge zwischen den Variablen wurden mit dem parameterfreien Korrelationskoeffizienten nach SPEARMAN geprüft. Die Berechnung der Anzahl nachweisbarer (über der Sensitivitätsgrenze des zur Bestimmung verwendeten Enzymimmunoassay) IGF-1 Konzentrationen erfolgte mittels Chi-Quadrat-Test nach PEARSON. In den nachfolgenden Abbildungen des Ergebnisteiles werden zur graphischen Darstellung zum überwiegenden Teil Box-Plots genutzt. Box-Plots werden verwendet zur Untersuchung der Verteilung einer Variablen. Die unteren und oberen Grenzen der „Boxen“ repräsentieren die unteren (1.) und oberen (3.) Quartile. Die Länge der Box entspricht dem Interquartilbereich, die Linie in der Box gibt die Lage des Medians wieder. Die von der Box weggehenden Linien (Whiskers) reichen jeweils bis zum letzten Wert, welcher weniger als ein Interquartilbereich außerhalb der Box liegt. 34 Ergebnisse 4 Ergebnisse Im Ergebnisteil sind die wesentlichen Daten der Arbeit als Abbildungen und die korrelativen Zusammenhänge in tabellarischer Form dargestellt. Das vollständige Datenmaterial der Untersuchung mit der statistischen Aufarbeitung ist im Anhang aufgeführt. Die signifikanten Differenzen (p≤0,05) zwischen den Werten der Tiere der jeweiligen Gruppe und den gesunden Kontrolltieren sind mit einem Sternchen (*) hinter der entsprechenden Erkrankung bzw. Zwillingsgravidität gekennzeichnet. Die signifikanten Differenzen (p≤0,05) zwischen den Entnahmen der Blut-/Harnproben bzw. der RFD-Messungen und die signifikanten Differenzen (p≤0,05) zwischen den Gruppen untereinander werden tabellarisch im Anhang (C, D) ersichtlich. 4.1 Klinische Untersuchung und Begleiterkrankungen Alle Tiere der Studie wurden am 3. d p.p. eingehend klinisch untersucht. Die Ergebnisse ausgewählter Parameter sind der Abbildung 4.1 zu entnehmen. T in °C P/min A/min 100 80 60 40 20 0 ges. M LMV GP Kl * 38,5 38,6 38,4 38,4 38,4 39 Puls (P) 80 80 80 80 80 Atmung (A) 32 32 28 32 36 Temperatur (T) En/Lo * R.s. * OZ TG * SG * FG * ZW * 38,7 38,5 39,2 38,7 38,7 39,1 88 88 84 92 84 88 84 36 36 32 36 36 34 34 Abb. 4.1: Ergebnisse ausgewählter klinischer Parameter am 3. d p.p. anhand der Medianwerte (1. und 3. Quartil im Anhang [Tab. B.1] ersichtlich) Die gemessene Rektaltemperatur liegt bei den Kühen mit Retentio secundinarum, Schwergeburt und Frühgeburt signifikant (p≤0,01) höher als bei den gesunden Tieren sowie bei den Kühen mit Endometritis/Lochiometra, Totgeburt und Zwillingsträchtigkeiten ebenfalls signifikant (p≤0,05) höher und ≥ 39,0 °C. Die Pulsfrequenz ist in der Gruppe Totgeburt signifikant (p≤0,01) höher, die Atemfrequenz bei Kühen mit Klauenerkrankungen, Retentio secundinarum, Totgeburt, Schwergeburt und Zwillingsträchtigkeiten in Bezug zu den gesunden Tieren signifikant (p≤0,01) höher. 35 Ergebnisse I II L 3. L L 5. L L L 9. L L L L L L R R R L L L L L L L R R R 11. 12. 13. 14. 15. 16. 17. 20. 22. 25. 31. 35. 40. 45. 49. 137. I Anzahl der Kühe mit LMV II Auftreten LMV (d p.p.) L= Dislocatio abomasi ad sinistrum R= Dislocatio abomasi ad dextrum Abb. 4.2: Zeitpunkte der klinischen Diagnose einer Dislocatio abomasi (n=25) Die Abbildung 4.2 zeigt den Zeitpunkt der klinischen Diagnose einer Labmagenverlagerung. Insgesamt sind in dieser Gruppe 6 rechte (24%) und 19 linke (76%) Labmagenverlagerungen zu verzeichnen. Durchschnittlich tritt die Erkrankung am 23. Tag nach der Kalbung auf. Die durchschnittliche Laktationsanzahl liegt bei 2,4 (davon 5 Kühe in der ersten Laktation betroffen). 7 Kühe sind als Abgang zu verzeichnen, bei 2 Kühen trat die Erkrankung nach operativer Behandlung erneut auf. Im Rahmen der Studie wurde darauf geachtet, den jeweiligen Krankheitsgruppen Tiere mit singulären Krankheiten zuzuordnen. Dies ist auch bei der überwiegenden Anzahl der Tiere gelungen. Die Gruppe mit LMV und die Gruppe der Zwillingsträchtigkeiten waren mit Begleiterkrankungen verbunden, welche in den nachfolgenden Abbildungen 4.3 und 4.4 dargestellt werden. Abb. 4.3: Begleiterkrankungen bei Kühen mit LMV (n=25) 36 Ergebnisse Als häufigste Begleiterkrankung in der Gruppe mit Labmagenverlagerung gingen Uteruserkrankungen einher, gefolgt von Klauenerkrankungen. Zweimal folgten der Labmagenverlagerung zystische Ovardegenerationen, jeweils einmal war die Erkrankung mit Retentio secundinarum, Totgeburt, Mastitis und Gebärparese verbunden. (n) 18 16 14 12 10 ZW ohne R.s. ZW mit R.s. 8 6 4 2 0 1 Abb.4.4: Auftreten der Retentio secundinarum nach Zwillingsträchtigkeiten (n=25) Zu 68% ging die Zwillingsträchtigkeit mit einer Retentio secundinarum einher, in 32% der Fälle ohne. Des Weiteren war die Zwillingsträchtigkeit zweimal mit Geburtshilfe und dreimal mit Totgeburten verbunden. 37 4.2 Veränderungen der Körperkondition vom Zeitpunkt des Trockenstellens bis 4 Monate nach der Kalbung RFD 30 (mm) 25 20 56. d a.p. 15 28. d a.p. 10. d a.p. 10 03. d p.p. 38 28. d p.p. 5 56. d p.p. 120. d p.p. 0 * ZW FG * 11 14 SG * 4 21 TG Z* 6 19 O .* 7 18 .s R 4 21 o* /L En 0 25 Kl P* d un 5 20 G 5 20 V* * M 4 21 LM s ge Färsen (n) Kühe (n) 6 19 4 8 5 20 Abb. 4.5: Körperkondition ante/post partum der verschiedenen Gruppen, dargestellt anhand der Medianwerte und 1.-3. Quartil (Entwicklung der Körperkondition getrennt nach Kühen und Färsen im Anhang [Tab. B.4-B.7] aufgeführt) In der Abbildung 4.5 ist die Körperkondition zu 3 verschiedenen Messzeitpunkten ante partum (56. d, 28. d, 10. d) sowie zu 4 verschiedenen Messzeitpunkten post partum (3. d, 28. d, 56. d, 120. d) dargestellt. Ergebnisse Im Mittel nimmt die RFD der Tiere der einzelnen Gruppen vom Zeitpunkt des Trockenstellens bis zur Abkalbung 2 - 3 mm zu. Die gesunden Kühe liegen mit Median 18 mm RFD kurz vor der Kalbung unter dem Referenzbereich von 19 - 27 mm RFD (STAUFENBIEL 2004) und sind damit gegenüber den Tieren aus den Krankheitsgruppen (ausgenommen Klauenerkrankung und Schwergeburt) geringer konditioniert, signifikant different (p≤0,05) zu den Gruppen Mastitis, Gebärparese, Retentio secundinarum, Ovarialzysten, Totgeburt und Zwillingsträchtigkeiten. Die Gruppe mit späteren Ovarialzysten ist ante partum mit 20 – 30 mm (1.-3. Quartil) am höchsten konditioniert, zu allen 3 Messzeitpunkten signifikant different (p≤0,01) zu der gesunden Vergleichsgruppe. Bei der RFD-Messung am 3. d p.p. wird deutlich, dass (wenn überhaupt) nur eine geringe Differenz zur Messung am 10. d a.p. besteht und somit die Gruppen auf dem Niveau ante partum verbleiben. So zeigen nur die Kühe mit Endometritis/Lochiometra, Ovarialzysten, Tot-, Frühgeburt und Zwillingsträchtigkeit eine geringfügige Abnahme des Medianwertes am 3. d p.p. im Vergleich zu den Messwerten vor der Kalbung, welcher nur in den Gruppen Totgeburt und Zwillingsträchtigkeit signifikant (p≤0,05) ist. Der Vergleich der Körperkondition zwischen 3. d p.p. und 28. d p.p. hingegen zeigt eine durchschnittliche Differenz aller Tiere von 7,5 mm (gesunde Tiere: Differenz 7 mm), welches eine Körperkonditionsabnahme innerhalb der ersten 4 Wochen p.p. von 0,3 mm/Tag bedeutet. In allen Gruppen ist diese Abnahme der Körperkondition zwischen den beiden Zeitpunkten signifikant (p≤0,05). Bei den Erkrankungsgruppen Labmagenverlagerung, Klauenerkrankung, Ovarialzyste(n) und Zwillingsträchtigkeit wird diese Abnahme mit Medianwertdifferenzen ≥9 mm besonders deutlich. Am 56. d p.p. liegen die Kühe aller Gruppen (bis auf Schwergeburt) mit Median ≤11 mm, am 120. d p.p. ≤8 mm. Die gesunden Tiere haben zu diesem Zeitpunkt sogar einen Medianwert von 6 mm, unterboten nur noch von Tieren mit Labmagenverlagerung und Klauenerkrankung mit Median 5 mm. Die gesunde Gruppe verliert somit vom 3. d p.p. bis zum 120. d p.p. 12 mm RFD bei einer Körperkondition von 18 mm kurz nach der Abkalbung, dies entspricht einem Verlust der Körperkondition von 67% (Durchschnitt aller erkrankten Tiere: 13 mm/20 mm = 65%; Tiere mit Zwillingsgravidität: 14 mm/20 mm = 70%)! Bei der getrennten Betrachtung der Entwicklung der Körperkondition zwischen Kühen und Färsen zeigt sich, dass die Färsen (außer in der Gruppe Labmagenverlagerung und Zwillingsträchtigkeit) eine etwas höhere Körperkondition im Messzeitraum aufweisen. Eine signifikante Differenz (p≤0,05) zwischen der Körperkondition von Kühen und Färsen besteht allerdings nur zum ersten Messzeitpunkt am 56. d a.p. bei den gesunden Tieren und der Gruppe Schwergeburt sowie am 56. d p.p. in der Gruppe Retentio secundinarum. Die geringsten RFD-Messwerte treten sowohl bei Kühen, als auch bei Färsen am 120. d p.p. mit vergleichbaren Minimalkonditionen auf, der Verlust der Körperkondition nach der Kalbung ist bei beiden entsprechend. 39 Ergebnisse 4.3 Gesamtleukozytenzahl 20 20 18 18 Leukozytenzahl (G/l Vollblut) 28. d a.p. 16 16 14 14 12 12 10 10 8 8 6 6 4 4 2 2 0 0 25 24 23 25 25 24 23 N = 25 24 25 24 24 2 22 ZW FG SG TG 20 18 Leukozytenzahl (G/l Vollblut) 28. d p.p. 18 Leukozytenzahl (G/l Vollblut) 3. d p.p. 16 16 14 14 12 12 10 10 8 8 6 6 4 4 2 2 0 0 24 25 25 24 25 23 24 25 N = 23 23 20 23 25 23 23 24 23 ZW FG 11 SG 22 TG Z O s. R. o /L En Kl P G V 24 LM ZW FG 10 SG TG Z O s. R. o /L En Kl P G V LM 24 Mnd su ge 25 Mnd su ge N = 24 24 Z O s. R. o /L En 24 Kl 20 25 P G 24 V 25 LM ZW 25 FG 7 SG TG Z O s. R. o /L En Kl V P G LM 25 Mnd su ge 25 Mnd su ge N = 25 Leukozytenzahl (G/l Vollblut) 10. d a.p. Abb. 4.6: Leukozytenzahlen im Vollblut aller Gruppen (Median, 1.-3. Quartil in G/l) vom 28. d a.p. - 28. d p.p. Bis auf die Tiere mit Retentio secundinarum und Zwillingsträchtigkeit zum Zeitpunkt 3. d p.p. liegen alle Medianwerte innerhalb des Referenzbereiches 5-10 G/l (Kraft u. Dürr 2005), wie Abb. 4.6 aufzeigt. Bei allen Gruppen tritt vor der Kalbung ein Anstieg der Leukozytenzahlen auf. Kühe mit Mastitis weisen ante partum eine signifikant (p≤0,05) niedrigere Leukozytenzahl im Vergleich zu den gesunden Tieren auf. 40 Ergebnisse Bei allen Gruppen ist die Abkalbung mit einer zum Teil deutlichen Abnahme der Leukozytenzahlen verbunden, bei Kühen mit Retentio secundinarum und Zwillingsgravidität zeigt sich eine Leukopenie am 3. d p.p. Bis zum 28. d p.p. kehrt die Anzahl der weißen Blutkörperchen auf das Ausgangsniveau ante partum zurück. In der Abbildung 4.7 ist die Leukozytenzahl ausgewählter Gruppen dargestellt. Bei den Kühen der aufgeführten Gruppen ist ein Anstieg der Leukozytenzahl ante partum zu beobachten (signifikant p≤0,01 bei Gruppe gesund und Retentio secundinarum), welcher zum Zeitpunkt 3. d p.p. zum Teil um über 2 G/l abfällt. Dieser Rückgang der Leukozytenzahl wird bis zum letzten Messzeitpunkt wieder ausgeglichen. (G/l) 10 8 6 4 28. d a.p. 10. d a.p. 03. d p.p. 28. d p.p. 2 0 gesund (n=25) M (n=25) R.s. (n=25) ZW (n=25) Abb. 4.7: Zeitlicher Verlauf der Leukozytenzahlen (Medianwerte, 1.-3. Quartil in G/l) der Gruppen gesund, Mastitis, Retentio secundinarum und Zwillingsgravidität 41 Ergebnisse 4.4 Klinisch-chemische Parameter 4.4.1 Parameter des Energie- und Fettstoffwechsels ß-Hydroxy-Butyrat (BHB) 3,0 3,0 BHB-Konzentration (mmol/l Serum) 28. d a.p. 2,5 2,0 2,0 1,5 1,5 1,0 1,0 ,5 ,5 0,0 0,0 24 25 25 23 25 25 24 25 7 25 N = 25 25 25 23 24 25 22 24 2 24 ZW FG SG TG Z O s. R. o /L En Kl P G V 5,0 4,5 4,5 BHB-Konzentration (mmol/l Serum) 3. d p.p. 4,0 BHB-Konzentration (mmol/l Serum) 28. d p.p. 4,0 3,5 3,5 3,0 3,0 2,5 2,5 2,0 2,0 1,5 1,5 1,0 1,0 ,5 ,5 0,0 0,0 24 25 24 24 25 12 25 N = 25 22 21 24 24 25 25 23 25 12 25 ZW FG SG TG Z O s. R. o /L En Kl P G V 25 LM ZW FG SG 25 TG 25 Z O s. R. o /L En Kl P G V LM 25 d Mn su ge 25 d Mn su ge N = 25 24 LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM 5,0 25 d Mn su ge 25 d Mn su ge N = 25 BHB-Konzentration (mmol/l Serum) 10. d a.p. 2,5 Abb. 4.8: BHB-Konzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in mmol/l) vom 28. d a.p. - 28. d p.p. (zu beachten: die unterschiedliche Skalierung der y-Achse ante/post partum) Die BHB-Konzentrationen im Serum liegen teilweise deutlich über dem Referenzbereich von <0,6 mmol/l; 3. d p.p. <0,85 mmol/l (FÜRLL 2005), wie in Abb. 4.8 ersichtlich ist. Die BHBKonzentrationen am 10. d a.p. sind bei allen Gruppen niedriger als zum ersten Entnahmezeitpunkt. Diese Abnahme ante partum ist bei allen (außer Labmagenverlagerung, Endometritis/Lochiometra, Zwillingsträchtigkeiten) signifikant (p≤0,05). Am 3. d p.p. ist der Median der Kühe mit Dislocatio abomasi das 2,4fache der Konzentration vor der Kalbung. Diese Gruppe zeigt damit die deutlichste Differenz zwischen den Konzentrationen ante und post partum. 42 Ergebnisse Die Konzentration der Ketonkörper im Serum der gesunden Kühe liegt am 3. d p.p. im Vergleich zu den restlichen Gruppen am niedrigsten, damit signifikant different (p≤0,05) zu den Gruppen Labmagenverlagerung, Gebärparese, Endometritis/Lochiometra, Retentio secundinarum, Ovarialzysten sowie Zwillingsträchtigkeiten. Neben Kühen mit Gebärparese, Ovarialzysten, Frühgeburten und Zwillingsträchtigkeiten überschreiten vor allem die BHBKonzentrationen im Serum von Tieren mit Labmagenverlagerung und Endometritis/Lochiometra mit einem Median von >1,0 mmol/l deutlich den Referenzwert. Einen Monat nach der Kalbung weisen die als gesund klassifizierten Kühe ein 1.-3. Quartil über dem Referenzbereich von <0,6 mmol/l auf, wobei demgegenüber Kühe mit Ovarialzysten mit der höchsten gemessenen Ketonkörperkonzentration als einzige Erkrankung einen signifikant (p≤0,01) abweichenden Medianwert aufweisen. Auch die Tiere mit Klauenerkrankungen haben sehr hohe BHB-Konzentrationen im Serum, die Kühe mit Frühgeburten liegen als einzige Erkrankungsgruppe im Referenzbereich und somit unter den Konzentrationen der gesunden Tiere. In der Tabelle 4.1 sind die Korrelationen (r) zwischen den BHB- und FFS-Konzentrationen im Serum der Tiere der jeweiligen Gruppen zu 4 verschiedenen Zeitpunkten dargestellt. Es wird der hohe korrelative Zusammenhang zwischen den beiden Parametern des Energie- und Fettstoffwechsels ersichtlich. Insbesondere zum Zeitpunkt 3. d p.p. besteht in den Erkrankungsgruppen (ausgenommen Klauenerkrankung und Retentio secundinarum) sowie in der Gruppe Zwillingsträchtigkeit eine starke Korrelation auf hoch signifikantem Niveau (p0,01). Tab. 4.1: Korrelationen zwischen den BHB- und FFS-Konzentrationen im Serum der jeweiligen Gruppen zu 4 verschiedenen Zeitpunkten (keine signifikante Korrelation (-), Korrelation mit p0,05 signifikant, Korrelation mit p0,01 signifikant) gesund 28.d a.p. -0,54 M -0,5 LMV GP -0,47 -0,37 Kl - En/ Lo - - - 3.d p.p. - 0,51 0,56 0,50 28.d p.p. - - 0,57 - OZ -0,48 -0,49 -0,29 -0,49 -0,55 10.d a.p. R.s. TG SG FG ZW - - -0,96 - -0,55 -0,69 1,00 - - -0,48 - - 0,73 - 0,62 0,60 0,61 0,58 0,51 - 0,62 - 0,50 0,53 - - - 43 Ergebnisse Freie Fettsäuren (FFS) 1500 1500 FFS-Konzentration (mol/l Serum) 28. d a.p. 1250 1250 1000 1000 750 750 500 500 250 250 0 0 24 25 25 23 25 25 24 25 7 25 N = 25 25 25 23 25 22 24 24 ZW FG 2 SG TG Z O s. R. o /L En Kl P G V 24 3000 2750 2750 FFS-Konzentration (mol/l Serum) 3. d p.p. 2500 2500 2250 2250 2000 2000 1750 1750 1500 1500 1250 1250 1000 1000 750 750 500 500 250 250 0 FFS-Konzentration (mol/l Serum) 28. d p.p. 0 25 25 25 24 25 12 25 N = 25 21 24 24 25 23 25 12 25 ZW FG SG TG 25 Z O s. R. o /L En Kl 22 P G V 25 LM ZW FG SG TG 25 Z O s. R. o /L En 24 Kl P G V LM 24 d Mn su ge 25 d Mn su ge N = 25 24 LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM 3000 25 d Mn su ge 25 d Mn su ge N = 25 FFS-Konzentration (mol/l Serum) 10. d a.p. Abb. 4.9: FFS-Konzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in µmol/l) vom 28. d a.p. - 28. d p.p. (zu beachten: die unterschiedliche Skalierung der y-Achse ante/post partum) Die FFS-Konzentrationen liegen bei den gesunden Tieren im Referenzbereich von a.p. <150 µmol/l; 3. d p.p. <600 µmol/l; p.p. <350 µmol/l nach FÜRLL (2005). Die Erkrankungsgruppen und Tiere mit Zwillingsträchtigkeiten weisen zum Teil Konzentrationen erheblich über diesen Grenzen auf, wie Abb. 4.9 demonstriert. Ante partum liegen die gesunden Tiere, Kühe mit späteren Labmagenverlagerungen, Gebärparese, Klauenerkrankungen, Retentio secundinarum und Ovarialzysten <150 µmol/l. Am 10. d a.p. weisen neben anderen Gruppen vor allem die Kühe mit Mastitis und Zwillingsträchtigkeiten mit Werten >200 µmol/l signifikante (p≤0,05) Unterschiede zu den gesunden Tieren auf. 44 Ergebnisse Die größte Anhebung des Niveaus der FFS-Konzentration ante partum zum 3. d p.p. zeigen (wie auch bei der Ketonkörperkonzentration) Kühe mit späterer Labmagenverlagerung durch eine Steigerung des Medianwertes auf das über 10fache des Ausgangswertes. Damit weist diese Gruppe mit einem Messwert >1200 µmol/l die mit Abstand höchste und zu allen anderen Gruppen signifikant (p≤0,05) differente FFS-Konzentration auf. Die FFS-Konzentration ist bei den Tieren aller Erkrankungsgruppen (außer Mastitis, Klauenerkrankungen, Frühgeburt) und bei den Kühen mit Zwillingsträchtigkeiten signifikant (p≤0,05) höher als bei den gesunden Tieren, welche als einzige Gruppe <600 µmol/l liegt. Am 28. d p.p. haben die Kühe mit Mastitis, Labmagenverlagerung, Klauenerkrankung, Retentio secundinarum und Ovarialzysten einen Medianwert deutlich >350 µmol/l und die letztgenannten 3 Gruppen liegen damit signifikant (p≤0,05) höher im Vergleich zu den gesunden Kühen. Analog zur BHB-Konzentration zeigen die Kühe mit Ovarialzysten zu diesem Zeitpunkt den höchsten Messwert, signifikant (p≤0,05) different zu den Gruppen gesund, Gebärparese, Endometritis/Lochiometra, Tot-, Schwer-, Frühgeburt und Zwillingsträchtigkeiten. µmol/l 1000 800 600 400 28. d a.p. 10. d a.p. 03. d p.p. 28. d p.p. 200 0 gesund (n=25) erkrankte Tiere (n=237) ZW (n=25) Abb. 4.10: Zeitlicher Verlauf der FFS-Konzentration (Medianwerte, 1.-3. Quartil in µmol/l) im Serum gesunder und erkrankter Kühe sowie bei Kühen mit Zwillingsträchtigkeit im Vergleich Die Abbildung 4.10 stellt deutlich die höhere FFS-Konzentration im Serum der erkrankten (Median aller erkrankten Kühe aus den 10 verschiedenen Krankheitsgruppen) gegenüber der von den gesunden Kühen dar, welche am 10. d a.p. und am 3. d p.p. signifikant different (p≤0,05) ist. Vor der Kalbung weisen die Kühe mit Zwillingsträchtigkeit die höchste FFSKonzentration auf, signifikant different (p≤0,05) zu den beiden in der Abb. 4.10 dargestellten Vergleichsgruppen. Im Verlaufsdiagramm erkennt man weiterhin den Peak der FFSKonzentrationen aller Gruppen am 3. d p.p. und der signifikanten (p≤0,05) Konzentrationsabnahme nach diesem Zeitpunkt. 45 Ergebnisse Glucose 6,0 5,5 5,0 6,0 5,5 Glucosekonzentration (mmol/l Serum) 28. d a.p. 5,0 4,5 4,5 4,0 4,0 3,5 3,5 3,0 3,0 2,5 2,5 2,0 2,0 1,5 1,5 1,0 1,0 24 24 23 25 24 25 25 23 24 25 22 24 ZW FG 2 SG TG Z O s. R. o /L En 24 6,0 Glucosekonzentration (mmol/l Serum) 3. d p.p. 5,5 5,0 5,0 4,5 4,5 4,0 4,0 3,5 3,5 3,0 3,0 2,5 2,5 2,0 2,0 1,5 1,5 1,0 Glucosekonzentration (mmol/l Serum) 28. d p.p. 1,0 24 24 24 25 25 12 25 N = 25 22 20 25 25 23 12 25 ZW FG 25 SG TG 24 Z O s. R. o /L En 23 Kl P G V 25 LM ZW FG SG 23 TG 25 Z O s. R. o /L En Kl P G V LM 24 d Mn su ge 25 d Mn su ge N = 25 24 Kl 5,5 24 P G 6,0 24 V 25 LM N = 25 ZW FG 7 SG TG 25 Z O s. R. o /L En Kl V P G LM 24 d Mn su ge 25 d Mn su ge N = 25 Glucosekonzentration (mmol/l Serum) 10. d a.p. Abb. 4.11: Glucosekonzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in mmol/l) vom 28. d a.p. - 28. d p.p. Wie in Abb. 4.11 ersichtlich, liegen die Tiere aller Gruppen nur zum Entnahmezeitpunkt 28. d p.p. im Referenzbereich von 2,2 - 3,3 mmol/l (FÜRLL 2005). Im Stoffwechsel ante partum fallen die Kühe mit späteren Tot- und Schwergeburten durch Glucosekonzentrationen über dem Referenzbereich auf. Beiden Gruppen liegen auch signifikant (p≤0,05) höhere Glucosekonzentrationen als bei den gesunden Kontrolltieren vor, welche sich zusammen mit Zwillingsgraviditäten und übrigen Erkrankungsgruppen an der oberen Grenze des physiologischen Bereiches nach FÜRLL (2005) bewegen. Am 3. d p.p. weisen die Festlieger, Kühe mit Tot-, Schwer- und Frühgeburten sowie die Kühe mit Zwillingsträchtigkeiten eine signifikant (p≤0,01) höhere Glucosekonzentration als die gesunde Kontrollgruppe auf. Einen Monat nach der Abkalbung haben alle Gruppen eine niedrigere Blutzuckerkonzentration als 46 Ergebnisse im vergleichbaren Zeitraum vor der Kalbung, welcher (außer bei der Gruppe Frühgeburt) auch eine signifikante Differenz (p≤0,05) darstellt. Insulin 0,60 0,60 Insulinkonzentration (nmol/l Serum) 28. d a.p. 0,50 Insulinkonzentration (nmol/l Serum) 10. d a.p. 0,50 0,40 0,40 0,30 0,30 0,20 0,20 0,10 0,10 00,00 00,00 10 10 18 13 19 17 12 5 5 13 N = 11 10 10 13 17 12 2 ZW 12 FG SG 5 TG 18 Z O s. R. o /L En 18 Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM 0,60 20 d Mn su ge 20 d Mn su ge N = 11 0,60 Insulinkonzentration (nmol/l Serum) 3. d p.p. 0,50 Insulinkonzentration (nmol/l Serum) 28. d p.p. 0,50 0,40 0,40 0,30 0,30 0,20 0,20 0,10 0,10 00,00 00,00 10 10 18 14 19 17 12 5 8 13 N = 11 20 7 8 17 13 19 17 12 5 8 13 ZW FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM d Mn su ge 20 d Mn su ge N = 11 Abb. 4.12: Insulinkonzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in mmol/l) vom 28. d a.p. - 28. d p.p. Die Insulinkonzentrationen im Serum aller Gruppen liegen innerhalb des Referenzbereiches von 0,075 - 0,200 nmol/l; 3. d p.p. 0,01 - 0,17 nmol/l (FÜRLL 1989), wie in Abb. 4.12 erkennbar ist. Es zeigt sich ein stetiger, und in allen Gruppen (ausgenommen Schwergeburten und Zwillingsträchtigkeiten) signifikanter (p≤0,05) Rückgang der Insulin- konzentration bis zur Kalbung mit den niedrigsten Konzentrationen post partum. So ist die Konzentration am 28. d a.p. im Mittel 3-4fach (bei Labmagenverlagerung 5fach) so hoch wie im vergleichbaren Zeitpunkt nach der Kalbung. Diese Differenz ist bei allen Gruppen (ausgenommen Frühgeburt) signifikant (p≤0,01). Am 10. d a.p. weist die Gruppe Schwergeburt und am 3. d p.p. die Gruppe Totgeburt die höchste Konzentration auf, signifikant different (p≤0,05) zur gesunden Vergleichsgruppe. 47 Ergebnisse Bilirubin 25,0 25,0 Bilirubinkonzentration (mol/l Serum) 28. d a.p. 20,0 20,0 15,0 15,0 10,0 10,0 5,0 5,0 0,0 0,0 24 25 23 25 24 25 N = 25 25 23 24 25 22 24 23 ZW FG SG TG Z O s. R. o /L En Kl P G 2 35,0 Bilirubinkonzentration (mol/l Serum) 3. d p.p. Bilirubinkonzentration (mol/l Serum) 28. d p.p. 30,0 25,0 25,0 20,0 20,0 15,0 15,0 10,0 10,0 5,0 5,0 0,0 0,0 25 25 25 24 25 12 25 N = 25 22 21 24 24 25 25 12 25 SG FG ZW 23 TG 25 Z O s. R. o /L En Kl P G V 25 LM ZW FG SG TG 25 Z O s. R. o /L En 24 Kl P G V LM 24 d Mn su ge 25 d Mn su ge N = 25 25 35,0 30,0 23 V 25 LM ZW 25 FG 8 SG TG 25 Z O s. R. o /L En Kl V P G LM 25 d Mn su ge 25 d Mn su ge N = 25 Bilirubinkonzentration (mol/l Serum) 10. d a.p. Abb. 4.13: Bilirubinkonzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in mol/l) vom 28. d a.p. - 28. d p.p. (zu beachten: die unterschiedliche Skalierung der y-Achse ante/post partum) Aus Abb. 4.13 wird ersichtlich, dass die Bilirubinkonzentrationen ante partum und am 28. d p.p. bei allen Gruppen innerhalb des Referenzbereiches von 2 - 5 mol/l liegen, der Medianwert ist am 3. d p.p. überall >5 mol/l. Im Zeitraum vor der Kalbung liegt nur die Bilirubinkonzentration von Kühen mit Gebärparese zu beiden Entnahmezeitpunkten mit den Medianen <2,0 mol/l (1.-3. Quartil 1,5-2,5 mol/l), bei den Tieren der übrigen Gruppen bewegen sie sich mehrheitlich im unterem Drittel des Referenzbereiches. 48 Ergebnisse Am 3. d p.p. sind nur die Konzentrationen im Serum der gesunden Tiere in der Nähe der oberen physiologischen Grenze von 5 mol/l, die Erkrankungsgruppen (ausgenommen Mastitis und Klauenerkrankungen) und Kühe mit Zwillingsträchtigkeiten weisen erhöhte Bilirubinkonzentrationen und damit signifikante Differenzen (p≤0,05) zu erstgenannten auf. Am höchsten liegen dabei zum Zeitpunkt 3. d p.p. die Gruppen Endometritis/Lochiometra, Labmagenverlagerungen und Frühgeburten. Zum 28. d p.p. fallen die Mediane überall <5 mol/l, wobei die Gruppen der Ovarialzyste(n) und Labmagenverlagerung 1,6fach höhere Konzentrationen als die gesunden Kühe aufweisen und letztgenannte mit einer signifikanten Differenz (p≤0,05) zu den gesunden Tieren den höchsten Quartilbereich erkennen lassen. Die Tabelle 4.2 verdeutlicht die starke Korrelationen (r) zwischen den Bilirubin- und FFSKonzentrationen im Serum der Tiere der jeweiligen Gruppen zu 4 verschiedenen Zeitpunkten. Bei der gesunden Gruppe ist diese erst nach der Kalbung signifikant (p≤0,01) zu beobachten. Die beiden Parameter stehen in den restlichen Gruppen zum Teil zu allen 4 Zeitpunkten (Mastitis, Labmagenverlagerung, Zwillingsträchtigkeiten) bzw. ab den 10. d a.p. im engen korrelativen Zusammenhang. Im Gegensatz dazu ist zwischen der Bilirubinkonzentration und der AST-Aktivität (als Vertreter der Leberfunktionsparameter) eine weniger deutliche Korrelation zu den jeweiligen Zeitpunkten ersichtlich. Tab. 4.2: Korrelationen zwischen den Bilirubin- und FFS-Konzentrationen sowie den ASTAktivitäten im Serum der jeweiligen Gruppen zu 4 verschiedenen Zeitpunkten (keine signifikante Korrelation (-), Korrelation mit p0,05 signifikant, Korrelation mit p0,01 signifikant) Bilirubin/ FFS gesund M LMV GP Kl En/ Lo R.s. OZ TG SG FG ZW 28.d a.p. - 0,43 0,52 - - - - - - - - 0,77 10.d a.p. - 0,73 0,53 0,61 0,56 0,55 0,69 0,52 0,45 0,55 1,00 0,88 3.d p.p. 0,68 0,75 0,40 - 0,53 0,62 0,71 0,71 0,47 0,75 0,67 0,66 28.d p.p. 0,63 0,58 0,77 0,45 0,86 0,61 0,65 0,55 0,62 0,59 - 0,63 gesund M LMV GP Kl En/ Lo R.s. OZ TG SG FG ZW 28.d a.p. - - - - - - - - - - - - 10.d a.p. - - -0,49 - - - - - - 1,00 - 3.d p.p. - - - - - - 0,44 - 0,64 - - 0,46 28.d p.p. - - - - 0,62 0,50 - 0,57 - - - - Bilirubin/ AST 49 Ergebnisse Cholesterol 7,0 6,0 7,0 Cholesterolkonzentration (mmol/l Serum) 28. d a.p. 6,0 5,0 5,0 4,0 4,0 3,0 3,0 2,0 2,0 1,0 1,0 0,0 0,0 24 25 25 23 25 25 25 N = 25 25 24 24 ZW 2 FG 22 SG 24 8,0 Cholesterolkonzentration (mmol/l Serum) 3. d p.p. 7,0 6,0 6,0 5,0 5,0 4,0 4,0 3,0 3,0 2,0 2,0 1,0 1,0 0,0 Cholesterolkonzentration (mmol/l Serum) 28. d p.p. 0,0 24 25 25 24 25 25 25 N = 25 25 22 21 24 24 25 25 23 25 12 25 ZW FG SG TG Z O s. R. o /L En Kl P G V LM 25 ZW FG 12 SG TG Z O s. R. o /L En Kl P G V LM 24 d Mn su ge 25 d Mn su ge N = 25 23 TG 7,0 25 Z O s. R. o /L En 8,0 25 Kl 24 P G V 25 LM ZW 25 FG 7 SG TG Z O s. R. o /L En Kl P G V LM 24 d Mn su ge 25 d Mn su ge N = 25 Cholesterolkonzentration (mmol/l Serum) 10. d a.p. Abb. 4.14: Cholesterolkonzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in mmol/l) vom 28. d a.p. - 28. d p.p. (zu beachten: die unterschiedliche Skalierung der y-Achse ante/post partum) Die Cholesterolkonzentrationen im Serum liegen am 3. d p.p. bei allen Gruppen unterhalb des Referenzbereiches >2,5 mmol/l (FÜRLL 2005), wie in Abb. 4.14 dargestellt ist. In der Gruppe mit Frühgeburten fällt die im Vergleich zu den gesunden Tieren niedrige Cholesterolkonzentration vor der Kalbung auf, welche zu beiden Entnahmezeitpunkten signifikant (p≤0,05) geringer ist. Weiterhin erkennt man überall einen signifikanten (p≤0,05) Rückgang der Cholesterolkonzentration bis zur Kalbung mit Fortsetzung bis zum Tiefpunkt am 3. d p.p. Zu diesem Zeitpunkt liegen alle Tiere <2,5 mmol/l, es zeigen sich nur unwesentliche Unterschiede zwischen den einzelnen Gruppen. 50 Ergebnisse Einen Monat nach der Kalbung ist die Cholesterolkonzentration überall (außer bei Labmagenverlagerungen) höher als zum vergleichbaren Zeitraum vor der Abkalbung. Diese Differenzen sind (ausgenommen Endometritis/Lochiometra) signifikant (p≤0,05). Die Gruppen der Kühe mit Dislocatio abomasi und Endometritis/Lochiometra gehen zu diesem Zeitpunkt mit einer gegenüber den gesunden Tieren signifikant (p≤0,001) niedrigeren Cholesterolkonzentration einher. Die folgende Abbildung 4.15 verdeutlicht die Unterschiede der Cholesterolkonzentrationen zwischen den gesunden und erkrankten Kühen zu den 4 Untersuchungszeitpunkten. Erkennbar ist die stetige Konzentrationsabnahme bis zum 3. d p.p. mit anschließendem Anstieg über den Ausgangswert. Die erkrankten Kühe (Median aller erkrankten Kühe aus den 10 verschiedenen Krankheitsgruppen) bewegen sich nach der Kalbung auf einem tieferem Niveau gegenüber der gesunden Gruppe. Dieser Konzentrationsunterschied ist am 28. d p.p. hoch signifikant (p≤0,001). mmol/l 5 4 3 2 28. d a.p. 10. d a.p. 03. d p.p. 28. d p.p. 1 0 gesund (n=25) erkrankte Tiere (n=237) Abb. 4.15: Zeitlicher Verlauf der Cholesterolkonzentrationen (Medianwerte, 1.-3. Quartil in mmol/l) im Serum gesunder und erkrankter Kühe im Vergleich Lactat Die Lactatkonzentrationen im Serum liegen zu den verschiedenen Zeitpunkten bei den Tieren aller Gruppen im Referenzbereich 0,5 - 2,0 mmol/l (FÜRLL 2005) und sind im Anhang (Tab. B.8) tabellarisch aufgeführt. Besonderheiten in den einzelnen Gruppen sind nicht erkennbar. 51 Ergebnisse 4.4.2 Parameter des Eiweißstoffwechsels Gesamtprotein 110 110 Proteinkonzentration (g/l Serum) 28. d a.p. 100 90 90 80 80 70 70 60 60 50 50 24 25 25 23 25 25 25 25 N = 25 23 24 25 22 24 24 ZW FG SG TG 2 110 Proteinkonzentration (g/l Serum) 3. d p.p. Proteinkonzentration (g/l Serum) 28. d p.p. 100 100 90 90 80 80 70 70 60 60 50 50 24 25 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 25 12 25 Abb. 4.16: Proteinkonzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in g/l) vom 28. d a.p. - 28. d p.p. ZW FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM d Mn su ge 25 d Mn su ge N = 25 25 Z O s. R. o /L En 110 25 Kl 24 P G V 25 LM ZW 7 FG SG TG Z O s. R. o /L En Kl P G V LM 24 d Mn su ge 25 d Mn su ge N = 25 Proteinkonzentration (g/l Serum) 10. d a.p. 100 Die Abb. 4.16 verdeutlicht, dass die ermittelten Proteinkonzentrationen im Serum an der oberen Grenze des Referenzbereiches von 60 - 80 g/l (FÜRLL 2005) liegen und diese teilweise überschreiten. Nur die Gruppen der Tot- und Frühgeburten weisen mit den Medianwerten ante partum signifikante (p≤0,05) Unterschiede zu den gesunden Tieren auf. Am 3. d p.p. treten sowohl bei den gesunden Kühen (Median 75 g/l), Kühen mit Zwillingsträchtigkeit (Median 72 g/l), als auch bei dem Durchschnitt aller erkrankten Tiere (Median 72 g/l) in Bezug zu den restlichen Entnahmezeitpunkten signifikant (p≤0,05) niedrigere Proteinkonzentrationen auf. 52 Ergebnisse Albumin Die Albuminkonzentrationen im Serum aller untersuchten Tiere (Medianwerte 28 - 37 g/l) verlaufen ähnlich wie die Gesamtproteinkonzentrationen und sind im Anhang (Tab. B.9) tabellarisch dargestellt. Harnstoff 11,0 10,0 11,0 10,0 Harnstoffkonzentration (mmol/l Serum) 28. d a.p. 9,0 9,0 Harnstoffkonzentration (mmol/l Serum) 10. d a.p. 8,0 8,0 7,0 7,0 6,0 6,0 5,0 5,0 4,0 4,0 3,0 3,0 2,0 2,0 1,0 1,0 0,0 24 25 25 23 25 25 24 25 7 25 N = 25 25 23 24 25 22 24 2 24 ZW FG SG TG Z O s. R. o /L En Kl 11,0 10,0 Harnstoffkonzentration (mmol/l Serum) 3. d p.p. 9,0 8,0 8,0 7,0 7,0 6,0 6,0 5,0 5,0 4,0 4,0 3,0 3,0 2,0 2,0 1,0 1,0 0,0 Harnstoffkonzentration (mmol/l Serum) 28. d p.p. 0,0 24 25 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 25 12 25 ZW FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM d Mn su ge 25 d Mn su ge N = 25 P G 9,0 25 V 10,0 24 LM ZW FG SG TG Z O s. R. o /L En Kl V P G LM 11,0 25 d Mn su ge 25 d Mn su ge N = 25 Abb. 4.17: Harnstoffkonzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in mmol/l) vom 28. d a.p. - 28. d p.p. Der Referenzbereich der Harnstoffkonzentration im Serum von 2,5 - 5,0 mmol/l (FÜRLL 2005) wird von den Medianen mehrheitlich nicht überschritten. In Abb. 4.17 ist ersichtlich, dass im Stoffwechsel ante partum die Harnstoffkonzentrationen der Gruppen (bis auf Mastitis 10. d a.p.) keine signifikanten Unterschiede aufweisen. Die Medianwerte liegen zwischen 4,0 - 5,0 mmol/l. 53 Ergebnisse Am 3. d p.p. zeigen die gesunden Tiere eine signifikante (p≤0,001) Abnahme der Harnstoffkonzentration im Serum, welche bei den Erkrankungsgruppen und Kühen mit Zwillingsträchtigkeiten nicht auftritt. Die Gruppe Endometritis/Lochiometra überschreitet geringfügig mit dem Median zum Zeitpunkt 3 als einzige den Referenzbereich, signifikant different (p≤0,05) zur gesunden Vergleichsgruppe. Einen Monat nach der Kalbung bleiben die Harnstoffkonzentrationen etwas unterhalb des Ausgangsniveaus bzw. kehren zu diesem zurück (gesunde Tiere, Kühe mit Mastitis, Klauenerkrankung und Zwillingsträchtigkeit). Creatinin 180 160 180 Creatininkonzentration (mol/l Serum) 28. d a.p. 160 140 140 120 120 100 100 80 80 60 60 40 40 20 20 24 25 25 23 25 25 25 25 25 25 23 24 25 24 2 24 ZW FG SG TG Z O s. R. o /L En Kl P G V 22 180 160 Creatininkonzentration (mol/l Serum) 3. d p.p. 140 140 120 120 100 100 80 80 60 60 40 40 20 Creatininkonzentration (mol/l Serum) 28. d p.p. 20 24 25 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 25 12 25 ZW FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM d Mn su ge 25 d Mn su ge N = 25 24 180 160 25 LM N = 25 ZW FG 7 SG TG Z O s. R. o /L En Kl P G V LM 24 d Mn su ge 25 d Mn su ge N = 25 Creatininkonzentration (mol/l Serum) 10. d a.p. Abb. 4.18: Creatininkonzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in mol/l) vom 28. d a.p. - 28. d p.p. Der Referenzbereich der Creatininkonzentration von 55 - 150 mol/l (FÜRLL 2005) wird durch die Median- und Quartilwerte, wie in Abb. 4.18 zu erkennen, eingehalten. 54 Ergebnisse Die Creatininkonzentrationen im Serum der Kühe mit späteren Tot- und Schwergeburten und der Kühe mit Zwillingsträchtigkeiten (kurz vor der Kalbung) weisen ante partum mit einer höheren Konzentration einen signifikanten (p≤0,05) Unterschied zu den gesunden Tieren auf. Am 3. d p.p. hat die Gruppe der Labmagenverlagerung die höchste Konzentration, signifikant different (p≤0,05) zu den gesunden Tieren. Außer bei den Frühgeburten und Zwillingsträchtigkeiten zeigt sich an diesem Zeitpunkt ein geringfügiger Konzentrationsanstieg, welcher zum 28. d p.p. bei allen Gruppen signifikant (p≤0,05) unter die Creatininkonzentration des vergleichbaren Zeitraumes vor der Geburt abfällt. 4.4.3 Leberfunktionsparameter Glutamat-Dehydrogenase (GLDH) 120 120 GLDH-Aktivität (U/l Serum) 28. d a.p. 100 80 80 60 60 40 40 20 20 0 0 24 25 25 23 25 24 7 N = 25 25 25 23 22 24 2 ZW 24 FG SG 25 TG 24 Z O s. R. o /L En Kl 120 24 P G V 25 LM ZW 25 FG 25 SG TG Z O s. R. o /L En Kl P G V LM 25 d Mn su ge 25 d Mn su ge N = 25 GLDH-Aktivität (U/l Serum) 10. d a.p. 100 160 GLDH-Aktivität (U/l Serum) 3. d p.p. 100 GLDH-Aktivität (U/l Serum) 28. d p.p. 140 120 80 100 60 80 60 40 40 20 20 0 0 24 25 25 24 25 25 24 12 25 22 21 24 24 25 25 23 25 12 55 25 ZW Abb. 4.19: GLDH-Aktivitäten im Serum aller Gruppen (Median, 1.-3. Quartil in U/l) vom 28. d a.p. - 28. d p.p. (zu beachten: die unterschiedliche Skalierung der y-Achse zum Zeitpunkt 28. d p.p.) FG SG TG Z O s. R. o /L En Kl P G V LM N = 25 ZW 25 FG SG TG Z O s. R. o /L En Kl P G V LM 25 d Mn su ge 25 d Mn su ge N = 25 Ergebnisse Die GLDH-Aktivitäten im Serum, welche in Abb. 4.19 dargestellt sind, liegen mehrheitlich im Referenzbereich <30 U/l (FÜRLL 2005). Vor der Kalbung sowie am 3. d p.p. liegt die GLDHAktivität im Serum mit Median und Quartilbereich <30 U/l. Zum 28. d p.p. ist bei allen Gruppen ein Aktivitätsanstieg erkennbar. Zu diesem Zeitpunkt weisen Tiere mit Mastitis (wie auch im Stoffwechsel ante partum) und Gebärparese eine signifikant (p≤0,01) niedrigere und Kühe mit Labmagenverlagerung eine signifikant (p≤0,05) höhere GLDH-Aktivität im Vergleich mit der gesunden Gruppe auf. In der Tabelle 4.3 sind die Korrelationen (r) zwischen den GLDH- und AST-Aktivitäten sowie den GLDH- und GGT-Aktivitäten im Serum der Tiere der jeweiligen Gruppen zu 4 verschiedenen Zeitpunkten dargestellt. Somit wird der korrelative Zusammenhang der in der vorliegenden Untersuchung bestimmten Leberfunktionsparameter ersichtlich. Im Serum besteht eine stärkere Korrelation zwischen den GLDH- und AST-Aktivitäten, als zwischen den GLDH- und GGT-Aktivitäten. Tab. 4.3: Korrelationen zwischen den GLDH- und AST- sowie den GGT-Aktivitäten im Serum der jeweiligen Gruppen zu 4 verschiedenen Zeitpunkten (keine signifikante Korrelation (-), Korrelation mit p≤0,05 signifikant, Korrelation mit p≤0,01 signifikant) GLDH/ AST M LMV GP Kl En/ Lo R.s. OZ TG SG FG ZW 28.d a.p. 0,60 0,40 0,68 0,71 0,47 - 0,70 0,79 0,52 0,58 - 0,45 10.d a.p. 0,60 - 0,85 0,73 0,66 - 0,73 0,68 0,57 0,51 1,00 - 3.d p.p. 0,60 - - - - - - 0,62 - 0,49 - - 28.d p.p. 0,42 0,46 0,83 0,44 - 0,62 0,68 0,52 - - - - gesund M LMV GP Kl En/ Lo R.s. OZ TG SG FG ZW 28.d a.p. - - - 0,45 - - - 0,41 - - - 0,45 10.d a.p. - 0,44 0,50 - - - - 0,51 - - 1,00 - 3.d p.p. - - - - - 0,63 0,46 - - - 0,69 - 28.d p.p. - - 0,47 - 0,49 0,49 - - - - - - GLDH/ GGT gesund 56 Ergebnisse -Glutamyl-Transferase (GGT) 100 100 90 90 GGT-Aktivität (U/l Serum) 28. d a.p. 80 80 70 70 60 60 50 50 40 40 30 30 20 20 10 10 0 0 24 25 25 25 24 25 7 25 N = 25 25 25 23 25 22 24 2 24 ZW FG SG TG Z O s. R. o /L En Kl P G V 24 100 GGT-Aktivität (U/l Serum) 3. d p.p. 90 GGT-Aktivität (U/l Serum) 28. d p.p. 90 80 80 70 70 60 60 50 50 40 40 30 30 20 20 10 10 0 0 24 25 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 12 25 ZW FG Abb. 4.20: GGT-Aktivitäten im Serum aller Gruppen (Median, 1.-3. Quartil in U/l) vom 28. d a.p. - 28. d p.p. 25 SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM d Mn su ge 25 d Mn su ge N = 25 24 100 25 LM ZW FG SG TG 25 Z O s. R. o /L En Kl P G V LM 23 d Mn su ge 25 d Mn su ge N = 25 GGT-Aktivität (U/l Serum) 10. d a.p. In den jeweiligen Gruppen liegen die GGT-Aktivitäten im Serum vom 28. d a.p. - 28. d p.p. auf relativ gleichem Niveau um 20 U/l und damit innerhalb des Referenzwertes <50 U/l (FÜRLL 2005), wie in Abb. 4.20 ersichtlich ist. Somit sind die GGT-Aktivitäten (orientiert an den Referenzwerten) unauffällig. Der Quartilbereich der Kühe mit Labmagenverlagerung liegt am 28. d p.p. signifikant (p≤0,001) höher als zu den anderen Entnahmezeitpunkten und weiterhin signifikant (p≤0,001) höher im Vergleich zu den gesunden Tieren. Die signifikanten Differenzen zwischen der gesunden und den einzelnen erkrankten Gruppen entstehen durch den engen Aktivitätsbereich und sollten nicht überinterpretiert werden. 57 Ergebnisse Aspartat-Amino-Transferase (AST) 300 300 AST-Aktivität (U/l Serum) 28. d a.p. 250 200 200 150 150 100 100 50 50 0 0 24 25 25 23 25 25 24 25 7 25 N = 25 24 25 25 23 24 25 22 23 2 24 ZW FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM 600 25 d Mn su ge 25 d Mn su ge N = 25 AST-Aktivität (U/l Serum) 10. d a.p. 250 300 AST-Aktivität (U/l Serum) 3. d p.p. 550 AST-Aktivität (U/l Serum) 28. d p.p. 500 250 450 400 200 350 300 150 250 200 100 150 100 50 50 0 0 24 25 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 25 25 ZW Abb. 4.21: AST-Aktivitäten im Serum aller Gruppen (Median, 1.-3. Quartil in U/l) vom 28. d a.p. - 28. d p.p. (zu beachten: die unterschiedliche Skalierung der y-Achse zum Zeitpunkt 3. d p.p.) 12 FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM d Mn su ge 25 d Mn su ge N = 25 Die AST-Aktivitäten im Serum zu den ersten 3 Entnahmezeitpunkten liegen bis auf eine Ausnahme mit Medianen im Referenzbereich <80 U/l; 3. d p.p. <100 U/l (FÜRLL 2005). Am 28. d p.p. zeigen sich einzelne Aktivitätserhöhungen >80 U/l, wie aus Abb. 4.21 zu ersehen ist. Ante partum gleichen sich die AST-Aktivitäten im Serum in den Gruppen. Am 3. d p.p. ist die Enzymaktivität bei Tieren mit Gebärparese deutlich >100 U/l und somit signifikant (p≤0,05) höher im Vergleich zu den restlichen Gruppen. Kühe mit Labmagenverlagerung, Schwergeburten sowie Kühe mit Zwillingsträchtigkeiten liegen am oberen Referenzbereich und zeigen damit signifikante (p≤0,05) Unterschiede zu der gesunden Gruppe. Einen Monat nach der Kalbung haben Kühe mit Dislocatio abomasi und Klauenerkrankungen ASTAktivitäten deutlich >80 U/l und sind damit signifikant (p≤0,001) höher als die bei gesunden Tieren, welche an der oberen Referenzgrenze liegen. 58 Ergebnisse 4.4.4 Parameter des Mineralstoffwechsels Natrium (Na), Kalium (K) Die Natrium- und Kaliumkonzentrationen im Serum liegen bei den Tieren aller Gruppen im Referenzbereich (Na 135 - 157 mmol/l; K 3,9 - 5,2 mmol/l) nach FÜRLL (2005) und sind im Anhang (Tab. B.10-B.11) tabellarisch aufgeführt. Chlorid (Cl) 130 130 Cl-Konzentration (mmol/l Serum) 28. d a.p. Cl-Konzentration (mmol/l Serum) 10. d a.p. 120 120 110 110 100 100 90 90 24 25 25 23 25 25 24 25 7 N = 25 25 23 24 25 22 24 2 ZW FG SG TG Z O s. R. o /L En 24 130 Cl-Konzentration (mmol/l Serum) 3. d p.p. Cl-Konzentration (mmol/l Serum) 28. d p.p. 120 120 110 110 100 100 90 90 24 25 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 25 12 25 ZW FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM d Mn su ge 25 d Mn su ge N = 25 25 Kl 130 24 P G V 25 LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM 25 d Mn su ge 25 d Mn su ge N = 25 Abb. 4.22: Chloridkonzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in mmol/l) vom 28. d a.p. - 28. d p.p. Die Chloridkonzentrationen im Serum liegen im Referenzbereich von 96 - 110 mmol/l (FÜRLL 2005), wie der Abb. 4.22 zu entnehmen ist. Ante partum fällt bei den Gruppen Tot-, Frühgeburt und Zwillingsträchtigkeiten eine signifikant (p≤0,05) höhere Chloridkonzentration im Vergleich zu den gesunden Tieren auf, welche aber noch im Referenzbereich liegt. 59 Ergebnisse Am 3. d p.p. gleicht sich der Chloridspiegel der einzelnen Gruppen. Am 28. d p.p. ist überall (außer Frühgeburt) eine signifikante (p≤0,01) Abnahme der Konzentration zu beobachten. Die gesunden Kühe weisen zu diesem Zeitpunkt den niedrigsten Medianwert auf, signifikant (p≤0,05) niedriger im Vergleich zu den Kühen mit Gebärparese, Endometritis/Lochiometra, Tot- und Frühgeburt. Calcium (Ca) 4,0 4,0 Ca-Konzentration (mmol/l Serum) 28. d a.p. 3,5 3,0 3,0 2,5 2,5 2,0 2,0 1,5 1,5 1,0 1,0 24 25 23 25 25 24 7 25 25 23 24 25 22 24 2 24 ZW FG SG TG Z O s. R. o /L En 4,0 Ca-Konzentration (mmol/l Serum) 3. d p.p. 3,5 Ca-Konzentration (mmol/l Serum) 28. d p.p. 3,5 3,0 3,0 2,5 2,5 2,0 2,0 1,5 1,5 1,0 1,0 24 25 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 25 12 25 ZW FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM d Mn su ge 25 d Mn su ge N = 25 25 Kl 4,0 24 P G V 25 LM N = 25 ZW FG 25 SG TG Z O s. R. o /L En Kl P G V LM 25 d Mn su ge 25 d Mn su ge N = 25 Ca-Konzentration (mmol/l Serum) 10. d a.p. 3,5 Abb. 4.23: Calciumkonzentrationen im Serum aller Gruppen (Median, 1.-3. Quartil in mmol/l) vom 28. d a.p. - 28. d p.p. Die Calciumkonzentration im Serum ist nur am 3. d p.p. unterhalb des Referenzbereiches von 2,3 - 2,8 mmol/l (FÜRLL 2005), wie die Abb. 4.23 demonstriert. Die Calciumkonzentrationen im Serum unterscheiden sich ante partum zwischen den Gruppen nur geringfügig und liegen in der unteren Hälfte des Referenzbereiches. 60 Ergebnisse Zum 3. d p.p. fällt diese (außer bei Tieren mit Klauenerkrankungen) überall in den Bereich der Hypokalzämie ab. Am 28. d p.p. kehren die Konzentrationen wieder in den Ausgangsbereich zurück und lassen zwischen den Gruppen keine signifikanten Unterschiede erkennen. Die folgende Abbildung 4.24 verdeutlicht den zeitlichen Verlauf der Calciumkonzentrationen bei den gesunden und erkrankten Tieren. In der Abbildung ist die signifikante (p≤0,01) Abnahme der Calciumkonzentration zum 3. d p.p. bei gesunden und erkrankten Kühen (Median aller erkrankten Kühe aus den 10 verschiedenen Krankheitsgruppen) zu erkennen. Diese, zu diesem Zeitpunkt bestehende Hypokalzämie, ist bis zum 28. d p.p. wieder ausgeglichen. mmol/l 2,6 2,5 2,4 2,3 28. d a.p. 10. d a.p. 03. d p.p. 28. d p.p. 2,2 2,1 2 gesund (n=25) erkrankte Tiere (n=237) Abb. 4.24: Zeitlicher Verlauf der Calciumkonzentrationen (Medianwerte, 1.-3.Quartil in mmol/l) im Serum gesunder und erkrankter Kühe im Vergleich 61 Ergebnisse anorganisches Phosphat (Pi) 4,5 4,5 4,0 4,0 Pi-Konzentration (mmol/l Serum) 28. d a.p. 3,5 3,5 3,0 3,0 2,5 2,5 2,0 2,0 1,5 1,5 1,0 1,0 ,5 ,5 0,0 0,0 24 25 23 25 24 25 7 N = 25 25 23 24 25 22 2 ZW 24 FG SG TG Z O s. R. o /L En 24 4,5 4,0 4,0 Pi-Konzentration (mmol/l Serum) 3. d p.p. 3,5 3,5 3,0 3,0 2,5 2,5 2,0 2,0 1,5 1,5 1,0 1,0 ,5 ,5 0,0 Pi-Konzentration (mmol/l Serum) 28. d p.p. 0,0 24 25 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 25 12 25 ZW FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM d Mn su ge 25 d Mn su ge N = 25 25 Kl 4,5 24 P G V 25 LM ZW 25 FG SG TG 25 Z O s. R. o /L En Kl P G V LM 25 d Mn su ge 25 d Mn su ge N = 25 Pi-Konzentration (mmol/l Serum) 10. d a.p. Abb. 4.25: Phosphatkonzentrationen im Serum aller Gruppen (Median, 1. - 3. Quartil in mmol/l) vom 28. d a.p. – 28. d p.p. Die Phosphatkonzentrationen im Serum bewegen sich mehrheitlich im Referenzbereich von 1,55 - 2,29 mmol/l (FÜRLL 2005), wie Abb. 4.25 verdeutlicht. Die Phosphatkonzentration im Serum der gesunden Gruppe liegt am 28. d a.p. über dem Referenzbereich. Ante partum weisen nur die Kühe mit Zwillingsträchtigkeiten zu beiden Zeitpunkten signifikant (p≤0,05) niedrigere Phosphatkonzentrationen auf. Am 3. d p.p. sind diese bei Kühen mit Gebärparese, Endometritis/Lochiometra, Tot- und Frühgeburten signifikant (p≤0,05) höher in Bezug zu den gesunden Tieren. Einen Monat nach der Kalbung liegt nur bei der gesunden Gruppe die Konzentration >2 mmol/l, die Erkrankungsgruppen weisen niedrigere Konzentrationen auf, welche sich aber noch im Referenzbereich befinden. Der Verlauf der anorganischen Phosphatkonzentrationen verhält sich analog zu dem der Calciumkonzentrationen. 62 Ergebnisse Nach der Abnahme der Phosphatkonzentration ante partum kommt es mit der Abkalbung zu einer weiteren signifikanten (p≤0,05) Reduktion (bei gesunden Tieren um 0,57 mmol/l), so dass am 3. d p.p. (bis auf Kühe mit Gebärparese und Frühgeburt) die niedrigsten Medianwerte zu beobachten sind. Eisen (Fe) 70 70 Fe-Konzentration (mol/l Serum) 28. d a.p. 60 50 50 40 40 30 30 20 20 10 10 0 0 24 25 25 23 25 25 24 7 N = 25 25 23 24 25 22 24 2 24 ZW FG SG TG Z O s. R. o /L En Kl 70 Fe-Konzentration (mol/l Serum) 3. d p.p. 60 Fe-Konzentration (mol/l Serum) 28. d p.p. 60 50 50 40 40 30 30 20 20 10 10 0 0 24 25 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 25 12 25 ZW FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM Mnd su ge 25 Mnd su ge N = 25 25 P G 70 24 V 25 LM ZW 25 FG SG TG Z O s. R. o /L En Kl V P G LM 25 Mnd su ge 25 Mnd su ge N = 25 Fe-Konzentration (mol/l Serum) 10. d a.p. 60 Abb. 4.26: Eisenkonzentrationen im Serum aller Gruppen (Median, 1. - 3. Quartil in mol/l) vom 28. d a.p. – 28. d p.p. Abb. 4.26 lässt erkennen, dass die Eisenkonzentrationen im Serum mit den Medianwerten innerhalb des Referenzbereiches von 13-33 mol/l (FÜRLL 2005) liegen. Ante partum zeigt sich eine Reduktion der Eisenkonzentration im Serum bis zur Kalbung, wobei die in der gesunden Gruppe auf einem gleichförmigen Niveau bis zum letzten Entnahmezeitpunkt verbleibt. 63 Ergebnisse Bei den Gruppen Labmagenverlagerung, Endometritis/Lochiometra, Retentio secundinarum, Ovarialzysten, Tot-, Schwer-, Frühgeburt und Zwillingsträchtigkeiten kommt es zu einem deutlichen (zum Teil >40%) und signifikanten (p≤0,01) Rückgang der Eisenkonzentrationen im Serum vom 10. d a.p. zum 3. d p.p. und damit zu signifikant (p≤0,05) niedrigeren Eisenkonzentrationen im Vergleich zu den gesunden Tieren. Insbesondere bei Kühen mit Labmagenverlagerungen bleibt dieser niedrige Eisenspiegel im Serum bis zum 28. d p.p. auch bestehen. Bei erkrankten Tieren liegt zu diesem Zeitpunkt die Eisenkonzentration mit einem Medianwert von 22 mol/l im Serum unterhalb der Konzentration im Serum der gesunden Gruppe. In der Tabelle 4.4 sind die Korrelationen (r) zwischen den Fe- und Ca-Konzentrationen im Serum der Tiere der jeweiligen Gruppen zu 4 verschiedenen Zeitpunkten aufgeführt. Es wird der bestehende korrelative Zusammenhang zwischen den beiden Parametern des Mineralstoffwechsels (in der Gruppe Mastitis und Schwergeburt zu allen 4 Zeitpunkten) ersichtlich. Tab. 4.4: Korrelationen zwischen den Eisen- und den Calciumkonzentrationen im Serum der jeweiligen Gruppen zu 4 verschiedenen Zeitpunkten (keine signifikante Korrelation (-), Korrelation mit p≤0,05 signifikant, Korrelation mit p≤0,01 signifikant) Fe/Ca 28.d a.p. gesund M LMV GP Kl En/ Lo R.s. OZ TG SG FG ZW - 0,56 - - - - 0,43 - - 0,48 - - 0,55 0,47 - 0,43 - 0,41 0,62 - 0,62 1,00 0,46 10.d a.p. 0,56 3.d p.p. - 0,46 0,43 - 0,50 - - - 0,79 0,50 - - 28.d p.p. - 0,55 - 0,51 - - - 0,51 - 0,47 - 0,49 Magnesium (Mg) Die Magnesiumkonzentrationen im Serum liegen mehrheitlich innerhalb des Referenzbereiches von 0,9 - 1,32 mmol/l (FÜRLL 2005) und sind im Anhang tabellarisch aufgeführt (Tab. B.12). Am 3. d p.p. sind die Mediane der Erkrankungsgruppen und der Kühe mit Zwillingsträchtigkeiten <0,9 mmol/l, welches eine Hypomagnesämie anzeigt. 64 Ergebnisse 4.4.5 Weitere labordiagnostische Parameter Creatinkinase (CK) 500 500 450 450 CK-Aktivität (U/l Serum) 28. d a.p. 400 CK-Aktivität (U/l Serum) 10. d a.p. 400 350 350 300 300 250 250 200 200 150 150 100 100 50 50 0 0 24 25 25 23 25 25 24 25 7 25 23 24 25 22 24 2 24 ZW FG SG TG Z O s. R. o /L En 500 900 450 CK-Aktivität (U/l Serum) 3. d p.p. 800 CK-Aktivität (U/l Serum) 28. d p.p. 400 700 350 600 300 500 250 400 200 300 150 200 100 100 50 0 0 24 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 25 12 25 ZW FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG V Z O s. R. o /L En Kl LM d Mn su ge 25 Mnd su ge N = 25 25 Kl 1000 24 P G V 25 LM N = 25 ZW FG SG TG Z O s. R. o /L En Kl P G V LM 24 d Mn su ge 25 d Mn su ge N = 25 Abb. 4.27: CK-Aktivitäten im Serum aller Gruppen (Median, 1.-3. Quartil in U/l) vom 28. d a.p. - 28. d p.p. (zu beachten: die unterschiedliche Skalierung der y-Achse zum Zeitpunkt 3. d p.p. ohne die Erkrankung Gebärparese) Die CK-Aktivitäten im Serum liegen teilweise deutlich über dem Referenzbereich <100 U/l; 3. d p.p. <200 U/l (FÜRLL 2005), wie in Abb. 4.27 ersichtlich ist. Im Stoffwechsel ante partum ist der Median der CK-Aktivität gesunder Kühe im Referenzbereich. Demgegenüber stehen Kühe mit Labmagenverlagerung, Endometritis/Lochiometra, Ovarialzysten, Tot-, Schwerund Frühgeburten, welche in diesem Zeitraum erhöhte CK-Aktivitäten im Serum von >100 U/l aufweisen. Am 3. d p.p. ist bei den Tieren aller Gruppen im Serum ein Anstieg der Enzymaktivität erkennbar, welcher in den Gruppen Mastitis, Labmagenverlagerung, Gebärparese, Klauenerkrankung, Retentio secundinarum, Ovarialzysten, Schwergeburt und Zwillingsträchtigkeiten signifikant (p≤0,05) ist. 65 Ergebnisse U/l 4000 3500 3000 2500 2000 1500 1000 500 0 GP * Abb. 4.28: CK-Aktivität (Median, 1.-3. Quartil in U/l) im Serum von Kühen mit Gebärparese (n=25) am 3. d p.p. Aus Gründen der Übersichtlichkeit ist die CK-Aktivität im Serum der Kühe mit Gebärparese am 3. d p.p. in der Abbildung 4.28 dargestellt. Die Gruppe der Gebärparese zeigt mit großem Abstand die höchste CK-Aktivität im Serum zu diesem Zeitpunkt, signifikant different (p≤0,001) zu allen anderen Gruppen. Daneben weisen auch Kühe mit Klauenerkrankungen und Schwergeburten am 3. d p.p. signifikant (p≤0,05) höhere Enzymaktivitäten im Serum im Vergleich zu der gesunden Gruppe auf. Am 28. d p.p. ist bei allen Gruppen der Referenzbereich deutlich überschritten, die Gruppe der gesunden Tiere zeigt zu diesem Zeitpunkt die höchste CK-Aktivität, welche signifikant (p≤0,05) höher ist als bei den Tieren der Gruppen Mastitis, Labmagenverlagerung, Gebärparese, Endometritis/Lochiometra, Frühgeburt und Zwillingsträchtigkeiten. Die Tabelle 4.5 verdeutlicht die Korrelationen (r) zwischen den CK- und AST-Aktivitäten im Serum der Tiere der jeweiligen Gruppen zu 4 verschiedenen Zeitpunkten. Es besteht ein hoher korrelativer Zusammenhang zwischen den beiden Enzymaktivitäten im Serum. Bei Gebärparese besteht am 3. d p.p. im Vergleich zu den restlichen Gruppen eine signifikant (p≤0,001) erhöhte CK-, als auch eine signifikant erhöhte (p≤0,05) AST-Aktivität, welche beide zu diesem Zeitpunkt stark und signifikant (p≤0,01) korrelieren. Tab. 4.5: Korrelationen zwischen den CK- und den AST-Aktivitäten im Serum der jeweiligen Gruppen zu 4 verschiedenen Zeitpunkten (keine signifikante Korrelation (-), Korrelation mit p≤0,05 signifikant, Korrelation mit p≤0,01 signifikant) CK/AST gesund M LMV GP Kl En/ Lo R.s. OZ TG SG FG ZW - - 0,45 0,52 - - 0,66 - - 0,57 - - 10.d a.p. 0,43 - - - - 0,70 0,64 0,46 0,46 - 1,00 - 3.d p.p. 0,62 0,44 0,58 0,82 0,47 - 0,80 0,40 0,63 0,73 0,61 0,55 28.d p.p. 0,43 0,70 - - 0,45 - - - - - - 0,48 28.d a.p. 66 Ergebnisse Alkalische Phosphatase (AP) 150 150 AP-Aktivität (U/l Serum) 28. d a.p. AP-Aktivität (U/l Serum) 10. d a.p. 125 125 100 100 75 75 50 50 25 25 0 0 24 25 25 23 25 24 7 N = 25 25 23 24 25 22 2 ZW 24 FG 24 SG TG Z O s. R. o /L En 150 AP-Aktivität (U/l Serum) 3. d p.p. AP-Aktivität (U/l Serum) 28. d p.p. 125 125 100 100 75 75 50 50 25 25 0 0 24 25 25 24 25 25 24 25 12 25 N = 25 25 22 21 24 24 25 25 23 25 25 ZW Abb. 4.29: AP-Aktivitäten im Serum aller Gruppen (Median, 1.-3. Quartil in U/l) vom 28. d a.p. - 28. d p.p. 12 FG SG TG Z O s. R. o /L En Kl P G V LM ZW FG SG TG Z O s. R. o /L En Kl P G V LM d Mn su ge 25 d Mn su ge N = 25 25 Kl 150 24 P G V 25 LM ZW 25 FG 25 SG TG Z O s. R. o /L En Kl P G V LM 25 d Mn su ge 25 d Mn su ge N = 25 Die Abb. 4.29 verdeutlicht, dass die Aktivität der Alkalischen Phosphatase im unteren Drittel des Referenzbereiches von 40 - 122 U/l (FÜRLL 2005) liegt, bzw. diesen unterschreitet. Die Gruppen Mastitis, Labmagenverlagerung, Retentio secundinarum, Ovarialzysten und Zwillingsträchtigkeiten weisen vor der Kalbung gegenüber den gesunden Kühen signifikant (p≤0,05) niedrigere Enzymaktivitäten auf. Kühe mit Gebärparese haben die niedrigste APAktivität von allen und zeigen damit zu allen 4 Zeitpunkten eine signifikante Differenz (p≤0,001) zu der gesunden Vergleichsgruppe. Am 3. d p.p. lässt die gesunde Gruppe die höchsten Median- und Quartilwerte erkennen, alle Erkrankungsgruppen und die Zwillingsträchtigkeiten liegen (teilweise signifikant mit p≤0,05) niedriger. 67 Ergebnisse Zum 28. d p.p. kommt es bei allen Gruppen (ausgenommen Frühgeburt) zu einer Abnahme der Enzymaktivität größtenteils unter die antepartalen Ausgangsaktivitäten. Die Abbildung 4.30 zeigt die signifikant (p≤0,001) geringere Aktivität der Alkalischen Phosphatase im Serum von festliegenden Kühen im Vergleich zu der bei den gesunden an allen 4 Entnahmezeitpunkten. U/l 80 70 60 50 40 30 28. d a.p. 10. d a.p. 03. d p.p. 28. d p.p. 20 10 0 gesund (n=25) GP* (n=25) Abb. 4.30: Zeitlicher Verlauf der AP-Aktivität (Medianwerte, 1.-3. Quartil in U/l) im Serum gesunder und festliegender Kühe im Vergleich 68 Ergebnisse 4.4.6 Endokrine Parameter Östradiol Die Mediane der Östradiolkonzentrationen im Serum liegen zwischen 10 – 63 pg/ml (Anhang Tab. B.13). Alle Gruppen zeigen ausnahmslos kurz vor der Kalbung die höchsten Östradiolkonzentrationen, in allen Gruppen (außer Frühgeburt) signifikant different (p≤0,05) zu den restlichen Entnahmezeitpunkten. Endometritis/Lochiometra geht im Vergleich zu den übrigen Gruppen mit (besonders zum Zeitpunkt 10. d a.p.) einer erniedrigten Östradiolkonzentration einher, wobei dies gegenüber den gesunden Kühen nicht statistisch gesichert werden kann. Insulin-like growth factor-1 (IGF-1) 350 300 350 IGF-1 Konzentration (ng/ml Serum) 28. d a.p. 250 250 200 200 150 150 100 100 50 50 0 0 10 10 18 13 19 17 12 5 5 13 18 17 12 5 2 ZW FG SG TG 12 100 IGF-1 Konzentration (ng/ml Serum) 3. d p.p. IGF-1 Konzentration (ng/ml Serum) 28. d p.p. 90 80 80 70 70 60 60 50 50 40 40 30 30 20 20 10 10 0 0 10 18 14 17 8 N = 11 9 9 17 14 19 17 12 5 8 13 ZW FG SG TG Z O s. R. o /L En Kl P G V 20 LM ZW 13 FG 5 SG 12 TG 19 Z O s. R. o /L En Kl P G V LM 10 d Mn su ge 20 d Mn su ge N = 11 18 Z O s. R. o /L En 90 10 Kl 100 10 P G V 20 LM N = 11 ZW FG SG TG Z O s. R. o /L En Kl P G V LM 13 d Mn su ge 20 d Mn su ge N = 11 IGF-1 Konzentration (ng/ml Serum) 10. d a.p. 300 Abb. 4.31: IGF-1 Konzentrationen im Serum aller Gruppen (Median, 1. - 3. Quartil in ng/ml) vom 28. d a.p. – 28. d p.p. (zu beachten: die unterschiedliche Skalierung der y-Achse ante/post partum) 69 Ergebnisse Ante partum lassen zu beiden Zeitpunkten Kühe mit Ovarialzysten sowie Zwillingsträchtigkeiten signifikant (p≤0,05) niedrigere IGF-1 Konzentrationen im Vergleich zu den gesunden Kontrolltieren erkennen. Am 10. d a.p. tritt lediglich bei Kühen mit Ovarialzyste(n) eine IGF-1 Konzentration <10 ng/ml auf; somit signifikant different (p≤0,05) zu den gesunden Vergleichskühen. Mit der Kalbung kommt es in allen Gruppen zu einer signifikanten (p≤0,05) Abnahme der Medianwerte des insulinähnlichen Wachstumsfaktors unter die Sensitivitätsgrenze des zur Bestimmung verwendeten Enzymimmunoassay von 10 ng/ml und diese verbleiben mit Ausnahme der Tot- und Frühgeburten auf dem Niveau am 28. d p.p. Im Vergleich der nachweisbaren IGF-1 Konzentrationsbestimmungen in dem Zeitraum einen Monat vor bis einen Monat nach der Kalbung kommt es in allen Gruppen (ausgenommen Frühgeburt) zu einer deutlichen und signifikanten (p≤0,05 - p≤0,001) Abnahme der auf die insulinähnliche Wachstumshormonkonzentration bestimmbaren Probenanzahl. Das unter 4.5 aufgeführte Piktogramm verdeutlicht in allen Gruppen die bisherigen unter Kapitel 4 der Dissertation beschriebenen Ergebnisse und soll der Übersichtlichkeit sowie der Veranschaulichung dienen. 70 4.5 Gesamtübersicht Leukozyten BHB FFS Glucose Insulin Bilirubin Cholesterol Gesamtprotein Harnstoff Creatinin GLDH GGT AST Cl Ca Pi Fe CK AP IGF-1 gesund M LMV GP Kl En/Lo R.s. OZ 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 TG SG FG ZW 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 Mediane außerhalb der Referenzwerte 1 = 28. d a.p. Mediane stark außerhalb der Referenzwerte 2 = 10. d a.p. Mediane außerhalb der Referenzwerte und signifikant different (p0,05) gegenüber der gesunden Gruppe 3 = 03. d p.p. Mediane stark außerhalb der Referenzwerte und signifikant different (p0,05) gegenüber der gesunden Gruppe 4 = 28. d p.p. Abb. 4.34: Piktogramm relevanter Veränderungen der Serumparameter aller Gruppen 71 Ergebnisse 4.6 Harnuntersuchung Netto-Säuren-Basen-Ausscheidung (NSBA) Am 10. d a.p. ist die NSBA im Harn bei Kühen mit Labmagenverlagerung und Ovarialzysten signifikant (p≤0,05) niedriger als bei gesunden Tieren, am 28. d p.p. liegt diese bei den Gruppen Mastitis, Ovarialzysten und Frühgeburten >200 mmol/l. Generell fällt auf, dass einen Monat nach der Kalbung die Konzentrationen aller Gruppen deutlich und damit signifikant (p≤0,05) höher liegen, als 10 Tage ante partum, wie Abb. 4.32 demonstriert. mmol/l 260 220 180 140 100 10. d a.p. 60 28. d p.p. 20 ZW FG SG TG Z* O Lo . .s R / En Kl P G V* LM M nd su ge Abb. 4.32: Ergebnisse der NSBA-Bestimmung (Medianwerte, 1. - 3. Quartil in mmol/l) nach KUTAS (1966), Referenzbereich nach FÜRLL (2005): 83-215 mmol/l pH-Wert Die Abb. 4.33 zeigt auf, dass die pH-Werte im Harn mit den Medianen zwischen 7,9 und 8,3 liegen. Am 28. d p.p. sind diese bei Kühen mit Labmagenverlagerung und Endometritis/Lochiometra signifikant (p≤0,05) niedriger als bei der Gruppe gesunder Kühe. pH 8,4 8,3 8,2 8,1 8 7,9 7,8 7,7 7,6 7,5 7,4 7,3 10. d a.p. 28. d p.p. ZW FG SG TG Z O . .s R o* /L En Kl P G V* LM M nd su ge Abb. 4.33: Ergebnisse der Messung des pH-Wertes (Medianwerte, 1. - 3. Quartil) im Harn 72 Diskussion 5 Diskussion Das frühlaktationsassoziierte Energiedefizit in Verbindung mit übermäßigem Verlust an Körperkondition und auftretenden Erkrankungen peri-/post partum stellt ein bedeutendes Problem intensiv gehaltener Milchleistungskühe dar (ROSSOW 2001, DRACKLEY 2004, JÄKEL 2005b). Ziel vorliegender Untersuchungen war eine deskriptive Bestandsanalyse in Verbindung mit der Fragestellung, welche Veränderungen im frühen Stoffwechsel ante partum (sowie bei Labmagenverlagerung und Ovarialzysten ebenfalls im Stoffwechsel post partum) den einzelnen Erkrankungen vorausgehen. Dazu wurden jeweils 25 Tiere den einzelnen Krankheitsgruppen zugeordnet und diese mit der gleichen Anzahl „klinisch gesunder“ Kühe verglichen. Letztere zeichneten sich dadurch aus, dass sie nach der Kalbung mindestens 4 Monate frei von klinischer Symptomatik waren und zu allen Entnahmezeitpunkten Leukozytenzahlen <10 G/l sowie RFD ≤27 mm aufwiesen. Des Weiteren sollte im Rahmen der Studie erörtert werden, ob zur Erkennung einer Disposition für eine Dislocatio abomasi der frühe Stoffwechsel ante partum ähnlich aussagekräftig wie der Zeitpunkt 3. d p.p. (FÜRLL u. KLEISER 1998b, KASTNER 2002) verläuft. Weiteres Augenmerk galt der Stoffwechselsituation von Kühen mit Zwillingsträchtigkeiten. 5.1 Klinische Untersuchung Die Morbiditätsrate wird von dem Erkrankungsbild Mastitis mit 17,2% angeführt und liegt damit etwas über der von KELTON et al. (1998) beschriebenen Erkrankungsinzidenz klinischer Mastitiden von 14,2%. Diese Tatsache entspricht der von WOLTERS et al. (2002) und SOBIRAJ (2005) beschriebenen enormen Bedeutung des Krankheitskomplexes Euterentzündung bei intensiv gehaltenen Milchkühen. Die Morbiditätsrate der übrigen Krankheitsgruppen (Tab. 3.1) sowie die Rate von Zwillingsträchtigkeiten entsprechen den jeweiligen in der Literaturübersicht aufgeführten üblichen Erkrankungsinzidenzen. Aus den Ergebnissen der klinischen Untersuchung am 3. d p.p. ist ersichtlich, dass die Erkrankungsgruppe Totgeburt den stärksten Einfluss auf die klinischen Parameter ausübt. In dieser Gruppe ist die höchste Körpertemperatur (Medianwert 39,2 °C) und eine signifikant höhere Pulsfrequenz (Medianwert 92/min) im Vergleich zu den gesunden Tieren zu beobachten. Weiterhin führen Endometritis/Lochiometra und Zwillingsträchtigkeiten zu einem Temperaturanstieg ≥39,0 °C. Die Mehrzahl (76%) der Dislocatio abomasi trat, wie in der Literatur (POIKE 2000, FREITAL 2003, RICKEN 2003) beschrieben, innerhalb des ersten Monats post partum auf. In diesen Zeitraum fallen 84% der linksseitigen (nach PEHRSON u. SHAVER [1992] ca. 80%) und 50% der rechtsseitigen (nach BRUNK [1993] 50-70%) Verlagerungen. 73 Diskussion Die klinische Diagnose einer Labmagenverlagerung wurde durchschnittlich am 23. d p.p. (ohne die sehr späte Verlagerung am 137. d p.p. liegt das arithmetische Mittel am 18. d p.p.) gestellt. Dies gleicht sich mit den Beobachtungen von FÜRLL und KLEISER (1998b) und liegt über den Angaben von LeBLANC (2005), welcher das durchschnittliche Auftreten am 11. d p.p. datierte. Am häufigsten (32%) ist die Verlagerung des Labmagens mit dem Erkrankungsbild Endometritis/Lochiometra verbunden. Diese Tatsache entspricht den Aussagen von SATTLER (2001). Von den 25 Kühen mit Zwillingsträchtigkeiten waren deutlich mehr als die Hälfte von einer Retentio secundinarum betroffen. Dies bestätigt die von ZEBERLE (1996) und SHELDON (2004) beschriebene erhöhte Inzidenz einer Nachgeburtsverhaltung infolge von Zwillingsträchtigkeiten. 5.2 Körperkondition Die Körperkondition aller Kühe der Studie wurde vom Zeitraum des Trockenstellens bis 4 Monate nach der Kalbung durch sonographische Messung der RFD an 7 verschiedenen Zeitpunkten ermittelt. Dabei dient diese Methode der objektiven Beurteilung des subkutanen Fettdepots (STAUFENBIEL 1997, SCHROEDER 2000, SCHROEDER u. STAUFENBIEL 2006), welches mit ca. 27% nach dem intramuskulären Fettanteil und vor dem Netzfettanteil die zweitstärkste Fraktion des Gesamtkörperfettgehaltes darstellt (CIANZO et al. 1982). WITTEK et al. (2002b) wiesen in eigenen Untersuchungen aufgrund von Dysbalancen zwischen der RFD-Messung mittels Ultraschall und der intraabdominalen Fettablagerung eine individuell unterschiedliche Fettverteilung nach. Nach STAUFENBIEL et al. (1993) entspricht 1 mm RFD-Änderung einer Zu-/Abnahme von ca. 5 kg Körperfett bzw. 200 MJ Nettoenergie. Ante partum zeigte sich bei den Tieren aller Gruppen in der Regel ein stetiger Anstieg der Körperkondition vom Zeitpunkt des Trockenstellens bis zur Kalbung um 2 - 3 mm RFD. Der gesunden Gruppe wurde das Kriterium RFD ≤27 mm zugrunde gelegt, um überkonditionierte Tiere auszuschließen. Diese Gruppe ist im Vergleich zu den Erkrankungsgruppen etwas geringer konditioniert und liegt mit dem Median 16 mm RFD deutlich unter der optimalen Kondition zum Zeitpunkt des Trockenstellens von 22 - 24 mm RFD (SCHROEDER 2000, ROSSOW 2001). Allerdings ist aus den Messungen ersichtlich, dass die Tiere aller Gruppen zum Teil erheblich mit den Medianwerten unter dieser Grenze liegen und sich somit im Bestandsniveau schon vor der Kalbung eine geringere Kondition aufzeigt. Dabei sind zu geringe Fettdepots von unter 20 mm RFD am Ende der Trockenstehphase und damit verbunden eine unzureichende Kompensation des Energiedefizits post partum verantwortlich für negative Auswirkungen auf Gesundheit, Fruchtbarkeit und Milchleistung (STAUFENBIEL et al. 1991, 1992, STAUFENBIEL et al. 2004, SCHROEDER u. STAUFENBIEL 2006). 74 Diskussion Die Gruppe der Ovarialzysten ist im Vergleich zu den verbleibenden Gruppen ante partum am höchsten konditioniert. Diese Erkenntnis entspricht den Untersuchungen von MÖSENFECHTEL et al. (2000) und HASLER (2003), wobei betont werden muss, dass dies in Bezug zu den übrigen Tieren des Bestandes zu werten ist und der Bestandsdurchschnitt kurz vor der Kalbung im unteren Referenzbereich 19-27 mm RFD (STAUFENBIEL et al. 2004) liegt. Da zwischen den RFD-Messungen 10. d a.p. und 3. d p.p. sich keine großen Differenzen aufzeigen, ist kein sonographisch messbarer Hinweis auf eine unphysiologisch starke antepartale Mobilisation des Körperfettes gegeben. Ausnahme bilden Kühe mit Endometritis/Lochiometra, Ovarialzysten und Frühgeburten, welche zwischen den Messzeitpunkten eine Medianwertdifferenz von 2 mm RFD aufweisen und somit eine beginnende Mobilisierung der Fettreserven vor der Kalbung naheliegt. Das eigentliche Problem auf Bestandsebene offenbart sich nach der Abkalbung. Nach Angaben von SCHROEDER (2000) ist im ersten Monat post partum eine tägliche Abbaurate bis 0,14 mm RFD/d tolerabel. Weiterhin sollte die „Minimalkondition im Herdenmittel 13 mm RFD nicht unterschreiten“ (SCHROEDER 2000). Nach Ansicht des Autors gehen konditionell niedrigere Werte auf Kosten der Tiergesundheit und er sieht diese als Ursache für höhere Abgangsraten in Milchviehbeständen an. Die in der Studie gemessene tägliche Abbaurate der Körperkondition im ersten Monat nach der Kalbung ist doppelt so hoch wie die von SCHROEDER (2000) beschriebene Grenze. Am 56. d p.p. liegen alle Tiere ≤11 mm, am 120. d p.p. ≤8 mm. Der höchste Körperkonditionsverlust ist bei Kühen mit Labmagenverlagerung (75%) erkennbar, gefolgt von den Gruppen Ovarialzysten (73%) und den Klauenerkrankungen (72%). Dies ist Ausdruck des FMS (KANEENE et al. 1997, HERDT 2000, FÜRLL 2002a, ROSSOW 2003b), wobei von einem relativ niedrigen Körperkonditionsniveau aus, dafür aber intensiv über einen langen Zeitraum mobilisiert wird. Dabei kommt es durch ein Energiedefizit zu verstärktem Körperfettabbau, verbunden mit einem Anstieg der FFS- und Ketonkörperkonzentrationen, gefolgt von Anreicherung freien Endotoxins im Blut durch Verminderung der Endotoxinbindung, des –abbaus und der –ausscheidung (FÜRLL 2002a). Folge ist nach Ansicht des Autors eine leichtere Passage von Krankheitserregern aus dem Magen-Darm-Kanal in das Blut und somit in die Körperorgane, lokale Organdurchblutungsstörungen in Verbindung mit auftretenden Entzündungserscheinungen, Verminderung der Muskelkontraktion als Ursache für unter anderem Labmagenverlagerungen, Fieberreaktionen und schwere Reperfusionsschäden (Endotoxinschock). 75 Diskussion Von dem massiven Körperkonditionsverlust sind nicht nur erkrankte Kühe betroffen, sondern auch gesunde und solche mit Zwillingsträchtigkeiten. Dies ist als Bestandsproblem zu werten, da alle Tiere in der Phase der Hochlaktation unterkonditioniert sind. Sie werden nicht in ihrer katabolen Stoffwechsellage mit der daraus resultierenden Mobilisationsphase (HERDT 2000, McNAMARA 2000, ROSSOW 2001) „aufgefangen“ und sind somit auch nicht in der Lage, im Laktationsverlauf bis zum erneuten Zeitpunkt des Trockenstellens ein adäquates Fettdepot aufzubauen, obwohl die Phase der negativen Energiebilanz nach 100 Laktationstagen überwunden sein sollte (SCHROEDER 2000, ROSSOW 2001). Dies erklärt auch die geringen Konditionswerte zu Beginn des Messzeitraumes. Ähnliche Beobachtungen beschreibt EVERTZ (2006), welcher in eigenen Untersuchungen mittels sonographischer Messung der RFD sowohl bei Kühen als auch Färsen eine zu niedrige Körperkondition in dem Zeitraum 8 Wochen vor bis 12 Wochen nach der Kalbung feststellte. Bei der getrennten Betrachtung der Körperkondition von Kühen und Färsen der einzelnen Gruppen (Anhang Tab. B.4-B.7) zeigt sich, dass letztere in der Regel (ausgenommen Labmagenverlagerung und Zwillingsträchtigkeit) höher konditioniert sind. Besonders deutlich wird diese Differenz in der Gruppe Schwergeburt. Übermäßiges perivaginales Fettgewebe führt zur Einengung des weichen Geburtsweges (GRUNERT u. ANDRESEN 1996, FÜRLL 2002a) und Färsen mit hoher Körperkondition sind nach vorliegender Untersuchung entsprechend prädisponiert für Geburtskomplikationen. Das Problem der massiven Mobilisation von Körperfett post partum betrifft sowohl Kühe als auch Färsen im selben Ausmaße mit vergleichbaren Minimalkonditionen am 120. d p.p. Kühe mit Labmagenverlagerung weisen die höchste tägliche Mobilisierungsrate mit ca. 0,4 mm RFD/d innerhalb des ersten Monats nach der Kalbung auf. Bei den Färsen zeigt die Mastitisgruppe mit der gleichen Rate die höchste Messwertdifferenz zwischen 3. d p.p. und 28. d p.p. GALLO et al. (1996) beobachteten eine geringere Körperfettmobilisation von Färsen gegenüber mehrkalbigen Kühen und begründeten diese anhand der niedrigeren Laktationsleistung. Dies bestätigt sich in vorliegender Untersuchung nur in den Gruppen Labmagenverlagerung, Endometritis/Lochiometra, Retentio secundinarum und Ovarialzysten. Gesunde Kühe und Färsen bauen gleich viel Körperfett nach der Kalbung ab. Färsen mit Mastitis, Tot- und Schwergeburten zeigen eine höhere Fettmobilisation post partum als die vergleichbaren Kühe der jeweiligen Gruppe. 76 Diskussion 5.3 Leukozytenzahl Der generell zu beobachtende Anstieg der Leukozytenzahlen ante partum deutet auf eine vermehrte Aktivierung des weißen Blutbildes bis zur Kalbung. Diese Tatsache gleicht Beobachtungen von KEHRLI et al. (1989). Die Autoren beschreiben einen Anstieg der Leukozytenzahlen durch Erhöhung der absoluten Anzahl der im Blut zirkulierenden neutrophilen Granulozyten, Lymphozyten und Monozyten gegen Ende der Trächtigkeit mit einem Maximum 2 Wochen vor der Kalbung. Nach der Abkalbung kommt es in der vorliegenden Untersuchung bei allen Tieren zu einem deutlichen Rückgang der Leukozytenzahlen. Dieser bewegt sich am 3. d p.p. (ausgenommen Gruppen Retentio secundinarum und Zwillingsträchtigkeit) im Referenzbereich nach KRAFT und DÜRR (2005) und ist nach KEHRLI et al. (1989) sowie GILBERT et al. (1993) dem Einwandern neutrophiler Granulozyten in den Reproduktionstrakt der Kühe zuzuschreiben. LEE und KEHRLI (1998) beschreiben um den Zeitpunkt der Kalbung sogar eine Dysfunktion der Leukozyten. So kommt es zu einer Beeinträchtigung der funktionellen Kapazität der mononukleären Leukozyten bei Milchkühen (PREISLER et al. 2000, NONNECKE et al. 2003). Die von SOBIRAJ et al. (2001) und WITTEK (2004) beschriebene Leukopenie infolge einer Nachgeburtsverhaltung zeigt sich ebenfalls in der Untersuchung. Zusammen mit der Zwillingsträchtigkeit, welche zum überwiegendem Teil mit Nachgeburtsverhaltung einhergeht, liegen die Leukozytenzahlen der Gruppe Retentio secundinarum unterhalb des physiologischen Bereiches. Ante partum weisen Kühe mit späteren Euterentzündungen die niedrigsten Leukozytenzahlen auf, welche aber noch im Referenzbereich liegen und somit keine eindeutige frühdiagnostische Aussage zulassen. 77 Diskussion 5.4 Klinisch-chemische Parameter 5.4.1 Energie- und Fettstoffwechsel Die Parameter des Energie- und Fettstoffwechsels lassen zum Teil erhebliche Unterschiede zwischen den Gruppen erkennen. Im Stoffwechsel ante partum und direkt nach der Kalbung weisen Kühe mit Zwillingsträchtigkeiten erhöhte BHB- und FFS-Konzentrationen auf, welche teilweise im Vergleich zu den gesunden Tieren eine signifikante Differenz aufzeigen. Diese Tatsache bestätigt Zwillingsträchtigkeiten als „Sonderfall erhöhten Energiebedarfes“ und dass sich Kühe mit Zwillingsgravidität besonders zum Ende der Trockenstehperiode in dem Zustand einer subklinischen Ketose befinden (FÜRLL 2002a). Am 10. d a.p. wird bei den Erkrankungsgruppen Mastitis, Endometritis/Lochiometra, Tot- und Schwergeburt der Anstieg der FFS-Konzentration gegenüber dem vorherigen Entnahmezeitpunkt und gegenüber der gesunden Gruppe offensichtlich. Diese Tatsache spricht für den Einfluss des Energiestoffwechsel bereits vor der Kalbung auf den Gesundheitsstatus post partum. Nach Untersuchungen von LeBLANC (2005) weichen die FFS-Konzentrationen von Kühen mit Labmagenverlagerungen schon 14 Tage vor der Kalbung von der gesunden Kontrollgruppe ab und liegen im Stoffwechsel ante partum teilweise ≥500 µmol/l. Diese Beobachtung konnte in der vorliegenden Studie nicht bestätigt werden. Die Medianwerte der Kühe mit späterer Labmagenverlagerung und gesunder Tiere gleichen sich im Zeitraum vor der Abkalbung. Dennoch deutet die Auslenkung des Quartilbereiches der von Dislocatio abomasi betroffenen Tiere am 10. d a.p. auf Unterschiede, welche aber nicht statistisch zu sichern sind. Bei Betrachtung der Gruppe Labmagenverlagerung wird deutlich, dass der 3. d p.p. wesentlich bessere Erkenntnisse im Hinblick auf den von VAN WINDEN et al. (2003) und LeBLANC (2005) beschriebenen massiven Einfluss des Energiestoffwechsels auf die Erkrankung zulässt. So liegen zu diesem Zeitpunkt die Ketonkörper- und FFS-Konzentration bei Kühen mit Labmagenverlagerung im Vergleich zu allen anderen am höchsten und zeigen mit diesen Werten zu den gesunden Kontrolltieren eine signifikante Differenz auf (bei der FFS-Konzentration sogar zu allen Gruppen). Damit geht der Labmagenverlagerung eine starke Entgleisung des Energiestoffwechsels voraus, welche in der vorliegenden Studie vor der Kalbung noch nicht so deutlich wird wie kurz nach dieser. Dies bestätigt die Ergebnisse von KASTNER (2002), nach deren Untersuchung ebenfalls der Dislocatio abomasi vorausgehend eine starke Veränderung des Fettstoffwechsels in Verbindung mit gesteigerter Lipolyse zu beobachten war. Der Anstieg der FFS-Konzentrationen der einzelnen Erkrankungsgruppen setzt sich nach der Kalbung fort, so dass nur die gesunden Kühe mit Medianwert <600 µmol/l liegen. Dies ist als Hinweis auf das FMS (KANEENE et al. 1997, HERDT 2000, FÜRLL 2002a, ROSSOW 2003b) zu verstehen, wobei das Syndrom in den vorliegenden Untersuchungen auf einem niedrigen Konditionsniveau abläuft. Dabei reflektiert die FFS-Konzentration die Lipolyserate 78 Diskussion (PULLEN et al. 1989) und erweist sich als aussagekräftiger Parameter zur Beurteilung der Energiebilanz (REIST et al. 2002). Die maximalen FFS-Konzentrationen sind in vorliegender Studie ausnahmslos am 3. d p.p. zu beobachten. Dies bestätigt den Einfluss des abkalbebedingten Stresses (GRUMMER 1995) in Verbindung mit einem akuten Energiemangel durch die eingeschränkte Trockenmasseaufnahme direkt nach der Kalbung (GOFF u. HORST 1997, HERDT 2000, GRUMMER 2004) auf die Serumkonzentration der Fettsäuren. Die Entwicklung der FFS-Konzentration zeigt sich im ähnlichem Ausmaß ebenfalls bei der Ketonkörperkonzentration (signifikante positive Korrelation besonders zum Zeitpunkt 3. d p.p.), wobei die Gruppen Labmagenverlagerung und Endometritis/Lochiometra am 3. d p.p. deutlich und signifikant different zur gesunden Vergleichsgruppe am höchsten liegen. Das oben genannte Problem der massiven Mobilisation von Körperfett nach der Kalbung spiegelt sich in der Ketonkörperkonzentration am 28. d p.p. wider. Die Mediane der BHBKonzentrationen sind bei Kühen aller Gruppen (ausgenommen Frühgeburt) >0,6 mmol/l. Eine erhöhte Ketonkörperkonzentration ist nach SCHOLZ (1990) Ausdruck eines manifesten Energiemangels. Die gesunde Gruppe liegt mit einem Medianwert von 0,73 mmol/l zu diesem Zeitpunkt deutlich über dem Referenzbereich von FÜRLL (2005). Eine obere Quartilauslenkung bis 0,90 mmol/l deutet auf eine subklinisch-ketotische Stoffwechsellage hin. Die gesunden Kühe unterscheiden sich darin nur unwesentlich von den Erkrankungsgruppen (ausgenommen Klauenerkrankungen und Ovarialzysten). Die Kühe mit Ovarialzysten zeigen am 28. d p.p. die höchsten BHB-Konzentrationen mit Median >1,0 mmol/l. Dies ist als Beweis zu deuten, dass zystische Entartungen an den Ovarien mit Entgleisungen des Energiestoffwechsels im Zusammenhang stehen. So gehen der Erkrankung neben den beschriebenen signifikant erhöhten Ketonkörper- auch sehr hohe FFS-Konzentrationen voraus, welche signifikant different im Vergleich zu den gesunden Tiere sind und sich am 28. d p.p. zum Teil deutlich von den restlichen Erkrankungsgruppen und der Zwillingsträchtigkeit abheben. Bei so hohen Ketonkörperkonzentrationen im Blut ist es weiterhin denkbar, im Sinne der Schnelldiagnostik Ketonkörper im Harn nachzuweisen und gefährdete Kühe auf diese Weise rechtzeitig zu erkennen. Die Glucosekonzentrationen im Serum bleiben bis zur Kalbung auf stabilem Niveau und fallen post partum in allen Gruppen signifikant unter die Ausgangskonzentration vom 28. d p.p. Diese Tatsache entspricht Beobachtungen von KUNZ et al. (1985) sowie VAZQUEZ-ANON et al. (1994). Zu beiden Zeitpunkten des Stoffwechsels ante partum zeigen Kühe mit Tot- und Schwergeburten eine im Vergleich zu der gesunden Gruppe signifikant erhöhte Glucosekonzentration im Serum. Die hohen Glucosekonzentrationen in den Gruppen Gebärparese, Tot-, Schwer- sowie Frühgeburt zum Zeitpunkt 3. d p.p. sind durch den mit diesen Erkrankungen verbundene Stresseinfluss erklärbar. 79 Diskussion KOVACS et al. (1995) sowie LAM et al. (1997) wiesen einen Zusammenhang zwischen verminderten Glucose- und Insulinkonzentrationen im Blut an Labmagenverlagerung erkrankter Kühe mit einem erniedrigten Nervus-vagus-Tonus nach, welcher unter anderem für die Ätiologie der Erkrankung verantwortlich gemacht wird (LAM et al. 1997, VAN WINDEN et al. 2003). Diese Parameterveränderungen können in vorliegender Untersuchung nicht beobachtet werden. Die Insulinkonzentrationen verdeutlichen den „peripartalen Diabetes der Milchkuh“ (FÜRLL 1997, STAUFENBIEL et al. 2005). Der Zustand des „Diabetes-like-state“ dient der Anpassung des Stoffwechsels an Belastungssituationen und ist bereits ante partum und besonders während der Frühlaktation bis 4 Wochen post partum durch eine eingeschränkte Insulingewebsempfindlichkeit (STANGASSINGER 1985) in Verbindung mit niedrigen Insulinkonzentrationen im Serum (BELL 1995, BEAM u. BUTLER 1997, VERNON 2002) gekennzeichnet. Die Ergebnisse der Insulinbestimmung lassen diese Abnahme der Serumkonzentrationen bis einen Monat nach der Kalbung in allen Gruppen deutlich erkennen. So sind die Insulinkonzentrationen am 28. d p.p. bei allen Gruppen (ausgenommen Frühgeburt) signifikant niedriger als im vergleichbaren Zeitraum vor der Kalbung. Die Bilirubinkonzentration korreliert stark mit der FFS-Konzentration im Serum. Somit zeigt sich ein ähnlicher Verlauf der beiden Parameter. Die kurz vor der Kalbung auftretenden hohen FFS-Konzentrationen von Kühen mit Zwillingsträchtigkeiten führen auch in der Bilirubinkonzentration am 10. d a.p. zu einer signifikanten Differenz dieser Gruppe gegenüber den gesunden Tieren. Ansonsten zeigt sich der Stoffwechsel ante partum in Bezug zu diesem Parameter unauffällig. Am 3. d p.p. folgt die Bilirubinkonzentration den starken Auslenkungen der BHB-/FFS-Konzentrationen in den Gruppen Labmagenverlagerung und Endometritis/Lochiometra mit einem Medianwert >10 µmol/l. Dies ist nach FÜRLL (1989) als Ausdruck einer gesteigerten Fettmobilisation zu werten. Der von NAYLOR et al. (1980) sowie von FÜRLL und SCHÄFER (1992) beschriebene pathophysiologische Zustand des Inanitionsikterus ist in der vorliegenden Untersuchung durch die Auslenkung der Bilirubinkonzentration aller Erkrankungsgruppen (ausgenommen Klauenerkrankung) zu beobachten. Die gesunden Kühe weisen von allen Gruppen am 3. d p.p. die niedrigsten Bilirubinkonzentrationen auf, aber erreichen mit dem Medianwert die Grenze von <5,0 µmol/l (FÜRLL 2005) zu diesem Zeitpunkt nicht. Einen Monat nach der Kalbung zeigt sich, dass besonders die Labmagenverlagerung mit erhöhten Bilirubinkonzentrationen im Zusammenhang steht. Die hohen BHB-Konzentrationen zum Zeitpunkt 28. d p.p. haben im Gegensatz zu den FFS-Konzentrationen am 3. d p.p. nur unwesentlich Einfluss auf die Bilirubinkonzentrationen im Serum der Kühe. 80 Diskussion FÜRLL (2005) versteht Cholesterol als indirekten Indikator der Futteraufnahme. Dies konnte durch die eigenen Untersuchungen anhand des zeitlichen Verlaufes der Cholesterolkonzentrationen bestätigt werden. So kommt es nach stetiger Konzentrationsabnahme um den Kalbezeitraum durch die eingeschränkte Futteraufnahme zu den niedrigsten Konzentrationen (<2,5 mmol/l), was mit Beobachtungen von TEUFEL (1999), KASTNER (2002) und ARNDT (2004) übereinstimmt. Wie von VAN SAUN (2004) festgestellt, führen auch in den vorliegenden Ergebnissen die nach der Abkalbung auftretenden Erkrankungen im Durchschnitt gegenüber den gesunden Kühen zu niedrigeren Cholesterolkonzentrationen im Serum. Dies ist besonders bei Labmagenverlagerung und Endometritis/Lochiometra im Vergleich zu den restlichen Tieren ersichtlich. 5.4.2 Eiweißstoffwechsel Der Proteinstoffwechsel erweist sich nicht so aussagekräftig wie der Fett- und Energiestoffwechsel. Ante partum kommt es in allen Gruppen zu einer Abnahme der Gesamtproteinkonzentration und vom 3. d p.p. zum 28. d p.p. zu einem signifikanten Anstieg der Eiweißkonzentration. Dies bestätigt die Beobachtungen von TEUFEL (1999) und CASTILLO et al. (2005), welche die Konzentrationsänderungen einer verminderten Futteraufnahme vor der Kalbung und dem steigenden Energiebedarf zuschrieben. Der von ARNDT (2004) und WITTEK (2004) beschriebene Rückgang der Konzentration des Proteins mit der Kalbung kann auch in den Ergebnissen der vorliegenden Untersuchung bestätigt werden. Den Kühen mit Tot- und Frühgeburten geht im Zeitraum eines Monats vor der Abkalbung eine im Vergleich zu der gesunden Gruppe signifikant niedrigere Gesamtproteinkonzentration einher. Kühe mit späterer Endometritis/Lochiometra kennzeichnet kurz vor der Kalbung ebenfalls eine signifikant erniedrigte Eiweißkonzentration. Im Durchschnitt aller erkrankten Kühe ist die Gesamtproteinkonzentration ante partum und kurz nach der Kalbung niedriger als bei den gesunden Tiere, welches auf einen stärkeren Proteinkatabolismus hindeutet. Die Albuminkonzentration liegt im gesamten Kontrollzeitraum auf stabilem Niveau im Referenzbereich nach FÜRLL (2005). KIDA (2002) beobachtete nach konstanten Konzentrationen ante partum einen Anstieg der Albuminserumkonzentration im Verlauf der Frühlaktation. Dies kann in der vorliegenden Untersuchung zumindest bis einen Monat nach der Kalbung nicht eindeutig nachvollzogen werden. Die von VAN SAUN (2004) beschriebene, den Erkrankungen vorausgehende erniedrigte Albuminkonzentration im Blut bestätigt sich in den Ergebnissen der Gruppen nicht. Die Harnstoffkonzentrationen liegen am 3. d p.p. bei Kühen mit Labmagenverlagerung und Endometritis/Lochiometra sowie die Creatininkonzentration bei Labmagenverlagerung am 3. d p.p. am höchsten und damit auch signifikant höher als die der gesunden Tiere. 81 Diskussion Dabei kann die erhöhte Harnstoffkonzentration im Blut einem verstärkten Proteinkatabolismus infolge eines Energiemangelzustandes zugeschrieben werden (SCHOLZ 1990, FÜRLL 2004), welcher in den beiden Gruppen zu diesem Zeitpunkt besonders ausgeprägt ist. Ansonsten verhalten sich die beiden Parameter physiologisch. 5.4.3 Leberfunktionsparameter Die GLDH ist ein weitgehend leberspezifisches Enzym und somit für die Erkennung von Leberfunktionsstörungen von besonderer Bedeutung. Da die GLDH sehr sensitiv reagiert, geht man erst bei deutlicher Überschreitung des Referenzbereiches von einer Leberschädigung aus (LOTTHAMMER 1981, KRAFT u. DÜRR 2005). Die GGT-Aktivität reagiert relativ träge, verbleibt aber nach Schädigungen des Lebergewebes auf hohem Niveau (FÜRLL 2005). Eine AST-Aktivitätserhöhung resultiert aus Skelett-, Herzmuskel- oder Leberschädigungen (GRÜNDER 1991, FÜRLL 1997). Trotz der massiven Mobilisation von Körperfett und den Entgleisungen des Fett- und Energiestoffwechsel sind keine gravierenden Aktivitätserhöhungen der Leberenzyme damit verbunden. Dies beweist eine gute Kompensation der Einflüsse durch die Leber und deutet weder auf akute noch auf chronische Störungen der Leberfunktionen. Die Aktivitäten ante partum der Enzyme GLDH, GGT und AST liegen nach FÜRLL (2005) im physiologischen Bereich und lassen den Gruppen keine eindeutigen Unterschiede zuordnen. Zwischen der GLDH- und AST-Aktivität im Serum besteht eine höhere positive Korrelation als zwischen der Aktivität von GLDH und GGT. VAN SAUN (2004) beobachtete eine AST-Aktivitätserhöhung von erkrankten gegenüber gesunden Kühen und VAN WINDEN et al. (2003) beschrieb eine erhöhte Aktivität der AST im Zeitraum 10 Tage vor der klinischen Diagnose einer Labmagenverlagerung. Diese Tatsache konnte in der vorliegenden Untersuchung nicht bestätigt werden. So gehen der Erkrankung Dislocatio abomasi weder im Stoffwechsel vor der Kalbung noch am 3. d p.p. deutliche Aktivitätserhöhungen der Leberenzyme voraus und auch die erkrankten Gruppen allgemein (ausgenommen Gebärparese am 3. d p.p.) zeigen keine höheren Leberenzymaktivitäten im Vergleich zu den gesunden Kühen. Die sehr hohe AST-Aktivität von fest-liegenden Kühen am 3. d p.p. ist myogenen Ursprungs und korreliert stark (r=0,82, p≤0,01) mit der CK-Aktivität zu diesem Zeitpunkt. Erst einen Monat nach der Kalbung wird deutlich, dass die Erkrankung Labmagenverlagerung mit einer Belastung der Leber einhergeht, da am 28. d p.p. alle Leberenzyme gegenüber der gesunden Gruppe signifikant erhöht sind und die GLDH- sowie die AST-Aktivitäten über der physiologischen Grenze (FÜRLL 2005) liegen. In den Krankheitsgruppen zeigt sich weiterhin, dass Klauenerkrankungen in Verbindung mit einer Leberbelastung stehen. Die von SATTLER und FÜRLL (2002) beschriebenen AST-Aktivitätserhöhungen infolge von Uterusschädigungen können in den Ergebnissen der vorliegenden Studie nicht beobachtet werden. 82 Diskussion 5.4.4 Mineralstoffwechsel Die Natrium-, Kalium und Chloridkonzentrationen verhalten sich in vorliegender Untersuchung unauffällig. BIALEK et al. (1998) beobachteten eine Abnahme der Kaliumkonzentration bei Kühen mit späterer Labmagenverlagerung am 3. d p.p. in den hypokalämischen Bereich sowie bei diesen Kühen auftretende erniedrigte Chlorid- und Calciumkonzentrationen bis zu 3 Wochen nach der Kalbung. Diese Veränderungen können durch die vorliegenden Ergebnisse nicht bestätigt werden. Zum 28. d p.p. kommt es bei allen Gruppen zu einer teilweise deutlichen Abnahme der Chloridkonzentrationen. Der zeitliche Verlauf der Calciumkonzentrationen offenbart in allen Gruppen eine deutliche, signifikante Abnahme der Konzentrationen im Serum am 3. d p.p. Das Auftreten dieser „physiologischen Hypocalcämie“ (KRAFT u. DÜRR 2005) ist dem erhöhten Calciumverlust in die Milch bei Einsetzen der Milchproduktion zuzuschreiben (SATTLER 2001, RICKEN 2005). In der Gruppe der Gebärparese ist am 10. d a.p. noch kein Rückgang der Calciumkonzentration zu verzeichnen, sie gleicht der bei den gesunden Kühen. Dies ist als Hinweis dafür zu verstehen, dass die Erkrankung 1 d vor bis 3 d nach der Kalbung auftritt (STAUFENBIEL 2002) und somit ist der 10. d a.p. noch zu früh, um Veränderungen des Mineralstoffwechsels in Hinblick auf den genannten Parameter zu erkennen. Die am 3. d p.p. im Referenzbereich liegende Calciumkonzentration bei Kühen mit Gebärparese erklärt sich durch die erfolgte Infusionstherapie. Die anorganischen Phosphatkonzentrationen folgen im Verlauf den Calciumkonzentrationen der Gruppen mit zum Teil deutlicher Abnahme der Konzentration am 3. d p.p. und belegen somit die von KLEE (2004) beschriebene temporäre Absenkung der beiden Parameter im unmittelbaren Zeitraum um die Kalbung. Die erhöhten Phosphatkonzentrationen festliegender Kühe zu diesem Zeitpunkt liefern Hinweise auf den Behandlungseffekt. Die vorliegenden Ergebnisse deuten übereinstimmend nach STAUFENBIEL (2002) und KLEE (2004) auf keine kausale Bedeutung der Hypophosphatämie an dem Erkrankungskomplex „Festliegen“. SCHRODER et al. (1995) und STAUFENBIEL (2005a) sehen die Hypophosphatämie als Folge einer gestörten Futteraufnahme an. Damit ist die in der Untersuchung unmittelbar post partum auftretende deutliche Abnahme der anorganischen Phosphatkonzentration im Serum der Kühe erklärbar. Mit der Kalbung kommt es bei fast allen Gruppen zu einem signifikanten Rückgang der Eisenkonzentrationen im Serum. Dieses Absinken wird besonders bei den Erkrankungsgruppen (ausgenommen Klauenerkrankungen) und den Zwillingsträchtigkeiten deutlich und ist mit dem Verbrauch des Transportproteins Transferrin erklärbar. ARNDT (2004) beschreibt die statistisch gesicherte negative Korrelation der Eisen- zur Haptoglobinkonzentration. 83 Diskussion Auch GOERRES und FÜRLL (2002) stellten in ihren Untersuchungen fest, dass „der Abfall der Eisenkonzentration am 3. d p.p. mit den höheren Konzentrationen an Haptoglobin im Serum in Einklang stehen“ und Eisen durch die Bindung an das „negative Akut-PhaseProtein Transferrin“ dessen Bewegungen folgt. 5.4.5 Creatinkinase, Alkalische Phosphatase Die Gruppe Labmagenverlagerung am 28. d a.p. und Kühe mit Endometritis/Lochiometra zu beiden Zeitpunkten im Stoffwechsel ante partum zeigen tendenziell höhere CK-Aktivitäten. Mit der Kalbung kommt es bei allen Gruppen zu einem Aktivitätsanstieg. Am 3. d p.p. ist die CK-Aktivität bei festliegenden Kühen deutlich erhöht und korreliert stark (r=0,82, p≤0,01) mit der AST-Aktivität, welche bei der Gebärparese ebenfalls zu diesem Zeitpunkt eine sehr hohe Aktivität aufweist, wobei der leberspezifische Anteil der AST dabei in den Hintergrund tritt (SATTLER 2001). Dieser Zusammenhang erklärt sich durch die gemeinsame Freisetzung der beiden Enzyme aus geschädigten Muskelzellen (WYSS u. KADDURAH-DAOUH 2000). Die gesunde Gruppe (Medianwert 142 U/l) zeigt am 28. d p.p. zusammen mit den Klauenerkrankungen (Medianwert 141 U/l) die höchsten CK-Aktivitäten. Die in der Literatur (SATTLER u. FÜRLL 2002) beschriebene CK-Aktivitätssteigerung im Serum von Kühen mit Labmagenverlagerung und Endometritis/Lochiometra kann in vorliegenden Ergebnissen nicht beobachtet werden. Allerdings führt die Schwergeburt zu einer signifikanten Erhöhung der CK-Aktivität am 3. d p.p. Dies lässt Rückschlüsse auf den in der Literatur beschriebenen (SATTLER u. FÜRLL 2004) engen Zusammenhang zwischen dem Uteruszustand und der CK-Aktivität im Blut der Kühe zu, da Geburtsstörungen mit einer starken Belastung des uterinen Gewebes einhergehen. Die Aktivität der AP ist im Kontrollzeitraum besonders bei festliegenden Kühen gering und zu allen 4 Zeitpunkten signifikant niedriger im Vergleich zu der bei der gesunden Gruppe. Dieses Phänomen beschreibt auch ECKERMANN (2005), welche vor der Kalbung statistisch gesicherte niedrigere AP-Aktivitäten von Kühen mit Gebärparese gegenüber gesunden beobachtete. Diese Tatsache deutet auf eine „verminderte Synthese des Knochenisoenzyms der AP, wobei besonders in der Trockenstehphase der Knochenstoffwechsel erniedrigt und somit die Möglichkeit einer ausreichenden Calciummobilisation aus dem Knochen zur Deckung des erhöhten Bedarfes bei der Geburt eingeschränkt ist“ (ECKERMANN u. FÜRLL 2005). Zur Klärung dieses Phänomens erscheint eine weiterführende Isoenzymbestimmung der AP-Aktivität im Serum und die Untersuchung der Osteoblasten-/-klastenaktivität von Knochenbioptaten festliegender Kühe im Vergleich zu gesunden als sinnvoller Lösungsansatz. 84 Diskussion 5.5 Endokrine Parameter Im Verlauf des letzten Drittels der Trächtigkeit kommt es im Sinne der Geburtsvorbereitung zu einer vermehrten Östrogenproduktion, so dass kurz vor der Kalbung ein Gipfel erreicht wird (SCHNURRBUSCH et al. 2003). So ist in der vorliegenden Untersuchung die Östradiolkonzentration am 10. d a.p. signifikant höher als zum ersten Kontrollzeitpunkt. Mit der Kalbung ist eine signifikante Abnahme der Steroidhormonkonzentrationen verbunden. Dies entspricht den Beobachtungen von RADCLIFF et al. (2003). Zwischen den einzelnen Gruppen bestehen keine statistisch zu sichernde Unterschiede in den jeweiligen Östradiolkonzentrationen. Die IGF-1 Konzentration im Plasma korreliert direkt mit der Energiebilanz (McCAFFERY et al. 2000, VAN DEN HURK u. ZHAO 2005). IGF-1 hat am Ovar eine gonadotrope Wirkung (LUCY 2000) und führt durch die Verstärkung der FSH- und LH-Wirkung zum Wachstum und zur Differenzierung der Follikel (LUCY 2000, ARMSTRONG et al. 2002, TAYLOR et al. 2004). Bleibt dies aus, können als Folge Ovarialzyste(n) resultieren (AURICH et al. 1996). Kühe mit späteren Ovarialzysten zeigen ante partum im Vergleich zur gesunden Kontrollgruppe eine signifikant niedrigere Konzentration des insulinähnlichen Wachstumsfaktors und als einzige Gruppe schon vor der Kalbung IGF-1 Konzentrationen <10 ng/ml. Damit kann aufgezeigt werden, dass der Erkrankung schon im frühen Stoffwechsel ante partum statistisch gesichert erniedrigte IGF-1 Konzentrationen vorausgehen, welche nur bei Zwillingsträchtigkeiten auf ähnlich niedrigem Niveau zu beobachten sind. Auch HIPPEL (2000) sowie KAULFUß et al. (2004) wiesen eine signifikante positive Korrelation zwischen der IGF1 Konzentration im Blutplasma zur Ovulationsrate der Follikel im Zyklus bei Schafen nach und folgerten daraus, dass IGF-1 bei der Differenzierung und Selektion der ovulatorischen Follikel involviert ist. Diese Erkenntnis kann in der vorliegenden Untersuchung indirekt bestätigt werden, da ein Mangel an IGF-1 die Ausbildung von Ovarialzysten bedingt. Die Abkalbung geht in allen Gruppen mit einer deutlichen Verringerung der IGF-1 Konzentrationen im Plasma einher, welches den Beschreibungen von NIKOLIC et al. (2003) sowie RADCLIFF et al. (2003) entspricht. In der vorliegenden Untersuchung fallen die Medianwerte aller Gruppen am 3. d p.p. unter die Sensitivitätsgrenze des zur Bestimmung verwendeten Enzymimmunoassay von 10 ng/ml und verbleiben (mit Ausnahme der Tot- und Frühgeburten) einen Monat post partum auf diesem Niveau. Damit liegen die IGF-1 Konzentrationen deutlich unter den von RADCLIFF et al. (2003) gemessenen IGF-1 Plasmakonzentrationen, welche bei Untersuchungen von 65 Holstein-Friesian Kühen am 5. d p.p. die niedrigsten Konzentrationen zwischen 30-40 ng/ml nachweisen konnten mit einem signifikanten Konzentrationsanstieg zum 14. d p.p. Die dazu im Vergleich geringen IGF-1 Konzentrationen der vorliegenden Studie sind in dem Ausmaß der negativen Energiebilanz begründet. 85 Diskussion LUCY (2003), TAYLOR et al. (2004) und WEBB et al. (2004) machten niedrige Konzentrationen des insulinähnlichen Wachstumsfaktors für Störungen des physiologischen Sexualzyklus und der Konzeption verantwortlich. Dies erklärt, im Zusammenhang mit der ausgeprägten negativen Energiebilanz und der resultierenden starken Körperkonditionsabnahme in der Frühlaktation, die verlängerte mittlere RZ von 88 Tagen sowie die zu hohe ZTZ von 125 Tagen im Bestand. TAYLOR et al. (2004) beobachteten höhere IGF-1 Konzentrationen im Plasma von Färsen als bei Kühen. Dies kann in der vorliegenden Studie nicht bestätigt werden (Anhang Tab. B.14-B.15). Lediglich Färsen mit Mastitiden und Nachgeburtsverhaltungen zeigen höhere Konzentrationen als Kühe mit den gleichen Erkrankungen. 5.6 Harnuntersuchung Zur Beurteilung des Säuren-Basen-Haushaltes wurden in vorliegender Untersuchung die NSBA-Ausscheidung nach KUTAS (1966) und der Harn pH-Wert bestimmt. Die NSBABestimmung ist zur Diagnose von Azidosen (LACHMANN et al. 1985) und Alkalosen (SCHÄFER et al. 1980) gut geeignet und offenbart Störungen des Säuren-Basen-Haushaltes früher als entsprechende Blutuntersuchungen (ENEMARK u. JØRGENSEN 2000). Die Ergebnisse zeigen bei allen Gruppen signifikant höhere NSBA-Konzentrationen am 28. d p.p. als vor der Kalbung, welche mit dem Einsatz von sauren Salzen zur Gebärpareseprophylaxe in der Trockenstehration zu erklären sind (OETZEL et al. 1998, STAUFENBIEL 2005b). Den Erkrankungen Labmagenverlagerung und Ovarialzysten gehen vor der Kalbung statistisch gesichert erniedrigte NSBA-Konzentrationen voraus. Dies kann als azidotische Belastung (LACHMANN et al. 1985) oder als Folge einer verminderten Futteraufnahme und damit verbunden einer reduzierten Kaliumausscheidung (FÜRLL et al. 1997) gewertet werden. Kühe mit Mastitis, Ovarialzysten und Frühgeburten weisen einen Monat nach der Kalbung eine alkalische Stoffwechsellage mit Konzentrationen >200 mmol/l auf. Die gemessenen pH-Werte liegen bei allen Gruppen im engen regulativen Bereich von 7,98,3. Dies entspricht Beobachtungen von BENDER (2002). Auch LUNN et al. (1990) sehen in der pH-Wert Messung lediglich einen qualitativen und keinen quantitativen Indikator für die H+-Ausscheidung. Der Einsatz von sauren Salzen vor der Kalbung führt bei allen Kühen zu einer Ansäuerung des Harns im Vergleich zum 28. d p.p., weiterhin beschreibt BENDER (2002) eine Abnahme des pH-Wertes 3 Wochen vor der Kalbung und einen pH-Wert Anstieg im Laufe der Laktation. 86 Diskussion 5.7 Wesentliche Stoffwechselbefunde ausgewählter Gruppen Bei der gesunden Gruppe tritt nach der Abkalbung ein Körperkonditionsverlust mit Verringerung auf eine Minimalkondition auf, welche deutlich unter der von SCHROEDER (2000) beschriebenen tolerablen Grenze liegt. Der Autor macht Unterschreitungen von 13 mm RFD für Fruchtbarkeitsprobleme verantwortlich und sieht Konditionswerte <10 mm RFD mit Leistungseinbußen in Form erniedrigter Milchmenge und Milchinhaltsstoffe verbunden. Die Körperkonditionsentwicklung der gesunden Kühe spiegelt sich auch in deren Ketonkörperkonzentrationen einen Monat nach der Kalbung wider. Dabei liegen zu diesem Zeitpunkt der Medianwert, 76% der Einzelwerte und auch der Quartilbereich der BHB-Konzentration über der von FÜRLL (2005) gesetzten oberen Toleranzgrenze von <0,6 mmol/l und somit im subklinisch-ketotischen Bereich. Dass diese Referenzgrenze der Ketonkörperkonzentration im vergleichbaren Zeitraum nach der Kalbung eingehalten werden kann, verdeutlichen Untersuchungen gesunder Kühe von WILKEN (2003). Ähnliches gilt für die CK-Aktivität der gesunden Gruppe am 28. d p.p., welche mit Medianwert und Quartilbereich über der oberen Toleranzgrenze von <100 U/l liegt (FÜRLL 2005). Die Kühe gelten als klinisch gesund, da keinerlei klinisch manifeste Stoffwechselstörungen oder sonstige Krankheitssymptomatik in dem definierten Zeitraum zu beobachten war. Allerdings muss der Begriff „gesund“ jedoch nach dem Bewertungssystem der Stoffwechselkontrolle (ROSSOW u. HORVATH 1988, KRAFT u. DÜRR 2005) als relativ verstanden werden und die Kühe sind eher als Vergleichsgruppe im Bestand anzusehen. Die Gruppe der Mastitis charakterisiert eine im Vergleich zur gesunden Kontrollgruppe signifikante Erhöhung der FFS-Konzentration am 10. d a.p. in Verbindung mit erhöhten Glucose- und erniedrigten Cholesterolkonzentrationen. Dies deutet auf eine vorhandene Mobilisation ante partum, welche noch einen Monat nach der Kalbung durch erhöhte FFS- und Ketonkörperkonzentrationen zum Ausdruck kommt. GOFF und HORST (1997), HOEBEN et al. (1997) sowie FÜRLL (2002) sehen in einer Energiemangelsituation und einer damit verbundenen ketotischen Stoffwechsellage negative Auswirkungen auf das Immunsystem. Folge ist unter anderem eine erhöhte Infektionsanfälligkeit und negative Beeinträchtigung der Eutergesundheit. Auch OLTENACU et al. (1994) und JANOSI et al. (2003) wiesen infolge erhöhter Ketonkörperkonzentrationen ein gesteigertes Erkrankungsrisiko an klinischer Mastitis nach. Kühe mit Dislocatio abomasi weisen mit 10 mm RFD die höchste Differenz der RFDMesswerte zwischen dem 3. d p.p. und dem 28. d p.p. auf, welches einer täglichen Mobilisationsrate von ca. 0,4 mm RFD/d entspricht. Der Medianwert der FFS-Konzentration in dieser Gruppe ist am 3. d p.p. >1200 µmol/l und damit signifikant different zu allen anderen Gruppen. Auch der Quartilbereich der BHB-Konzentration im Serum der Kühe ist zu diesem Zeitpunkt am höchsten. Weiterhin lässt sich der Inanitionsikterus (FÜRLL und SCHÄFER 87 Diskussion 1992) anhand der Bilirubinauslenkung erkennen. Diese Tatsachen belegen sehr deutlich die Bedeutung des FMS am Erkrankungskomplex und prädisponieren in vorliegender Untersuchung den 3. d p.p. zur Vorhersage des Risikos einer späteren Labmagenverlagerung. LeBLANC (2005) beschreibt eine signifikante Abweichung der FFS-Konzentration ante partum zwischen Kühen mit Labmagenverlagerung und der gesunden Kontrollgruppe. Diese Beobachtung kann in vorliegender Untersuchung nicht statistisch gesichert werden, tritt aber tendenziell auf. Der in der Literatur (FÜRLL und KLEISER 1998b, GEISHAUSER et al. 2000, ØSTERGAARD und GRÖHN 2000, ROSSOW 2001, VAN WINDEN et al. 2003) beschriebene Anstieg der Ketonkörperkonzentration im Vorfeld der Erkrankung kann bestätigt werden. Eine der Labmagenverlagerung vorausgehende AST-Aktivitätserhöhung (GEISHAUSER et al. 1998, FÜRLL u. KLEISER 1998b, VAN WINDEN et al. 2003) am 3. d p.p. trat nicht auf. Der signifikante Anstieg der AST- und GLDH-Aktivität einen Monat post partum ist als eine der Dislocatio abomasi nachfolgende Leberbelastung zu interpretieren. Der Erkrankung Labmagenverlagerung geht am 10. d a.p. im Vergleich zu den gesunden Kühen eine signifikant erniedrigte NSBA-Konzentration voraus. Dies ist durch eine zurückgehende Futteraufnahme erklärbar. Damit sinkt die Menge des aufgenommenen Kaliums, die Basenausscheidung wird reduziert und die NSBA-Konzentrationen sinken (HÖRÜGEL u. FÜRLL 1998). Die Erkrankung an Gebärparese ist am 3. d p.p. mit, im Vergleich zur gesunden Kontrollgruppe, signifikant erhöhten BHB-, FFS- und Bilirubinkonzentrationen verbunden. Die daraus ersichtliche Belastung des Energiestoffwechsels tritt erst nach der Kalbung auf. Somit können die von FÜRLL und HOOPS (2000) beobachteten, bereits während der Trockenstehphase bestehenden, Entgleisungen des Energiestoffwechsels und Säuren-Basen-Haushaltes bei festliegenden Kühen nicht bestätigt werden. Signifikante Veränderungen der Calcium- und Phosphatkonzentrationen bei Gebärparese in Bezug zu den bei gesunden Kühen konnte zu keinem Zeitpunkt beobachtet werden. Hierfür erweist sich der 10. d a.p. als ein zu früher Zeitpunkt. Die vorliegende Untersuchung verdeutlicht, dass bei festliegenden Kühen schon im frühen Stoffwechsel ante partum eine im Vergleich zu der in der gesunden Kontrollgruppe signifikant erniedrigte Aktivität der Alkalischen Phosphatase besteht. Dies bestätigt die Beobachtungen von LAPPETELAINEN et al. (1993) und ECKERMANN (2005), welche einen proportionalen Zusammenhang zwischen der im Serum gemessenen APAktivität und der Osteoblastenaktivität im Knochen vermuten. Die AST- und CK-Aktivitätserhöhung am 3. d p.p. ist myogenen Ursprungs und durch die Enzymfreisetzung aus geschädigten Muskelzellen erklärbar. Endometritis/Lochiometra geht mit einer beginnenden Mobilisation der Fettreserven ante partum (Differenz RFD-Messung 10. d a.p. zum 3. d p.p.) und einer starken Belastung des Energiestoffwechsels einher, welche sich schon am 10. d a.p. durch eine signifikant erhöhte 88 Diskussion FFS-Konzentration und am 3. d p.p. ebenfalls durch eine erhöhte FFS- und stark erhöhte BHB-Konzentration (beide signifikant zur gesunden Gruppe) äußert. Diese ketotische Stoffwechselsituation wirkt sich negativ auf das Immunsystem aus (GOFF u. HORST 1997, HOEBEN et al. 1997, FÜRLL 2002a) und führt somit zu einer erhöhten Infektanfälligkeit des Uterus. Des Weiteren steht eine erhöhte Ketonkörperkonzentration mit Wehenschwäche und einer verzögerten Uterusinvolution im Zusammenhang (FÜRLL 2006). In dieser Erkrankungsgruppe ist der von FÜRLL und SCHÄFER (1992) beschriebene pathophysiologische Zustand des Inanitionsikterus am 3. d p.p. erkennbar. Tendenziell gehen der Endometritis/Lochiometra schon im Stoffwechsel ante partum erhöhte CK-Aktivitäten im Serum voraus, welche aber nicht statistisch zu sichern sind. Die von SATTLER und FÜRLL (2002) beobachtete CK-Aktivitätssteigerung infolge von Puerperalstörungen kann in vorliegender Untersuchung nicht beobachtet werden. Kühe mit Ovarialzysten sind in der Trockenstehperiode im Vergleich zu den anderen Gruppen am höchsten konditioniert. Diese Tatsache gleicht Beobachtungen von MÖSENFECHTEL et al. (2000) und HASLER (2003). Aufgrund der Differenz der RFDMessungen zwischen 10. d a.p. und 3. d p.p. ist von einer beginnenden Mobilisierung der Körperfettreserven ante partum auszugehen. Nach der Abkalbung tritt bei Kühen mit Ovarialzysten die zweithöchste Mobilisationsrate auf. Der Erkrankung gehen schon am 3. d p.p. starke Belastungen des Energiestoffwechsels voraus, welche sich in einer erhöhten FFSund Bilirubin- sowie der stark erhöhten Ketonkörperkonzentration im Serum der Kühe äußert. Einen Monat nach der Kalbung verstärken sich die Entgleisungen zunehmend. ZEHRUN (2002) belegte die Bedeutung der Lipidmobilisation für die Genese zystischer Ovardegenerationen. Danach waren betroffene Kühe einer latent azidotischen sowie ketotischen Stoffwechsellage 6-10 Wochen post partum ausgesetzt. In der vorliegenden Studie kann belegt werden, dass an Ovarialzysten erkrankte Kühe schon im Vergleich zu gesunden Kontrolltieren kurz nach der Kalbung statistisch gesichert eine ausgeprägte negative Energiebilanz aufweisen, welche sich im fortschreitenden Zeitraum post partum verstärkt. Auch VAN KNEGSEL et al. (2005) sehen hohe FFS- sowie BHB-Plasmakonzentrationen und erniedrigte Glucosekonzentrationen im Zusammenhang mit abnehmenden Fruchtbarkeitsleistungen, wobei in der vorliegenden Untersuchung die Glucosekonzentration von Kühen mit Ovarialzysten im Referenzbereich nach FÜRLL (2005) liegt. Dem Auftreten von Ovarialzysten geht zusammen mit der Störung des Energiestoffwechsels weiterhin eine signifikant erniedrigte NSBA-Konzentration vor der Kalbung voraus und somit kann die von ZEHRUN (2002) beobachtete azidotische Belastung schon am 10. d a.p. statistisch gesichert werden. Ante partum bestehen bereits zu beiden Kontrollzeitpunkten signifikant erniedrigte IGF-1 Konzentrationen. 89 Diskussion Die Totgeburt übt den stärksten Einfluss auf die klinischen Parameter peripartal aus. Dabei führt die längere Verweildauer des toten Fötus im Uterus zu einer verstärkten Endotoxinanflutung in Verbindung mit einer starken pathogenen Keimbelastung und somit zu einer Beeinträchtigung des Allgemeinbefindens der Mutterkuh (JÄKEL 2005a). Die Gruppen der Tot- und Schwergeburten weisen schon einen Monat vor der Kalbung mit Fortsetzung bis zum 3. d p.p. stetig erhöhte, zur gesunden Gruppe signifikant differente Glucosekonzentrationen auf. In Verbindung mit den hohen Insulinkonzentrationen deutet dies auf eine auftretende Insulinresistenz (STANGASSINGER 1985, BELL 1995, VERNON 2002), welche in den beiden Gruppen schon früh in der Trockenstehperiode zu beobachten ist. Die Schwergeburt führt zu einer signifikanten Erhöhung der CK-Aktivität am 3. d p.p. und bestätigt somit den engen Zusammenhang zwischen Uteruszustand und der Enzymaktivität (SATTLER u. FÜRLL 2002, 2004). Die vorliegende Untersuchung zeigt weiterhin, dass die Zwillingsträchtigkeit schon ante partum mit einer im Vergleich zu den gesunden Kühen signifikanten Erhöhung der FFSKonzentration einhergeht. Dies ist Ausdruck des von FÜRLL (2002), von SCHULZ und ILCHMANN (2002) sowie von LEONARD (2004) beschriebenen erhöhten Energiebedarfes infolge der Zwillingsgravidität. Der entstandene manifeste Energiemangel wird sichtbar anhand der erhöhten, signifikant differenten Ketonkörperkonzentration am 3. d p.p. in Verbindung mit Hyperglyc- und Hyperbilirubinämie. Die in der Literatur (ZEBERLE 1996, SCHULZ und ILCHMANN 2002, SHELDON 2004) beschriebene Neigung zum Auftreten einer Retentio secundinarum nach Zwillingsträchtigkeiten kann bestätigt werden. 90 Diskussion 5.8 Auswertung der Fütterung JEROCH et al. (1999) errechnen den täglichen energetischen Erhaltungsbedarf bei Milchkühen nach der Formel: 0,293 x kg Lebendmasse0,75 (MJ NEL/d). Nach ihren Angaben bedarf die Leistung 3,17 MJ/kg Milch. Dies bedeutet bei einer 500 kg schweren Milchkuh mit 30 kg Milch am Tag einen täglichen Energiebedarf von 126 MJ, welcher über die Ernährung gedeckt werden muss. Sowohl die gefütterten Tagesrationen der Hochleistungskühe ab April 2004 (Tab. 3.3) als auch die ab Dezember 2004 (Tab. A.1-A.2) liegen laut Rationsberechnung über dem oben berechneten energetischen Tagesbedarf. Bewertet man weiterhin die Kuh gleicher Körpermasse mit 40 l Milcheinstiegsleistung, so ergibt sich für die Fütterung ab April 2004 ein geringes Energiedefizit von 8 MJ, die gefütterte Ration ab Dezember 2004 ist diesbezüglich energetisch ausgeglichen. Der Rohproteinbedarf der Milchkuh von etwa 3000 g/d ist gewährleistet. Das Proteinenergieverhältnis liegt um 23 g Protein/1MJ NEL und entspricht damit den Empfehlungen (JEROCH et al. 1999). Es treten aber trotz korrekt berechneter Rationen beträchtliche Stoffwechselimbalancen auf. Somit ist das Bestandsproblem der massiven Mobilisierung von Körperfett nach der Abkalbung entweder durch Diskrepanz der Inhaltsstoffe der gefütterten TMR zur theoretischen Berechnung oder durch unzureichende Trockenmasseaufnahme der laktierenden Kühe erklärbar. Eine Analyse von Futtermittelproben der verschiedenen Produktionsstadien auf den energetischen Gehalt erscheint als sinnvoller Ansatz zur Problembehebung. Diese bietet auch aus produktiver Sichtweise durch Steigerung der Jahresmilchleistung erhebliches Potenzial, denn Stoffwechselgesundheit steht in Verbindung mit hoher Leistung und Tiergesundheit (JÄKEL 2005b). 91 Diskussion 5.9 Schlussfolgerungen Die durchgeführten Untersuchungen offenbaren ein Bestandsproblem, welches sich in einem massiven Verlust von Körperkondition nach der Kalbung und damit verbunden einer starken ketogenen Belastung im Stoffwechsel der Kühe äußert. Diese Tatsache ist mit negativen Auswirkungen auf die Tiergesundheit verbunden und verdeutlicht das Auftreten des FMS auf niedrigem Körperkonditionsniveau. Es muss prophylaktisch durch ein adäquates Management sowie dem Energiebedürfnis der Kühe in der Früh- und Hochlaktation gerechtwerdender Fütterung dem horrenden Körperkonditionsverlust Einhalt geboten werden. Trotz der teilweise erheblichen Belastungen des Fett- und Energiestoffwechsels ist die Leber in der Lage die Einflüsse zu kompensieren. Die FFS-Konzentration reflektiert im Gegensatz zu der Ketonkörperkonzentration im Serum schon 10 d a. p. die Erkrankungsgruppen wider und erweist sich somit als sensibler Indikator vor der Kalbung für das Risiko des Auftretens einer späteren Erkrankung post partum. Der Labmagenverlagerung am 3. d p.p. und der(n) Ovarialzyste(n) am 28. d p.p. gehen deutliche Entgleisungen des Energie- und Fettstoffwechsels voraus, welche vor allem aus der FFSund BHB-Konzentration im Serum zu den jeweiligen Zeitpunkten ersichtlich werden. Weiterhin gehen Geburts- und Puerperalstörungen bereits während der Trockenstehperiode subklinisch Energiestoffwechselstörungen voraus. Der 3. d p.p. bietet frühdiagnostisches Potenzial zur Erkennung der Krankheitsgefährdung einer Labmagenverlagerung und erweist sich deutlich aussagekräftiger als der 10. d a.p. Bei der Gebärparese können schon im frühen Stoffwechsel ante partum statistisch gesicherte signifikant erniedrigte Aktivitäten der AP beobachtet werden. Diese Erkenntnis ist im Sinne der frühdiagnostischen Erkennung gefährdeter Kühe zur prophylaktischen Behandlung nutzbar. Als weiterer frühdiagnostischer Parameter kann die schon im frühen Stoffwechsel ante partum nachgewiesene signifikant erniedrigte IGF-1 Konzentration von Tieren mit späteren Ovarialzysten angesehen werden. Die vorliegende Untersuchung zeigt außerdem, dass Zwillingsträchtigkeiten mit einer Belastung des Energie- und Fettstoffwechsels ante sowie peri partum einhergehen. So ist die FFS-Konzentration am 10. d a.p., die BHB-, FFS-, Glucose- und Bilirubinkonzentration am 3. d p.p. signifikant im Vergleich zu der gesunden Kontrollgruppe erhöht. Die Parameter des Proteinstoffwechsels und der Leberfunktion erwiesen sich in der vorliegenden Untersuchung ohne frühdiagnostische Aussagekraft. Signifikante Abweichungen waren weder in der Trockenstehphase, noch direkt nach der Kalbung zu beobachten. 92 Zusammenfassung 6 Zusammenfassung Verfasser Titel Klinik Eingereicht im Bibliographische Angaben Schlüsselworte: Gunter Hädrich Untersuchungen zu der Entwicklung der Körperkondition, dem peripartalen Stoffwechsel und der Morbidität von Hochleistungskühen Medizinische Tierklinik der Veterinärmedizinischen Fakultät der Universität Leipzig Juli 2006 96 Seiten, 39 Abbildungen, 12 Tabellen, 262 Literaturangaben, 4 Anhänge (24 Tabellen) Kühe, negative Energiebilanz, Morbidität, Mobilisierung, Körperkondition, frühdiagnostische Parameter Steigende Milchleistung geht bei Milchkühen mit immer stärkeren Stoffwechselbelastungen einher. Stoffwechselstörungen und damit gekoppelte Erkrankungen konzentrieren sich besonders auf den Zeitraum der Frühlaktation. Prophylaktischen Maßnahmen kommen deshalb erhebliche Bedeutungen im Sinne der Wirtschaftlichkeit und des Tierschutzes zu. Zielstellung vorliegender Untersuchung war vorwiegend die Fragestellung, ob sich Erkrankungen post partum (p.p.) bereits in der Trockenstehperiode bzw. vor deren klinischer Manifestation durch Stoffwechseluntersuchungen erkennen lassen. Zur Beantwortung dieser Frage wurden während eines Jahres bei insgesamt 969 SB-Kühen sowie -Färsen einer MVA mit einer durchschnittlichen Milchjahresleistung von 8950 kg sonographisch die Rückenfettdicke (RFD) am 56. d, 28. d, 10. d ante partum (a.p.) sowie am 3. d, 28. d, 56. d, 120. d p.p. gemessen. Für die Stoffwechselbeurteilung wurden Blutproben am 28. d und 10. d a.p. sowie am 3. d und 28. d p.p. entnommen und darin die Gesamtleukozytenzahl, Parameter des Energie- und Fettstoffwechsels (BHB, FFS, Glucose, Insulin, Bilirubin, Cholesterol, Lactat), des Proteinstoffwechsels (Gesamtprotein, Albumin, Harnstoff, Creatinin), der Leberfunktion (GLDH, GGT, AST), des Mineralstoffwechsels (Na, K, Cl, Ca, Pi, Fe, Mg), die Enzymaktivitäten der CK und AP sowie die Konzentration der endokrinen Parameter Östradiol und IGF-1 analysiert. Die am 10. d a.p. sowie am 28. d p.p. entnommenen Harnproben dienten der pH-Wert Messung und der Bestimmung der Netto-SäurenBasen-Ausscheidung (NSBA). Für die statistische Bearbeitung wurden folgende Gruppen (n) gebildet: Mastitis (25), Dislocatio abomasi (25), Gebärparese (25), Klauenerkrankung (25), Endometritis/Lochiometra (25), Retentio secundinarum (25), Ovarialzysten (25), Tot- (25) und Schwergeburten (25), Frühgeburten (12), Zwillingsträchtigkeiten (25) sowie gesunde Tiere (25). Für die Auswahl der gesunden Gruppe wurden folgende Kriterien postuliert: keine klinische Erkrankung bis 4 Monate p.p., RFD 27 mm, Leukozytenzahl zu allen Entnahmezeitpunkten <10 G/l. Die gesunden Kühe wiesen 28 d p.p. repräsentativ für den Gesamtbestand eine starke Abnahme der RFD und erhöhte BHB-Konzentrationen (x= ̃ 0,75 mmol/l) auf. 93 Zusammenfassung Der Dislocatio abomasi gingen am 3. d p.p. im Vergleich zu allen Gruppen die höchsten (p≤0,05) FFS-Medianwerte (>1200 mol/l) sowie erhöhte (p≤0,05) BHB- und Bilirubin-Konzentrationen voraus. 28 d p.p. bestanden weiterhin erhöhte BHB- und FFS-Konzentrationen sowie erhöhte (p≤0,05) GLDH-, AST- und CK-Aktivitäten. Die RFD nahm p.p. überdurchschnittlich ab. Kühe mit späterer Gebärparese hatten während der Trockenstehperiode erniedrigte AP-Aktivitäten (p≤0,001) sowie erniedrigte Bilirubinkonzentrationen. Bei Kühen der Gruppen Endometritis/Lochiometra und Retentio secundinarum gingen a.p. gesteigerte FFSBHB- und Glucose- (p≤0,05) Konzentrationen voraus. Am 3. d p.p. dominierten in beiden Gruppen signifikant veränderte FFS-, Bilirubin- und Ca- sowie Glucose-, Cholesterol und PiKonzentrationen außerhalb der Referenzwerte. Bei Tieren mit Retentio secundinarum blieben die FFS-Konzentrationen bis zum 28. d p.p. gesteigert (p≤0,05). Kühe mit späteren Ovarialzysten hatten 28 d a.p. erhöhte BHB-, Glucose- und Fe-Konzentrationen sowie CKAktivitäten, 10 d a.p. erhöhte CK- und erniedrigte IGF-1-Konzentrationen (p≤0,05). Am 3 d p.p. bestanden stärker veränderte Bilirubin-, Ca- sowie bis 28 d p.p. anhaltend erhöhte FFS- und BHB-Konzentrationen (p≤0,05). Die Gruppen Tot- und Schwergeburten zeigten während der Trockenstehperiode erhöhte Glucose- (p≤0,05) und FFS-Konzentrationen sowie gesteigerte CK-Aktivitäten. Zwillingstragende Kühe hatten a.p. gesteigerte FFS-Konzentrationen (p≤0,05), am 3. d p.p. Leukopenie, gesteigerte FFS-, BHB-, Glucose- und Bilirubinsowie verminderte Cholesterol- und Ca-Konzentrationen (p≤0,05) sowie bis 28 d p.p. anhaltend BHB-, AST- und CK-Abweichungen. Bei den Parametern des Proteinstoffwechsels und der Leberfunktion waren zu den kontrollierten Zeitpunkten in der Trockenstehphase keine Abweichungen zwischen gesunden und kranken Rindern statistisch zu sichern. Diese besitzen somit kein frühdiagnostisches Potential in Hinblick auf das Risiko des Auftretens späterer Erkrankungen und erwiesen sich auch in der Frühlaktation als stabil. Die teilweise deutlichen Energiestoffwechselstörungen führten nicht zwangsläufig zu gesicherten Abweichungen von Leberfunktionsparametern. Es ist zu schlussfolgern, dass die meisten Erkrankungsgruppen schon a.p. durch Stoffwechselstörungen auffallen, besonders durch signifikant gesteigerte FFS- und Glucose-Konzentrationen. Am 3. d p.p. kommen hauptsächlich erhöhte BHB-, Bilirubin-Konzentrationen, CKAktivitäten und verminderte Ca- sowie Cholesterolkonzentrationen hinzu. Dies gilt besonders für Kühe mit Dislocatio abomasi. Fruchtbarkeitsstörungen kündigen sich bei Kühen mit späteren Ovarialzysten bereits 28 bzw. 10 d a.p. durch signifikant (p≤0,05) erniedrigte IGF1Konzentrationen an. Kühe mit Gebärparese fallen schon in der Trockenstehperiode durch stark erniedrigte AP-Aktivitäten (x< ̃ 45 U/l) auf. Somit lassen sich die genannten postpartalen Erkrankungen bereits a.p. selektiv subklinisch nachweisen. Diese Erkenntnis kann als Grundlage für einen Screening zur Früherkennung von Krankheitsdispositionen genutzt werden. 94 Summary 7 Summary Author Title Gunter Hädrich Investigations of the body condition development, the periparturient metabolism and the morbidity in high yielding dairy cows Large Animal Clinic for Internal Medicine, Faculty of Veterinary Medicine, University of Leipzig July 2006 96 pages, 39 figures, 12 tables, 262 references, 4 appendices (24 tables) cattle, negative energy balance, morbidity, mobilisation, body condition, early metabolic predictors Clinic Submitted in Bibliography Keywords: Increasingly higher milk yields in dairy cows are accompanied by a constant rise in metabolic stress. Resulting metabolic disorders and diseases are in particular seen in early lactation. Prophylactic measures have therefore considerable economic importance and are an animal welfare issue. The main target of the present investigation was the question, if post partum (p.p.) diseases can be already diagnosed by an investigation of the metabolism in the dry period and before their clinical manifestation, respectively. In answering this question at a total of 969 SB cows and heifers of one dairy farm with an average milk yield of 8950 kg per year were included. In all animals the back fat thickness (RFD) has been measured during one year on Days 56, 28, 10 ante partum (a.p.) as well as on Days 3, 28, 56 and 120 p.p. In addition blood samples have been taken on Days 28 and 10 a.p. as well as on Days 3 and 28 p.p. to monitor the total number of leukocytes, parameters of energy and fat metabolism (BHB, NEFA, glucose, insulin, bilirubin, cholesterol, lactate), protein metabolism (total protein, albumin, urea, creatinine), liver function (GLDH, GGT, AST), mineral metabolism (Na, K, Cl, Ca, Pi, Fe, Mg), enzyme activities of CK and AP as well as the concentration of endocrine parameters estradiol and IGF-1 were analysed. Finally urea samples taken on the Days 10 a.p. and 28 p.p. were collected for pH measurement and for determination of the net-acid-base status. The following groups (n) were formed for statistical comparison: mastitis (25), displaced abomasum (25), parturient paresis (25), digital diseases (25), endometritis/lochiometra (25), retained placenta (25), cystic ovarian diseases (25), stillbirth (25) and dystocia (25), premature parturition (12), twin pregnancy (25) and healthy animals (25). The following criteria have been defined for the selection of the healthy group: no clinical disease during the first 4 months after calving, RFD 27 mm, number of leukocytes at all times of sampling <10 G/I. However, even the healthy cows showed a considerable reduction of RFD and increased BHB concentrations (x= ̃ 0,75 mmol/l) on Day 28 p.p. representative of the total stock. Cases of displaced abomasum were preceded by the highest (p≤0,05) NEFA median values (>1200 µmol/l) as well as increased (p≤0,05) BHB and bilirubin concentrations on Day 3 p.p. 95 Summary in comparison to all other groups. BHB and NEFA concentrations as well as increased (p≤0,05) GLDH, AST and CK activities continued to Day 28 p.p. RFD showed an aboveaverage decrease in these animals. Cows which were later diagnosed with parturient paresis had lower AP activities (p≤0,001) as well as decreased bilirubin concentrations during the dry period. In cases of endometritis/lochiometra and retained placenta increased NEFA, BHB and glucose (p≤0,05) concentrations preceded were observed a.p. On Day 3 p.p. significantly changed NEFA, bilirubin and Ca as well as glucose, cholesterol and Pi concentrations were dominating out of reference. In animals with retained placenta NEFA concentrations continued to be increased until Day 28 p.p. (p≤0,05). Cows later diagnosed with ovarian cysts had increased BHB, glucose and Fe concentrations and also increased CK activities on Day 28 p.p. In addition they increased CK and decreased IGF-1 concentrations (p≤0,05) were observed on Day 10 p.p. However, on Day 3 p.p. significantly changed bilirubin, Ca concentrations as well as up to Day 28 p.p. continuously increased NEFA and BHB concentrations (p≤0,05) could also be observed. Cows in the groups diagnosed with stillbirth and dystocia showed increased glucose (p≤0,05) and NEFA concentrations as well as increased CK activities during the dry period. Cows being pregnant with twins had increased NEFA concentrations (p≤0,05) a.p., on Day 3 p.p. leukopenia, increased NEFA, BHB, glucose and bilirubin concentrations as well as reduced cholesterol and Ca concentrations (p≤0,05) and up to Day 28 p.p. continuously to be observed BHB, AST and CK deviations. Parameters of the protein metabolism and liver function showed no statistical significant differences between healthy and diseased cattle during the observation period. Thus, these parameters seem to not offer the advanage of an early diagnosis with regard to the risk of occurrence of later disease. In addition they also proved to be stable in the early lactation. Obviously the clinically significant consequences of disturbed energy metabolism did not necessarily lead to observable changes of liver function parameters. It is therefor concluded that most of the postpartal diseases in dairy cows as observed in this study can be noticed already a.p. by monitoring certain parameters of the metabolism, particularly NEFA and glucose concentrations. On Day 3 p.p. additional findings are increased BHB, bilirubin concentrations, CK activities and reduced Ca and cholesterol concentrations. This refers particularly to cows later diagnosed with displaced abomasum. Fertility disorders in form of ovarian cysts are already preceded 28 and 10 days a.p., respectively, by significantly (p≤0,05) decreased IGF1 concentrations. Cows with parturient paresis already demonstrate very low AP activities (x< ̃ 45 U/I) in the dry period. Hence, the postpartal diseases mentioned in this study can already be selectively predicted a.p. at a subclinical state. This finding might be used as basis for a screening to early diagnose a susceptibility to diseases. 96 Literaturverzeichnis 8 Literaturverzeichnis Abribat T, Lapierre H, Dubreuil P, Pelletier G, Gaudreau P, Brazeau P, et al. Insulin-like growth factor-1 concentration in Holstein female cattle: variations with age, stage of lactation and growth hormone-releasing factor administration. Dom Anim Endocrin. 1990; 7: 93-102. Albrecht E, Unglaub W. Zur Anwendung der GLDH–Bestimmung in Rinderproblembeständen. Tierärztl Umsch. 1992; 47: 427-30. Alsemgeest SPM. Blood concentrations of acute-phase proteins in cattle as markers for disease. Universität Utrecht. 1994; 5-9. Armstrong DG, Baxter G, Hogg CO, Woad KJ. Insulin-like growth factor (IGF) system in the oocyte and somatic cells of bovine preantral follicles. Reprod. 2002; 123: 789-97. Arndt A. Untersuchungen zur gesundheitsstabilisierenden Wirkung von am ersten Tag post partum appliziertem Flunixin-Meglumin und Dexamethason bei Kühen. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 2004. Aurich JE, Andresen P, Ahlers D. Fruchtbarkeitsstörungen. in: Grunert E (Hrsg.): Buiatrik Band I. 5. Aufl., Verlag M.&H. Scharper Alfeld-Hannover. 1996; 217-41. Baumgartner W. Ein Beitrag zur Frühdiagnose von Stoffwechselerkrankungen bei Hochleistungsrindern. Dtsch Tierärztl Wschr. 1979; 86: 336-43. Beam SW, Butler WR. Energy balance and ovarian follicle development prior to first ovulation postpartum in dairy cows receiving three levels of dietary fat. Biol of Reprod. 1997; 56: 133-42. Beede DK, Wang C, Risco CA, Donovan GA. Implementation of Cation-Anion Difference Concept in late pregnant dry cow ration. Vita Plus Corp Conf. 1992; 1-14. Bell AW. Regulation of organic nutrient metabolism during transition from late pregnancy to early lactation. J Anim Sci. 1995; 73, 2804-19. Bender S. Einsatz der Harnuntersuchung zur Beurteilung des Säure-Base- und Mineralstoffhaushaltes im Rahmen der prophylaktischen Bestandsbetreuung von Milchviehherden. [Dissertation med. vet.]. Berlin: Univ. Berlin; 2002. 97 Literaturverzeichnis Benz B. Kuhkomfort: Auch die Laufflächen nicht vernachlässigen. Nutztierpraxis Akt. 2003; 4, 4-8. Bergmann EN. Hyperketonemia - ketogenesis and ketone body metabolism. J Dairy Sci. 1971; 54: 936-48. Bialek N, Fürll M, Kirrbach H, Gruys E, Jäkel L, Krüger M. Verhalten Akuter Phasen Proteine sowie weiterer klinisch-chemischer Parameter im Vorfeld der Dislocatio abomasi (DA) bei Milchkühen. in: Fürll M (Hrsg.): Stoffwechselbelastung, -diagnostik und –stabilisierung beim Rind. Med Tierklinik Leipzig. 1998; 182-99. Bobe G, Young JW, Beitz DC. Invited review: pathology, etiology, prevention and treatment of fatty liver in dairy cows. J Dairy Sci. 2004; 87: 3105-24. Bostedt H, Bless S. Überprüfung einiger Verfahren zur Prophylaxe der Gebärparese beim Rind. Tierärztl Umsch. 1993; 48: 424-31. Bostedt H. Geburt und Nachgeburtsperiode. in: Bostedt H (Hrsg.): Fruchtbarkeitsmanagement beim Rind. 4. Aufl., Frankfurt am Main. 2003; 191-255. Brade W. Verhaltenscharakteristika des Rindes und tiergerechte Rinderhaltung. Prakt Tierarzt. 2002; 83: 716-23. Breymann N. Experimentelle Untersuchungen zum Einfluss der antepartalen Energieversorgung auf das postpartale Verhalten von Leistung, Fruchtbarkeit und Stoffwechselgesundheit der Milchkuh. [Dissertation med. vet.]. Berlin: Univ. Berlin; 1999. Brunk J. Untersuchungen über späteren Verbleib, Milchleistung und Fruchtbarkeit von Kühen mit konservativ und operativ behandelter rechtseitiger Labmagenverlagerung. [Dissertation med. vet.]. Hannover: TiHo. Hannover; 1993. Burton JL, Erskine RJ. Immunity and mastitis – Some new ideas for an old disease. Vet Clin North Am Food Anim Pract. 2003; 19: 1-45. Cameron RE, Dyk PB, Herdt TH, Kaneene JB, Miller R, Bucholtz HF, et al. Dry cow diet management and energy balance as risk factors for displaced abomasum in high dairy herds. J Dairy Sci. 1998; 81: 132-9. 98 Literaturverzeichnis Castellino P, Cataliotti A. Changes of protein kinetics in nephrotic patients. Curr Opin Clin Nutr Met Care. 2002; 5: 51-4. Castillo C, Hernandez J, Bravo A, Lopez-Alonso M, Pereira V, Benedito JL. Oxidative status during late pregnancy and early lactation in dairy cows. Vet J. 2005; 169:286-92. Cianzo DS, Topel DG, Whitehust GB, Beitz DC, Self HC. Adipose tissue growth in cattle representing two frame sizes: distribution among depots. J Anim Sci. 1982; 55: 305-12. Citil M. Untersuchungen zur Carnitinkonzentration und zu weiteren biochemischen Parametern im Blutserum bei Milchkühen mit besonderer Berücksichtigung der Dislocatio abomasi und von Puerperalstörungen. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 1999. Comin A, Gerin D, Cappa A, Marchi V, Renaville R, Motta M, et al. The effect of an acute energy deficit on the hormone profile of dominant follicles in dairy cows. Theriogen. 2002; 58: 899-910. Contreras LL, Ryan CM, Overton TR. Effects of dry cow grouping strategy and prepartum body condition score on performance and health of transition dairy cows. J Dairy Sci. 2004; 87: 517-23. Cox VS, Mc Grath CJ, Jorgensen SE. The role of pressure damage in pathogenesis of the downer cow syndrome. Am J Vet Res. 1982; 43: 26-31. De Kruif A. Störungen der Graviditätsdauer. in: Richter J, GÖTZE R (Hrsg.): Tiergeburtshilfe. 4. Auflage, Paul Parey Verlag Berlin und Hamburg. 1993; 190-208. De Kruif A. Fruchtbarkeit und Bestandsbetreuung. Fertilitätskontrollen sowie gynäkologische und peripartale Probleme beim Rind. DVG-Tagung Gießen. 1999; 5-8. Diederichs M. Untersuchungen zum Vorkommen der Labmagenverlagerung bei Rindern der Rasse Deutsche Schwarzbunte in Hessen. [Dissertation med. vet.]. Gießen: TiHo. Gießen; 1995. Dinges G. Untersuchungen zum antioxidativen Status bei verschiedenen Formen der Dislocatio abomasi des Rindes im Blut der V. jugularis und der V. epigastrica. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 2004. 99 Literaturverzeichnis Dingwell RT, Kelton DF, Leslie KE. Management of the dry cow in control of peripartum disease and mastitis. Vet Clin Food Anim. 2003; 19: 235-65. Dirksen G. Die Erweiterung, Verlagerung und Drehung des Labmagens beim Rind. Zbl Vet Med. 1961; 8(10): 935-1013. Dirksen G. Displacement of the abomasum. IXth Internat. Conference on Prod. Diseases in Farm Anim., Berlin Sept.1995; 63-7. Distl O. Verbesserung von Gesundheit als neues züchterisches Ziel in der Selektion auf Fundamentmerkmale beim Rind. Tierärztl Umsch. 1996; 51: 331-40. Doll K. Stoffwechselsituation in Milchviehherden mit hoher Leistung. 5. Berlin-Brandenburgischer Rindertag, Berlin Okt. 2004; Vortrag, 158-9. Dominci FP, Turyn D. Growth hormone-induced alterations in the insulin-signaling system. Exper Biol and Med. 2002; 227: 149-57. Drackley JK. Biology of dairy cows during the transition period: The final frontier? J Dairy Sci. 1999; 82: 2259-73. Drackley JK. The role of nutrition and management in prevention of metabolic disorders in periparturient dairy cows. BPT-Kongress Nürnberg, Nov. 2002; Vortragszusammenfassungen, 28-45. Drackley JK. Advances in transition cow biology: new frontiers in production diseases. 12th ICPD Brochure. 2004; www.12icpd.cvm.msu.edu. Drackley JK, Overton TR, Douglas GN. Adaptation of glucose and long-chain fatty acid metabolism in liver of dairy cows during the periparturient period. J Dairy Sci. 2001; 84: Suppl: 100-12. Duffield T. Subclinical ketosis in lactating dairy cattle. Vet Clin of North Am Food Anim Pract. 2000; 16: 231-53. Eckermann K. Labordiagnostische Unterschiede im Blutbild gesunder und an Gebärparese erkrankter Kühe. DVG-Tagung München, Februar. 2005, Vortrag. 100 Literaturverzeichnis Eckermann K, Fürll M. Beziehungen zwischen Gebärparese und Stoffwechsel in der Trockenstehperiode bei Kühen. 30. Fortbildungsveranst für Klin Labordiagnostik, Leipzig Juni. 2005; Vortrag, 25-6. Eddy RG, Davies O, David C. An economic assessment of twin births in British dairy herds. Vet Rec. 1991; 129: 526-9. Enemark JMD, Jørgensen RJ. Bestemmelse af netto syre-base ekskretion; kvaegurin: teari og praksis. Dansk Vet Schr. 2000; 83: 6-11. Engelhardt T. Hohe Milchleistung und gesunde Kühe. Geht das? Neue Landwirtsch. 2003; 5: 62-7. Engelhardt T. Fütterungseckpunkte vom Trockenstehen bis zur Frühlaktation. 3. Leipziger Tierärztekongress, Leipzig Jan. 2005; Vortrag. Erb HN, Gröhn YT. Epideminologie of metabolic disorders in the periparturient dairy cow. J Dairy Sci. 1988; 71: 2557-71. Eulenberger K. Physiologische und pathophysiologische Grundlagen für Maßnahmen zur Steuerung des Puerperiums beim Rind. [Habilschr. med. vet.]. Leipzig: Univ. Leipzig; 1984. Eulenberger K. Puerperium. in: BUSCH, W., J. SCHULZ (Hrsg.) Geburtshilfe bei Haustieren. Gustav Fischer Verlag Jena. 1993; 239-51. Eulenberger K, Wilhelm J, Schulz J, Gutjahr S, Wohamka K, Däberitz H. Uterotonika im Puerperium des Rindes. Mh Vet Med. 1986; 41: 371-7. Eulenberger K, Schulz J, Gutjahr S, Strohbach U, Strohbach C, Randt A. Beeinflussung der Geburt bei Schwein und Rind mit Oxytocin, Carbetocin und Carazolol. Wiener Tierärztl Monatsschr. 1993; 80: 276-9. Evertz C. Untersuchungen zur Stoffwechselsituation von Hochleistungskühen im peripartalen Zeitraum unter besonderer Berücksichtigung klinischer Erkrankungen. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 2006. 101 Literaturverzeichnis Fiedler A, Maierl J. DLG-Leitfaden Klauenkrankheiten. European Hoof Care, Euro Tier Hannover; Nov. 2004. Fourichon C, Seegers H, Malher X. Effect of disease on reproduction in the dairy cow: a meta-analysis. Theriogen. 2000; 53: 1729-59. Frahmen K, Graf F, Kräusslich H, Osterkorn K. Enzymaktivitäten in Rinderorganen. 2. Mitteilung: Organanalysen bei Holstein-Friesian-Kühen. Zbl Vet Med A. 1978; 25: 197-206. Freital J. Rekonvaleszenz und Verbleib von Kühen nach Behebung der linksseitigen Labmagenverlagerung mittels perkutaner Abomasopexie nach GRYMER und STERNER im Vergleich zur Omentopexie nach DIRKSEN. [Dissertation med. vet.]. Hannover: TiHo. Hannover; 2003. Fürll M. Vorkommen, Ätiologie, Pathogenese, Diagnostik und medikamentelle Beeinflussung von Leberschäden beim Rind. [Habilschr. med. vet.]. Leipzig: Univ. Leipzig; 1989. Fürll M. Fit und gesund in die neue Laktation. Milchrind. 1997; 6: 48-51. Fürll M. Das Fettmobilisationssyndrom. Großtierpraxis. 2000; 1: 24-34. Fürll M. Veränderter Charakter – unveränderte Bedeutung Ketose bei Kühen. Großtierpraxis. 2001; 2: 28-39. Fürll M. Damit der Stoffwechsel auch in kritischen Phasen nicht verrückt spielt. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002a; 2-13. Fürll M. Grundlagen der Stoffwechseldiagnostik und -überwachung. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002b; 28-44. Fürll M. Stoffwechselkontrollen und –überwachung bei Rindern. Teil1: Chancen, Regeln und Risiken. Nutztierpraxis Akt. 2004; 9, 4-8. Fürll M. Stoffwechseldiagnostik und –überwachung bei Milchkühen. 3. Leipziger Tierärztekongress, Leipzig Jan. 2005; Vortrag. 102 Literaturverzeichnis Fürll M, Schäfer M. Lipolyse und Hyperbilirubinämie – ein Beitrag zur Pathogenese des Ikterus. Mh Vet Med. 1992; 47: 181-6. Fürll M, Schäfer M, Dabbagh MN. Auswirkungen dreiwöchiger Buttersäurebelastungen auf den Mineralstoffwechsel und des Skelettsystem bei Rindern. Tierärztl Wochenschr. 1993; 106: 370-7. Fürll M, Kirbach H. Neues zur Harnreaktion (NSBA) bei Wiederkäuern. 6. Jahrestagung der Fachgruppe „Innere Medizin und klinische Laboratoriumsdiagnostik“ der DVG. 1997; München, 5-9. Fürll B, Dabbagh N, Fürll M. Reperfusionsschäden: theoretisch begründet – beim Nutztier beeinflussbar? Zur Ätiologie, Pathogenese und Prophylaxe der geburtsnahen Labmagenverlagerung (Dislocatio abomasi – DA) bei Kühen. in: Fürll M (Hrsg.): Ätiologie, Pathogenese, Diagnostik, Prognose, Therapie und Prophylaxe der Dislocatio abomasi. Proc International Workshop Leipzig. 1998a; 255-71. Fürll M, Kleiser L. Screening zur Früherkennung einer Disposition für die Dislocatio abomasi bei Kühen. in: Fürll M (Hrsg.): Stoffwechselbelastung, -diagnostik und –stabilisierung beim Rind. Med Tierklinik Leipzig. 1998b; 95-104. Fürll M, Dabbagh MN, Hoops M, Jäkel L, Kirbach H, Kleiser L, et al. Ketose bei Milchkühen. Großtierpraxis. 2001; 2: 28-39. Fürll M, Bauerfeld J, Goerres A, Hoops M, Jäkel L, Kirbach H, et al. Klinisch-ätiologische Aspekte des atypischen Festliegens. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002a; 166-72. Fürll M, Hiebl B, Nauruschat C. Wie „leberspezifisch“ ist die GLDH beim Rind? in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002b; 45-6. Fürll M, Hoops M, Jünger C, Wilken H. Bedeutung von Stoffwechselstörungen für die Eutergesundheit. BPT-Kongress Nürnberg Nov. 2002c, Vortragszusammenfassungen, 71-80. 103 Literaturverzeichnis Fürll M, Kleiser L, Sattler T. CK - Grenzwerte beim Rind – biologische Aspekte. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002d; 47-8. Fürll M, Nauruschat C. Zur diagnostischen Bedeutung von CK-Isoenzymen bei Kühen. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002e; 48-50. Fürll M, Stenschke E, Stertenbrinck W, Jäkel L, Krüger M. Stoffwechselstatus während der Trockenstehperiode bei Kühen mit Dislocatio abomasi post partum. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002f; 103-5. Fürll M, Dübeler I, Sattler T, Wittek T. Klinische Bedeutung und Management von Begleitkrankheiten bei Dislocatio abomasi bei Kühen. 5. Berlin-Brandenburgischer Rindertag, Okt. 2004; Vortrag, 185-8. Fürll M, Eckermann K, Evertz C, Hädrich G, Hoops M, Jäkel L, et al. Subklinische Vorboten in der Trockenstehphase als Indikatoren von Erkrankungen in der Frühlaktation. Nutztierpraxis Akt. 2006; 2, 50-7. Gallo L, Carnier P, Cassandro M, Mantovani R, Bailoni L, Costiero B, et al. Change in body condition score of Holstein cows as affected by parita and mature equivalent milk yield. J Dairy Sci. 1996; 79: 1009-15. Geishauser T, Leslie K, Duffield T, Sandals D, Edge V. Abomasal displacement in the bovine – a review on character, occurrence aetiologie and pathogenesis. J of Vet Med. 1995; 42: 229-51. Geishauser T, Leslie K, Duffield T, Sandals D, Edge V. The association between selected metabolic parameters and left abomasal displacement in dairy cows. J Vet Med. 1998; 45:499-511. Geishauser T, Leslie K, Duffield T. Metabolic aspects in the etiology of displaced abomasum. Vet Clin of North Am Food Anim Pract. 2000; 16: 255-65. 104 Literaturverzeichnis Gilbert RO, Gröhn YT, Miller PM, Hoffman DJ. Effect of parity on periparturient neutrophil function in dairy cows. Vet Immun Immunopath. 1993; 36: 75-82. Goerres A, Fürll M. Endotoxine (ET) und ET-effektoren (ALA-AK APP) bei häufigen Rinderkrankheiten. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002; 137-44. Goff JP, Horst RL. Physiological changes at parturition and their relationship to metabolic disorders. J Dairy Sci. 1997; 80: 1260-8. Gottschalk J. Validierte Methode zur Bestimmung von Progesteron und 17ß-Oestradiol. Labormitteilungen an das Institut für Tierarzneimittel Berlin GmbH. 1999. Gregory KE, Echternkamp SE, Cundiff LV Effects of twinning on dystocia, calf survival, calf growth, carcass traits, and cow productivity. J Dairy Sci. 1996; 74: 1223-33. Gröhn YT, Erb HN, McCulloch E, Sloneini H. Epidemiology of metabolic disorders in dairy cattle: Association among host characteristics, disease and production. J Dairy Sci. 1989; 72: 1876. Gründer HD. Aussagefähigkeit von Blutuntersuchungsbefunden. Prakt Tierarzt. 1991; 72: 127. Grummer RR. Etiologie of lipid-related metabolic disorders in periparturient dairy cows. J Dairy Sci. 1993; 85: 3882-96. Grummer RR. Impact of changes in organic nutrient metabolism on feeding the transition cow. J Anim Sci. 1995; 73: 2820-33. Grummer RR. Etiology, pathophysiology and prevention of fatty liver in dairy cows. 12th ICPD Brochure. 2004; www.12icpd.cvm.msu.edu. Grummer RR, Mashek DG, Hayirli A. Dry matter intake and energy balance in the transition period. Vet Clin of North Am Food Anim Pract. 2004; 20: 447-70. Grunert E. Ätiologie, Pathogenese und Therapie der Nachgeburtsverhaltung beim Rind. Wiener Tierärztl Monatsschr. 1983; 70: 230-5. 105 Literaturverzeichnis Grunert E, Ahlers D, Heuwieser W. The role of endogenous estrogens in the maturation process of the bovine placenta. Theriogen. 1989; 31: 1081-91. Grunert E, Andresen P. Geburtshilfe. in: Grunert E (Hrsg.): Buiatrik Band I. 5. Aufl., Verlag M.&H. Scharper Alfeld-Hannover. 1996; 129-90. Gyang EO, Markham RJF, Usenik EA, Maheswaran SK. Polymorphonuclear leukocyte function in cattle with left displaced abomasum with or without concurrent infections. Am J Vet Res. 1986; 47 (2): 429-32. Hamann J. Zum Erreger- und Entzündungsnachweis im Rahmen der Mastitisdiagnostik – Befunderhebung und Konsequenzen für Bekämpfungsmaßnahmen der bovinen Mastitis. BPT-Kongress Nürnberg, Nov. 2002; Vortragszusammenfassungen, 81-92. Hamann J, Fehlings K. Mastitisbekämpfung – praxisorientierte, ökonomische Aspekte. 5. Berlin-Brandenburgischer Rindertag, Okt. 2004; Vortrag, 75-7. Haraszti J, Huszenicza G, Molnar L, Solti L, Cernus V. Veränderungen gewisser metabolischer Blutparameter ante partum und ihre Bedeutung zur Vorhersage der postpartalen Fortpflanzungschancen. Dtsch Tierärztl Wschr. 1982; 89: 353-61. Hasler ML. Körperkondition und Häufigkeit von Ovarialzysten bei Braunviehkühen während der ersten 40 Laktationstage. [Dissertation med. vet.]. Zürich: Univ. Zürich; 2003. Herdt TH. Ruminant adaptation to negative energy balance. Influences on the etiologie of ketosis and fatty liver. Vet Clin of North Am Food Anim Pract. 2000; 16: 215-30. Heuer C. Negative energy balance in dairy cows – prediction, consequences, prevention. Ph D thesis Utrecht Univ. 2000; 165-89. Heuwieser W, Grunert E, Hoppen HO. A dystocia and caesarean section model to characteriae uteroplacental prostaglandin concentrations associated with retained placenta in dairy cattle. Theriogen. 1993; 40: 159-66. 106 Literaturverzeichnis Hippel T. Untersuchungen zum Verhalten des Insulin-ähnlichen Wachstumsfaktors (IGF-1) im Blutplasma von Schafen während einzelner Phasen der Reproduktion unter Berücksichtigung seiner Beziehungen zur Dynamik ovarieller Funktionskörper sowie zu den Plasmakonzentrationen an 17ß-Östradiol und Progesteron. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 2000. Hoeben D, Heyneman R, Burvenich C. Elevated levels of beta-hydroxybutyric acid in periparturient cows and in vitro effect on respiratory burst activity of bovine neutrophils. Vet Immun Immunopath. 1997; 58: 165-70. Hoops M, Fürll M. Metabolische Hintergründe jahreszeitlicher Morbiditätsdifferenzen bei Hochleistungskühen. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002; 13-4. Hörügel U, Fürll M. Untersuchungen zur Früherkennung der Gebärparesegefährdung bei Kühen. Prakt Tierarzt Coll Vet. 1998; 28: 86-92. Houe H, Østergaard S, Thilsing-Hansen T, Jørgensen RJ, Larsen T, Sørensen JT, et al. Milk fever and subclinical hypocalcaemia – an evaluation of parameters on incidence risk, diagnostic, risk factors and biological effects as input for a decision support system for disease control. Acta Vet Scand. 2001; 42: 1-29. Jäkel L. Physiologie und Management der Hochleistungskuh. 3. Leipziger Tierärztekongress, Leipzig Jan. 2005a; Vortrag. Jäkel L. Stoffwechselerkrankungen sind größtes Bestandsproblem. VETimp. 2005b; 21: 7-8. Jäkel L, Gebresselassi H, Fürll M. Gebärpareseprophylaxe mit veränderter Calol® Anwendung. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002; 177-8. Janosi SZ, Kulcsar M, Korodi O, Katai L, Reiczigel J, Dieleman SJ, et al. Energy imbalance related predisposition to mastitis in group – fed high-producing postpartum dairy cows. Acta Vet Hung. 2003; 51: 409-24. Jeroch H, Drochner W, Simon O. Milchkuhfütterung. in: Jeroch H, Drochner W, Simon O (Hrsg.): Ernährung landwirtschaftlicher Nutztiere. 1. Aufl., Verlag Eugen Ulmer Stuttgart. 1999; 413-45. 107 Literaturverzeichnis Johanson JM, Berger PJ, Kirkpatrick BW, Dentine MR. Twinning rates for North American Holstein Sires. J Dairy Sci. 2001; 84: 2081-9. Jorritsma R, Jorritsma H, Schukken YH. Prevalence and indicators of postpartum fatty infiltration of the liver in nine commercial dairy herds in the Netherlands. Livest Prod Sci. 2001; 68: 53-60. Joshi NP, Herdt TH, Neuder L. Association of rump fat thickness and NEFA with postpartum metabolic diseases in Holstein cows. 12th ICPD Brochure. 2004; www.12icpd.cvm.msu.edu. Kaneene JB, Miller R, Herdt TH, Gardiner JC. The association of serum nonesterified fatty acids and cholesterol, management and feeting practice with peripartum disease in dairy cows. Prev Vet Med. 1997; 31: 59-72. Kastner A. Untersuchungen zum Fettstoffwechsel und Endotoxin-Metabolismus bei Milchkühen vor dem Auftreten der Dislocatio abomasi. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 2002. Kaulfuß KH, Hippel T, Moritz S, Gottschalk J, Grün E. Untersuchungen zur Dynamik des Insulin-ähnlichen Wachstumsfaktors 1 (IGF-1) im Blutplasma von zyklischen und frühträchtigen Schafen und deren Beziehung zu 17ß-Östradiol und Progesteron sowie zur Follikelentwicklung. Tierärztl Umsch. 2004; 59: 297-305. Kehrli ME, Nonnecke BJ, Roth JA. Alterations in bovine neutrophil function during the periparturient period. Am J Vet Res. 1989; 50: 207-14. Kelton DF, Lissemore KD, Martin RE. Recommendations for recording and calculating the incidence of selected clinical diseases of dairy cattle. J Dairy Sci. 1998; 81: 2502-9. Kerr DE, Laarveld B, Fehr MI, Manns JG. Profiles of Serum IGF-1concentrations in calves from birth to eighteen month of age and in cows throughout the lactation cycle. Canad J of Anim Sci. 1991; 71: 695-705. Kida K. Use of every ten-day criteria for metabolic profile test after calving and dry off in dairy herds. J Vet Med Sci. 2002; 64: 1003-10. 108 Literaturverzeichnis Kim H, Suh GH. Effect of the amount of body condition loss from the dry to near calvingperiods on the subsequent body condition change - occurrence of postpartum diseases, metabolic para-meters and reproductive performance in Holstein dairy cows. Theriogen. 2003; 60: 1445-56. Kinsel ML. Dairy cows postpartum disease: Definitions decisions and dilemmas. Bov Proc. 1996; 29: 3-6. Kirk JH, Huffman EM, Lane M. Bovine cystic ovarian disease: hereditary relationships and case study. J Am Vet Med Ass. 1982; 181: 474-6. Klee W, Metzner M. Die festliegende Kuh – Bedeutung klinischer Beobachtungen unter besonderer Berücksichtigung der Serum-Phosphatkonzentration und alternativer Verfahren zum Aufstellen der Tiere. 5. Berlin-Brandenburgischer Rindertag Okt. 2004, Vortrag, 159-61. Knight CH. Lactation and gestation in dairy cows: flexibility avoids nutritional extremes (in process citation). Proc Nutr Soc. 2001; 60: 527-37. Kovacs TOG, Lloyd KCK, Walsh JH. Gastrin partially mediates insulin-induced acid secretion in dogs. Peptides. 1996; 17: 583-7. Kraft W, Dürr UM. Klinische Labordiagnostik in der Tiermedizin. 6. Aufl., Verlag Schattauer Stuttgart/New York. 2005. Krüger M, Fürll M. Zur Entstehung der geburtsnahen Labmagenverlagerung (Dislocatio abomasi) bei Kühen. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002; 105-16. Kümper H. Entstehungsweise, Therapie und Prophylaxe von Gliedmaßenerkrankungen bei Kühen. Großtierpraxis. 2000; 5: 6-24. Kunz PL, Blum JW, Hart IC, Bickel H, Landis J. Effects of different energy intakes before and after calving on food intake, performance and blood hormones and metabolites in dairy cows. Anim Prod. 1985; 40: 219-31. 109 Literaturverzeichnis Kurth A. Feldstudie zur Überprüfung der klinischen Wirksamkeit von Prostaglandin F2α als Ergänzung zu einer konventionellen Therapie der Retentio secundinarum bei Milchkühen. [Dissertation med. vet.]. Berlin: Univ. Berlin; 2001. Kutas F. Über die Diagnostik metabolischer Störungen des Säuren-Basen-Gleichgewichtes mittels Bestimmung der Netto-Säuren-Basen-Ausscheidung beim Rind. Int Tag Weltges Buiatrik Zürich Aug. 1966; Vortrag. Lachmann G, Siebert H, Schäfer M. Säuren-Basen-Parameter in Blut, Erythrozyten, Lebergewebe und Harn bei dekompensierter metabolischer Azidose des Rindes. Arch Exper Vet Med. 1985; 39: 422-8. Lam WF, Masclee AAM, Muller ESM, Lamers CBHW. Effect of hyperglycaemia on gastric acid secretion during gastric phase of digestion. Am J of Phys. 1997; 272: 1116-21. Lappetelainen P, Lappetelainen E, Harsinen T, Hahl M, Pirshanen A, Maenpaa PH. Biochemical indicators of bone metabolic activity in bovine periparturient hypocalcaemia. Zentralbl Vet Med. 1993; 40: 67-72. Larven RA, Peters AR. Bovine retained placenta: Aetiology, pathogenesis and economic loss. Vet Rec. 1996; 139: 465-71. Le Blanc SJ, Leslie KE, Duffield TF. Metabolic predictors of displaced abomasum in dairy cattle. J Dairy Sci. 2005; 88: 159-70. Lee EK, Kehrli ME. Expression of adhesion molecules on neutrophils of periparturient cows and neonatal calves. Am J Vet Res. 1998; 59: 37-43. Leonard D. Problems associated with twin pregnancies in dairy cows. Vet Rec. 2004; 155: 343-4. Lewis GS. Uterine health and disorders. J Dairy Sci. 1997; 80: 984-94. Löffler G, Petrides PE. Biochemie und Pathobiochemie. 6. Aufl., Verlag Springer Berlin/Heidelberg/New York. 1998. 110 Literaturverzeichnis Lopez-Gatius F, Santolaria P, Yaniz J, Fenech M, Lopez-Bejar M. Risk factors for postpartum ovarian cysts and their spontaneous recovery or persistence in lactating dairy cows. Theriogen. 2002; 58, 1623-32. Lorenz RJ. Grundbegriffe der Biometrie. 3. Aufl., Verlag Fischer Stuttgart/Jena. 1992. Lotthammer KH. Eierstocks- und Gebärmuttererkrankungen bei subklinischen Stoffwechselstörungen der Milchkühe. Prakt Tierarzt Colleg Vet. 1974; 56: 24-9. Lotthammer KH. Gesundheits- und Fruchtbarkeitsstörungen beim Milchrind – klinischchemische Untersuchungen als Hilfsmittel zur Herdendiagnostik (Klärung der Ursache). Tierärztl Praxis. 1981; 9: 541-51. Lucy MC. Regulation of ovarian follicular growth by somatotropin and insulin-like growth factor in cattle. J Dairy Sci. 2000; 83: 1635-47. Lucy MC. Mechanism linking nutrition and reproduction in postpartum cows. Reprod Suppl. 2003; 61: 415-27. Lunn DP, McGuirk SM, Smith DF, McWilliams PS. Renal net acid and electrolyt excretion in an experimental model of hypochloremic metabolic alkalosis in sheep. J Vet Res. 1990; 51: 1723-31. Markusfeld O. What are Production Diseases, and how do we manage them? Acta vet scand Suppl. 2003; 98: 21-32. Markusfeld O, Galon N, Ezra E. Body condition score, health, yield and fertility in dairy cows. Vet Rec. 1997; 141: 67-72. Martens H. Beziehungen zwischen Fütterung, Physiologie der Vormägen und Pathogenese der Dislocatio abomasi. Intern Workshop Leipzig Okt. 1998; Proceed., 81-101. Mc Caffery FH, Leask R, Riley SC, Telfer EE. Culture of bovine preantaral follicles in a serum-free system: markers for assessment of growth and development. Biol of Reprod. 63: 267-73. 111 Literaturverzeichnis Mc Namara JP. Regulation of adipose tissue metabolism in support of lactation. J Dairy Sci. 1991; 74: 706-19. Mc Namara JP. Integrating genotype and nutrition on utilization of body reserves during lactation of dairy cattle. Symposium on Ruminant Phys. 2000; 353-70. Mee JF. Managing the dairy cow at calving time. Vet Clin of North Am Food Anim Pract. 2004; 20: 521-46. Menke KH., Huss W. Tierernährung und Futtermittelkunde. 3. Aufl., Verlag Ulmer Stuttgart. 1987. Merle R. Beziehungen zwischen Eutergesundheit und Funktionalität von aus Blut und Milch isolierten Leukozyten des Rindes unter besonderer Berücksichtigung der Chemielumineszenz. [Dissertation med. vet.]. Hannover: TiHo. Hannover; 2003. Mgasa MN. Bovine pododermatitis aseptica diffusa (Laminitis): Aetiologie, pathogenesis, treatment and control. Vet Res Com. 1987; 11: 235-41. Miettinen PVA. Einfluss der Fütterung auf Energiebilanz und Fruchtbarkeit bei Milchkühen. Tierärztl Praxis. 1992; 20: 149-52. Morrow DA. Fat cow syndrome. J Dairy Sci. 1975; 59: 1625-8. Morrow DA, Hillman D, Dade AW, Kitchen Y. Clinical investigation of dairy herd with fat cowsyndrome. J Am Vet Med Ass. 1979; 174: 161-7. Mösenfechtel S, Eigenmann UJ, Rüsch P, Wanner M. Rückenfettdicke und Fruchtbarkeit bei Braunviehkühen. Arch Tierheilk. 2000; 142: 679-89. Nakao T, Gamal A, Osawa T, Nakada K, Moryoshi M, Kawata K. Postpartum plasma PGF metabolite profile in cows with dystocia and/or retained placenta, and effect of fenprostalene on uterine involution and reproductive performance. J Vet Med Sci. 1997; 59: 791-4. Naylor JM, Kronfeld DS, Johnson K. Fasting hyperbilirubinaemia and its relationship of free fatty acids and triglycerides in horse. Proc Soc Exper Biol Med. 1980; 165: 86-90. 112 Literaturverzeichnis Newbold JR. Praktische Untersuchungen zur Stoffwechselsituation der hochleistenden Milchkuh. Tagungsband zur 4. Haupttagung der Agrar-/Veterinärakademie (AVA) Göttingen Februar. 2005; 104-12. Nikolic JA, Kulcsar M, Katai L, Nedic O, Janosi S, Huszenicza G. Periparturient endocrine and metabolic changes in healthy cows and in cows affected by mastitis. J Vet Med A Phys Path Clin Med. 2003; 50: 22-9. Nonnecke BJ, Kimura K, Goff JP, Kehrli ME. Effects of the mammary gland on functional capacities of blood mononuclear leukocyte populations from periparturient cows. J Dairy Sci. 2003; 86: 2359-68. Obritzhauser W, Behm D (Arbeitsgruppe Wiederkäuer). Programm zur Bekämpfung von Fruchtbarkeitsstörungen in der österreichischen Rinderhaltung zur Verbesserung des Gesundheits- und Leistungsstandes der Rinderbestände. Amtl Vet Nachr. 10a. 2004. Oetzel GR. Use of anionic salts for prevention of milk fever in dairy cattle. Food Anim Comp. 1993; 15(8): 1138-46. Oetzel GR. Monitoring and testing dairy herds for metabolic disease. Vet Clin of North Am Food Anim Pract. 2004; 20: 651-74. Oetzel R, Schoon HA, Fürll M. Einfluß unterschiedlicher Calcium-Chlorid-Formulierungen auf den Calcium-Blutspiegel und die Calcium-Ausscheidung mit dem Harn sowie die Verträglichkeit bei Kühen. 7. Jahrestagung der Fachgruppe „Innere Medizin und klinische Laboratoriumsdiagnostik“ der DVG. 1998; München. Ohtsuka H, Koiwa M, Hatsugaya A, Kudo K, Hoshi F, Itoh N, et al. Relationship between serum TNF activity and insulin resistance in dairy cows affected with naturally occurring fatty liver. J Vet Med Sci. 2001; 63: 1021-5. Oikawa S, Katoh N, Kawawa F, Ono Y. Decreases serum apolipoprotein B-100 and A-1 concentrations in cows with ketosis and left displacement of the abomasums. Am J Vet Res. 1997; 58: 121-5. Oltenacu PA, Ekesbo I. Epidemiological study of clinical mastitis in dairy cattle. Vet Res. 1994; 25: 208-12. 113 Literaturverzeichnis Østergaard S, Gröhn YT. Concentrate feeding, dry matter intake and metabolic disorders in Danish dairy cows. Livest Prod Sci. 2000; 65: 107-18. Paape MJ, Capuco AV, Guidy AJ, Burvenich C. Morphology, function and adaption of mammary cells in normal and disease states. Lact Workshop Int Congr Minneap. 1994; 1-44. Pehrson BG, Shaver RD. Displaced abomasums: clinical data and effects of peripartal feeding and management on incidence. 17th World Buiatr Congr St Paul. 1992; 116-20. Poike A. Epidemiologische Erhebungen zum Vorkommen von Labmagenverlagerungen beim Rind in ausgewählten Betrieben Mitteldeutschlands im Zeitraum 1989-1998. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 2000. Preisler MT, Weber PSD, Tempelman RJ, Erskine RJ, Hunt H, Burton JL. Glucocorticoid receptor expression profiles in mononuclear leukocytes of periparturient Holstein cows. J Dairy Sci. 2000; 83: 38-47. Pullen DL, Palmquist DL, Emery RS. Effect on days of lactation and methionine hydroxy analog on incorporation of plasma fatty acids into plasma triglycerids. J Dairy Sci. 1989; 72: 49-58. Puscas I, Coltau M, Baican M, Domuta G, Hecht A. Calcium, carbonic anhydrase and gastric acid secretion. Phys Res. 2001; 50: 349-64. Pushpakumara PGA, Gardner NH, Reynolds CK, Beever DE , Wathes DC. Relationships between transition period diet, metabolic parameters and fertility in lactating dairy cows. Theriogen. 2003; 60: 1165-85. Radcliff RP, McCormack BL, Crooker BA, Lucy MC. Plasma hormones and expression of growth hormone receptor and insulin-like growth factor-1 mRNA in hepatic tissue of periparturient dairy cows. J Dairy Sci. 2003; 86: 3920-6. Reist M, Edrin D, von Euw D, Tschuemperlin K, Leuenberger H, Chilliard Y, et al. Estimation of energy balance at the individual and herd level using blood and milk traits in high-yielding dairy cows. J Dairy Sci. 2002; 85: 3314-27. 114 Literaturverzeichnis Ricken MW. Labmagenverlagerung beim Rind: Analyse von genetischen Faktoren und ökonomischen Auswirkungen auf die Milchproduktion. [Dissertation med. vet.]. Hannover: TiHo. Hannover; 2003. Ricken GE. Transport von Calcium über das isolierte Pansenepithel des Rindes. [Dissertation med. vet.]. Hannover: TiHo. Hannover; 2005. Ronge H, Blum J, Clement C, Jans F, Leuenberger H, Binder H. Somatomedin C in dairy cows related to energy and protein supply and to milk production. Anim Prod. 1988; 47: 16583. Rossow N. Die Energiebilanzsituation der Milchkuh in der Frühlaktation. 2001 (zitiert vom 22.05.2005):1-20. www.portal-rind.de/portal/data/artikel49/artikel_49.pdf. Rossow N. Ketose der Milchkuh – Wesen der Erkrankung und Bekämpfungsstrategie. 2002 (zitiert vom 22.05.2005):1-16. www.portal-rind.de/portal/data/artikel46/artikel_46.pdf. Rossow N. Warum nehmen Fruchtbarkeitsprobleme in Milchkuhbeständen mit hoher Leistung zu? 2003a (zitiert vom 22.05.2005):1-20. www.portal-rind.de/portal/data/ artikel47/artikel_47.pdf. Rossow N. Fettmobilisationssyndrom der Milchkuh. 2003b (zitiert vom 22.05.2005):1-16. www.portal-rind.de/portal/data/artikel45/artikel_45.pdf. Rossow N, Staufenbiel R. Störungen des Lipidstoffwechsel bei der Milchkuh unter besonderer Berücksichtigung der Lipolyse. Mh Vet Med. 1983; 38: 404-9. Rossow N, Horvath Z. Innere Krankheiten der Haustiere. Band II: Funktionelle Störungen. 1. Aufl., Gustav Fischer Verlag Stuttgart. 1988. Rossow N, Staufenbiel B, Staufenbiel R, Gürtler H, Dargel D, Neuer R. Zur Bewertung erhöhter Ketonkörperkonzentrationen bei der Milchkuh. Mh Vet Med. 1991; 46: 11-7. Rukkwamsuk T, Geelen MJ, Kruip TA, Wensing T. Interrelation of fatty acid composition in adipose tissue, serum and liver of dairy cows during the development of fatty liver postpartum. J Dairy Sci. 2000; 83: 52-9. 115 Literaturverzeichnis Sato H, Mohamed T, Goto A, Oikawa S, Kurosawa T. Fatty acid profiles in relation to triglyceride level in the liver of dairy cows. J Vet Med Sci. 2003; 66: 85-7. Sattler T. Untersuchungen zum antioxidativen Status von Kühen mit Labmagenverlagerung. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 2001. Sattler T, Fürll M. Labordiagnostische Bedeutung der Creatinkinase und der AspartatAminotransferase bei Kühen mit Labmagenverlagerung und Endometritis. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002; 55-7. Sattler T, Fürll M. Creatine kinase and aspartat aminotransferase in cows as indicators for endometritis. J Vet Med Series A. 2004; 51: 132-7. Schäfer M, Lachmann G, Kron A, Jahn HJ. Untersuchungen zur metabolischen Alkalose in Milchkuhbeständen. Mh Vet Med. 1980; 35: 64-7. Schnorr B, Kressin M. Embryologie der Haustiere. 4. Aufl., Enke Verlag Stuttgart. 2001. Schnurrbusch U, Vogler B. Gynäkologie für Veterinärmediziner Teil 1. Verlag wissenschaftliche Scripten Zwickau. 2003. Scholz H. Stoffwechselkontrolle in der Milchkuhherde an Hand von Blut- und Milchparametern. Prakt Tierarzt Coll Vet XXI. 1990; 72: 32-5. Schroder B, Kappner H, Failing K, Pfeffer E, Breves G. Mechanism of intestinal phosphate transport in small ruminants. Br J Nutr. 1995; 74: 635-48. Schroeder UJ. Untersuchungen zur Konditionsbeurteilung mittels ultrasonografischer Messung der Rückenfettdicke als Grundlage zur Anwendung in der Bestandsbetreuung von Milchviehherden. [Dissertation med. vet.]. Berlin: Univ. Berlin; 2000. Schroeder UJ, Staufenbiel R. Methods to determine body fat reserves in the dairy cow with special regard to ultrasonographic measurement of backfat thickness. J Dairy Sci. 2006; 89: 1-14. Schulz J, Ilchmann G. Gesundheitsfürsorge HALBERGMOOS®. 2002. 116 beim hochträchtigen Rind. MERIAL Literaturverzeichnis Seidel H, Schröter J. Die experimentelle Hypokalzämie als Modell zum Studium ätiopathogenetischer Faktoren der hypokalzämischen Gebärparese der Milchkuh. Arch exper Vet Med. 1976; 30: 497-512. Sheldon M. The postpartum uterus. Vet Clin of North Am Food Anim Pract. 2004; 20: 569-91. Sheldon M, Noakes DE, Rycroft AN, Pfeiffer DU, Dobson H. Influence of uterine bacterial contamination after parturition on ovarian dominant follicle selection and follicle growth and function in cattle. Reprod. 2002; 123: 837-45. Sobiraj A. Management zur Sicherung der Eutergesundheit. 3. Leipziger Tierärztekongress, Leipzig Jan. 2005; Vortrag, 27. Sobiraj A., Bleul U. Hämatologische Verlaufsuntersuchungen bei Rindern intra- und postpartum. Tierärtzl Praxis. 2001; 29: 339-44. Sommer H. Zur Überwachung der Gesundheit des Rindes mit Hilfe klinisch-chemischer Untersuchungsmethoden. Arch Exper Vet Med. 1970; 24: 735-76. Sorge U, Staufenbiel R. Beziehungen der postnatalen Blutlaktatkonzentration bei Kälbern zur Dauer der Vorbereitungsphase, zum Geburtsverlauf, zur Totgeburtenrate, zur neonatalen Vitalität und zur Lebendmasseentwicklung in den ersten Lebendwochen. 30. Fortbildungsveranst für Klin Labordiagnostik, Leipzig Juni. 2005; Vortrag, 9-10. Spicer LJ, Crowe MA, Prendiville DJ, Goulding D, Enrigh WJ. Systemic but not intraovarian concentrations of insuline-like growth factor-1 are affected by short-term fasting. Biol of Reprod. 1992; 46: 920-5. Stangassinger M. Charakterisierung des Normal- und des Fastenzustandes beim Wiederkäuer an Hand der Insulinempfindlichkeit und des metabolischen Glucoseflusses. J Anim Phys and Anim Nutrition. 1985; 54: 66-7. Staufenbiel R. Energie- und Fettstoffwechsel des Rindes unter besonderer Berücksichtigung der Messung der Rückenfettdicke und der Untersuchung von Fettgewebe. [Habilschr. med. vet.]. Berlin: Univ. Berlin; 1993. 117 Literaturverzeichnis Staufenbiel R. Konditionsbeurteilung von Milchkühen mit Hilfe der sonographischen Rückenfettdickenmessung. Prakt Tierarzt Coll Vet. 1997; 26: 87-92. Staufenbiel R. Sind unsere Hochleistungskühe noch gesund? Eine kritische Betrachtung am Beispiel der Ketose. Milchpraxis Heft. 2001; 2: 46-9. Staufenbiel R. Gebärparese des Rindes – neue Aspekte zum klinischen Bild und zur Therapie. BPT-Kongress Nürnberg, Nov. 2002; Vortragszusammenfassungen, 61-66. Staufenbiel R. Bewertung, Kontrolle und Sicherung optimaler Körperkondition. 3. Leipziger Tierärztekongress, Leipzig Jan. 2005a; Vortrag. Staufenbiel R. Aktuelle Aspekte zur Klinik, Diagnostik, Differentialdiagnostik, Therapie und Prophylaxe der Gebärparese der Milchkuh. Erfahrungsaustausch BOEHRINGER INGELHEIM®, Mellingen Nov. 2005b; Vortrag. Staufenbiel R, Staufenbiel B, Lachmann I, Lukas H. Fettstoffwechsel und Fruchtbarkeit der Milchkuh. Prakt Tierarzt Coll Vet. 1991; 22: 18-25. Staufenbiel R, Staufenbiel B, Meier R, Hackbarth KH, Rossow N. Untersuchungen zum optimalen Fettansatz bei der Milchkuh. Monatsh Vet Med. 1992; 47: 125-36. Staufenbiel R, Staufenbiel B, Rossow N, Wiedemann F. Energie- und Fettstoffwechsel des Rindes - Vergleich der Aussage der Rückenfettdicke mit anderen Untersuchungsgrößen. Monatsh Vet Med. 1993; 48: 167-74. Staufenbiel R, Schroeder UJ. Körperkonditionsbeurteilung durch Ultraschallmessung der Rückenfettdicke. Methodische Grundlagen. Nutztierspiegel. 2004; 2: 149-55. Staufenbiel R, Weber J, Behn H. Anwendung des Glucosetoleranztests zur Beurteilung der Stoffwechselreaktion von Rindern. 30. Fortbildungsveranst für Klin Labordiagnostik, Leipzig Juni. 2005, Vortrag, 15. Stevens JB, Olson WG. Free fatty acid induced hypocalcemia in food deprivated dairy cattle. Am J Vet Res. 1984; 45: 2448-50. 118 Literaturverzeichnis Sustronck B. Studies on abomasal emptying in cattle. Intern Workshop Leipzig Okt. 1998, Proceed. Taylor VJ, Cheng Z, Pushpakumara PGA, Beever DE, Wathes DC. Relationships between the plasma concentrations of insulin-like growth factor-1 in dairy cows and their fertility and milk yield. Vet Rec. 2004; 155: 583-8. Tenhagen S. Vergleich verschiedener Behandlungen der chronischen Endometritis des Rindes unter Berücksichtigung von Faktoren des Behandlungserfolges. [Dissertation med. vet.]. Hannover: TiHo. Hannover; 2001. Teufel EM. Verlaufsuntersuchungen zu Serum-Amyloid A, L-Carnitin sowie ausgewählten Stoffwechselparametern bei hochleistenden Milchkühen im peripartalen Zeitraum. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 1999. Tschudie P. Labordiagnostik bei Lebererkrankungen. Prakt Tierarzt Coll Vet XIV. 1983; 65: 115-8. Van den Hurk R, Zhao J. Formation of mammalian oocytes and their growth, differentiation and maturation within ovarian follicles. Therigen. 2005; 63: 1717-51. Van Knegsel AT, Van den Brand H, Dijkstra J, Tamminga S, Kemp B. Effect of dietary energy source on energy bilance, production, metabolic disorders and reproduction in lactating dairy cattle. Reprod Nutr Dev. 2005; 45: 665-88. Van Saun RJ. Glucose deficiency diseases: Ketosis, hepatic lipidosis. 2002; www.vetsci.psu.edu/coursedesc/vsc497b/11ketosis.htm. Van Saun RJ. Metabolic profiling to assess health risk in transition dairy cows. 12th ICPD Brochure. 2004; www.12icpd.cvm.msu.edu. Van Winden SCL, Jorritsma R, Müller KE, Noordhuizen JPTM. Feed intake, milk yield and metabolic parameters prior to left displaced abomasum in dairy cows. J Dairy Sci. 2003; 86: 1465-71. Vazquez-Anon M, Bertics S, Luck M, Grummer RR. Peripartum liver triglyceride and plasma metabolites in dairy cows. J Dairy Sci. 1994; 77: 1521-8. 119 Literaturverzeichnis Vernon RG. Nutrient partitioning, lipid metabolism and relevant imbalances. in: Kaske M, Scholz H, Höltershinken M. (Hrsg.): Recent developments and perspectives in bovine medicine keynote lectures. Hildesheimer Druck- und Verlags-GmbH. 2002; 210-23. Webb R, Garnsworthy PC, Gong JG, Armstrong DG. Control of follicular growth: local interactions and nutritional influences. J of Anim Sci. 2004; E. Suppl. 83: 63-74. Weber E. Grundriss der biologischen Statistik. Gustav Fischer Verlag Jena. 1980. Wendt K, Lotthammer KH, Fehlings K, Spohr M. Handbuch Mastitis. Kamlage Verlag Osnabrück. 1998. Wensing T, Kruip T, Geelen MJH, Wentink GH, van den Top AM. Postpartum fatty liver in high-producing dairy cow in practice and in animal studies. The connection with health, production and reproduction problems. Comp Haematol Int. 1997; 7: 167-71. Wilken H. Endotoxin-Status und antioxidative Kapazität sowie ausgewählte Stoffwechselparameter bei gesunden Milch- und Mutterkühen. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 2003. Wittek K. Einfluss einer einmaligen Glucocorticoidapplikation im postpartalen Zeitraum beim Rind auf ausgewählte hämatologische Stoffwechsel- und immunologische Parameter. [Dissertation med. vet.]. Leipzig: Univ. Leipzig; 2004. Wittek T, Fürll M. Prognostic value of pre-operative clinical and clinical-chemical parameters in cows with abomasal dislocation. in: Fürll M (Hrsg.): Stoffwechselstörungen bei Wiederkäuern: Erkennen – Behandeln – Vorbeugen. Med Tierklinik Leipzig. 2002a; 121-6. Wittek T, Fürll M. Untersuchungen zu Körperkondition und abdominalen Fettdepots in Beziehung zur Fettmobilisation bei an Labmagenverlagerung erkrankten Kühen. Tierärztl Umsch. 2002b; 57: 423-38. Wolf V, Hamann H, Scholz O, Distl O. Influences on the occurence of abomasal displacement in German Holstein cows. Dtsch Tierärztl Wochenschr. 2001; 108(10): 403-8. 120 Literaturverzeichnis Wolters W, Kloppert B, Castaneda H, Zschöck V, Zschöck M. Die Mastitis des Rindes. Staatl. Untersuchungsamt Hessen, 2002; www./bibl7.hrz.uni-giessen.de/gdoc/ 2002/uni/p02001.pdf. Wyss M, Kaddurah-Daouh E. Creatine and creatine metabolism. Phys Rev. 2000; 80: 110787. Zeberle H. Peripartale und puerperale Störungen beim Rind und deren Einfluss auf die Fruchtbarkeit. [Dissertation med. vet.]. Berlin: Univ. Berlin; 1996. Zehrun M. Untersuchungen zur Ätiologie der Zystischen Ovardegeneration bei Hochleistungskühen einer Milchviehherde in Sachsen-Anhalt. [Dissertation med. vet.]. Berlin: Univ. Berlin; 2002. Zepperitz H. Untersuchungen zur Diagnostik, Prophylaxe und Therapie der Gebärparese des Rindes unter besonderer Berücksichtigung des Verhaltens des ionisierten Calciums im Blut und des Einsatzes von Vitamin D3 und 25- bzw. 1λ-Hydroxycholecalciferol. [Habilschr. med. vet.]. Leipzig: Univ. Leipzig; 1994. 121 Anhang Anhang A Tab. A.1: Tagesrationen in den verschiedenen Produktionsstadien (Stand Dezember 2004) Trocken- Futtermittel (kg) 1. 2.-9. 6.-11. Laktations- Laktations- Laktations- monat monat monat steher1/ Trocken- tragende steher 2 Färsen (3.-0. (8.-4. Wo a.p.) Wo a.p.) Heu 1. Schnitt 1,00 Gerstenstroh 0,30 1,50 0,20 0,50 1,00 23,00 12,00 MPLA* 26,00 30,00 Lieschkolbensilage 2,75 3,20 Anwelksilage 17,00 2,00 8,00 7,00 11,00 Ganzpflanzensilage 1,00 2,00 5,00 WRM* 3,80 4,80 1,90 Melasse 1,10 1,30 1,30 1,00 0,50 Sojaextraktionsschrot 1,40 2,00 1,50 0,75 0,30 3,30 2,40 Ausgleichfutterfutter Vorbereitungsfutter 2,00 Viehsalz 0,04 Minerale 0,10 2,80 1,70 0,03 0,03 0,05 0,05 Trockenstehermineral 0,10 Harnstoff 0,10 Propylenglykol 0,30 Summe 38,69 *WRM = Wintergerste/Triticale Rapsextraktionsschrot Maiskleberfutter 57% 3% 30% *MPLA = Maissilage Pressschnitzelsilage Luzernegrünmehl Anwelksilage 60% 17% 3% 20% 0,05 0,15 46,08 44,83 32,98 25,35 Anhang Tab. A.2: Futterinhaltsstoffe und Futtermittelkennzahlen der Rationen in den verschiedenen Produktionsstadien (Stand Dezember 2004) Trocken1. 2.-9. 6.-11. Laktations- Laktations- Laktations- monat monat monat steher1/ Trocken- tragende steher 2 Färsen (3.-0. (8.-4. Wo a.p.) Wo a.p.) Inhaltsstoffe Trockenmasse (kg) 19,17 22,93 20,61 13,11 12,85 TM/kg TMR (kg) 0,50 0,50 0,46 0,40 0,50 NEL (MJ) 134,50 158,89 135,96 75,87 88,12 Rohprotein (g) 3145,80 4001,74 3614,02 1851,46 1975,27 Rohfett (g) 611,96 786,64 672,47 314,36 445,97 Rohfaser (g) 3333,54 4028,06 4149,06 3412,60 2341,72 Rohasche (g) 1503,15 1859,52 1818,37 1085,63 1016,70 Stärke (g) 3182,13 4757,27 3332,12 1241,32 2134,09 Zucker (g) 1117,34 1322,59 1221,63 820,71 683,42 NXP (g) 116,59 115,80 340,71 471,86 244,33 RNB (g) 31,46 57,64 54,48 -9,41 10,70 Ca (g) 143,01 171,55 156,06 57,16 92,01 P (g) 79,16 92,21 80,66 40,93 52,02 NEL je kg TM (MJ) 7,02 6,93 6,60 5,79 6,86 Rohprotein i. TM (%) 16,41 17,45 17,54 14,12 15,37 Rohfett i. TM (%) 3,19 3,43 3,26 2,40 3,47 Rohfaser i. TM (%) 17,39 17,57 20,14 26,03 18,22 Ca:P (... : 1) 1,81 1,86 1,93 1,40 1,77 Na:K (1: …) 5,09 4,87 5,72 5,20 4,72 Milch-NEL (kg) 31,75 38,75 28,81 11,90 15,49 Milch-XP 32,85 42,31 34,99 15,84 17,18 Milch-nXP 30,89 38,54 30,64 15,85 16,93 Kennzahlen Anhang Anhang B Tab. B.1: statistische Maßzahlen Temperatur (°C), Puls/min, Atmung/min, Pansenmotorik/5min Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Temperatur 3. d p.p. Puls 3. d p.p. Atmung 3. d p.p. Pansenmotorik 3. d p.p. (n) 25 38,5 ± 0,3 38,5 (38,4-38,6) 25 38,7 ± 0,5 38,6 (38,3-38,7) 25 38,6 ± 0,6 38,4 (38,2-39,1) 25 38,5 ± 0,4 38,4 (38,3-38,8) 25 38,4 ± 0,4 38,4 (38,2-38,7) 25 39,1 ± 0,6 39,0 (38,7-39,6) 25 39 ± 0,8 38,7 (38,5-39,3) 25 38,7 ± 0,6 38,5 (38,2-39,0) 25 39,2 ± 0,6 39,2 (38,8-39,5) 25 38,9 ± 0,6 38,7 (38,5-39,3) 11 39,1 ± 0,5 38,7 (38,6-39,5) 25 39,0 ± 0,7 39,1 (38,3-39,6) 0:5;0:6 0:8;0:9 0:10;0:11 25 81 ± 13 80 (72-88) 25 84 ± 11 80 (76-92) 25 83 ± 10 80 (76-92) 25 83 ± 18 80 (76-84) 25 82 ± 7 80 (78-85) 25 88 ± 14 88 (76-100) 25 85 ± 14 88 (76-96) 25 84 ± 11 84 (76-92) 25 91 ± 13 92 (80-100) 25 85 ± 10 84 (78-94) 11 84 ± 12 88 (76-88) 25 82 ± 14 84 (72-90) 0:8 25 31 ± 8 32 (24-34) 25 35 ± 10 32 (30-40) 25 32 ± 11 28 (24-36) 25 34 ± 11 32 (28-40) 25 35 ± 8 36 (28-40) 25 35 ± 9 36 (28-40) 25 38 ± 9 36 (30-42) 25 33 ± 6 32 (28-36) 25 42 ± 15 36 (31-50) 25 37 ± 10 36 (28-46) 11 37 ± 12 34 (32-40) 25 37 ± 12 34 (28-44) 0:4 0:6 0:8 0:9;0:11 25 11 ± 1 12 (10-12) 25 11 ± 1 10 (10-12) 25 11 ± 2 10 (10-12) 25 9±2 10 (8-10) 25 11 ± 2 12 (10-12) 25 10 ± 2 10 (10-11) 25 11 ± 9 10 (10-12) 25 11 ± 1 10 (10-12) 25 10 ± 2 10 (10-12) 25 10 ± 2 10 (9-12) 11 9±1 10 (8-10) 25 10 ± 2 10 (8-10) 0:1;0:2;0:3 0:5;0:6 0:8;0:9 0:10;0:11 x ±s Median (1.-3. Quartil) Mastitis (1) (n) x ±s Median (1.-3. Quartil) LMV (2) (n) x ±s Median (1.-3. Quartil) Gebärparese (3) (n) x ±s Median (1.-3. Quartil) Klauenerkrankung (4) (n) x ±s Median (1.-3. Quartil) Endometritis/ (n) x ±s Lochiometra (5) Median (1.-3. Quartil) Retentio (n) x ±s secundinarum (6) Median (1.-3. Quartil) Ovarialzyste(n) (7) (n) x ±s Median (1.-3. Quartil) Totgeburt (8) (n) x ±s Median (1.-3. Quartil) Schwergeburt (9) (n) x ±s Median (1.-3. Quartil) Frühgeburt (10) (n) x ±s Median (1.-3. Quartil) Zwillings(n) x ±s trächtigkeit (11) Median (1.-3. Quartil) signifikante Differenzen (MannWhitney-U-Test p≤0,05) zwischen den gesunden und erkrankten Tieren (bzw. Zwillingsträchtigkeiten) Anhang Tab. B.2: statistische Maßzahlen RFD (mm) Gesamtgruppen Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Messzeitpunkt 1 56. d a.p. (n) 25 14 ± 5 16 (12-19) 24 20 ± 8 20 (17-24) 25 17 ± 7 18 (11-22) 25 17 ± 6 18 (13-21) 25 17 ± 7 16 (14-19) 25 18 ± 8 19 (12-26) 25 17 ± 5 18 (13-20) 25 19 ± 6 19 (14-25) 25 17 ± 7 18 (13-22) 25 17 ± 8 16 (12-21) 12 16 ± 5 17 (11-21) 25 20 ± 7 19 (16-25) 0:1 0:5, 0:7 0:8; 0:11 1:4, 4:11 x ±s Median (1.-3. Quartil) Mastitis (1) (n) x ±s Median (1.-3. Quartil) LMV (2) (n) x ±s Median (1.-3. Quartil) Gebärparese (3) (n) x ±s Median (1.-3. Quartil) Klauen(n) x ±s erkrankung (4) Median (1.-3. Quartil) Endometritis/ (n) x ±s Lochiometra (5) Median (1.-3. Quartil) Retentio (n) x ±s secundinarum (6) Median (1.-3. Quartil) Ovarialzyste(n) (7) (n) x ±s Median (1.-3. Quartil) Totgeburt (8) (n) x ±s Median (1.-3. Quartil) Schwergeburt (9) (n) x ±s Median (1.-3. Quartil) Frühgeburt (10) (n) x ±s Median (1.-3. Quartil) Zwillings(n) x ±s trächtigkeit (11) Median (1.-3. Quartil) signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den Gruppen Messzeitpunkt 2 28. d a.p. Messzeitpunkt 3 10. d a.p. 25 25 16 ± 5 17 ± 4 17 18 (12-20) (13-21) 25 24 23 ± 7 23 ± 7 22 21 (19-25) (19-24) 25 25 20 ± 8 21 ± 8 20 20 (15-26) (15-26) 25 25 21 ± 7 21 ± 6 20 21 (19-26) (19-24) 25 25 19 ± 7 20 ± 7 18 18 (15-20) (16-21) 25 23 20 ± 8 21 ± 8 20 21 (15-28) (13-27) 25 24 20 ± 5 21 ± 4 20 21 (19-23) (19-24) 25 24 23 ± 6 25 ± 6 22 23 (19-29) (20-30) 25 23 20 ± 6 21 ± 7 19 21 (16-24) (17-26) 25 24 19 ± 8 20 ± 8 18 19 (15-24) (16-26) 10 4 18 ± 7 18 ± 7 20 17 (12-24) (12-25) 25 25 22 ± 8 22 ± 8 21 21 (16-28) (15-27) 0:1/2/3/6/7 0:1/3/6/7/8 0:8/11, 1:4 0:11, 1:4/10 1:9, 3:4, 4:6 3:4, 4:6/7 4:7, 7:9 7:9 Messzeitpunkt 4 3. d p.p. 25 18 ± 5 18 (14-21) 25 22 ± 7 21 (19-24) 24 20 ± 8 20 (14-24) 24 22 ± 7 22 (18-25) 25 19 ± 6 18 (17-20) 25 20 ± 8 19 (15-27) 24 20 ± 6 21 (15-25) 24 23 ± 6 22 (20-27) 25 19 ± 6 20 (15-23) 25 20 ± 7 19 (15-24) 11 15 ± 6 15 (11-21) 25 21 ± 8 20 (14-25) 0:1/3/7 1:4, 3:10, 4:7, 6:10 7:8/9/10 signifikante Differenzen (WilcoxonTest p≤0,05) zwischen den Messungen 1:2;1:3;1:4 1:5;1:6;1:7 2:4/5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:3/5/6/7 3:5/6/7 1:2/5/6/7 2:5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:5/6/7 3:4/5/6/7 1:2/3/4/5/6/7 2:3/5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:5/6/7 3:4/5/6/7 1:2/3/4/5/6/7 2:5/6/7 3:5/6/7 1:5/6 2:4/5/6/7 1:2/5/6/7 2:4/5/6/7 3:4/5/6/7 Anhang Tab. B.3: statistische Maßzahlen RFD (mm) Gesamtgruppen Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Messzeitpunkt 5 28. d p.p. Messzeitpunkt 6 56. d p.p. Messzeitpunkt 7 120. d p.p. (n) 24 11 ± 3 11 (9-13) 24 15 ± 6 14 (11-18) 23 11 ± 4 10 (8-15) 21 14 ± 5 14 (10-18) 23 11 ± 5 9 (8-14) 24 13 ± 6 12 (8-18) 24 12 ± 4 13 (10-14) 25 15 ± 5 13 (12-19) 24 13 ± 5 13 (8-17) 25 13 ± 6 12 (10-17) 10 13 ± 5 13 (8-17) 22 12 ± 4 11 (8-14) 0:1, 0:7 1:2/4/11 2:7, 3:4 4:7, 7:11 25 8±3 8 (6-10) 23 11 ± 5 10 (8-15) 21 8±2 7 (6-10) 19 10 ± 5 9 (6-13) 19 8±5 8 (5-9) 20 10 ± 6 8 (5-12) 23 9±4 9 (6-12) 23 11 ± 6 10 (7-13) 23 10 ± 4 10 (6-12) 23 11 ± 4 11 (8-14) 12 11 ± 6 9 (6-17) 22 9±4 8 (6-10) 0:1/9 1:2/4/11 2:7/8/9 4:7/9 9:11 25 8±3 6 (5-8) 22 9±4 7 (6-12) 20 6±1 5 (5-6) 17 8±3 6 (5-10) 21 7±4 5 (5-7) 19 7±4 6 (5-7) 24 8±3 8 (5-10) 25 8±5 6 (5-9) 24 9±4 8 (5-9) 19 9±4 8 (5-10) 10 9±5 8 (5-12) 22 8±4 6 (5-11) 0:2, 1:2/4 2:3/6/7/8/9 2:10/11 4:9 x ±s Mastitis (1) LMV (2) Gebärparese (3) Klauenerkrankung (4) Endometritis/ Lochiometra (5) Retentio secundinarum (6) Ovarialzyste(n) (7) Totgeburt (8) Schwergeburt (9) Frühgeburt (10) Zwillingsträchtigkeit (11) Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den Gruppen signifikante Differenzen (Wilcoxon-Test p≤0,05) zwischen den Messungen 4:5;4:6;4:7 5:6;5:7 6:7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 6:7 4:5/6 4:5/6/7 5:6/7 6:7 Anhang Tab. B.4: statistische Maßzahlen RFD (mm) Kühe Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Messzeitpunkt 1 56. d a.p. (n) 21 17 ± 6 16* (12-21) 19 20 ± 9 18 (14-24) 20 16 ± 6 16 (11-20) 25 17 ± 6 18 (13-21) 21 16 ± 7 15 (13-18) 18 19 ± 9 20 (7-27) 19 16 ± 6 16 (11-19) 21 19 ± 6 19 (19-25) 14 16 ± 9 15 (7-23) 19 16 ± 8 15* (10-19) 8 15 ± 6 15 (10-20) 20 20 ± 7 19 (16-26) 4:11 9:11 Messzeitpunkt 2 28. d a.p. Messzeitpunkt 3 10. d a.p. 21 21 18 ± 7 19 ± 6 Median 17 18 (1.-3. Quartil) (13-22) (16-24) Mastitis (1) (n) 20 19 x ±s 23 ± 8 23 ± 8 Median 22 21 (1.-3. Quartil) (18-25) (19-25) LMV (2) (n) 20 20 x ±s 20 ± 6 21 ± 6 Median 20 20 (1.-3. Quartil) (15-24) (17-24) Gebärparese (3) (n) 25 25 x ±s 21 ± 7 21 ± 6 Median 20 21 (1.-3. Quartil) (19-26) (19-24) Klauen(n) 21 21 x ±s erkrankung (4) 19 ± 8 20 ± 7 Median 18 18 (1.-3. Quartil) (15-20) (16-21) Endometritis/ (n) 18 17 x ±s Lochiometra (5) 20 ± 9 21 ± 9 Median 22 22 (1.-3. Quartil) (11-29) (13-28) Retentio (n) 19 18 x ±s secundinarum (6) 20 ± 5 21 ± 5 Median 20 22 (1.-3. Quartil) (17-22) (18-24) Ovarialzyste(n) (7) (n) 21 20 x ±s 23 ± 6 25 ± 6 Median 22 23 (1.-3. Quartil) (19-28) (20-30) Totgeburt (8) (n) 14 13 x ±s 19 ± 8 20 ± 8 Median 19 22 (1.-3. Quartil) (12-26) (12-26) Schwergeburt (9) (n) 19 18 x ±s 19 ± 8 19 ± 7 Median 17 17 (1.-3. Quartil) (14-21) (15-22) Frühgeburt (10) (n) 7 3 x ±s 16 ± 7 19 ± 8 Median 17 20 (1.-3. Quartil) (9-22) (11-26) Zwillings(n) 20 20 x ±s trächtigkeit (11) 23 ± 8 23 ± 7 Median 22 22 (1.-3. Quartil) (18-29) (17-28) signifikante Differenzen 1:4/9 0:7 (Mann-Whitney-U-Test p≤0,05) 4:7/11 1:4/9 zwischen den Gruppen 7:9, 9:11 4:7, 7:9 * signifikante Differenz (Mann-Whitney-U-Test p≤0,05) RFD Kühe/Färsen x ±s Messzeitpunkt 4 3. d p.p. 21 18 ± 6 18 (16-23) 20 22 ± 8 21 (18-24) 19 20 ± 6 20 (16-23) 24 22 ± 7 22 (18-25) 21 19 ± 7 18 (16-20) 18 21 ± 9 20 (14-30) 18 21 ± 6 21 (15-24) 20 24 ± 6 22 (20-27) 14 19 ± 8 19 (11-24) 19 19 ± 7 18 (13-21) 7 14 ± 7 11 (10-19) 20 22 ± 8 20 (15-25) 0/1/3/6:10 , 7:9/10, 4:7,10:11 signifikante Differenzen (WilcoxonTest p≤0,05) zwischen den Messungen 1:2;1:3;1:4 1:5;1:6;1:7 2:3;2:5;2:6 2:7;3:5/6/7 1:2/3/4/5/6/7 2:5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:3/5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:5/6/7 3:5/6/7 1:5/6/7 2:5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:3/5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:3/5/6/7 3:5/6/7 1:2/3/6/7 2:5/6/7 3:5/6/7 1:2/3/4/5/6/7 2:5/6/7 3:5/6/7 1:2/3//5/6/7 2:4/5/6/7 3:4/5/6/7 Anhang Tab. B.5: statistische Maßzahlen RFD (mm) Kühe Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen (n) Messzeitpunkt 5 28. d p.p. Messzeitpunkt 6 56. d p.p. Messzeitpunkt 7 120. d p.p. 20 21 21 12 ± 4 9±4 8±3 Median 11 8 6 (1.-3. Quartil) (10-15) (6-10) (5-8) Mastitis (1) (n) 19 18 18 x ±s 16 ± 6 12 ± 5 9±5 Median 15 10 7 (1.-3. Quartil) (11-19) (8-16) (6-13) LMV (2) (n) 18 16 16 x ±s 12 ± 4 8±2 6±1 Median 10 7 5 (1.-3. Quartil) (9-15) (6-10) (5-6) Gebärparese (3) (n) 21 19 17 x ±s 14 ± 5 10 ± 5 8±3 Median 14 9 6 (1.-3. Quartil) (10-18) (6-13) (5-10) Klauenerkrankung (4) (n) 19 15 17 x ±s 11 ± 5 8±5 7±4 Median 9 8 5 (1.-3. Quartil) (8-12) (5-9) (5-7) Endometritis/ (n) 17 15 14 x ±s Lochiometra (5) 14 ± 6 11 ± 7 8±4 Median 14 9 6 (1.-3. Quartil) (8-19) (5-16) (6-12) Retentio (n) 18 18 18 x ±s secundinarum (6) 12 ± 4 9±3 8±4 Median 12 8* 6 (1.-3. Quartil) (10-14) (6-12) (5-10) Ovarialzyste(n) (7) (n) 21 19 21 x ±s 15 ± 5 12 ± 7 8±5 Median 15 10 6 (1.-3. Quartil) (11-19) (7-13) (5-8) Totgeburt (8) (n) 14 13 14 x ±s 13 ± 5 11 ± 4 10 ± 5 Median 13 10 9 (1.-3. Quartil) (8-17) (8-14) (5-11) Schwergeburt (9) (n) 19 17 14 x ±s 12 ± 5 10 ± 3 9±4 Median 11 10 8 (1.-3. Quartil) (8-15) (8-13) (5-10) Frühgeburt (10) (n) 6 8 6 x ±s 13 ± 4 11 ± 6 10 ± 6 Median 13 9 9 (1.-3. Quartil) (10-17) (6-17) (5-15) Zwillings(n) 18 18 18 x ±s trächtigkeit (11) 12 ± 4 9±4 9±4 Median 11 8 7 (1.-3. Quartil) (8-13) (6-12) (6-13) signifikante Differenzen 0:4, 1:4 1:2/4/11 0:2, 1:2/4 (Mann-Whitney-U-Test p≤0,05) 1:11, 3:4 2:9 2:5/8/9/11 zwischen den Gruppen 4:7 4:7/9 4:8/9/11 7:11 * signifikante Differenz (Mann-Whitney-U-Test p≤0,05) RFD Kühe/Färsen x ±s signifikante Differenzen (Wilcoxon-Test p≤0,05) zwischen den Messungen 4:5;4:6;4:7 5:6;5:7 6:7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:6/7 4:5/6/7 5:6/7 4:5/6/7 5:6/7 6:7 4:5/6/7 5:7 4:5/6/7 5:6/7 4:5 4:5/6/7 5:6/7 6:7 Anhang Tab. B.6: statistische Maßzahlen RFD (mm) Färsen Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Messzeitpunkt 1 56. d a.p. Messzeitpunkt 2 28. d a.p. Messzeitpunkt 3 10. d a.p. Messzeitpunkt 4 3. d p.p. (n) 4 20 ± 7 20* (15-25) 5 22 ± 2 21 (21-24) 5 18 ± 7 15 (12-25) - 4 19 ± 6 19 (14-24) 5 23 ± 4 21 (20-26) 5 20 ± 5 17 (16-25) - 4 20 ± 7 20 (17-23) 5 21 ± 2 22 (19-23) 5 19 ± 6 19 (15-25) - 4 19 ± 7 19 (15-23) 5 21 ± 2 22 (19-23) 5 18 ± 6 16 (14-24) - x ±s Median (1.-3. Quartil) Mastitis (1) (n) x ±s Median (1.-3. Quartil) LMV (2) (n) x ±s Median (1.-3. Quartil) Gebärparese (3) (n) x ±s Median (1.-3. Quartil) Klauen(n) 4 4 4 x ±s erkrankung (4) 20 ± 4 20 ± 4 19 ± 4 Median 20 20 19 (1.-3. Quartil) (17-23) (17-22) (16-22) Endometritis/ (n) 7 7 6 x ±s Lochiometra (5) 18 ± 6 20 ± 6 19 ± 6 Median 18 19 19 (1.-3. Quartil) (14-23) (16-24) (14-25) Retentio (n) 6 6 6 x ±s secundinarum (6) 19 ± 2 23 ± 4 22 ± 4 Median 20 22 21 (1.-3. Quartil) (18-21) (20-26) (20-24) Ovarialzyste(n) (7) (n) 4 4 4 x ±s 22 ± 5 26 ± 7 26 ± 7 Median 21 26 26 (1.-3. Quartil) (18-27) (19-32) (19-32) Totgeburt (8) (n) 11 11 10 x ±s 19 ± 5 20 ± 5 21 ± 5 Median 19 20 21 (1.-3. Quartil) (13-22) (18-23) (19-24) Schwergeburt (9) (n) 6 6 6 x ±s 23 ± 6 23 ± 7 25 ± 7 Median 22* 21 27 (1.-3. Quartil) (18-29) (18-30) (19-32) Frühgeburt (10) (n) 4 3 1 x ±s 18 ± 5 21 ± 5 13 ± 0 Median 19 22 13 (1.-3. Quartil) (14-23) (16-25) (13-13) Zwillings(n) 5 5 5 x ±s trächtigkeit (11) 18 ± 6 18 ± 8 18 ± 9 Median 20 16 15 (1.-3. Quartil) (13-23) (12-26) (11-27) signifikante Differenzen 0:2/5, 1:2 2:7 0:11 (Mann-Whitney-U-Test p≤0,05) 1:6 7:11 2:9, 4:9, 5:9 zwischen den Gruppen 2:7/9 9:11 9:11 * signifikante Differenz (Mann-Whitney-U-Test p≤0,05) RFD Kühe/Färsen 4 19 ± 2 19 (17-20) 7 19 ± 6 17 (16-25) 6 20 ± 6 19 (16-25) 4 22 ± 4 21 (19-26) 11 20 ± 5 20 (16-22) 6 24 ± 6 24 (18-28) 4 18 ± 5 18 (14-23) 5 18 ± 9 14 (11-27) 2:9 5:9 9:11 signifikante Differenzen (WilcoxonTest p≤0,05) zwischen den Messungen 1:5/6/7 2:5/6/7 3:4/5/6/7 1:5/6/7 2:5/6/7 1:5/6/7 2:5/6/7 3:5/6/7 1:2/5/6/7 2:5/6/7 3:5/6/7 1:2/5/6/7 2:5/6/7 3:4/5/6/7 1:3/5/6/7 2:5/6/7 3:4/5/6/7 1:5 2:5 3:5 1:7 2:7 3:7 Anhang Tab. B.7: statistische Maßzahlen RFD (mm) Färsen Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Messzeitpunkt 5 28. d p.p. Messzeitpunkt 6 56. d p.p. Messzeitpunkt 7 120. d p.p. (n) 4 12 ± 5 12 (11-13) 5 12 ± 2 12 (11-14) 5 10 ± 3 10 (8-12) - 4 11 ± 4 10 (7-15) 5 10 ± 2 10 (9-12) 5 7±2 6 (6-9) - 4 8±4 7 (6-9) 4 7±2 7 (6-9) 4 6±2 5 (5-7) - x ±s Mastitis (1) LMV (2) Gebärparese (3) Klauenerkrankung (4) Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) 4 4 4 14 ± 1 9±2 7±4 14 9 7 (13-15) (8-9) (6-9) Endometritis/ 7 5 5 Lochiometra (5) 10 ± 3 7±3 6±1 10 7 5 (9-12) (5-9) (5-7) Retentio 6 5 6 secundinarum (6) 13 ± 2 12 ± 4 9±2 14 12* 9 (11-14) (8-14) (7-10) Ovarialzyste(n) (7) 4 4 4 14 ± 4 11 ± 4 8±3 13 10 7 (12-18) (8-15) (5-11) Totgeburt (8) 10 10 10 13 ± 4 10 ± 4 8±3 12 10 7 (9-17) (6-13) (5-9) Schwergeburt (9) 6 6 5 16 ± 5 15 ± 6 11 ± 6 16 14 10 (13-19) (9-17) (5-15) Frühgeburt (10) 4 4 4 13 ± 6 10 ± 6 8±4 12 9 7 (8-19) (6-16) (5-12) Zwillings4 4 4 trächtigkeit (11) 11 ± 5 8±2 6±2 10 9 6 (6-16) (7-10) (5-8) signifikante Differenzen 0:2/5/11 0:2, 1:2 2:6/9 (Mann-Whitney-U-Test p≤0,05) 2:9 2:6/7/8/9 5:6/9 zwischen den Gruppen 5:7/9 5:6/9 8:9 * signifikante Differenz (Mann-Whitney-U-Test p≤0,05) RFD Kühe/Färsen signifikante Differenzen (Wilcoxon-Test p≤0,05) zwischen den Messungen 4:5/6/7 5:6/7 6:7 4:5/6/7 5:7 6:7 4:5/6/7 5:6/7 4:6/7 5:6/7 4:5 5:6 4:5/6/7 5:7 6:7 4:/ 5:/ 4:5/6/7 5:6/7 6:7 4:5/6/7 5:7 6:7 4:7 Anhang Tab. B.8: statistische Maßzahlen Lactat (mmol/l Serum) Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Entnahmezeitpunkt 1 28. d a.p. Entnahmezeitpunkt 2 10. d a.p. Entnahmezeitpunkt 3 3. d p.p. Entnahmezeitpunkt 4 28. d p.p. (n) 25 2,0 ± 0,6 1,9 (1,7-2,5) 25 1,8 ± 0,5 1,9 (1,4-2,2) 25 1,4 ± 0,5 1,5 (1,0-1,8) 25 1,8 ± 0,6 1,7 (1,3-2,1) 25 1,8 ± 0,7 1,6 (1,3-2,3) 24 1,8 ± 1,7 1,4 (1,0-1,8) 25 1,7 ± 0,6 1,6 (1,2-2,0) 25 1,5 ± 0,6 1,3 (1,1-1,8) 25 1,6 ± 0,5 1,5 (1,3-1,9) 24 1,7 ± 0,9 1,4 (1,0-1,9) 7 1,7 ± 0,4 1,6 (1,4-1,9) 25 1,5 ± 0,7 1,2 (0,9-1,9) 0:2/5/6/7/8 0:9;0:11 1:2/7/11 2:3/4 3:11, 4:11 25 2,1 ± 1,1 1,8 (1,4-2,4) 25 1,7 ± 0,5 1,5 (1,3-2,1) 25 1,6 ± 0,5 1,7 (1,2-2,0) 25 1,8 ± 0,7 1,6 (1,3-2,0) 25 1,8 ± 0,5 1,8 (1,4-2,1) 24 2,0 ± 1,6 1,7 (1,2-2,1) 24 1,7 ± 0,5 1,6 (1,3-2,0) 25 1,9 ± 0,9 1,7 (1,2-2,4) 23 1,8 ± 0,8 1,4 (1,2-2,0) 23 1,7 ± 0,6 1,6 (1,1-2,2) 2 1,5 ± 0,5 1,5 (1,2-1,9) 24 1,7 ± 0,7 1,6 (1,3-2,2) 25 1,3 ± 0,8 1,2 (0,8-1,6) 25 1,1 ± 0,5 1,0 (0,8-1,5) 25 1,1 ± 0,6 0,9 (0,7-1,3) 25 1,5 ± 1,8 1,2 (0,8-1,5) 25 1,5 ± 0,9 1,5 (0,9-1,8) 25 1,2 ± 0,8 0,9 (0,8-1,5) 25 1,4 ± 0,6 1,2 (1,0-1,7) 25 1,3 ± 0,6 1,2 (0,9-1,6) 25 1,5 ± 1,2 1,2 (0,9-2,0) 24 1,2 ± 0,4 1,1 (0,7-1,6) 12 1,3 ± 0,6 1,1 (0,8-1,5) 25 1,3 ± 0,7 1,1 (0,8-1,6) 2:4 2:6 25 1,9 ± 0,8 1,5 (1,2-2,6) 25 1,7 ± 0,6 1,4 (1,2-2,3) 23 1,5 ± 0,6 1,3 (1,0-1,9) 21 1,5 ± 0,7 1,4 (1,0-2,1) 24 2,0 ± 1,4 1,6 (1,1-2,6) 25 1,8 ± 0,9 1,5 (1,0-2,3) 25 1,9 ± 0,7 1,8 (1,3-2,4) 25 1,9 ± 0,9 1,5 (1,2-2,4) 24 1,6 ± 0,6 1,4 (1,1-1,9) 24 1,5 ± 0,7 1,4 (0,9-1,9) 12 1,9 ± 1,0 1,4 (1,2-2,7) 25 1,7 ± 0,9 1,7 (1,0-2,2) 2:6 x ±s Median (1.-3. Quartil) Mastitis (1) (n) x ±s Median (1.-3. Quartil) LMV (2) (n) x ±s Median (1.-3. Quartil) Gebärparese (3) (n) x ±s Median (1.-3. Quartil) Klauen(n) x ±s erkrankung (4) Median (1.-3. Quartil) Endometritis/ (n) x ±s Lochiometra (5) Median (1.-3. Quartil) Retentio (n) x ±s secundinarum (6) Median (1.-3. Quartil) Ovarialzyste(n) (7) (n) x ±s Median (1.-3. Quartil) Totgeburt (8) (n) x ±s Median (1.-3. Quartil) Schwergeburt (9) (n) x ±s Median (1.-3. Quartil) Frühgeburt (10) (n) x ±s Median (1.-3. Quartil) Zwillings(n) x ±s trächtigkeit (11) Median (1.-3. Quartil) signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den Gruppen signifikante Differenzen (WilcoxonTest p≤0,05) zwischen den EZ 1:3 2:3 3:4 1:3 2:3 3:4 1:3 2:3 3:4 1:3 2:3 1:3 2:3 1:3 2:3 3:4 3:4 1:4 2:3 3:4 1:3 2:3 3:4 1:2 2:3 Anhang Tab. B.9: statistische Maßzahlen Albumin (g/l Serum) Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Entnahmezeitpunkt 1 28. d a.p. Entnahmezeitpunkt 2 10. d a.p. Entnahmezeitpunkt 3 3. d p.p. Entnahmezeitpunkt 4 28. d p.p. (n) 25 34 ± 2 33 (33-35) 25 35 ± 2 35 (33-37) 25 36 ± 2 37 (35-37) 25 36 ± 3 37 (35-39) 25 35 ± 3 36 (34-37) 24 35 ± 2 35 (34-37) 25 36 ± 3 35 (35-37) 25 35 ± 2 35 (33-36) 25 36 ± 2 36 (34-37) 24 36 ± 4 36 (34-38) 7 35 ± 3 35 (31-37) 25 36 ± 2 36 (35-37) 0:1;0:2 0:3;0:4 0:5;0:6;0:8 0:9;0:11 25 33 ± 3 34 (32-34) 25 33 ± 3 33 (31-35) 25 34 ± 2 35 (33-36) 25 35 ± 3 35 (33-37) 25 34 ± 3 35 (33-36) 24 34 ± 2 33 (33-35) 24 35 ± 3 35 (34-36) 25 34 ± 2 34 (33-35) 23 35 ± 2 35 (33-36) 23 35 ± 4 36 (33-37) 2 29 ± 0,1 29 (29-29) 24 35 ± 2 34 (33-35) 0:3;0:4 0:6;0:8 0:9 0:10 25 34 ± 3 33 (32-36) 25 33 ± 3 33 (31-34) 25 33 ± 3 34 (31-36) 25 33 ± 4 34 (30-35) 25 34 ± 4 34 (33-37) 25 31 ± 3 31 (29-32) 25 33 ± 3 33 (31-34) 25 34 ± 3 34 (32-36) 25 31 ± 3 31 (29-34) 24 31 ± 4 32 (29-33) 12 31 ± 3 31 (28-33) 25 33 ± 3 32 (30-35) 0:5 0:8 0:9 0:10 25 36 ± 2 35 (34-37) 25 35 ± 4 34 (32-38) 23 30 ± 3 31 (27-32) 21 35 ± 3 34 (32-37) 24 35 ± 3 35 (33-37) 25 29 ± 4 28 (27-32) 25 35 ± 3 35 (34-37) 25 35 ± 3 35 (33-37) 24 32 ± 4 32 (31-34) 24 32 ± 3 32 (31-34) 12 32 ± 4 33 (29-34) 25 33 ± 3 33 (31-34) 0:2 0:5 0:8;0:9 0:10;0:11 x ±s Median (1.-3. Quartil) Mastitis (1) (n) x ±s Median (1.-3. Quartil) LMV (2) (n) x ±s Median (1.-3. Quartil) Gebärparese (3) (n) x ±s Median (1.-3. Quartil) Klauen(n) x ±s erkrankung (4) Median (1.-3. Quartil) Endometritis/ (n) x ±s Lochiometra (5) Median (1.-3. Quartil) Retentio (n) x ±s secundinarum (6) Median (1.-3. Quartil) Ovarialzyste(n) (7) (n) x ±s Median (1.-3. Quartil) Totgeburt (8) (n) x ±s Median (1.-3. Quartil) Schwergeburt (9) (n) x ±s Median (1.-3. Quartil) Frühgeburt (10) (n) x ±s Median (1.-3. Quartil) Zwillings(n) x ±s trächtigkeit (11) Median (1.-3. Quartil) signifikante Differenzen (MannWhitney-U-Test p≤0,05) zwischen den gesunden und erkrankten Tieren (bzw. Zwillingsträchtigkeiten) signifikante Differenzen (WilcoxonTest p≤0,05) zwischen den EZ 1:4 2:4 3:4 1:2 1:3 3:4 1:2 1:3;1:4 2:4 3:4 1:2 1:3 1:4 2:3 1:2 1:2 1:3;1:4 2:3 2:4;3:4 1:2 1:3 2:3 3:4 1:2 3:4 1:2 1:3;1:4 2:3 2:4 1:2 1:3;1:4 2:3 2:4 1:3 1:2 1:3;1:4 2:3 2:4 Anhang Tab. B.10: statistische Maßzahlen Natrium (mmol/l Serum) Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen (n) x ±s Mastitis (1) LMV (2) Gebärparese (3) Klauenerkrankung (4) Endometritis/ Lochiometra (5) Retentio secundinarum (6) Ovarialzyste(n) (7) Totgeburt (8) Schwergeburt (9) Frühgeburt (10) Zwillingsträchtigkeit (11) Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den Gruppen Entnahmezeitpunkt 1 28. d a.p. Entnahmezeitpunkt 2 10. d a.p. Entnahmezeitpunkt 3 3. d p.p. Entnahmezeitpunkt 4 28. d p.p. 25 25 142 ± 3 143 ± 3 142 142 (140-144) (141-144) 25 25 145 ± 3 145 ± 3 145 145 (142-146) (143-147) 25 25 144 ± 3 145 ± 3 144 145 (143-145) (143-148) 25 25 145 ± 3 145 ± 3 145 145 (143-147) (144-146) 25 25 145 ± 3 145 ± 3 145 146 (143-148) (143-148) 24 24 145 ± 2 145 ± 3 145 145 (143-146) (144-148) 25 24 145 ± 3 145 ± 3 145 145 (143-147) (143-147) 25 25 144 ± 4 144 ± 4 143 144 (142-146) (142-146) 25 23 146 ± 2 146 ± 3 146 146 (145-147) (144-149) 24 23 145 ± 4 146 ± 4 145 146 (143-147) (144-147) 7 2 147 ± 3 147 ± 1 148 147 (145-150) (146-147) 25 24 145 ± 2 146 ± 3 145 146 (144-147) (144-149) 0:1/2/3/4/5/ 0:1/2/3/4/50 0:6/8/9/10 0:6/8/9/11 0:11, 1:8/10 7:8 2:8/10, 3:10 7:11 5:10 7:8/10/11 25 145 ± 3 144 (143-146) 25 146 ± 3 145 (144-148) 25 147 ± 3 146 (145-149) 25 146 ± 4 146 (143-149) 25 148 ± 3 147 (146-150) 25 146 ± 3 146 (144-148) 25 146 ± 3 146 (143-147) 25 145 ± 3 145 (143-148) 25 147 ± 3 147 (144-149) 24 145 ± 3 145 (144-148) 12 145 ± 3 146 (143-148) 25 146 ± 2 146 (145-147) 0:1/2/4/5/8 0:11, 1:4 4:6/7/9/10 4:11 25 141 ± 4 141 (139-144) 25 143 ± 2 143 (141-144) 23 143 ± 3 143 (140-145) 21 144 ± 3 143 (142-146) 24 144 ± 3 144 (142-147) 25 143 ± 3 143 (141-146) 25 143 ± 3 143 (141-145) 25 142 ± 3 141 (140-145) 24 144 ± 2 145 (142-146) 24 143 ± 3 143 (140-146) 12 145 ± 2 146 (142-146) 25 143 ± 3 143 (141-145) 0:3/4/5/6/8 0:9/10 1:4/8 4:7 7:8/10 signifikante Differenzen (Wilcoxon-Test p≤0,05) zwischen den EZ 1:3 2:3 2:4 3:4 1:4 2:4 3:4 1:3 2:3 2:4 3:4 2:4 3:4 1:3 2:3 3:4 1:4 2:4 3:4 1:4 2:4 3:4 1:3 1:4 2:3 2:4;3:4 1:4 2:4 3:4 1:4 2:4 3:4 1:4 2:4 3:4 Anhang Tab. B.11: statistische Maßzahlen Kalium (mmol/l Serum) Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Entnahmezeitpunkt 1 28. d a.p. Entnahmezeitpunkt 2 10. d a.p. Entnahmezeitpunkt 3 3. d p.p. (n) 25 4,5 ± 0,3 4,6 (4,2-4,7) 25 4,5 ± 0,3 4,4 (4,3-4,8) 25 4,6 ± 0,3 4,5 (4,4-4,8) 25 4,6 ± 0,4 4,5 (4,3-4,9) 25 4,6 ± 0,3 4,6 (4,4-4,9) 24 4,7 ± 0,3 4,7 (4,5-5,0) 25 4,5 ± 0,3 4,5 (4,2-4,8) 25 4,5 ± 0,4 4,5 (4,2-4,8) 25 4,6 ± 0,4 4,5 (4,3-4,8) 24 4,5 ± 0,2 4,5 (4,4-4,7) 7 4,6 ± 0,4 4,6 (4,3-4,8) 25 4,7 ± 0,3 4,7 (4,4-4,9) 1:5 5:6/7/9 25 4,5 ± 0,3 4,6 (4,4-4,7) 25 4,5 ± 0,2 4,5 (4,4-4,6) 25 4,6 ± 0,3 4,5 (4,4-4,9) 25 4,6 ± 0,4 4,6 (4,2-4,8) 25 4,7 ± 0,4 4,6 (4,5-4,9) 24 4,6 ± 0,3 4,7 (4,4-4,8) 24 4,5 ± 0,3 4,6 (4,2-4,7) 25 4,5 ± 0,3 4,6 (4,4-4,7) 23 4,6 ± 0,3 4,6 (4,3-4,9) 23 4,7 ± 0,3 4,7 (4,4-5,0) 2 4,9 ± 0,5 4,9 (4,5-5,2) 24 4,6 ± 0,3 4,6 (4,4-4,9) 1:4 25 4,4 ± 0,3 4,3 (4,2-4,5) 25 4,3 ± 0,3 4,3 (4,2-4,5) 25 4,4 ± 0,3 4,4 (4,3-4,5) 25 4,5 ± 0,4 4,5 (4,2-4,8) 25 4,6 ± 0,3 4,6 (4,5-4,8) 25 4,2 ± 0,3 4,3 (4,0-4,5) 25 4,4 ± 0,3 4,4 (4,2-4,6) 25 4,5 ± 0,2 4,5 (4,3-4,7) 25 4,4 ± 0,4 4,4 (4,2-4,6) 24 4,2 ± 0,4 4,3 (4,1-4,4) 12 4,4 ± 0,4 4,2 (4,1-4,7) 25 4,4 ± 0,3 4,4 (4,2-4,5) 0:4 1:4/7 2:4 3:5, 4:5 x ±s Mastitis (1) LMV (2) Gebärparese (3) Klauenerkrankung (4) Endometritis/ Lochiometra (5) Retentio secundinarum (6) Ovarialzyste(n) (7) Totgeburt (8) Schwergeburt (9) Frühgeburt (10) Zwillingsträchtigkeit (11) Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den Gruppen Entnahmesignifikante zeitpunkt 4 Differenzen 28. d p.p. (Wilcoxon-Test p≤0,05) zwischen den EZ 25 1:4 4,7 ± 0,3 2:3 4,7 3:4 (4,5-4,9) 25 1:3 4,6 ± 0,3 2:3 4,6 3:4 (4,5-4,7) 23 1:3 4,7 ± 0,5 2:3 4,7 3:4 (4,5-5,0) 21 3:4 4,8 ± 0,5 4,8 (4,4-5,3) 24 3:4 4,8 ± 0,4 4,7 (4,5-5,0) 25 1:3 4,8 ± 0,4 2:3 4,8 2:4 (4,6-5,0) 3:4 25 1:4 4,7 ± 0,3 3:4 4,6 (4,5-4,9) 25 1:4 4,8 ± 0,4 2:4 4,7 3:4 (4,5-5,1) 24 1:4 4,8 ± 0,3 2:3 4,8 3:4 (4,6-5,0) 24 1:2 4,8 ± 0,4 1:3 4,8 1:4 (4,5-5,0) 2:3;3:4 12 3:4 4,9 ± 0,3 5,0 (4,6-5,2) 25 1:3 4,9 ± 0,3 1:4 4,9 2:3 (4,8-5,1) 2:4;3:4 0:11 1:5/8/10/11 6:10 6:11 Anhang Tab. B.12: statistische Maßzahlen Mg (mmol/l Serum) Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Entnahmezeitpunkt 1 28. d a.p. Entnahmezeitpunkt 2 10. d a.p. Entnahmezeitpunkt 3 3. d p.p. Entnahmezeitpunkt 4 28. d p.p. (n) 25 1,00 ± 0,07 0,99 (0,95-1,05) 25 0,95 ± 0,07 0,94 (0,90-0,99) 25 1,02 ± 0,10 1,01 (0,94-1,09) 25 1,00 ± 0,09 0,98 (0,93-1,07) 25 1,07 ± 0,34 1,00 (0,94-1,08) 24 0,99 ± 0,10 0,99 (0,93-1,08) 25 0,95 ± 0,07 0,94 (0,89-1,00) 25 0,97 ± 0,09 0,97 (0,92-1,02) 25 1,00 ± 0,10 0,99 (0,97-1,06) 24 1,01 ± 0,10 1,00 (0,95-1,10) 7 0,94 ± 0,10 0,95 (0,83-1,03) 25 0,99 ± 0,09 0,98 (0,91-1,06) 0:1/6 1:2/4/8/9 2:6, 4:6 6:8/9 25 0,91 ± 0,09 0,91 (0,86-0,98) 25 0,90 ± 0,09 0,91 (0,84-0,97) 25 0,94 ± 0,11 0,95 (0,85-1,01) 25 0,92 ± 0.09 0,93 (0,86-1,00) 25 0,96 ± 0,09 0,95 (0,90-1,03) 24 0,91 ± 0,09 0,91 (0,82-0,99) 24 0,94 ± 0,08 0,97 (0,86-1,01) 25 0,91 ± 0,07 0,92 (0,87-0,97) 23 0,92 ± 0,08 0,92 (0,84-0,99) 23 0,94 ± 0,09 0,94 (0,87-0,99) 2 0,95 ± 0,01 0,95 (0,94-0,95) 24 0,92 ± 0,09 0,92 (0,87-0,99) 1:4 25 0,93 ± 0,13 0,96 (0,83-1,03) 25 0,92 ± 0,15 0,87 (0,81-0,96) 25 0,88 ± 0,13 0,84 (0,79-1,02) 25 0,98 ± 0,23 0,88 (0,81-1,14) 25 0,96 ± 0,16 0,94 (0,82-1,07) 25 0,85 ± 0,16 0,80 (0,75-0,95) 25 0,84 ± 0,10 0,83 (0,78-0,91) 25 0,87 ± 0,13 0,85 (0,78-0,94) 25 0,83 ± 0,12 0,83 (0,76-0,89) 24 0,86 ± 0,14 0,85 (0,74-1,00) 12 0,78 ± 0,10 0,76 (0,70-0,84) 25 0,85 ± 0,12 0,83 (0,77-0,93) 0:5/6/8/10/ 0:11, 1:8/10 2:10, 3:5/8 3:10,4:5/6/7 4:8/9/10/11 7:10 25 1,06 ± 0,06 1,06 (1,01-1,09) 25 1,05 ± 0,11 1,06 (0,99-1,11) 23 1,02 ± 0,16 1,01 (0,92-1,12) 21 1,04 ± 0,10 1,02 (0,96-1,10) 24 1,07 ± 0,16 1,04 (0,93-1,17) 25 0,98 ± 0,11 1,01 (0,92-1,06) 25 1,06 ± 0,10 1,05 (0,98-1,12) 25 1,07 ± 0,09 1,06 (1,00-1,13) 24 1,03 ± 0,11 1,04 (0,95-1,11) 24 1,07 ± 0,14 1,11 (1,00-1,15) 12 1,02 ± 0,72 1,02 (0,95-1,06) 25 1,06 ± 0,09 1,06 (1,01-1,13) 0:5 1:5 5:6/7/9/11 x ±s Mastitis (1) LMV (2) Gebärparese (3) Klauenerkrankung (4) Endometritis/ Lochiometra (5) Retentio secundinarum (6) Ovarialzyste(n) (7) Totgeburt (8) Schwergeburt (9) Frühgeburt (10) Zwillingsträchtigkeit (11) Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) (n) x ±s Median (1.-3. Quartil) signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den Gruppen signifikante Differenzen (Wilcoxon-Test p≤0,05) zwischen den EZ 1:2 1:3 1:4 2:4;3:4 1:2 1:4 2:4 3:4 1:2 1:3 2:4 3:4 1:2 2:4 1:2 2:4 3:4 1:2 1:3 2:4 3:4 1:3 1:4 2:3 2:4;3:4 1:2 1:3 1:4 2:4;3:4 1:2 1:3 2:3 2:4;3:4 1:2 1:3 2:3 2:4;3:4 1:3 1:4 3:4 1:2 1:3 1:4;2:4 2:3;3:4 Anhang Tab. B.13: statistische Maßzahlen Östradiol (pg/ml Serum) Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Entnahmezeitpunkt 1 28. d a.p. Entnahmezeitpunkt 2 10. d a.p. Entnahmezeitpunkt 3 3. d p.p. (n) 13 28,6 ± 8,2 30,8 (20,7-34,5) 20 27,3 ± 8,2 26,3 (21,3-29,8) 10 30,4 ± 8,9 32,9 (22,5-36,4) 10 29,3 ± 10,3 30,9 (20,7-34,1) 18 29,2 ± 9,0 30,4 (20,6-33,7) 13 28,5 ± 9,4 23,9 (22,0-36,9) 19 29,2 ± 10,9 27,3 (20,8-36,5) 16 33,1 ± 8,3 34,9 (26,6-38,8) 12 27,1 ± 12,1 23,7 (18,2-38,4) 5 26,0 ± 7,4 28,7 (18,5-32,3) 5 59,0 ± 56,7 39,7 (21,1-107) 13 32,5 ± 20,2 27,1 (19,2-39,5) 1:7 12 65,7 ± 31,2 62,7 (48,9-74,9) 20 74,5 ± 51,3 49,7 (34,7-121) 10 77,3 ± 65,2 60,1 (31,0-102) 10 54,0 ± 25,8 53,2 (30,3-74,6) 18 68,4 ± 57,6 45,2 (38,7-70,4) 12 53,8 ± 57,4 34,9 (29,0-42,1) 18 57,3 ± 39,4 46,4 (34,8-57,9) 16 75,7 ± 57,3 49,2 (37,2-96,6) 12 76,7 ± 56,2 61,3 (42,3-80,9) 5 52,7 ± 32,7 41,7 (33,1-77,7) 2 58,1 ± 60,2 58,1 (15,5-101) 12 99,8 ± 88,9 62,7 (27,4-162) 13 13 22,1 ± 7,3 15,3 ± 5,9 25,0 14,0 (14,7-27,6) (10,4-20,5) 20 20 22,7 ± 9,4 16,8 ± 6,9 23,5 15,6 (14,1-30,0) (11,9-22,4) 10 8 23,7 ± 11,1 17,0 ± 10,0 25,1 14,4 (13,1-34,6) (8,7-26,7) 10 8 28,9 ± 20,5 17,1 ± 6,7 25,1 18,6 (13,9-36,5) (12,6-20,5) 18 17 20,7 ± 11,6 15,6 ± 8,0 19,6 15,9 (9,9-27,7) (6,6-19,9) 14 14 17,6 ± 7,7 15,1 ± 7,2 16,1 14,8 (11,5-25,5) (9,6-18,3) 19 18 23,9 ± 8,9 17,3 ± 6,7 23,4 15,3 (17,0-32,1) (12,2-23,0) 16 16 22,3 ± 7,7 19,3 ± 7,2 21,8 19,5 (16,5-28,0) (13,7-25,6) 12 12 20,0 ± 7,2 12,5 ± 5,4 19,2 13,8 (15,5-26,7) (9,5-16,8) 5 5 23,3 ± 11,6 13,4 ± 5,4 22,9 10,5 (11,9-35,0) (9,0-19,3) 8 8 28,1 ± 7,9 14,3 ± 8,8 29,5 14,1 (20,9-34,2) (4,9-21,9) 13 13 26,8 ± 10,7 19,5 ± 7,4 26,3 17,2 (17,4-34,9) (13,7-26,7) 0:10, 5:6 7:11 5:10, 5:11 8:11 8:10 x ±s Median (1.-3. Quartil) Mastitis (1) (n) x ±s Median (1.-3. Quartil) LMV (2) (n) x ±s Median (1.-3. Quartil) Gebärparese (3) (n) x ±s Median (1.-3. Quartil) Klauen(n) x ±s erkrankung (4) Median (1.-3. Quartil) Endometritis/ (n) x ±s Lochiometra (5) Median (1.-3. Quartil) Retentio (n) x ±s secundinarum (6) Median (1.-3. Quartil) Ovarialzyste(n) (7) (n) x ±s Median (1.-3. Quartil) Totgeburt (8) (n) x ±s Median (1.-3. Quartil) Schwergeburt (9) (n) x ±s Median (1.-3. Quartil) Frühgeburt (10) (n) x ±s Median (1.-3. Quartil) Zwillings(n) x ±s trächtigkeit (11) Median (1.-3. Quartil) signifikante Differenzen (MannWhitney-U-Test p≤0,05) zwischen den Gruppen Entnahmezeitpunkt 4 28. d p.p. signifikante Differenzen (WilcoxonTest p≤0,05) zwischen den EZ 1:2 1:3, 1:4 2:3, 2:4 3:4 1:2 1:4 2:3, 2:4 3:4 1:2 1:4 2:3 2:4 1:2 1:4 2:3 2:4 1:2 1:3, 1:4 2:3, 2:4 3:4 1:2 1:3, 1:4 2:3 2:4 1:2 1:4 2:3, 2:4 3:4 1:2 1:3, 1:4 2:3 2:4 1:2 1:4 2:3, 2:4 3:4 1:2 1:4 2:3, 2:4 3:4 1:4 3:4 1:2 1:4 2:3, 2:4 3:4 Anhang Tab. B.14: statistische Maßzahlen IGF-1 Kühe (ng/ml Serum) Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen Entnahmezeitpunkt 1 28. d a.p. Entnahmezeitpunkt 2 10. d a.p. Entnahmezeitpunkt 3 3. d p.p. Entnahmezeitpunkt 4 28. d p.p. (n) 7 85,0 ± 66,9 75,3 (15,1-168) 15 46,3 ± 67,5 15,4 (<10-46,2) 6 134,1± 79,9 134,0 (66,3-202) 10 65,0 ± 53,0 63,2 (11,0-109) 14 51,2 ± 55,3 32,6 (<10-62,0) 8 46,9 ± 48,0 26,3 (16,9-73,2) 14 40,5 ± 44,9 16,8 (<10-69,9) 13 52,5 ± 74,5 16,8 (11,9-66,5) 6 103 ± 51,4 114,0 (53,4-146) 3 76,3± 60,5 77,1 (41,7-85,8) 2 15,9 ± 3,77 16,0 (<10-14,3) 9 29,9 ± 17,5 29,8 (13,3-45,5) 1:8, 2:6/11, 6:8, 7:8, 8:11, 9:11 7 67,2 ± 68,3 22,1 (15,1-139) 15 41,5 ± 72,9 12,3 (<10-56,9) 6 99,6 ± 57,8 127,0 (43,7-142) 10 51,6 ± 37,1 52,7 (13,2-73,1) 14 29,8 ± 26,1 16,1 (<10-52,2) 8 26,4 ± 32,6 11,0 (<10-29,8) 14 33,4 ± 41,1 15,4 (<10-45,1) 13 34,3 ± 59,1 <10 (<10-27,0) 6 54,8 ± 8,1 55,9 (46,6-62,7) 3 59,6 ± 69,8 24,2 (14,7-112) 1 10,9 ± 0,0 10,9 (10,9-10,9) 10 16,8 ± 8,2 14,0 (<10-25,6) 2:4/5/11 3:7/11, 4:8 6:8, 7:8 8:11 7 19,6 ± 12,1 14,4 (<10-35,0) 15 10,4 ± 3,4 <10 (<10-<10) 6 14,0 ± 9,2 <10 (<10-21,6) 10 12,1 ± 7,1 <10 (<10-11,6) 14 17,0 ± 32,7 <10 (<10-<10) 9 12,6 ± 10,7 <10 (<10-<10) 14 12,0 ± 7,4 <10 (<10-11,8) 13 <10 ± 3,0 <10 (<10-<10) 6 11,9 ±4,8 <10 (<10-16,3) 3 78,0 ± 76,5 <10 (<10-130) 5 12,1 ± 4,7 10,3 (<10-17,1) 9 <10 ± 0,0 <10 (<10-<10) 0:1/4/7/11 7 56,6 ± 66,1 <10 (<10-126) 15 13,2 ± 9,7 <10 (<10-10,9) 5 12,5 ± 6,9 <10 (<10-19,4) 9 10,2 ± 2,3 <10 (<10-11,4) 13 <10 ± 0,0 <10 (<10-<10) 9 10,8 ± 3,4 <10 (<10-13,1) 14 16,5 ± 19,2 <10 (<10-14,1) 13 14,4 ± 14,1 <10 (<10-<10) 6 25,3 ± 17,6 21,4 (<10-43,1) 3 23,2 ± 22,4 10,5 (10,0-49,0) 5 14,6 ± 6,6 13,8 (<10-20,9) 9 19,6 ± 33,9 <10 (<10-<10) 0:4, 1:4/8 2:4, 3:8/9 4:5/6/8/9 5:8, 7:8/9 8:11, 9:11 x ±s Median (1.-3. Quartil) Mastitis (1) (n) x ±s Median (1.-3. Quartil) LMV (2) (n) x ±s Median (1.-3. Quartil) Gebärparese (3) (n) x ±s Median (1.-3. Quartil) Klauen(n) x ±s erkrankung (4) Median (1.-3. Quartil) Endometritis/ (n) x ±s Lochiometra (5) Median (1.-3. Quartil) Retentio (n) x ±s secundinarum (6) Median (1.-3. Quartil) Ovarialzyste(n) (7) (n) x ±s Median (1.-3. Quartil) Totgeburt (8) (n) x ±s Median (1.-3. Quartil) Schwergeburt (9) (n) x ±s Median (1.-3. Quartil) Frühgeburt (10) (n) x ±s Median (1.-3. Quartil) Zwillings(n) x ±s trächtigkeit (11) Median (1.-3. Quartil) signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den Gruppen signifikante Differenzen (WilcoxonTest p≤0,05) zwischen den EZ 1:3 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4 1:2 1:3 1:4 2:4 1:2 1:3 1:4 1:3 1:4 2:3 1:2 1:3 1:4 2:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4 1:2 1:3 2:3 Anhang Tab. B.15: statistische Maßzahlen IGF-1 Färsen (ng/ml Serum) Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) statistische Maßzahlen (n) x ±s Median (1.-3. Quartil) Mastitis (1) (n) x ±s Median (1.-3. Quartil) LMV (2) (n) x ±s Median (1.-3. Quartil) Gebärparese (3) (n) x ±s Median (1.-3. Quartil) Klauen(n) x ±s erkrankung (4) Median (1.-3. Quartil) Endometritis/ (n) x ±s Lochiometra (5) Median (1.-3. Quartil) Retentio (n) x ±s secundinarum (6) Median (1.-3. Quartil) Ovarialzyste(n) (7) (n) x ±s Median (1.-3. Quartil) Totgeburt (8) (n) x ±s Median (1.-3. Quartil) Schwergeburt (9) (n) x ±s Median (1.-3. Quartil) Frühgeburt (10) (n) x ±s Median (1.-3. Quartil) Zwillings(n) x ±s trächtigkeit (11) Median (1.-3. Quartil) signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den Gruppen Entnahmezeitpunkt 1 28. d a.p. Entnahmezeitpunkt 2 10. d a.p. Entnahmezeitpunkt 3 3. d p.p. Entnahmezeitpunkt 4 28. d p.p. 4 4 4 4 50,3 ± 28,2 33,2 ± 24,1 27,8 ± 37,5 <10 ± 0,0 61,1 28,7 <10 <10 (20,8-69,1) (13,8-57,2) (<10-65,3) (<10-<10) 5 5 5 5 82,8 ± 71,0 63,6 ± 64,5 41,9 ± 71,6 17,4 ± 10,6 51,5 39,7 <10 16,5 (28,7-152) (18,4-121) (<10-91,3) (<10-26,3) 4 4 4 4 57,4 ± 46,4 27,8 ± 29,0 <10 ± 0,0 14,2 ± 8,9 43,8 12,3 <10 <10 (19,3-109) (<10-61,3) (<10-<10) (<10-24,5) - 4 29,2 ± 22,5 27,3 (20,6-33,7) 5 57,2 ± 42,4 46,2 (19,1-101) 5 68,2 ± 42,4 50,3 (33,7-115) 4 23,2 ± 22,4 11,6 (<10-49,0) 5 67,0 ± 30,8 64,5 (38,9-96,9) 2 43,1 ± 1,0 43,1 (31,8-34,0) 3 64,4 ± 26,3 52,9 (45,9-94,5) 4 <10 ± 0,0 <10 (<10-<10) 6:11 8:11 4 12,6 ± 9,3 11,5 (<10-18,4) 5 36,9 ± 24,7 24,9 (16,8-63,1) 4 66,3 ± 45,4 41,7 (30,9-114) 4 23,3 ± 15,8 20,7 (<10-40,3) 5 53,2 ± 34,5 60,9 (16,7-74,8) 2 41,0 ± 26,2 40,9 (16,8-45,8) 1 31,2 ± 0,0 31,2 (31,2-31,2) 2 <10 ± 0,0 <10 (<10-<10) 4 <10 ± 0,0 <10 (<10-13,1) 5 <10 ± 1,3 <10 (<10-10,5) 5 14,1 ± 4,7 14,1 (<10-18,7) 4 12,2 ± 5,5 <10 (<10-18,6) 5 12,9 ± 5,3 10,1 (<10-18,7) 2 <10 ± 0,0 <10 (<10-<10) 3 13,2 ± 6,5 10,0 (<10-20,7) 4 <10 ± 0,0 <10 (<10-<10) 4 15,6 ± 12,8 <10 (<10-24,5) 5 11,0 ± 4,4 <10 (<10-13,9) 5 25,1 ± 18,6 21,0 (<10-44,1) 4 14,5 ± 9,6 <10 (<10-25,6) 5 15,1 ± 8,2 12,5 (<10-20,9) 2 <10 ± 0,0 <10 (<10-<10) 3 26,4 ± 10,9 30,5 (14,0-34,7) 4 <10 ± 0,0 <10 (<10-<10) 0:4/10 5:10 signifikante Differenzen (WilcoxonTest p≤0,05) zwischen den EZ 1:3 1:4 1:3 1:3 1:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 1:3 1:4 2:3 2:4 1:2 1:4 2:3 2:4 1:3 Anhang Anhang C Tab. C.1: signifikante Differenzen (Wilcoxon-Test p≤0,05) zwischen den Entnahmezeitpunkten Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) Leukozyten BHB. FFS Glucose Insulin Bilirubin Cholesterol 1:2 2:3 1:2 1:3 1:4 2:3;2:4 1:2 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4 1:2 1:3 1:4 2:3;2:4 1:2 1:3 1:4;2:3 2:4;3:4 1:3 1:4 2:3 2:4;3:4 1:2 1:3 1:4 2:3;2:4 1:2 1:3 1:4 2:3;2:4 1:2 1:3 1:4 2:3;2:4 1:2 1:3 2:3 2:4;3:4 1:3 1:3;1:4 2:3;2:4 3:4 1:4 2:4 3:4 1:2; 2:3 1:3; 2:4 1:4; 3:4 1:4 2:4 3:4 1:3 1:4 2:3 2:4;3:4 1:2; 2:3 1:3; 2:4 1:4; 3:4 1:2 1:3 1:4 2:4;3:4 1:4 3:4 1:2 1:3, 1:4 2:3 2:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 1:2 1:3 1:4 2:3;2:4 1:2; 2:3 1:3; 2:4 1:4; 3:4 1:4 2:4 3:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4;3:4 1:2;1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4;3:4 1:3 3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:3 2:3 3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:3 2:3 3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:3 1:4 3:4 1:2 1:3 1:4 2:3;3:4 1:2 1:3 1:4;2:3 2:4;3:4 Mastitis (1) LMV (2) 1:2 2:4 Gebärparese (3) 1:2 2:3 2:4 Klauenerkrankung (4) Endometritis/ Lochiometra (5) Retentio secundinarum (6) 1:3 2:3 2:4 1:2 1:3 1:4 2:3;3:4 Ovarialzyste(n) (7) Totgeburt (8) Schwergeburt (9) 1:3 2:3 3:4 Frühgeburt (10) Zwillingsträchtigkeit (11) 1:3 1:4 2:3 3:4 1:3 1:4 2:3 3:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4, 3:4 1:2 1:3 1:4 1:2; 2:3 1:3; 2:4 1:4; 3:4 1:2 1:4 2:4 3:4 1:4 2:4 3:4 1:2; 2:3 1:3; 2:4 1:4; 3:4 1:4 2:4 3:4 1:2; 2:3 1:3; 2:4 1:4; 3:4 1:4 2:4 3:4 1:2; 2:3 1:3; 2:4 1:4; 3:4 1:4 2:4 3:4 1:3 1:4 2:3 2:4, 3:4 1:2 1:3, 1:4 2:3 2:4 1:3 1:4 2:4 3:4 1:4 2:3 2:4 1:3 3:4 3:4 1:3 1:2 1:3 1:4 2:3;3:4 1:2 1:4 2:3 2:4;3:4 1:4 Anhang Tab. C.2: signifikante Differenzen (Wilcoxon-Test p≤0,05) zwischen den Entnahmezeitpunkten Gesundheitsstatus/ Zwillingsträchtigkeit Eisen Protein Harnstoff Creatinin GLDH GGT AST gesund (0) 1:2 1:3 1:4 1:3 2:3 3:4 1:3 2:3 3:4 1:4 2:4 3:4 1:2 1:3 Mastitis (1) 1:2 1:3 1:4 1:4 2:4 3:4 1:3 1:4 2:4 3:4 1:2 1:4 2:4 3:4 1:4 2:4 3:4 1:2 1:3 1:4 2:3;2:4 1:2 1:3 1:4 2:3 1:2 1:3 1:4 2:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:3 1:4 2:3;2:4 1:2 1:3 1:4 2:3 1:2 1:3 1:4 2:3;3:4 1:3 1:4 3:4 1:2; 2:4 1:3; 3:4 2:3 1:4 3:4 1:4 2:4 3:4 1:4 2:4 3:4 1:2; 2:4 1:3; 3:4 2:3 1:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:4 2:4 3:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4;3:4 1:3 3:4 1:2 1:3 1:4 2:3;2:4 1:2; 1:3 1:4 2:4 3:4 LMV (2) Gebärparese (3) Klauenerkrankung (4) Endometritis/ Lochiometra (5) Retentio secundinarum (6) Ovarialzyste(n) (7) Totgeburt (8) Schwergeburt (9) Frühgeburt (10) Zwillingsträchtigkeit (11) 1:3; 2:4 1:4 3:4 2:3 1:2 1:3 2:4 3:4 1:2 1:3 2:3 3:4 1:2 1:3 2:4 3:4 1:3 1:4 2:4 3:4 1:3; 1:4 2:3 2:4 3:4 1:4 3:4 1:3 1:4 2:3 3:4 1:2 1:4 3:4 1:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:4 3:4 1:3 1:4 2:4 3:4 1:4 2:4 3:4 1:3 1:3 1:3 1:4 2:4 3:4 1:3 1:4 2:4 3:4 1:3 1:4 2:3 2:4;3:4 1:2 1:3;1:4 2:3;2:4 3:4 1:2 1:3 1:4 2:4;3:4 1:2 1:4 3:4 1:3 3:4 1:4 2:4 3:4 1:4 2:4 3:4 1:4 2:4 3:4 2:4 1:4 3:4 2:4 3:4 1:4 2:4 1:2 1:4 2:3 2:4;3:4 1:3 1:4 2:3 2:4;3:4 Anhang Tab. C.3: signifikante Differenzen (Wilcoxon-Test p≤0,05) zwischen den Entnahmezeitpunkten Gesundheitsstatus/ Zwillingsträchtigkeit gesund (0) AP CK 1:4 Gebärparese (3) 1:3 2:3 3:4 Klauenerkrankung (4) 1:2 2:3 3:4 1:3 2:3 2:4 3:4 1:4 2:3 2:4 Endometritis/ Lochiometra (5) 1:2 1:4 3:4 Retentio secundinarum (6) 1:2 1:3 1:4 Ovarialzyste(n) (7) 2:3 3:4 1:3 1:4 2:3 2:4 1:3 1:4 Totgeburt (8) 1:2 1:4 2:4 3:4 Schwergeburt (9) 1:2 1:3 2:3 Frühgeburt (10) 3:4 LMV (2) Zwillingsträchtigkeit (11) Calcium anorg. IGF 1 Phosphat 1:2 1:4 2:3 2:4;3:4 1:3 1:4 2:3 3:4 2:3 3:4 Mastitis (1) Chlorid 1:4 2:3 2:4 2:3 1:3 1:4 2:3 2:4;3:4 1:2;1:3 1:4 2:4 3:4 1:2 1:4 2:3 2:4;3:4 1:2 1:4 2:4 3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:3 1:4 2:4;3:4 1:2 1:4 2:3 2:4;3:4 1:2 1:4 2:3 2:4;3:4 1:2 1:4 2:3 2:4;3:4 1:2 1:3 1:4;2:3 2:4;3:4 1:2 1:4 2:3 2:4;3:4 1:3 1:4 1:2 1:4 2:3 2:4;3:4 1:3 1:4 2:3 3:4 1:3 2:3 3:4 1:2 1:3 1:4 2:3;3:4 1:2 1:3 2:3 3:4 1:3 2:3 3:4 1:2 1:3 1:4 2:3;3:4 1:3 2:3 2:4 3:4 1:2 1:3 2:3 2:4;3:4 1:2 1:3 1:4 2:3;3:4 1:2 1:3 2:3 2:4;3:4 1:3 3:4 1:2 1:3 2:3 3:4 1:2 1:3 1:4 2:3;3:4 1:2 1:3 1:4 2:3;3:4 1:3 1:4 2:3 2:4;3:4 1:2 1:3 1:4 1:3 1:4 2:3 2:4;3:4 1:3 1:4 2:3 1:2 1:3 1:4 2:3;3:4 1:3 1:4 2:3 2:4 1:3 1:4 1:2 1:3 1:4 2:3;3:4 NSBA/ Harn pH 1:3 1:4 2:3 1:3 1:4 2:3 2:4 1:2,1:3 1:4 2:3 2:4 1:3 1:4 2:3 2:4 1:2 1:3 1:4 2:3,2:4 1:2 1:3 1:4 2:3,2:4 1:2 1:3 1:4 2:3;3:4 1:2 1:3 1:4 2:3,2:4 1:3 1:4 2:3 2:4 1:4 2:3 2:4 NSBA1:2 NSBA1:2 NSBA1:2 NSBA1:2 NSBA1:2 Harn pH 1:2 NSBA1:2 NSBA1:2 Harn pH 1:2 NSBA1:2 Harn pH 1:2 NSBA1:2 NSBA1:2 Harn pH 1:2 1:4 3:4 1:3 2:3 2:4 1:2 1:3 2:3 NSBA1:2 Anhang Anhang D Tab. D.1: signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den KG bzw. Zwillingsträchtigkeit Temperatur 3. d p.p. Puls 3. d p.p. Atmung 3. d p.p. Pansenmotorik 3. d p.p. Leukozytenzahl 28. d a.p. Leukozytenzahl 10. d a.p. Leukozytenzahl 3. d p.p. Leukozytenzahl 28. d p.p. BHB-Konzentration 28. d a.p. BHB-Konzentration 10. d a.p. BHB-Konzentration 3. d p.p. BHB-Konzentration 28. d p.p. FFS-Konzentration 28. d a.p. FFS-Konzentration 10. d a.p. FFS-Konzentration 3. d p.p. FFS-Konzentration 28. d p.p. Glucosekonzentration 28. d a.p. Glucosekonzentration 10. d p.p. Glucosekonzentration 3. d p.p. Glucosekonzentration 28. d p.p. Insulinkonzentration 28. d a.p. Insulinkonzentration 10. d a.p. Insulinkonzentration 3. d p.p. Insulinkonzentration 28. d p.p. Bilirubinkonzentration 28. d a.p. Bilirubinkonzentration 10. d a.p. Bilirubinkonzentration 3. d p.p. Bilirubinkonzentration 28. d p.p. 1:5/8/10, 2:5/6/8/10, 3:5/6/8/9/10, 4:5/6/8/9/10/11, 5:7, 7:8/10, 8:9 1:8, 2:8, 3:8, 4:8, 7:8, 8:11 2:4/6/8/9/11 1:3/10, 2:3/10, 3:4/6/7/8, 4:5/8/9/10/11, 6:10, 7:10/11 1:4/5/8/9, 2:9, 3:6/9, 4:6, 5:6, 6:8/9, 7:9, 9:11 1:5/9 1:6, 2:6/11, 3:6/11, 4:5/6/11, 6:7/8/9, 7:11, 9:11 1:9, 2:4/8/9, 3:4/8/9/11, 4:5/7, 5:8/9, 7:9 2:3/7 1:11, 2:11, 4:11, 6:11, 9:11, 10:11 1:2/5/6/7/11, 2:3/4/6/8/9, 4:5/7/11, 9:11 1:9/10, 2:7, 3:9/10, 4:9/10, 5:7, 6:9/10, 7:8/9/10/11 2:3, 3:11, 4:11, 6:11, 7:11, 9:11 1:3, 2:11, 3:8/11, 4:11, 5:11, 6:11, 7:11, 8:11 9:11 1:2/3/6/7/11, 2:3/4/5/6/7/8/9/10/11, 4:6 1:9/10, 2:9/10, 3:6/7, 4:5/8/9/10, 5:7, 6:9/10, 7:8/9/10/11, 10:11 1:2/5/8/9, 2:3/4/6/10/11, 3:5/8/9, 4:8/9, 6:8/9, 7:8/9, 8:11, 9:10, 9:11 1:8, 2:8/11, 3:8, 4:8, 5:8, 6:8/11, 7:8/9, 8:11, 9:11 1:9/10, 2:8/9/10, 3:4/7, 4:8/9/10/11, 5:7/9, 6:9/10, 7:8/9/10/11 1:9, 2:8/9, 3:6/7, 4:9, 6:8/9/10, 7:8/9/10, 9:11 2:11, 3:11, 4:11, 5:11, 6:11, 7:11 3:5/7, 4:7, 5:9, 6:9, 7:9, 9:11 1:2, 2:5/6/8/10/11, 3:8, 5:7, 7:11 1:4/7, 4:5, 5:7 3:4/10, 4:5/9, 5:10, 6:10, 7:9, 9:10 3:8/11, 5:11, 6:11, 7:11, 9:11 1:2/5/6/8/10/11, 2:3/4/7, 3:4/5, 4:5/6/8/10/11, 5:7 2:3/8/9, 4:9, 6:9, 7:9 Anhang Tab. D.2: signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den KG bzw. Zwillingsträchtigkeit Cholesterolkonzentration 28. d a.p. Cholesterolkonzentration 10. d a.p. Cholesterolkonzentration 3. d p.p. Cholesterolkonzentration 28. d p.p. Proteinkonzentration 28. d a.p. Proteinkonzentration 10. d a.p. Proteinkonzentration 3. d p.p. Proteinkonzentration 28. d p.p. Albuminkonzentration 28. d a.p. Albuminkonzentration 10. d a.p. Albuminkonzentration 3. d p.p. Albuminkonzentration 28. d p.p. Harnstoffkonzentrationen 28. d a.p. Harnstoffkonzentrationen 10. d a.p. Harnstoffkonzentrationen 3. d p.p. Harnstoffkonzentrationen 28. d p.p. Creatininkonzentrationen 28. d a.p. Creatininkonzentrationen 10. d a.p. Creatininkonzentrationen 3. d p.p. Creatininkonzentrationen 28. d p.p. GLDH-Aktivität 28. d a.p. GLDH-Aktivität 10. d a.p. GLDH-Aktivität 3. d p.p. GLDH-Aktivität 28. d p.p. GGT-Aktivität 28. d a.p. GGT-Aktivität 10. d a.p. GGT-Aktivität 3. d p.p. GGT-Aktivität 28. d p.p. 1:3/4, 2:10, 3:8/9/10/11, 4:5/8/9/10/11, 6:10 1:2/3/4/6/10, 2:10, 3:5/9/10/11, 4:5/9/10/11, 5:10, 6:10, 7:10, 8:10, 9:10, 10:11 3:4/11, 4:9, 9:11 1:2/5/6, 2:3/4/6/7/8/9/11, 3:5, 4:5/9/10/11, 5:6/7/8/9/11, 6:9/10/11 1:3/4, 2:4/8/10, 3:5/8/9/10/11, 4:5/7/8/9/10/11, 6:8/10, 7:8, 8:11 2:4/8, 3:5/8/9/10/11, 4:5/6/8/9/10/11, 6:8/10, 7:8/10 1:3/5/6/8/9/10/11, 2:8, 4:5/6/7/8, 5:7, 6:7, 7:8 1:6, 2:4, 3:6, 4:5/6/8/10/11 2:7, 3:5/7, 7:9/11 1:3/4/6/8/9/11, 2:10, 3:10, 4:10, 5:6/9/10, 6:7/10, 7:9/10, 8:10, 9:11 1:4/5, 2:5/8/9/10, 3:5/10, 4:5/6/8/9/10/11, 5:6/7, 7:8/9/10 1:2/5/8/9/10/11, 2:3/4/6/7/8/9/11, 3:5/8/9/11, 4:5/8/9/10/11, 5:6/7/8/9/10/11, 6:8/9/10/11, 7:8/9/10/11 1:3, 3:8 1:2/4/5/6/9/10/11, 4:5, 5:6/7/8/11 2:3, 3:4/5/8/9/10/11, 5:6, 6:9 1:3/11, 2:3, 3:4/5/6/7/8/9/11, 4:11, 6:11, 7:11 1:2/6/8, 2:3, 3:6/8 2:4/6/7 1:2/3/4/5/9, 2:11, 3:6/7/11, 4:10/11, 5:11, 8:11, 9:11 1:3, 2:11, 3:7/10/11, 4:10, 5:10/11, 7:10, 9:10/11 1:2/3/4/9, 2:6/7, 3:6/7/8/10, 4:6/7, 6:9, 7:9 9:10 1:2/4/5/6/7/8, 2:3/8/9/11, 3:4/5/7, 4:9/11, 7:9 1:3, 2:10, 3:7/9/10/11, 5:10 2:7/11, 3:7/11, 4:11, 5:11, 6:11, 8:11, 9:11 1:7/10/11, 5:7/10/11, 6:9, 7:8/9, 8:10, 9:10, 9:11 1:2, 2:3/4/5/6/7/8/9/10/11, 5:10 Anhang Tab. D.3: signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den KG bzw. Zwillingsträchtigkeit AST-Aktivität 28. d a.p. AST-Aktivität 10. d a.p. AST-Aktivität 3. d p.p. AST-Aktivität 28. d p.p. Chloridkonzentration 28. d a.p. Chloridkonzentration 10. d a.p. Chloridkonzentration 3. d p.p. Chloridkonzentration 28. d p.p. Calciumkonzentration 28. d a.p. Calciumkonzentration 10. d a.p. Calciumkonzentration 3. d p.p. Calciumkonzentration 28. d p.p. Anorganische Phosphatkonzentration 28. d a.p. Anorganische Phosphatkonzentration 10. d a.p. Anorganische Phosphatkonzentration 3. d p.p. Anorganische Phosphatkonzentration 28. d p.p. Eisenkonzentration 28. d a.p. Eisenkonzentration 10. d a.p. Eisenkonzentration 3. d p.p. Eisenkonzentration 28. d p.p. CK-Aktivität 28. d a.p. CK-Aktivität 10. d a.p. CK-Aktivität 3. d p.p. CK-Aktivität 28. d p.p. 2:11, 3:11, 4:11, 5:11, 8:11, 9:11 9:11 1:2/3/5/6/8/9/10/11, 2:3/7, 3:4/5/6/7/8/9/10/11, 4:9/11, 7:9/11 1:2/4/6/7, 2:3/6/7/8/9/10/11, 3:4, 4:5/6/7/8/9/10/11, 6:8, 7:8/10 1:8/10/11, 2:8/10, 3:8/10/11, 4:8/10, 6:8/10/11, 7:8/10, 8:9 2:11, 3:8/11, 6:11 1:3, 3:5/6/7/9/10/11 1:8/10, 3:7, 4:8, 5:7, 6:8, 7:8/10, 8:11 1:5/9, 2:6, 3:6, 4:6, 5:6/7, 6:9, 7:9, 8:9, 9:10/11 3:6, 4:6, 5:6, 6:9, 7:9, 9:10/11 2:4, 4:6/10/11 1:3/9, 2:3/9, 3:5, 5:9, 8:9 1:10/11, 3:10/11, 4:10/11, 5:11, 9:11 3:4/7, 4:11, 7:11 1:3, 2:3/10, 3:4/6/7/9/11, 4:5/10, 5:6, 6:8/10, 7:10, 9:10, 10:11 1:10, 2:10, 3:7/10, 5:10, 6:7, 7:10/11, 8:10, 9:10 7:11 1:2/5/6/8/9/10/11, 2:4, 4:5/6/8/9/10/11, 5:7, 7:9/10 2:3/6/7/8/9/10, 5:9, 7:9 1:5/8/9/11, 2:11, 3:5/8/11, 4:5/11, 5:6/11, 6:8/9/11, 7:11, 8:11, 9:11, 10:11 1:4/5/7/8/9, 3:5, 4:5, 5:11 1:2/3/4/6/8/9/11, 2:3, 3:4/5/6/7/8/9/10/11, 4:10, 8:10, 9:10, 10:11 1:4/6, 2:4, 3:4/6/7, 4:10/11, 6:11 Anhang Tab. D.4: signifikante Differenzen (Mann-Whitney-U-Test p≤0,05) zwischen den KG bzw. Zwillingsträchtigkeit AP-Aktivität 28. d a.p. AP-Aktivität 10. d a.p. AP-Aktivität 3. d p.p. AP-Aktivität 28. d p.p. IGF-1-Konzentration 28. d a.p. IGF-1-Konzentration 10. d a.p. IGF-1-Konzentration 3. d p.p. IGF-1-Konzentration 28. d p.p. NSBA 10. d a.p. NSBA 28. d p.p. Harn pH 10. d a.p. Harn pH 28. d p.p. 1:8/9/10, 2:8/10, 3:4/5/6/8/9/10, 4:8/9/10, 6:10, 7:8/10, 8:11, 9:11, 10:11 3:5/6/8/9 1:6, 3:8/9, 4:6, 6:7/8/9/11, 8:10, 9:10/11 1:8/9/10/11, 2:8/9/10, 3:4/5/6/7/8/9/10/11, 4:8/9/10, 6:8/10, 7:10, 10:11 1:2/8, 2:4/6/7/11, 4:8, 7:8/9, 8:11, 9:11 2:4/5/7/11, 3:7/11, 4:8, 7:8/9, 8:11, 9:11 4:10 1:4, 3:10, 4:6/8/9/10, 8:11, 10:11 1:2/4/7, 2:6/8/11, 6:7 1:2/8, 2:3/4/5/6/7/8/9/10/11, 10:11 2:3/4/6/7/8/9/10/11, 4:5, 5:6, 7:11, 9:11 Danksagung Mein Dank im Speziellem gilt an erster Stelle Herrn apl. Prof. Dr. med. vet. MANFRED FÜRLL für die Vergabe und die wissenschaftliche Betreuung der Dissertation. Weiterer großer Dank gebührt meiner tierärztlichen Kollegin FRANZISKA HECKEL und dem betreuenden Tierarzt „vor Ort“ Herrn Dr. med. vet. LOTHAR JÄKEL, welche die Durchführung der praktischen Arbeit in der MVA jederzeit durch besonderen Einsatz und in freundschaftlicher Art und Weise ermöglichten. Danken möchte ich ebenfalls Herrn Dr. med. vet. LEOPOLD GOETZE und Herrn Dr. med. vet. PETER FLORIAN von PFIZER EUROPE® neben der finanziellen Unterstützung vor allem für die wertvollen Anregungen und Literaturverweise zur Fertigstellung der Dissertation. Frau Dr. rer. nat. ANTJE MEISTER und allen Mitarbeitern des Labors der Medizinischen Tierklinik sowie Frau Prof. Dr. med. vet. ALMUTH EINSPANIER, Frau Dr. med. vet. JUTTA GOTTSCHALK und den Labormitarbeitern des Veterinär-Physiologisch-Chemischen Institutes der Universität Leipzig (Bestimmung Östradiol, Insulin und IGF-1) gilt mein uneingeschränkter Dank für die rasche und emsige Bearbeitung des riesigen Probenpools. Ein gebührendes Dankeschön an Herrn ANDREAS RICHTER für seine geduldige und professionelle Unterstützung bei der statistischen Auswertung der Daten. Nicht zuletzt möchte ich mich sehr herzlich bei meinen Eltern und meiner Freundin SUSANN für die hilfreiche moralische Unterstützung, die Motivation und ihre nicht selbstverständliche Geduld (auch in anstrengenden Phasen) bedanken. Vielen Dank!