Vgl. Abb. 5.6 Gruppen und Familien von Pflanzenviren
Werbung

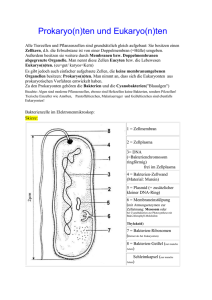
Pflanzenphysiologie Phytopathologie 11. Phytopathologie: Viren, Bakterien und Pilze als Krankheitserreger 11.1 Viroide und Viren 11.1.1 Viroide - Kleinste Erreger von Pflanzenkrankheiten (1/10 so groß wie kleinste Viren) - bestehen nur aus einem kurzen RNS-Molekül, das für keine Proteine kodiert (Intron-ähnliche Sequenz ?) - Fallbeispiel: potato spindle tuber viroid - Erreger der Kartoffelspindelknollen-Krankheit 360 Nukleotide, ringförmiges RNA-Molekül Vgl. Abb. 34.27 Mögliche Faltung - Fallbeispiel: Kadang-Viroid - tötet Kokospalmen (in Südost-Asien starben bereits 30-40 Millionen) 250 Nukleotide - Viroide befallen nur Angiospermen - 20-30 Viroidarten bekannt; Krankheitsbilder gleichen weitgehend den von Viren ausgelösten Krankheiten Vgl. Tabelle 4.1 Heute bekannte Viroidgruppen, Wirtspflanzen, Symptome 11.1.2 Viren (virus, lat.: Gift) Vgl. Abb. 5.6 Gruppen und Familien von Pflanzenviren, Abb. 5.1 Relative Größenverhältnisse und Abgrenzungen der Viren von niederen Mikroorganismen - in Europa ca 1200 pflanzliche Virosen (Viruskrankheiten) bekannt - Charakteristik von Viren: - unempfindlich gegenüber Antibiotika - maximale Größe: 300 nm - enthalten entweder RNA oder DNA, nie beides zugleich - ohne eigenen Stoffwechsel; Vermehrung deshalb nur in lebenden Wirtszellen - Viren auch als Phagen bezeichnet: Phytophagen, Zoophagen, Arthropodophagen, Bakteriophagen - Morphologie: stäbchen- und fadenförmig; polyedrisch (= isometrisch); bazillenförmig (“Rhabdoviren”) - Aufbau: Nucleinsäure plus Proteinhülle (Capsid); Rhabdoviren besitzen zusätzlich eine äußere Hülle aus Lipoprotein (Envelope = Peplos) Disk: File: Pflanzenphysiologische Vorlesung Kurzfassung PFLA-11K 1 Pflanzenphysiologie Phytopathologie - Fallbeispiel Tabakmosaik-Virus (TMV) - Größe: 18 nm breit, 300 nm lang; Molekulargewicht: 40 x 106 D - im Innern befindet sich ein einsträngiger (single stranded, ss) RNA-Faden aus 6000 Nucleotiden; das Capsid besteht aus 2130 identischen Polymeren = Capsomeren (jedes Peptid hat eine Größe von 17500 D = 158 Aminosäuren) - die Capsomere lagern sich selbständig spiralförmig um die spiralig aufgewundene RNA (self assembly) Vgl. Abb. 34.4 Elektronenmikroskopische Aufnahme, Abb. 34.10 Modell für die Assoziation, Abb. 5.8 Phasen der TMV-Replikation, Abb. 34. 5 Modell eines Teils des TMV, Abb. 34.6 Elektronendichtekarte einer TMV-Proteinscheibe - Fallbeispiel turnip yellow mosaic Virus (TYMV) = Wasserrübengelbmosaik-Virus - RNA (35 % Gewichtsanteil) - Capsid aus Gruppen von 5 bzw. 6 Polypeptidketten, die rosettenförmig zusammengelagert sind: 32 Capsomere insgesamt, 20 Hexamere und 12 Pentamere ( 180 UE) Vgl. Abb. 5.3 Schematischer Aufbau - Fallbeispiel: Rhabdovirus - bazillenförmige Gestalt; ss RNA (Gewichtsanteil 1 %), Capsid aus Proteinen der Größe 30 kD (Matrixproteine), hierauf folgt eine Lipidschicht, durch die Glykoproteine (Mr = 60-80 kD) nach außen ragen; diese Peplomere bilden den Peplos Vgl. Abb. 5.4 Ausschnitt aus einem Rhabdovirusmodell Gruppierung von Viren nach ihrer Nucleinsäure - einzelsträngig, ss : RNS, DNS - doppelsträngig, ds: RNS, DNS - DNA-Viren haben keine Hülle (Geminiviren, Caulimoviren, Commelina-yellow-virus) 11.1.2.1 Der virale Infektionsprozeß Kein aktives Eindringen in die Pflanze; Eintritt in Pflanzen unmittelbar mit einer Verwundung oder über Vektoren, das sind vor allem Insekten mit stechend-saugenden Mundwerkzeugen, Nematoden, Pilzsporen. Nicht infiziert werden das Xylem und die Interzellularräume. Vermutlich nimmt das Plasmalemma die Viren auf. Abwehrreaktionen der Pflanze: - Immobilisation von Viren in einer infizierten Zelle (unsichtbare Reaktion). - Hypersensitive Reaktion einzelner Zellen nach Virusbefall. Das ist eine Abwehrreaktion, die zum Absterben der Zelle bzw. von Gewebeteilen führt. Mann nennt die abgestorbenen Teile Nekrosen. Sie sind braun bis schwarz gefärbt. Die Braunfärbung geht auf die Wirkung von Phenoloxidasen zurück, die Phenole zu Chinonen oxidieren; diese bilden covalente Bindungen mit den Peptidbindungen von Proteinen, was sie inaktiviert und letztlich (mit anderen Radikalreaktionen) zum Zelltod führt. Disk: File: Pflanzenphysiologische Vorlesung Kurzfassung PFLA-11K 2 Pflanzenphysiologie Phytopathologie Reicht die Abwehrkraft der Pflanze nicht aus, so kommt es zur Ausbreitung der Viren in der gesamten Pflanze (systemische Reaktion) - über den Symplasten - - Über die primären Plasmodesmen als Nucleinsäurefaden (ohne Proteinhülle) mit Hilfe von “movement” Proteinen (Mr ca 30 kD). Das Tabakmosaik-Virus-movement-Protein hat die Fähigkeit, sich in die primären Plasmodesmen zu integrieren und diese von ursprünglich 2,5 nm auf 6-7 nm zu erweitern, damit kann die Virus-RNA durch die primären Plasmodesmen geschleust werden. - - Über sekundär (unter dem Einfluß der Viren) gebildete Plasmodesmen. Diese entstehen (Beispiel cow pea mosaic virus, CPMV) durch Ausstülpung von mit Viren gefüllten Plasmamembranbereichen durch die Zellwand hindurch in die Nachbarzellen. Diese sekundären Plasmodesmen tragen kein Endoplasmatisches Retikulum wie die primären Plasmodesmen. Vom CPMV wird ein 48 kD Protein codiert, das direkt an der Bildung der Ausstülpungen beteiligt ist. 11.1.2.2. Replikation von Viren - Eindringen des Virus in die Zelle (passiv) - Verlust der Proteinhülle des Virus (uncoating) - Bildung primärer (früher) Proteine auf Veranlassung des Virus (Inhibitoren, die gegen die Wirtszelle gerichtet sind, Enzyme) - Replikation der Virus-Nucleinsäure (RNA oder DNA) - Bildung sekundärer (später) Proteine (Enzyme, Capsidproteine) - Rekonstruktion des Virus (Zusammenschluß von Hüllproteinen unter Einschluß der Nucleinsäure) - Verlassen der Wirtszelle Positiv-strängige ss (single stranded) RNA-Viren: die eingeschleuste Virus RNA kann unmittelbar in Proteine umgeschrieben (translatiert) werden. Negativ-strängige ss RNA-Viren: die eingeschleuste RNA muß zunächst durch Virusassoziierte Proteine in einen positiven Strang transkribiert werden, bevor sie an den Ribosomen des Wirtes translatiert werden kann. Nicht immer liegt das ganze Genom in einem Viruspartikel komplett vor. Bei manchen Viren der gleichen Art (Comogruppe) ist das Genom auf verschiedene Viren der gleichen Art verteilt. Im Wirt ergänzen sich die Gene und sorgen dafür, daß wieder einzelne Viren entstehen können. 11.1.2.3 Mechanismen der Symptomausprägung Die Ausprägung einer Virusinfektion reicht von nicht-sichtbar bis zum Absterben der Pflanze. Virus-Resistenz hängt ab von der Resistenz der Pflanze und der Virulenz des Virus. Die Resistenz der Pflanze (Sorte) hängt von ihrem Genotyp sowie von Umweltfaktoren ab. Die Epidemiologie der Virusverbreitung ist abhängig von der Vermehrungsrate und den Generationsfolgen der Vektoren. Disk: File: Pflanzenphysiologische Vorlesung Kurzfassung PFLA-11K 3 Pflanzenphysiologie Phytopathologie Symptome eines Virusbefalls: - Großflächige, mosaikhafte Vergilbung in Verbindung mit Wachstumsstörungen und Veränderungen auf der Blattoberfläche. Das Rotscheckungsvirus (red clover mottle virus RCMV) führt nach 12 Wochen zu Erbsen-Pflanzen, die nur halbsogroß sind, kaum Blätter und Samen tragen. - Plastidenmorphologie gestört, Störung der Zelldifferenzierung; Stärke häuft sich in den Chloroplasten an, Saccharosebildung geht zurück. Die Aminosäure- und Purinbildung nimmt zu. Die Zahl der Chloroplastenribosomen nimmt ab. Die Atmungsrate der Mitochondrien wird reduziert (Tomate, infiziert mit TMV). In Chinakohl, der mit dem “turnip yellow mosaic virus” (TYMV) systemisch infiziert ist, korreliert der Verlust von Chloroplastenribosomen mit dem Vergilbungssymptom bei gleichzeitiger Zunahme der Viren. In Tabakblättern, die mit dem TMV befallen sind, geht die Verminderung der Chloroplastenribosomen mit einer 75 %igen Reduktion des CO2-fixierenden Enzyms Ribulosebisphosphat-Carboxylase einher. 11.1.2.4 Pflanzliche Abwehrreaktionen - Viruslokalisation: Das Virus wird von infizierten Zellen des Wirts aktiv festgehalten (aktive Resistenz). Dieser Vorgang ist nicht unbedingt von außen zu erkennen. Für die Lokalisierung der Viren ist ein Wirtsgen verantwortlich: das Gen N, das in dominanter Form vorliegen muß. Das N-Gen wird durch exogene Stimulantien, Hüllproteine des Virus, tRNAs, Ethylen, Salicylsäure aktiviert. - Nekrotisierung und Lokalisierung überlappen sich häufig. - Hypersensitive Reaktion: Bildung von H2O2, Chinonen, Absterben der Zellen; die nekrotischen Flecken auf der Blattoberfläche und ihre Umgebung fluoreszieren, wenn sie mit UV-Licht bestrahlt werden. Die Fluoreszenz geht von Verbindungen aus dem Zimtsäure- und Benzoesäure-Stoffwechsel aus (Zimtsäurederivate, Kaffeesäure, Ferulasäure). Insbesondere Salicylsäure induziert Resistenz gegen diverse Pathogene (in Tabak und Gurke). - Eine nicht letale Infektion kann in der Pflanze eine Resistenz gegen erneuten Befall auslösen (aquired resistance; induced resistance). - Strukturelle Abwehrmechanismen führen zu einer Verfestigung der Zellwände in den an eine Nekrose angrenzenden Zellen: Bildung von Kallose (ß-1 3-Glucan), peroxidatische Verfestigung der Zellwände über Lignin. Disk: File: Pflanzenphysiologische Vorlesung Kurzfassung PFLA-11K 4 Pflanzenphysiologie Phytopathologie 11.2 Phytopathogene Bakterien Pflanzenkrankheiten können von ca. 200 Bakterien ausgelöst werden. Mit Ausnahme der Streptomyceten sind alle anderen phytopathogenen Bakterien stäbchenförmig. Häufig sind phytopathogene Bakterien begeißelt. Charakteristika: Keine Dauersporen (Ausnahme: Streptomyceten), dafür Überdauerung in einer Schleimkapsel aus Polysacchariden und Peptiden, die gegen Hitze, UV-Strahlung und Austrocknung schützt. Überdauerung auch in ausdauernden Wirten, Samen und Pflanzenresten. Bakteriengattungen: Pseudomonas, Xanthomonas, Erwinia, Corynebacterium, Agrobacterium oder Streptomyces (Strahlenpilze). Besiedelung des Wirtes: - Durch Wunden, natürliche Öffnungen (Spaltöffnungen, Lenticellen, Hydathoden). - Bakterielle Infektionen treten auch nach Pilzbefall, Befall durch Nematoden und Insekten ein (Sekundärinfektion). - Agrobacterium- und Erwinia-Arten treten über nichtkutinisierte Oberflächen (Wurzelhaare, Wurzeln, Nektarien) in die Pflanze ein. - Agrobacterium-, Corynebakterium-, Pseudomonas-, Xanthomonas- und Erwinia-Arten treten häufig über Wunden ein. - Pseudomonas-, Xanthomonas- und Erwinia-Arten gelangen durch natürliche Öffnungen in die Pflanze. Pflanzen mit einer gut kutinisierten Oberfläche können von Bakterien (auch im Spaltöffnungsbereich) kaum erobert werden. 11.2.1 Symptome pflanzenpathogener Bakterien Phytopathogene Bakterien lösen vor allem folgende Krankheiten aus: Weich- oder Naßfäule, Fleckenbildungen, Welken, Hypertrophien sowie Brände (nekrotische Verfärbungen). Naßfäulen treten häufig an Früchten, Knollen, Stengeln, Zwiebeln und Blättern auf. Fleckenkrankheiten gehen häufig auf Pseudomonaden (P. tabaci, P. phaseolicola) oder Xanthomonaden (X. begonie) zurück. Die Flecken werden durch Toxine oder Exoenzyme der Bakterien ausgelöst. Welken entstehen, wenn Bakterien die wasserleitenden Elemente des Xylems der Pflanzen blockieren. Auslöser sind häufig Pseudomonas-, Corynebacterium- und Erwinia-Arten. “Brände” sind Austrocknungen oberirdischer Pflanzenteile, insbesondere an Rinden oder Ästen (Erwinia amylovora und Pseudomonas mors-prunorum). Wuchsanomalien und Hypertrophien, wie Tumore oder Wurzelhals- oder Stengelkröpfe gehen auf Pseudomonas savastanoi, Corynebacterium fascians und vor allem auf Agrobacterium tumefaciens (crown gall) zurück. Bakterien können durch Antibiotika bekämpft werden. 11.2.2. Die bakterielle Infektion Der Befall von Wurzeln mit Bakterien ist passiv und aktiv möglich. Passiv, indem die Wurzeln in neue Bodenräume vordringen und dabei auf Bakterien stoßen. Aktiv durch begeißelte Bakterien, die auf die Wurzeln zuschwimmen. In beiden Fällen ist die Erkennung des Wirtes durch die Bakterien entscheidend. Disk: File: Pflanzenphysiologische Vorlesung Kurzfassung PFLA-11K 5 Pflanzenphysiologie Phytopathologie Bohnenblätter tragen auf der Oberfläche spezifische Bindungsstellen, an die Agrobacterium tumefaciens bindet. Lipopolysaccharide auf der Bakterienoberfläche sind für das Andocken an Rezeptoren innerhalb pflanzlicher Wunden verantwortlich. Agrobacterium tumefaciens besitzt auf seiner Oberfläche eine Struktur, die an ein Rezeptormolekül auf der pflanzlichen Oberfläche (Vitonectinrezeptor) bindet. Nach Bindung der Bakterien setzen die Pflanzenzellen eine Substanz frei, die in Agrobacterium tumefaciens die Bildung von Zellulosefibrillen ermöglicht; mit diesen werden die Bakterien verankert. Vgl. Abb. 8.2 Modell für die fünf Phasen der Anheftung 11.2.3 Ausbreitung phytopathogener Bakterien in Pflanzen Phytopathogene Bakterien breiten sich in Pflanzen sowohl über das Xylem als auch über das Phloem aus. In Wurzeln eingedrungene Bakterien werden über das Xylem in der Pflanze verbreitet (Agrobacterium tumefaciens: ca 1,5 cm/h). Bei Infektion der Blätter gelangen Bakterien hauptsächlich in das Phloem. Einen Teil ihrer Pathogenität entwickeln Bakterien im Xylem. Vom Xylem aus dringen sie in die angrenzenden Parenchymzellen, und von dort kommt es zu Ausstülpungen in die Xylemzellen. Die wasserführenden Zellen werden sekundär besiedelt (Pseudomonas solanacearum). Die Ausstülpungen heißen Tüllen. Diese verstopfen die Gefäße; Welkeerscheinungen sind die Folge. Die Tüllen werden von den Bakterien abgebaut und die entstehenden Schleime hemmen ebenfalls den Wassertransport. Welke Zellen können von den Bakterien leichter durch Hydrolasen (Pektinesterasen, Zellulasen) abgebaut bzw. lysiert werden (Proteasen, Esterasen, Phospholipasen...). 11.2.4 Symptomausprägung Pflanzenschädigungen werden oft durch Toxine der Bakterien hervorgerufen. Diese können das Chlorophyll zerstören bzw. seine Synthese unterbinden (Pseudomonas tabaci). Die Thylakoide schwellen nach Bakterienbefall an, die Plastoglobuli nehmen zu und vergrößern sich. Die Zahl der Ribosomen nimmt in den Chloroplasten und im Cytoplasma ab. 11.2.5 Resistenz gegenüber bakteriellen Infektionen Die Resistenz der Pflanzen gegen Bakterien geht vor allem von ihrer Oberfläche (Cutikula) aus. Weiter trägt eine langsame Wasserflußgeschwindigkeit im Xylem zur Hemmung der systemischen Infektion bei (Zuckerrohr/Corynebacterium: die resistente Sorte hat eine Wassertransportgeschwindigkeit von 1,8 ml/min, die empfindliche eine von 16,8 ml/min). Die resistente Sorte weist eine stärkere Verzweigung der großen Xylemgefäße in den Internodien des Zuckerrohrs auf, sodaß die Wassertransportgeschwindigkeit erniedrigt ist. Einbau von Lignin macht die Zellwände resistenter gegen Bakterien. Durch Quervernetzung der Arabinoxylanketten der Hemizellulosen über Ferulasäurereste werden die Zellwände ebenfalls resistenter. Im Zuge der Tüllenbildung in den Gefäßen füllen sich diese mit Luft. Aerobe Bedingungen sind für viele phytopathogene Bakterien ungünstig. Disk: File: Pflanzenphysiologische Vorlesung Kurzfassung PFLA-11K 6