Nervenzellen bilden ein komplexes Netzwerk von Fortsätzen, den
Werbung

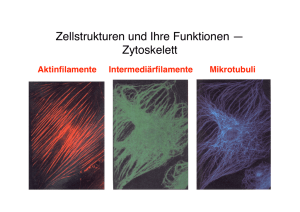
Nervenzellen bilden ein komplexes Netzwerk von Fortsätzen, den sogenannten Neuriten. Die genaue Kontrolle über diesen Prozess ist essentiell für die normale Entwicklung und Funktion des Gehirns. Selbst kleine Veränderungen in der Struktur oder Stabilität der Neuriten kann zur Degeneration der Nervenzellen, Demenz oder Psychosen führen. Aktuelle Therapieansätze für derartige Krankheitsbilder basieren jedoch nur auf unvollständigen Informationen. Um diese Behandlungsmöglichkeiten zu verbessern, ist ein besseres und vollständiges Verständnis der zugrunde liegenden biologischen Systeme erforderlich. In diesem Projekt untersuchen wir das neuronale Zytoskelett, insbesondere die Rolle der beiden Hauptkomponenten Mikrotubuli und Aktin. Durch das Zusammenspiel zahlreicher "molekularen Maschinen" werden diese Komponenten in der Entwicklung, Funktion und Reparatur des Gehirns kontinuierlich umorganisiert. Zur Analyse der zugrundeliegenden Mechanismen verwenden wir einen multidisziplinären Forschungsansatz der sowohl High-Content Screening als auch zeitaufgelöste Mikroskopie einschließt. Basierend auf detaillierten mikroskopischen Aktivitätsmessungen und Manipulationen einzelner Regulatoren erstellen wir ein computergestützes Modell des neuronalen Zytoskeletts. Dieses Modell dient als Leitfaden für weiterführende Studien der neuronalen Entwicklung. Abb. 1: Das Zytoskelett während der Ausbildung eines Fortsatzes. Die beiden Hauptkomponenten des Zytoskeletts: Mikrotubuli (grün) und Aktin (rot) bilden polymere Strukturen, welche eine Schlüsselrolle in der neuronalen Entwicklung spielen. Film 1: Dynamische Interaktionen zwischen dem Mikrotubuli (grün) und Aktin (rot) Zytoskelett in neuronalen Zellen. Zahlreiche Aspekte der Interaktion zwischen den beiden Systemen wurden mit Hilfe fluoreszierender Proteine und Videomikroskopie untersucht. AVI high / AVI low / QT high / QT low Beteiligte Personen: Leif Dehmelt – Gruppenleiter Julia Arens – Doktorandin Silke Gandor – Doktorandin Magda Krejczy – Studentische Hilfskraft Anja Biesemann – Master-Studentin Verena Hannak – Master-Studentin Pia Jeggle – Master-Studentin Relevante Publikationen: Halpain S, Calabrese B, and Dehmelt L. Actin Cytoskeleton in Growth Cones, Nerve Terminals, and Dendritic Spines. New Encyclopedia for Neuroscience, (Ed. Larry Squire) (in press). Dehmelt L, Halpain S. (2007): Neurite Outgrowth: A Flick of the Wrist. Curr Biol 17:R611R614 Dehmelt L, Nalbant P, Steffen W, Halpain S. (2006): A Microtubule-Based, DyneinDependent Force Induces Local Cell Protrusions: Implications for Neurite Initiation. Brain Cell Biology 35:39-56 Halpain S, Dehmelt L. (2006): The MAP1 family of microtubule-associated proteins. Genome Biology ;7:224. Dehmelt L, Halpain S. (2005): MAP2/tau family proteins. Genome Biology 6:204 Roger B, Al-Bassam J, Dehmelt L, Milligan RA, Halpain S. (2004): MAP2c, but not tau, binds and bundles F-actin via its microtubule binding domain. Curr Biol 14:363-71 (featured in N&V, Nature Cell Biology 6:390) Dehmelt L, Halpain S. (2004): Actin and microtubules in neurite initiation: are MAPs the missing link? J Neurobiol 58:18-33 Dehmelt L, Smart FM, Ozer RS, Halpain S (2003): The role of microtubule-associated protein 2c in the reorganization of microtubules and lamellipodia during neurite initiation. J Neurosci 23:9479-90 (cover illustration)