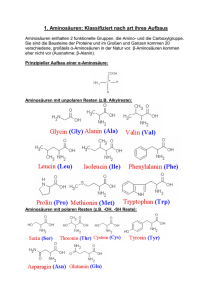
Aminosäuren, Peptidbindung, Peptide
Werbung
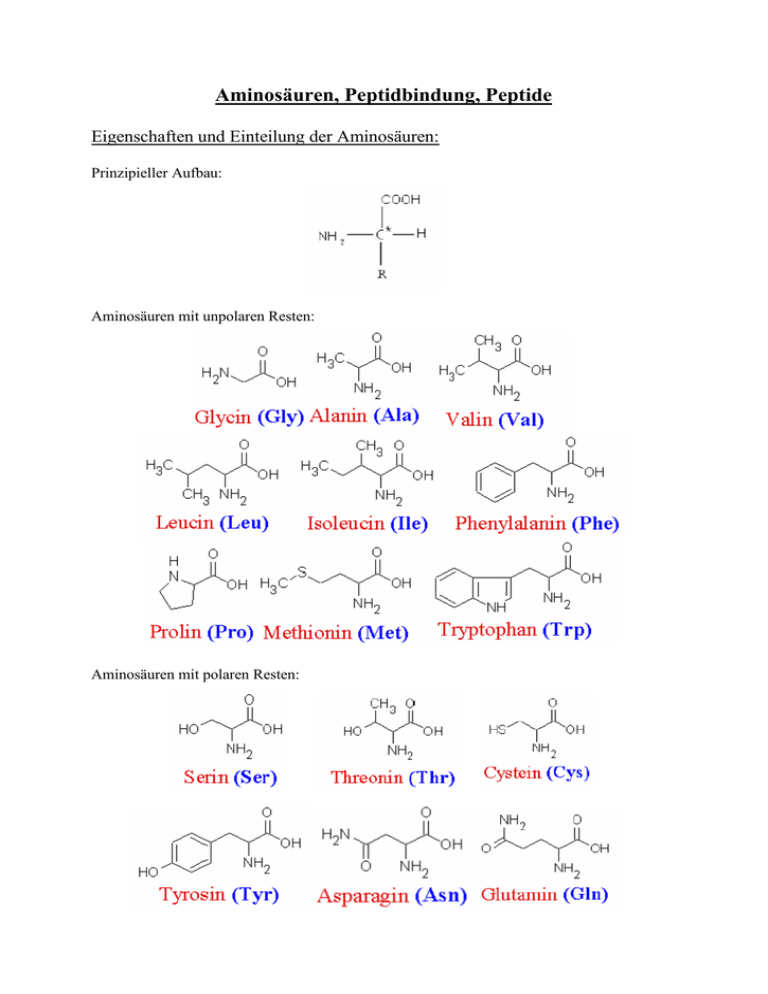
Aminosäuren, Peptidbindung, Peptide Eigenschaften und Einteilung der Aminosäuren: Prinzipieller Aufbau: Aminosäuren mit unpolaren Resten: Aminosäuren mit polaren Resten: Aminosäure mit sauren Resten: Aminosäuren mit basischen Resten: Relevante Reaktionen und Informationen von/zu einigen Aminosäuren: Tyrosin: Tyrosin bildet über mehrere Zwischenstufen durch enzymatische Oxidation (Poly-)Melanin, ein Pigment, dass für die Färbung der Haut verantwortlich ist; Threonin: Aus Threonin kann α-oxo-Buttersäure hergestellt werden, welches ein charakteristisches „Suppenaroma“ besitzt. Lysin: Lysin zersetzt sich leicht, vor allem bei Hitzeeinwirkung, weil die zweite Aminogruppe sehr reaktiv ist; Da Lysin eine essentielle Aminosäure ist, muss sie in großen Mengen in Lebensmittel enthalten sein um den Bedarf zu decken. Oftmals werden hierzu auch Nahrungsergänzungsmittel verwendet. Isoelektrischer Punkt(IEP): Am isoelektrischen Punkt liegt die Aminosäure als Zwitterion vor; Der IEP ist vom pH-Wert und der Aminosäure abhängig; Peptidbindung: Durch Wasserabspaltung können zwei Aminosäuren ein Dipeptid bilden, wenn diese Reaktion mit vielen Aminosäuren an der Kette weitergeführt wird, bilden sich Polypeptide, die als Proteine bezeichnet werden. Die Einteilung der Peptide erfolgt oft durch Bestimmung der Kettenlänge (und somit der Molekülgröße, bzw. des Molekülgewichts): Oligopeptide (2-10 Aminosäuren) Polypeptide (10-100 Aminosäuren) Makropeptide (100-1000 Aminosäuren) Makropeptide werden auch als Proteine bezeichnet, diese haben Molmassen von ca. 10 000 bis 300 000 g/mol. In Ausnahmefällen können Proteine (sog. „Kleberproteine“) bis zu 20 000 000 g/mol schwer sein. Ausschlaggebend für die Polarität des Peptids ist der „Mittelwert“ der Polaritäten der einzelnen Aminosäuren; Biologische Wertigkeit: Die biologische Wertigkeit eines Eiweißes in einem Lebensmittel ist ein Maß, mit welcher Effizienz ein Nahrungsprotein in körpereigenes Protein umgesetzt werden kann. Als Referenzwert dient Vollei, dessen biologische Wertigkeit willkürlich auf 100 (%) gesetzt wurde, da es zu damaliger Zeit das Protein war, für welches die höchste Wertigkeit angenommen wurde. Durch Mischen verschiedener Lebensmittel kann die Wertigkeit stark erhöht werden, da sich die enthaltenen Aminosäuren ergänzen. Beispiele: Vollei: 100 Kartoffeln: 98-100 Rindfleisch: 92 Thunfisch: 92 Edamer Käse: 85 Kuhmilch: 88 Weizenmehl: 56-59 36%Vollei und 64%Kartoffel: 136 75% Milch und 25% Weizenmehl: 125