Ursachen und Folgen von Harnwegsinfektionen bei Diabetes mellitus
Werbung

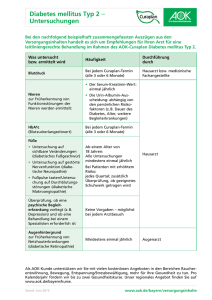
Ursachen und Folgen von Harnwegsinfektionen bei Diabetes mellitus * 1 Reinhard Fünfstück, 2Lindsay E. Nicolle, 3Markolf Hanefeld, 4Günter Stein (Nachdruck aus: Chemotherapie-Journal 2011: 6; 193 – 199. Mit freundlicher Genehmigung des Verlages) 1 Klinik für Innere Medizin 1, Sophien- und Hufeland-Klinikum Weimar / Deutschland 2 University of Manitoba and Health Science Centre, Winnipeg, Manitoba / Canada 3 Zentrum für Klinische Studien, GWT, Technische Universität Dresden / Deutschland 4 Klinik für Innere Medizin, Friedrich-Schiller-Universität Jena / Deutschland * Herrn Prof. Dr. Dr. K.G. Naber zum 70. Geburtstag gewidmet Korrespondenz: Prof. Dr. Reinhard Fünfstück Sophien- und Hufeland-Klinikum Weimar Henry-van-de-Velde-Straße 2 99425 Weimar Tel.: ++49 3643 571100 Fax: ++49 3643 571102 E-mail: [email protected] Zusammenfassung Diabetes mellitus ist eine weit verbreitete und folgenschwere Erkrankung. Das Risiko, eine Harnwegsinfektion zu entwickeln, ist fast 20mal größer als bei gleichaltrigen, nicht an Diabetes leidenden Menschen. Die Faktoren, die eine Infektmanifestation begünstigen, sind vielschichtig. Das Lebensalter und die Dauer der Diabeteserkrankung des betroffenen Patienten, dessen metabolische Situation, das Ausmaß mikro- und makrovaskulärer Folgeschäden sowie die mit einer diabetischen Zystopathie verbundenen Komplikationen fördern die Prädisposition für eine Infektion. Der Verlauf der Erkrankung wird weiterhin durch Störungen der Reaktionsfähigkeit des Immunsystems und durch spezifische Virulenzeigenschaften uropathogener Mikroorganismen beeinflusst. Eine genaue Charakterisierung des Krankheitsbildes ist für eine zielgerichtete Antibiose und damit für den Therapieerfolg entscheidend. Die Behandlung einer asymptomatischen Bakteriurie ist bei Patienten mit Diabetes mellitus nicht indiziert. Bei symptomatischen Infektionen (Zystitis, Pyelonephritis) sollte der Schweregrad der metabolischen Störung die Therapiestrategie bestimmen. Weitere klinische Studien zur Bewertung einzelner Therapieempfehlungen, besonders bei Patienten mit einer instabilen Stoffwechselsituation im Vergleich zu Fällen ohne Diabetes mellitus sind notwendig. Schlüsselwörter: Diabetes mellitus, Harnwegsinfektion, Niereninsuffizienz, Behandlungsstrategie asymptomatische Bakteriurie, Summary Diabetes mellitus is a world wide spread disease. Urinary tract infection occurs with increased frequency and severity in patients with diabetes mellitus. The risk for an infection in diabetic patients is 20times higher than in cases with normal metabolic situation. General host factors enhancing risk for urinary tract infection include age, metabolic control, long term micro- and macrovascular complications, primarily diabetic nephropathy and cystopathy. Alterations in the innate immune system have been described and may also contribute risk of urinary infections. Virulence properties of uropathogenic microorganisms influence the activity and the course of an infection. For an effective treatment strategy of urinary tract infection it is necessary to characterize the clinical risk of the disease. Treatment of asymptomatic bacteriuria in diabetic patients is not indicated. Early diagnosis and prompt intervention is recommended to limit morbidity of symptomatic infection. The quality of glycaemic control as well as the risk of hypo- or hyperglycaemia determines antimicrobic intervention. Clinical studies comparing management of urinary tract infection in persons with diabetes compared to those without as well as diabetic patients with good or poor glucose control will be necessary. Key words: Diabetes mellitus, urinary tract infection, asymptomatic bacteriuria, renal insufficiency, treatment strategies Die Krankheit Diabetes mellitus erreicht weltweit dramatische Ausmaße. In Deutschland sind fast 10 Millionen Menschen davon betroffen [21]. Im Verlaufe einer Diabeteserkrankung werden durch die metabolische Störung und infolge hämodynamischer Veränderungen Funktionen lebenswichtiger Organe irreversibel beeinträchtigt. Klinische Beobachtungen weisen auf Zusammenhänge zwischen Diabetes mellitus und Störungen lokaler sowie systemischer wirtspezifischer Abwehrmechanismen hin [23]. Da eine erhöhte Infektionsprädisposition durch verschiedene Faktoren beeinflusst wird, ist es problematisch, den Effekt einzelner Prozesse exakt zu charakterisieren. Die Diabetesdauer, der Schwergrad der metabolischen Veränderungen, aber auch das Ausmaß mikro- und makrovaskulärer Folgeerkrankungen beeinflussen Diabeteskranken gegenüber unter anderem pathogenen und die Anfälligkeit fakultativ des pathogenen Mikroorganismen. Harnwegsinfektionen gehören bei Patienten mit Diabetes mellitus zu den häufigsten Infektionen. Besonders bei einer instabilen diabetischen Stoffwechsellage mit einem HbA1c-Wert > 8% sind diese Infektionen mit komplizierten Krankheitsverläufen assoziiert [32]. Andererseits können Harnwegsinfektionen bei Patienten mit Diabetes mellitus die pathogenetisch bedeutsame Insulinresistenz verstärken und eine labile Stoffwechselsituation verschlechtern [3]. Harnwegsinfektionen können als asymptomatische Bakteriurie, akute unkomplizierte Infektion bei Frauen (akute Zystitis oder akute nicht obstruktive Pyelonephritis), als komplizierte Harnwegsinfektion bei Männern und Frauen bei Abnormalitäten des Urogenitalsystems und als akute oder chronische Prostatitis bei Männern auftreten. Die Infektionen neigen zu rekurrierenden Verläufen, da die Krankheitserreger in der Lage sind, im Urogenitaltrakt zu persistieren. Dadurch sind Mikroorganismen fähig, nach Beendigung einer Therapie erneut eine Infektion zu initiieren. Epidemiologie Eine asymptomatische Bakteriurie tritt bei 8 – 20% der Frauen mit Diabetes mellitus auf. Die Prävalenz liegt 2 – 3mal höher als bei Frauen ohne diese Stoffwechselstörung [45]. Angaben zur Häufigkeit einer asymptomatischen Bakteriurie bei Männern mit Diabetes mellitus sind nicht verfügbar. Das Risiko, dass sich bei Diabetes mellitus eine symptomatische Harnwegsinfektion entwickeln kann, ist bei Frauen fast 25mal und bei Männern fast 20mal größer [30]. In einer kanadischen Untersuchung wurde gezeigt, dass Frauen mit Diabetes mellitus 6 – 15 und Männer 3 – 17mal häufiger wegen einer akuten Pyelonephritis hospitalisiert werden mussten [30]. Komplizierte Krankheitsverläufe mit renalen und perirenalen Abszessen, Papillennekrosen oder eine emphysematöse Pyelonephritis sowie Pilzinfektionen kommen bei Diabetikern häufiger vor als bei Personen ohne Diabetes. Über 90% aller akuten Episoden einer emphysematösen Pyelonephritis und über 67% aller Fälle mit einer emphysematösen Zystitis treten bei Patienten mit Diabetes mellitus auf [38,40]. Diese epidemiologischen Daten bestätigen klinische Beobachtungen, dass Harnwegsinfektionen vermehrt bei Patienten mit Diabetes mellitus auftreten und dass bei diesen Personen ein erhöhtes Risiko für komplizierte Krankheitsverläufe besteht. Pathogenetische Effekte Mikrobiologische Aspekte Harnwegsinfektionen bei Patienten mit Diabetes mellitus werden am häufigsten durch Escherichia coli (E.coli) verursacht. Aber auch andere Mikroorganismen, wie Proteus species – Stämme, Klebsiella pneumoniae, Staphylococcus aureus und Enterococcus species werden nachgewiesen [45]. Nicht alle im Harntrakt auftretenden Mikroorganismen vermögen eine Infektion auszulösen. verschiedenster Bakterien können Virulenzmechanismen die durch die Aktivierung Abwehrsysteme eines Wirtsorganismus überwinden. Uropathogene E.coli sind in der Lage, verschiedene Toxine, wie Hämolysine sowie Speichersysteme für Eisenionen zu bilden, und sie besitzen auch die Fähigkeit zur Hydroxamat- und Aoerobactinbildung. Weiterhin können uropathogene Erreger verschiedene Adhäsine oder spezifische O- und K-Antigene exprimieren. Zwischen Mikroorganismen, die eine akute Harnwegsinfektion verursachen und jenen, die bei einer asymptomatischen Bakteriurie vorkommen, gibt es sowohl bezüglich der geno- als auch ihrer phenotypischen Eigenschaften Unterschiede [13]. E.coli, die aus dem Urin von Patienten mit einer asymptomatischen Bakteriurie isoliert wurden, verfügen über weniger genetische Determinanten, die unter anderem die Fähigkeiten zur Hämolysinbildung, zur Produktion des zytotoxisch nekrotisierenden Faktors oder zur Expression von Typ1-Fimbrien kodieren. Diese Eigenschaften lassen sich in typischer Weise bei Erregern nachweisen, die bei akuten Infektionen auftreten [33,45]. Andererseits zeigten Untersuchungen bei hospitalisierten Patienten keine Differenzen in der antimikrobiellen Sensibilität zwischen Stämmen, die aus dem Urin von Personen mit und ohne Diabetes gewonnen wurden [2, 35]. Allerdings fielen bei nicht hospitalisierten Diabetikern im Vergleich zu nicht an Diabetes erkrankten Patienten eine höhere Rate „extended spectrum betalactamase“ (ESBL) bildender E.coli- und Klebsiella pneumoniae-Stämme auf [6]. Es gibt bisher keine Studien, die nachweisen, dass Diabetes mellitus pe se ein unabhängiger Risikiofaktor für eine erhöhte Resistenz gegenüber antimikrobiellen Substanzen darstellt. Diese Feststellung gilt unabhängig vom Alter des Patienten, von nachweisbaren anatomischen Abnormalitäten im Harntrakt und von der vorausgegangenen antimikrobiellen Therapie. Wirtspezifische Faktoren Unter normalen Bedingungen verhindern die wirtspezifischen Abwehrmechanismen eine Kolonisation des Harntraktes durch pathogene oder fakultativ pathogene Keime sowie deren Adhäsion am Uroepithel und ihre Invasion in das Urogenitalsystem. Urin ist ein Medium, das durch unterschiedlichste Substanzen wechselnde physikochemische Eigenschaften aufweist. In seiner Zusammensetzung, seiner Osmolalität und dem pH-Bereich verändert sich Urin in Abhängigkeit verschiedenster Einflüsse, beispielsweise der Stoffwechselsituation des Patienten oder infolge von Störungen glomerulärer Filtrations- und tubulärer Reabsorptionsprozesse. Die Erkenntnisse von in vitro-Untersuchungen zur Rolle des Mediums Urin, sind wegen steter Veränderungen der Urinzusammensetzung nur mit Einschränkung auf in vivo-Verhältnisse übertragbar. Infektionserreger wie E.coli sind in der Lage, Abwehrfaktoren durch osmoprotektive Mechanismen zu überwinden. Der Überlebensvorteil dieser Mikroorganismen ergibt sich aus deren Fähigkeit zur Aufnahme von Glycin, Betain, Prolin, Glutamin, Trehalose und Kalium. Diese Substanzen werden von den Erregern intrazellulär akkumuliert und schützen sie gegenüber Dehydration. Mikroorganismen, die nicht in der Lage sind Glycin oder Betain zu speichern, besitzen schlechte Überlebenschancen im Harntrakt [4]. Bei Diabetes mellitus begünstigt eine erhöhte Glukoseausscheidung im Urin die Vermehrung uropathogener Keime. Glukosekonzentrationen zwischen 100 bis 1000 mg/dl (mäßige bis schwere Glukosurie) stimulieren unter in vitroBedingungen das Bakterienwachstum deutlich [16]. Aber auch bei geringen Glukosekonzentrationen lassen sich unter in vitro-Bedingungen deutliche Unterschiede im Wachstumsverhalten von E.coli nachweisen. Die Abbildung 1 zeigt das Wachstumsverhalten von E.coli ATC 25922 und E.coli DSM 787 in Abhängigkeit der Glukose- und Harnstoffspiegel im Urin verschiedener Patienten. Die Untersuchungen belegen, dass ein glukosehaltiges Medium im Gegensatz zu einem Milieu mit erhöhtem Harnstoffgehalt das Bakterienwachstum begünstigt. Diese Situation erklärt u.a. die erhöhte Infektanfälligkeit von Patienten mit Diabetes mellitus [12]. Der Prozess der Adhäsion uropathogener Mikroorganismen an Uroepithelzellen ist notwendig, damit Keime den Harntrakt besiedeln und dort persistieren können. Im Verlaufe der bakteriellen Zytoadhärenz erfolgt eine Aktivierung des Immunsystems. Typ-1-Fimbrien (fimH) von E.coli sind ein essentielles Merkmal von Erregern, die eine akute Zystitis verursachen. Mikroorganismen mit diesen Fimbrien-Antigenen adhärieren stärker an Uroepithelzellen von Frauen mit Diabetes mellitus im Vergleich zu jenen ohne Diabetes [17]. Eine Schutzfunktion gegenüber der Aktivität uropathogener E.coli besitzt das Tamm-Horsfall-Glykoprotein (THP). Es wird in den medullären und kortikalen Abschnitten des aufsteigenden Teils der Henleschen Schleife gebildet und zeichnet sich besonders durch mannosehaltige Rezeptorstrukturen aus. Dies sind Liganden, durch die Typ1- und S-Fimbrien von E.coli gebunden werden [37]. Durch die Bindung von E.coli an die THP-Moleküle wird die Adhäsion der Mirkroorganismen an den Oberflächen der Uroepithelien eingeschränkt [34]. Bei Patienten mit einer diabetischen Nephropathie ist eine verminderte Ausscheidung von THP nachweisbar [1,37]. Ob diese Beobachtung allerdings klinisch relevant ist, wurde bisher nicht bewiesen. Die Interaktion zwischen den Krankheitserregern und den Uroepithelzellen des Wirtsorganismus verschiedener Zytokine führt zu sowie einer zum Aktivierung Recruitment und von Expression Granulozyten, Makrophagen, Monozyten und anderen immunregulatorischen Zellen am Ort der bakteriellen Invasion. Die Wirksamkeit lokaler Abwehrmechanismen wird besonders durch die Funktionsfähigkeit der Granulozyten geprägt. Eine Dysfunktion der Zellen korreliert mit der Höhe der Hyperglykämie [8,27]. Weiterhin werden bei Diabetikern signifikant niedrige Urinkonzentrationen von IL-8 und IL-6 gefunden. Eine verminderte Leukozytenexkretion im Urin von Diabetikern ist mit diesem Phänomen erklärbar [15]. Ebenso wird bei Diabetes mellitus durch eine erhöhte Konzentration von Advanced Glycation Endproducts (AGE) die enzymatische Aktivität und die Potenz von Lysozy und Lactoferrin zum bakteriellen „Killing“ gehemmt [25]. Zur Störung körpereigener Abwehrmechanismen bei Diabetes mellitus liegen mehrere Studien vor, deren klinische Bedeutung allerdings durch weitere Untersuchungen zu klären ist [7,8,27]. Diabetesspezifische Organkomplikationen Das Risiko der Entwicklung einer Harnwegsinfektion im Rahmen eines Diabetes mellitus wird durch zahlreiche Faktoren geprägt. Dazu zählen das Lebensalter des Patienten, die Dauer der Diabeteserkrankung, das Ausmaß der metabolischen Entgleisung, Endothelfunktionsstörungen sowie die eine diabetische Polyneuropathie, progrediente Inkontinenz, zerebrovaskuläre Erkrankungen oder eine fortschreitende Demenz. Wichtige prädisponierende Faktoren sind in Abbildung 2 zusammengefasst. Im Bezug zur Inzidenz und hinsichtlich des Schweregrades einer Infektion sind die einzelnen Komponenten nur unzulänglich charakterisiert. Allerdings ist davon auszugehen, dass Diabetiker mit einer langen Krankheitsdauer auch ein hohes Risiko für einen komplizierten Infektionsverlauf haben [14]. Eine Harnwegsinfektion wird durch die in Folge des Diabetes mellitus aufgetretene Blasendysfunktion begünstigt. Über 50% der Frauen und Männer mit Diabetes mellitus entwickeln eine diabetische Zystopathie [24]. Eine Harninkontinenz bei Frauen mit einem Diabetes mellitus ist mit einem erhöhten Infektionsrisiko verbunden [36]. Die diabetische Zystopathie entwickelt sich im Rahmen der autonomen Neuropatie. Sie ist durch einen Verlust der Empfindlichkeit gegenüber einer Blasenfüllung mit Abnahme der Miktionsfrequenz und einer Zunahme der Restharnmenge chrarkterisiert. Blasendysfunktionen treten bei 26 – 86% der Frauen mit Diabetes mellitus auf und sind mit einer deutlich erhöhten Infektionsrate verbunden [10]. Bei etwa 30% der an Diabetes mellitus erkrankten Frauen begünstigen Zystozelen sowie Zelenbildung in der Urethra und im Rektum eine Erregerinvasion in den Urogenitaltrakt [9]. Die bei Diabetikerinnen häufig auftretende Pilzbesiedelung der Genitalregion fördert ebenso die Aszension und Invasion uropathogener Bakterien. Diese Faktoren erklären nicht nur eine erhöhte Prädisposition an Diabete erkrankten Patienten begünstigen gegenüber komplizierte einer Harnwegsinfektion, Erkrankungsverläufen mit sondern konsekutiven Auswirkungen auf die diabetische Stoffwechselsituation. Diagnostische Aspekte Die klinischen Zeichen einer Harnwegsinfektion bei Patienten mit Diabetes mellitus entsprechen prinzipiell jenen, die auch bei Patienten ohne diese Stoffwechselstörung nachweisbar sind. Aufgrund der peripheren und autonomen Neuropathie werden die Symptome Dysurie und Strangurie sowie Blasentenesmen im fortgeschrittenen Stadium des Diabetes mellitus nicht mehr ausreichend wahrgenommen. Gelegentlich ist der Fieberanstieg wenig dramatisch. Eine Hämaturie und Flankenschmerzen können bei akuter Papillennekrose auftreten. Obwohl deren Genese nicht geklärt ist, spielen durch die Infektion begünstigte Infarzierungen der Papillen sehr wahrscheinlich eine Rolle [18]. Differentialdiagnostisch sollte bedacht werden, dass Flankenschmerzen auch bei einer emphysematösen Pyelonephritis auftreten können. Sie ist auf die Anwesenheit von Mikroorganismen zurückzuführen, die in starkem Maße Glukose fermentieren und Kohlendioxid bilden [22]. Die Untersuchungsbefunde des Urins, einschließlich der mikrobiologischen Diagnostik sind zur Einordnung der klinischen Symptome von grundsätzlicher Bedeutung. Für Therapieentscheidungen sind die Urinkultur mit Keimzahlbestimmung, die Erregeridentifizierung und die Resistenztestung gegenüber den antimikrobiellen Chemotherapeutika notwendig. Die Stoffwechselsituation, das Ausmaß der Entzündungsreaktion und die Nierenfunktion sind zur Risikoabschätzung und zur Verlaufsbeobachtung wichtig. Blutkulturen sollten sowohl bei Patienten mit einer Pyelonephritis und bei Verdacht auf eine Urosepsis veranlasst werden. Zur frühzeitigen Erfassung Untersuchungsverfahren von wichtig. Komplikationen Die sind bildgebende Ultraschalltomografie ermöglicht Aussagen über eine Harnstauung infolge einer Obstruktion. Sie ist zum Nachweis akuter entzündlicher Veränderungen und zur Abschätzung der Restharnmenge wichtig. Eine intravenöse Ausscheidungsurografie ist nur selten notwendig. Die Gefahr eines kontrastmittelinduzierten Nierenversagens ist bei Patienten mit einer diabetischen Nephropathie hoch. In kritischen Situationen, in denen die Ultraschalldiagnostik, röntgenologische oder nuklearmedizinische Verfahren keine zufriedenstellenden Ergebnisse erbringen, sind eine Computertomografie oder eine Magnetresonanztomografie indiziert. Behandlungsstrategien Die Therapieempfehlungen für Harnwegsinfektionen bei Patienten mit Diabetes mellitus entsprechen jenen, die auch für Patienten ohne Diabeteserkrankung akzeptiert sind. Wichtig ist es, das klinische Bild der Infektion (asymptomatischen Bakteriurie, symptomatische Erkrankung) die Lokalisation und die Nierenfunktion zu charakterisieren. Bedeutsam ist ferner die Einschätzung der metabolischen Situation; eine klinisch manifeste Infektion verstärkt die Neigung zu einer Stoffwechselentgleisung. Infektionen können den Insulinbedarf drastisch erhöhen. Faktoren, die eine Therapieentscheidung bei einer Harnwegsinfektion bei Diabetes mellitus beeinflussen sind in Tabelle 1 zusammengefasst. Asymptomatische Bakteriurie Die Behandlung mit Antibiotika bei einer asymptomatischen Bakteriurie bringt weder einen kurz- noch einen langfristigen Nutzen für die Patienten [20,26]. Bei Patienten mit einer stabilen Stoffwechselsituation reduziert eine derartige Therapie weder das Risiko der Entwicklung einer symptomatischen Infektion noch die Häufigkeit eine Zystitis oder Pyelonephritis. Eine Behandlung hat auch keinen Einfluss auf die Hospitalisierungsrate der Patienten [29]. Eine asymptomatische Bakteriurie führt in der Regel nicht zu einer Progression einer bereits manifesten Nierenfunktionsstörung oder zu einer Verschlechterung der diabetischen Spätfolgen [26]. Demzufolge ist auch ein Screening zum Nachweis einer asymptomatischen Bakteriurie Diabetikern mit einer stabilen Stoffwechselsituation nicht indiziert [29]. Symptomatische Infektionen bei Eine akute Zystitis bei Frauen mit einer stabilen Stoffwechselsituation ohne diabetische Organkomplikationen kann in gleicher Weise behandelt werden, wie es für Personen ohne Diabetes empfohlen wird; eine antimikrobielle Kurzzeittherapie ausreichend. Die Empfehlungen entsprechend der S3Leitlinie „Harnwegsinfektion [43] finden sich in der Tabelle 2 wieder. Patienten mit einer Pyelonephritis und einer moderaten klinischen Symptomatik können prinzipiell auch nach der Strategie, die in der S3Leitlinie zusammengefasst wurden, behandelt werden [43]. Alle Fälle mit einer ausgeprägten klinischen Symptomatik mit Übelkeit, Erbrechen sowie einer hämodynamischen und metabolischen Instabilität sollten hospitalisiert werden. Im akuten Stadium ist eine parenterale Antibiotikatherapie erforderlich. Die Empfehlungen zur Antibiotikatherapie bei diesen Patienten sind in Tabelle 3 zusammengestellt. Falls im Verlauf der Infektion Komplikationen wie renale bzw. perirenale Abszessbildung oder eine emphysematöse Pyelonephritis auftreten, sind eine kombinierte medikamentöse Therapie und eine chirurgische Intervention erforderlich. Auswahl der antimikrobiellen Substanzen Das Ziel der antimikrobiellen ist die Sanierung der Infektion. Die Behandlungsstrategien sollten auf der Grundlage evidenzbasierter Leitlinien erfolgen [29,42]. Bei jeder Therapieentscheidung spielen die diabetische Stoffwechselsituation und der klinische Schweregrad der Infektion eine wichtige Rolle. Klinische Erfahrungen beim Umgang mit antimikrobiellen Chemotherapeutika und Kenntnisse über die Empfindlichkeit der Infektionserreger gegenüber den antimikrobiellen Substanzen sollten die Grundlage jeder Entscheidung prägen. Breitspektrumcepahlosporine und Gyrasehemmer sind vorrangig bei einer Pyelonephritis einzusetzen. Alternativ kann der Einsatz von Carbapenemen (Meropenem, Imipenem, Ertapenem) oder von Betalactamaseinhibitoren (Piperacillin, Tazobactam, Ampicillin, Sulbactam), falls es die antimikrobielle Resistenzanalyse erlaubt, erfolgen. Bei einem schweren Krankheitsverlauf mit Entwicklung einer Sepsis oder eines septischen Schocksyndroms müssen Breitspektrumantibiotika unverzüglich im Sinne einer kalkulierten Therapie eingesetzt werden. Mit Kenntnis der mikrobiologischen Testergebnisse sollte die Entscheidung überprüft und eventuell ein Wechsel des Antibiotikums vorgenommen werden. Bei der Verordnung antimikrobieller Arzneimittelinteraktionen, Substanzen insbesondere zu müssen mögliche Antidiabetika und Antihypertensiva beachtet werden. Vielfach erhalten die Patienten wegen ihrer Multimorbidität zahlreiche unterschiedliche Arzneimittel, die mit einem hohen Nebenwirkungsrisiko belastet sind. In der Tabelle 4 sind einige Interaktionen antimikrobieller Substanzen auf den Glukosestoffwechsel zusammengefasst [5]. Antibiotika mit nephrotoxischer Wirkung, wie sie von Aminoglykosiden bekannt sind, sollten nur bei strengster Indikation eingesetzt werden. Bei Patienten mit einer Einschränkung der Nierenfunktion kann diese durch die Kombination von Cephalosporin und Furosemid weiter verschlechtert werden. Andere Antibiotika wie Trimetoprim hemmen die tubuläre Sekretion von Kreatinin und bedingen einen Kreatininanstieg im Serum. Tetracycline lösen besonders in Fällen mit einer Niereninsuffizienz antianabole Reaktionen aus. Nitrofurantoin sollte bei einer diabetischen Nephropathie nicht eingesetzt werden, da dessen Metabolite akkumulieren und eine periphere Neuropathie verursachen [19,29]. Um toxische Effekte einzelner Antibiotika zu vermeiden, ist bei einer manifesten Niereninsuffizienz die Dosierung der Medikamente dem Grad der Nierenfunktionsstörung anzupassen. Hierzu finden sich verschiedene tabellarische Zusammenstellungen, Einschränkung der glomerulären die unter Filtrationsrate Berücksichtigung der Empfehlungen zur Arzneimittelverordnung ausweisen [11]. Chronische Infektionen Die Behandlung rekurrierender bzw. rezidivierender Infektionsverläufe ist für Patienten mit und ohne Diabetes mellitus ähnlich. Bei jungen Frauen ohne diabetische Langzeitkomplikationen sollte eine rekurrierende/rezidivierende Infektion zunächst im Sinne einer akuten unkomplizierten Zystitis behandelt werden. Anschließend ist eine antimikrobielle Langzeittherapie mit einer Verordnung in niedriger Dosierung vertretbar. Eine antimikrobielle Prophylaxe nach dem Geschlechtsverkehr wird ebenfalls empfohlen [31]. Problematischer ist die Behandlung chronischer Infektionen bei Patienten mit urologischen Abnormalitäten Niereninsuffizienz (Stadium oder 4 und im Stadium 5 nach der K/DOQI). chronischen Vor einer antimikrobiellen Langzeittherapie ist es notwendig, eventuelle urologische Störungen zu diagnostizieren und möglichst zu beseitigen. Besonders bei niereninsuffizienten Patienten oder bei Männern mit einer chronischen Prostatitis können Bakterien im Nierengewebe oder in der Prostata längere Zeit in Endosomen persistieren, ohne dass sie einer antimikrobiellen Therapie zugänglich sind. Zum Einsatz von Immunstimulation (Urovac, Strovac, Univac) oder zu anderen Substanzen (L-Methionin, Cranberryprodukten) gibt es bei Patienten mit Diabetes mellitus nur Einzelbeobachtungen. Kontrollierte Studien, die eine Empfehlung dieser Behandlungsstrategien zulassen, sind nicht verfügbar. Schlussfolgerungen Durch die strikte Beachtung potentieller Risiken sind Exazerbationen symptomatischer Infektionen der Nieren- und ableitenden Harnwege bei Patienten mit Diabetes mellitus gut beeinflussbar. Bei Stoffwechselentgleisungen (Hypo- oder Hyperglykämien), insbesondere nach operativen Eingriffen besteht ein hohes Risiko für die Entwicklung einer Harnwegsinfektion. Eine langfristige normoglykämische Stoffwechseleinstellung ist eine entscheidende Voraussetzung, die lokalen Abwehrmechanismen gegenüber potentiellen Infektionserregern zu stabilisieren. Obwohl auch bei Patienten mit einem Diabetes mellitus eine Harnwegsinfektion nicht unmittelbar zu einer terminalen Niereninsuffizienz führt, kann jede Infektion, besonders bei einer vorbestehenden diabetischen Nephropathie den Nierenfunktionsverlust begünstigen. Die Mechanismen, die zu einer Harnwegsinfektionen bei Patienten mit Diabetes mellitus führen, sind nicht umfassend geklärt. Die Heterogenität der an Diabetes mellitus erkrankten Patientenpopulation, die Krankheitsdauer bei einzelnen Patienten oder der Schweregrad vorbestehender mikro- und makrovaskulärer Schäden sind Komponenten, die sowohl eine Infektprädisposition als auch den Krankheitsverlauf beeinflussen. Kontrollierte klinische Studien zum Vergleich von Patienten mit und ohne Diabetes mellitus sind erforderlich, um die Spezifik der therapeutischen Handlung bei Patienten mit Diabetes mellitus zu klären. Legenden Abbildung 1: Wachstumsverhalten von E.coli in Abhängigkeit von der Glukose- und Harnstoffkonzentration im Urin Abbildung 2: Prädisponierende Faktoren für eine Harnwegsinfektion bei Patienten mit Diabetes mellitus Tabelle 1: Faktoren für die Therapieentscheidung bei Patienten mit Diabetes mellitus Tabelle 2: Empfehlungen zur Antibiotikatherapie bei akuter unkomplizierter Zystitis bei Patienten mit Diabetes mellitus (Strategie entsprechend der S3-Leitlinie „Harnwegsinfektion“) [43] Tabelle 3: Empfehlungen zur Antibiotikatherapie bei einer akuten unkomplizierten Pyelonephritis bei Patienten mit Diabetes mellitus (Strategie entspricht der S3-Leitlinie „Harnwegsinfektionen) [43] Tabelle 4: Potentielle metabolische Effekte antimikrobieller Substanzen auf den Glukosespiegel bei Patienten mit Diabetes mellitus Literatur 1. Below AA, Chakrabory J, Khuder SH, Haselhun GD. Evaluation of urinary Tamm-Horsfall protein in postmenopausal diabetic women. J Diab Complic 1999; 13: 204 – 210 2. Bonadio M, Costarelli S, Morelli G, Tartaglia T. The influence of diabetes mellitus on the spectrum of uropathogens and the antimicrobial resistancein elderly adult patients with urinary tract infection. BMC Infect Dis 2006; 6: 54 – 61 3. Bonadio M, Meiki M, Gigli M, Longo B, Vigna A. Urinary tract infection in diabetic patients. Urol Int 1999; 63: 215 - 219 4. Chambers ST, Lever M. Betaines and urinary tract infections. Nephron 1996; 74: 1 – 10 5. Chan JC, Cockran CS, Critchley JA. Drug-induced disorders of glucose metabolisms. Mechanisms and management. Drug Saf 1996; 15: 135 – 157 6. Colodner R, Rock W, Chazan B. Risk factors for development of extended spectrum beta-lactamase-producing bacteria in nonhospitalized patients. Eur J Clin Microbiol Infect Dis 2004; 23: 163 – 167 7. Conolly SB, Sandlier D, Kieran NE, Doran P, Brady HR. Transcriptome profiling and the phathogenesis of diabetic complications. J Am Soc Nephrol 2003; 14: 279 – 283 8. Delamaire M, Mangendre D, Moreno M, Le Goff MC, Allanic H, Genelet B. Impaired leucocytes in diabetic patients. Diab Med 1997; 14: 29 – 34 9. Forland M, Thomas VL. The treatment of urinary tract infection in women with diabetes mellitus. Diab Care 1985; 8: 499 – 506. 10. Frimodt-Moller C. Diabetic Cystopathy: epidemiology and related disorders. Ann Intern Med 1980; 92: 318 – 321 11. Fünfstück R, Naber KG, Bishop MC. Urinary tract infections in renal insufficiency and dialysis. in: Urogenital infections. Hrsgb.: Naber KG, Schaeffer AJ, Heyns CF, Matsumoto T, Shoskes OA, Bjerklund Johansen TE. Europ Ass Urol 2010; 426 – 437 12. Fünfstück R, Nicolle LE, Hanefeld M, Naber KG. Urinary tract infection in patients with Diabetes mellitus. Clin Nephrol 2011 (in press) 13. Fünfstück R, Tschäpe H, Stein G, Vollandt R, Schneider S, Virulence of Escherichia coli strains in relevation to their hemolysin formation, mannoseresistant hemaglutination, hydroxamate production, K1antigen and their plasmid profil in patients with chronic pyelonephritis. Clin Nephrol 1989; 32: 178 – 184 14. Fünfstück R, Werner T. Harnwegsinfektionen bei Diabetes mellitus. Nierenund Hochdruckkrankheiten 2009; 38: 3 15. Geerlings SE, Brouwer EC, van Kessel KC, Gaastra W, Stolk RP, Heopelmann AIE. Cytokine secretion is impaired in women with diabetes mellitus. Eur J Clin Invest 2003; 30: 995 – 1001 16. Geerlings SE, Brower eC, Gaast W, Verhoef J, Hoepelmann AIM. Effect of glucose and pH on uropathogenic and non-uropathogenic Escherichia coli: studies with urine from diabetic and non-diabetic individuals. J. Med. Microbiol 1999, 48: 535 – 539 17. Geerlings SE, Meiland R, van Lith EC, Brouwer EC, Gaastra W, Hoepelmann AIE. Adherence of type 1-fimbriated Escherichia coli to uroepithelial cell: more in diabetic women than in controls. Diabetes care 2002; 25: 1405 – 1409 18. Griffin MD, Bergstrahl HU, Larson TS. Renal papillary necrosis – a sixteen year clinical experience. J Am Soc Nephrol 1995; 6: 248 – 256 19. Handrick W, Spencker F-B. Fragen zu Nitrofurantoin. Chemoth Journ 2011; 2:37 20. Harding GKM, Zhanel GG, Nicolle LE, Cheang M. Antimicrobial treatment in diabetic women with asymptomatic bacteriuria. New Engl Med 2002; 347: 1576 – 1583 21. Hauner, H. Diabetesepidemie und Dunkelziffer. Deutscher Gesundheitsbericht Diabetes 2011; 8 – 13 22. Huang JJ, Tseng CC. Emphysematous pyelonephritis: clinical-radiological classification, management, prognosis and pahogenesis. Arch Intern Med 2000; 160: 797 – 805 23. Joshi N, Caputo GM, Weitekapm MR, Krachmer AW. Infections in patients with diabetes mellitus. N Engl J Med 1999; 25: 1906 – 1912 24. Kaplan SA, Te AE, Blaivas JG. Urodynamic findings in patients with diabetic cystopathy. J Urol 1995; 153: 342 – 344 25. Li YM, Tan AX, Vlassara. Antibacterial activity of lysozyme and lactoferrin is inhibited by binding of advanced glycation – modified proteins to a conserved modification. Nar med 1995; 1: 1057 – 1061 26. Meidland R, Geerlings SE, Stolk RP, Netten PM, Schneeberger PM, Hoepelmann AIM. Asymptomatic bacteriuria in women with diabetes mellitus. Arch Intern Med 2006; 166: 2222 – 2227 27. Muchova J, Liptakova A, Ovszaghova Z. Antioxidant systems in polymorphnuclear leukocytes of typ 2 diabetes mellitus. Diab Med. 1999; 16: 74 – 78 28. Munar MY, Singh H. Drug dosing adjustment in patients with chronic kidney disease. Am Fam Physican 2007; 75: 1487 – 1496 29. Nicolle LE, Bradley S, Colgan R, Rice JC, Schaeffer A, Hooton TM. IDSA guidelines for the diagnosis and treatment of asymptomatic bacteriuria in adults. Clin Infect Dis 2005; 40: 643 – 654 30. Nicolle LE, Friesen Friesen D, Harding GMK, Ross LL. Hospitalization for acute pyelonephritis in Manitoba Canada during the period from 1989 to 1992: impact of diabetes, pregnancy and aboriginal origin. Clin Infect Dis. 1996, 22: 1051 – 1056 31. Nicolle LE. Uncomplicated urinary tract infections in adults including uncomplicated pyelonephritis. Urol Clin North Am 2008; 35: 1 – 12 32. Nicolle LE. Urinary tract infection in diabetes. Curr Opin Infect Dis. 2005; 18: 49 – 53 33. Oelschläger T, Fünfstück R. Rezidivierende Harnwegsinfektionen der Frau. Urologe A 2006; 4: 412 – 420 34. Pak J, Pu Y, Zhang ZT, Hasty DL, Wu XR. Tamm-Horsefall protein binds to typ 1 fimbriated Escherichia coli and prevents E.coli from binding to Uroplakin Ia and Ib receptors. J Biol Chem 2001; 276: 9924 – 9930 35. Papazafiropoulou A, Daniil I, Sotiropoulus A. Urinary tract infection, uropathogenes and antimicrobial resistance in diabetic and nondiabetic patients. Diabetes Res Clin Pract 2009; 85: e12 – e13 36. Phelan S, Kanaya AM, Subak LL. Prevalence and risk factos for urinary incontinence in overweight and obese diabetic women. Diabetes care 2009; 32: 1391 – 1397 37. Serafini-Cessi F, Malagolini B, Cavallone D. Tamm-Horsfall-Glycoprotein : Biology and clinical relevance. Am J Kidney Dis. 2003 ; 42 : 658 – 676. 38. Soo Park B, Lee SJ, Jim YK, Sik Huh J, Il Kim J, Chang SG. Outcome of nephrectomy and kidney preserving procedure fort he treatment of emphysematous pyelonephritis. Scan J Urol Nephrol 2006; 40: 332 – 338 39. Strevel EL, Kuper A, Gold WL. Severe and protracted hypoglycaemia associated with co-trimoxazole use. Lancet Infect Dis 2006; 6: 178 – 182 40. Thomas AA, Lane BR, Thomas AZ, Remert EM, Campbell SC, Shoskes DA. Emphysematous cystitis: A review of 135 cases. BJU Internat 2007; 100: 17 – 20 41. Thomson Micromedex; 1974 – 2009 42. Wagenlehner FME, Hoyme U, Kaase M, Fünfstück R, Naber KG, Schmiemannh G. Unkomplizierte Harnwegsinfektionen. Dtsch Ärztebl 2011; 1^08: 415 – 423 43. Wagenlehner FME, Schmiemann G, Hoyme U, Fünfstück R, HummersPradier E, Kaase M, Kniehl E, Selbach I, Seester U, Vahlensieck W, Watermann D, Naber KG. Epidemiologie, Diagnostik, Therapie und Management unkomplizierter bakterieler ambulant erworbener Harnwegsinfektionen bei erwachsenen Patienten. S3-Leitlinie AWMF-Register Nr.: 043/044.2010 44. Werner T. Geno- und phänotypische Charakteristika von E.coli bei Patienten mit Diabetes mellitus Typ 2 und einer asymptomatischen Bakteriurie und Patienten nach Nierentransplantation. Promotionsschrift, Universität Jena: 2008 45. Zahnel GG, Harding GK, Nicolle LE. Asymptomatic bacteriuria in patients with diabetes mellitus. Rev Infect Dis 1991; 13: 150 – 154