„Eisbecher“ – Zersetzung von Wasserstoffperoxid durch Blut
Werbung

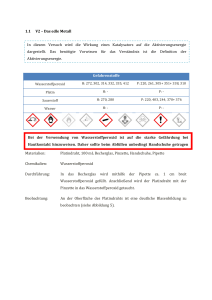
Das Experiment im Chemie-Unterricht Dominique Gebert, 29.11.2013 Demonstrationsexperiment „Eisbecher“ – Zersetzung von Wasserstoffperoxid durch Blut Ziele: Katalytische Prozesse sind in der Chemie essentiell, sowohl in der Industrie als auch in der Biochemie. Dieses Experiment zeigt, dass ein Enzym, namentlich die Katalase, welches in fast allen aeroben lebenden Lebewesen vorkommt, für den schnellen Abbau des für den Organismus schädlichen Wasserstoffperoxids sorgt. Voraussetzungen: Die SuS können Lewis-Formeln zeichnen und Reaktionsgleichungen formulieren, wissen, dass bei chemischen Reaktionen Energie umgesetzt wird, können vorteilsweise bereits ein Geschwindigkeitsgesetz für eine Reaktion formulieren, kennen vorteilweise schon die Begriffe Aktivierungsenergie, Katalyse, und Enzym (evtl. auch aus der Biologie). Zeitbedarf: Experiment: maximal 5 Minuten; Erklärungen: je nachdem ungefähr 10 Minuten Skizze: Quelle der Abbildung: http://lp.uni-goettingen.de/get/bigimage/3699 , 18.11.2013 1 Das Experiment im Chemie-Unterricht Dominique Gebert, 29.11.2013 Materialien: · Für Pt-katalysierte Reaktion: Pyrex-Glas 20 mL, Platin-Ring · Für Katalase-katalysierte Reaktion: Kelchglas, Glasstab, Schutzbrille, Schutzhandschuhe; um Blut-Volumen abzumessen: Becherglas 20 mL; um H2O2-Volumen abzumessen: Pasteur-Pipette, Messzylinder 10 mL Chemikalien: 30% H2O2-Lösung; Blut (e.g. Rind), welches bei einem Metzger bezogen werden kann; billiger, mit Platin beschichteter Kunststoff-Ring, der in einem Optikergeschäft gekauft werden kann Gefahrenhinweise: Wasserstoffperoxid (30%): reizend; R 22-41; S 26-39 Durchführung: 1) In ein Pyrex-Glas wird der Platin-Ring gelegt, und dann 1-2 mL H2O2 (30%) darüber geträufelt Dies soll als Vergleichsreaktion dienen 2) Während erstere Reaktion abläuft, werden in ein Kelchglas 10 mL Blut gefüllt, und anschliessend mit 2 mL H2O2 (30%) versetzt. Beobachtung für Reaktion mit Blut: Sofort setzt unter Aufschäumen eine heftige Reaktion ein. Eine schaumige Masse steigt in dem zylindrischen Kelch empor. Das Blut wird teilweise entfärbt und das Aussehen des Gemisches ähnelt dem eines Eisbechers mit Früchten. Reaktionsgleichung: 2 H2O2 (aq.) ¾Katalase ¾¾® 2 H2O (l) + O2 (g) Erklärung: Das aktive Zentrum dieses Enzyms besteht aus einem Fe3+-Ion, welches von einem Porpyhrin-Ring umgeben und über letzteren mit dem Enzym verknüpft ist. Das Enzym Katalase katalysiert die Zersetzung von Wasserstoffperoxid zu Wasser und Sauerstoff. Bei dieser Reaktion handelt es sich um eine sogenannte Disproportionierung: Die Oxidationszahl des Sauerstoffatoms im Edukt Wasserstoffperoxid beträgt -1. In den Produkten beträgt sie in Wasser -2, im Sauerstoff 0. Der freiwerdende Sauerstoff hat stark oxidierende Wirkung und entfärbt den roten Blutfarbstoff. Theorie, die mit diesem Experiment thematisiert werden kann: · Katalyse · Enzyme · Aktivierungsenergie bzw. –barriere · Reaktionsgeschwindigkeit 2 Das Experiment im Chemie-Unterricht Dominique Gebert, 29.11.2013 Entsorgung: Der Inhalt des „Eisbechers“ kann verdünnt in den Ausguss geleert werden. Bemerkungen: Mit diesem Experiment gäbe es diverse Querbezüge, beispielsweise zur FentonReaktion, generell zum Thema oxidativer Stress, als Beispiel für eine Häm-Gruppe, etc. Literatur: H. W. Roesky: Chemische Kabinettstücke – Spektakuläre Experimente und geistreiche Zitate, 2. Auflage, 1994, Weinheim, VCH Verlagsgesellschaft mbH, S. 83-86. http://lp.uni-goettingen.de/get/text/2571 , 19.11.2013 Autor: Dominique Gebert, 19.11.2013 3 Das Experiment im Chemie-Unterricht Dominique Gebert, 29.11.2013 Arbeitsblatt – Zersetzung von Wasserstoffperoxid durch Blut Einleitung: Bei der Zellatmung sowie im Rahmen des Abbaus wasserunlöslicher Verbindungen können im menschlichen Körper reaktive Sauerstoffverbindungen entstehen, sogenannte reactive oxygen species (ROS). Dabei handelt es sich um das Superoxid-Anionenradikal O2·-, das Hydroxylradikal HO· und Wasserstoffperoxid H2O2.[1] Solche schädliche Verbindungen fallen aber auch in anderen Prozessen an. Zum Schutz dagegen besitzen die Zellen im Organismus verschiedene Abwehr- bzw. Neutralisierungssysteme. Zum effektiven Abbau von H2O2 verfügen aerob lebende Lebewesen über das Enzym Katalase.[2] 1.) Dieses Enzym katalysiert die Zersetzung von Wasserstoffperoxid zu Wasser und Sauerstoff. Formulieren Sie die Reaktionsgleichung. 2.) Zeichnen Sie die Lewis-Formeln der an der Reaktion beteiligten Moleküle. Bestimmen Sie die Oxidationszahlen der Sauerstoffatome in den jeweiligen Verbindungen. Welche Elementarteilchen werden bei dieser Reaktion transferiert? 3.) Nennen Sie mindestens zwei Merkmale eines Katalysators. 4.) Zeichnen Sie in einem Energiediagramm schematisch den Verlauf einer unkatalysierten und katalysierten exergonen Reaktion mit gleichen Edukten und Produkten. Kennzeichnen Sie die Aktivierungsenergie, sowie die Gibbssche freie Energie für diese Reaktion. 1 2 http://de.wikipedia.org/wiki/Oxidativer_Stress , 19.11.2013 http://de.wikipedia.org/wiki/Katalase , 19.11.2013 4 Das Experiment im Chemie-Unterricht Dominique Gebert, 29.11.2013 Arbeitsblatt – Zersetzung von Wasserstoffperoxid durch Blut Einleitung: Bei der Zellatmung sowie im Rahmen des Abbaus wasserunlöslicher Verbindungen können im menschlichen Körper reaktive Sauerstoffverbindungen entstehen, sogenannte reactive oxygen species (ROS). Dabei handelt es sich um das Superoxid-Anionenradikal O2·-, das Hydroxylradikal HO· und Wasserstoffperoxid H2O2.[3] Solche schädliche Verbindungen fallen aber auch in anderen Prozessen an. Zum Schutz dagegen besitzen die Zellen im Organismus verschiedene Abwehr- bzw. Neutralisierungssysteme. Zum effektiven Abbau von H2O2 verfügen aerob lebende Lebewesen über das Enzym Katalase.[4] 1.) Dieses Enzym katalysiert die Zersetzung von Wasserstoffperoxid zu Wasser und Sauerstoff. Formulieren Sie die Reaktionsgleichung. 2 H2O2 (aq.) ¾Katalase ¾¾® 2 H2O (l) + O2 (g) 2.) Zeichnen Sie die Lewis-Formeln der an der Reaktion beteiligten Moleküle. Bestimmen Sie die Oxidationszahlen der Sauerstoffatome in den jeweiligen Verbindungen. Welche Elementarteilchen werden bei dieser Reaktion transferiert? Es werden Elektronen übertragen (Es handelt sich um eine katalysierte RedOx-Reaktion) 3.) Nennen Sie mindestens zwei Merkmale eines Katalysators. - 4.) 3 4 Ein Katalysator „verbraucht“ sich nicht durch die Reaktion. Er kann demnach wiederverwendet werden. Ein Katalysator vermindert die Aktivierungsenergie für eine Reaktion. Der letzte Punkt hat zur Folge, dass die Reaktion dadurch schneller abläuft. Zeichnen Sie in einem Energiediagramm schematisch den Verlauf einer unkatalysierten und katalysierten exergonen Reaktion mit gleichen Edukten und Produkten. Kennzeichnen Sie die Aktivierungsenergie, sowie die Gibbssche freie Energie für diese Reaktion. http://de.wikipedia.org/wiki/Oxidativer_Stress , 19.11.2013 http://de.wikipedia.org/wiki/Katalase , 19.11.2013 5 Das Experiment im Chemie-Unterricht Dominique Gebert, 29.11.2013 Quelle Bild: http://commons.wikimedia.org/wiki/File:Energiediagramm-Enzymreaktion.svg , 29.11.2013 6