Antibiotika
Werbung

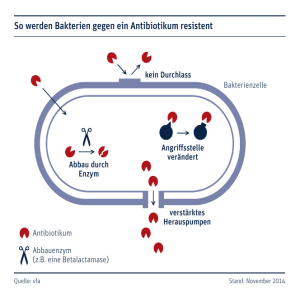
Versuch 18 Mittwoch Melanie Thompson C. B. Gruppe 2 Mikrobiologisches und Genetisches Praktikum Sommersemester 2006 Johann Wolfgang Goethe-Universität Frankfurt am Main Versuch 18: Antibiotika Einleitung Antibiotika sind von Mikroorganismen (Bakterien, Pilze) produzierte, chemische Substanzen, die das Wachstum anderer Mikroorganismen einschränken oder diese sogar abtöten können. Da Bakterien und Pilze häufig dieselben ökologischen Nischen besiedeln, dient die Bildung von Antibiotika als Wettbewerbsvorteil gegenüber dem/den Konkurrenten. Obwohl Antibiotika nachhaltige Eingriffe in den prokaryotischen Stoffwechsel vornehmen können, haben sie nur selten einen nachhaltigen Einfluss auf den eukaryotischen Stoffwechsel, da Antibiotika zumeist an Orten wirken, die Eukaryoten nicht, oder nicht in gleicher Art und Weise besitzen (bspw. unterschiedliche ribosomale Untereinheiten bei Eukaryoten/Prokaryoten), weshalb diese chemischen Verbindungen als Medikamente im Kampf gegen Infektionen genutzt werden. Antibiotika können unterschiedliche Wirkorte und damit verschiedene Auswirkungen auf den prokaryotischen Organismus haben, dies sind z.B. Einwirkungen auf: die Zellwandsynthese (Penicillin z.B.) die Cytoplasmamembran (z.B. Polymyxine, Daptomycin) die DNA-Synthese (z.B. Ciprofloxacin, Novobiocin) die RNA-Elongation (z.B. Actinomycin) die RNA-Polymerase (z.B. Rifampin, Streptovaracine) die Proteinsynthese, darunter: o Blockierung der Bindung der Aminoacyl-tRNA an die A-Stelle des Ribosoms (Tetracyclin) o Verhinderung des Übergangs vom Initiations- in den Elongationszustand des Ribosoms, Verursachen von Fehlcodierungen (Streptomycin) o Blockierung der Peptidyl-Transferase-Reaktion am Ribosom (Chloramphenicol) o Blockade der Translokationsreaktion am Ribosom (Erythromycin) Versuch 18 Mittwoch Melanie Thompson C. B. Gruppe 2 o Blockieren der Initiation der RNA-Synthese durch Binden an RNAPolymerase (Rifamycin) den Folsäure-Metabolismus (z.B. Trimethroprim, Sulfonamide) Wobei die hier genannten Antibiotika, die Einwirkungen auf die Proteinsynthese haben bakteriostatisch wirken, d.h. die Bakterien werden nicht abgetötet, sie wachsen nur nicht weiter. Wird die Zufuhr des Antibiotikums eingestellt, können die Bakterien ihr Wachstum wieder aufnehmen. Die Effektivität eines Antibiotikums hängt nicht zuletzt davon ab, in welchen Konzentrationen es verabreicht wird, dabei unterscheidet man zwei Fälle: o Die niedrigste Konzentration eines Antibiotikums in einer Verdünnungsreihe, die gerade noch ausreicht um das Wachstum eines Mikroorganismus einzuschränken bezeichnet man als MIC – minimum inhibitory concentration. o Als MBC – minimum bactericidal concentration - bezeichnet man die niedrigste Konzentration eines Antibiotikums in einer Verdünnungsreihe, die einen Organismus gerade noch abtötet. Natürlich versuchen Bakterien sich der Antibiotika zu erwehren, dies bspw. durch die Übertragung von Resistenzgenen durch Transfektion oder Konjugation auf andere Organismen der gleichen, aber auch einer anderen Art! Resistenzen entstehen zunächst meist über spontane Mutationen in einem Organismus. Diese Mutationen begünstigen bei Antibiotika-Gabe selektiv das Überleben/die Vermehrung resistenter Stämme, die unter normalen Bedingungen nur eine kleine Sub-Population in einer großen Masse von Mikroorganismen darstellen würden. Gängige Resistenz-Mechanismen sind dabei: o die Inaktivierung des Antibiotikums o die verringerte Aufnahme des Antibiotikums o Veränderung der Angriffs-Stelle des Antibiotikums im eigenen Organismus o Einführung alternativer Stoffwechsel-Reaktionen auf das Antibiotikum. Resistenzen stellen in der Medizin ein großes Problem dar, da sie sich unglaublich schnell ausbreiten und einzelne Stämme sogar multiple-Resistenzen gegen verschiedenste Antibiotika vorweisen können. Die Wirkung von Antibiotika auf Mikroorganismen soll in den weiteren Versuchsteilen auf verschiedenste Art untersucht werden. Versuch 18 Mittwoch Melanie Thompson C. B. Gruppe 2 Versuchsteil 18A: Wirkungsspektrum In diesem Versuchsteil soll die Wirkung von Antibiotika qualitativ bestimmt werden. Das verwendete Antibiotikum ist Streptomycin, welches Anfang der 40er Jahre durch S. Waksman entdeckt und als erstes wirksames Mittel gegen Tuberkulose eingesetzt wurde. Streptomycin wird durch den Mikroorganismus Streptomyces griseus produziert, bindet an die 30S Untereinheit bakterieller Ribosomen und hemmt damit die Proteinsynthese. Untersucht werden soll die unterschiedliche Wirkung von Streptomycin auf verschiedene Mikroorganismen. Material und Methoden Siehe Skript. Auswertung Untersucht werden sollte die Wirkung von Streptomycin auf die Mikroorganismen: o Escherichia coli o Micrococcus luteus o Bacillus subtilis o Serratia marcescens o Pseudomonas fluorescens o Saccharomyces cerevisiae Die Abstände vom Filterpapierstreifen bis zum nicht mehr gehemmten Bakterienrasen wurden gemessen und auffällige Beobachtungen aufgeschrieben. Der Abstand zwischen dem Filterpapier und dem verbleibenden farblos, trüben E. coli-Rasen betrug 1cm. Bei M. luteus betrug der Abstand vom Filterpapier bis zur nicht-gehemmten Kolonie 9mm, wobei dieser Abstand in diesem Fall nicht leicht zu erkennen war, da zu viel BakterienMaterial ausgestrichen wurde und die gelbe Färbung von M. luteus das Erkennen des gehemmten Bereiches nicht vereinfachte. Der Abstand Filterpapierstreifen zu B. subtilis betrug 1cm, die Kolonie war und blieb farblos. Versuch 18 Mittwoch Melanie Thompson C. B. Gruppe 2 Da der Ausstrich von S. marcescens bei dieser Gruppe (2) nur ungenau zu erkennen war, diente die Versuchsdurchführung von Gruppe 5 als Beobachtungsgrundlade. Bei S. marcescens konnte die interessante Beobachtung gemacht werden, dass die Kolonie im Abstand von 9mm vollkommen gehemmt war, danach farblose Kolonien zu erkennen waren und die ursprüngliche rosa/rot-Färbung der Kolonie erst wieder ab einem Abstand von 1,4cm zu erkennen war. Da Streptomycin ein bakteriostatisches Antibiotikum ist, welches seine Wirkung u.a. dadurch entfaltet, dass es ein die ribosomalen Untereinheiten der Bakterien bindet, könnte die Entfärbung der Kolonie darauf zurückzuführen sein, dass durch die Hemmung auch das Pigment, welches für die Rotfärbung verantwortlich ist, nicht gebildet wird. Da Bakterien jedoch nicht sterben, sondern nur im Wachstum gehemmt werden verlieren sie ihre rote Farbe nach einiger Zeit aufgrund des gewöhnlichen zellulären Abbaus, es wird aber kein neues Pigment nachgeliefert, die Kolonien sind damit farblos. Der Abstand von P. fluorescens zum Filterpapierstreifen betrug 4mm, die Kolonie war und blieb farblos. Der Abstand vom S. cerevisiae – Rasen bis zum Filterpapierstreifen betrug 5mm. Dies ist ein verwunderliches Ergebnis, da S. cerevisiae zu den Eukaryoten gehört, also eigentlich andere ribosomale Untereinheiten aufweisen sollte, als die Prokaryoten deren ribosomale Untereinheiten blockiert werden. Entweder liegen hier also Mutanten von S. cerevisiae vor, die eine andere ribosomale Untereinheit besitzen, die durch Streptomycin angegriffen wird, oder S. cerevisiae besitzt an sich schon ribosomale Untereinheiten, die denen der Bakterien ähneln, wobei hier leider nichts Näheres gefunden werden konnte. Am wahrscheinlichsten bleibt jedoch, dass der Ausstrich trotz großer Sorgfalt nicht bis an den Filterpapierstreifen heranreichte, womit kein durch Antibiotika-Diffusion gehemmter Wachstumsbereich, sondern einfach nur ein nicht-bewachsener Bereich vorliegen würde. Die Abstände der wachsenden Mikroorganismen zum Filterpapierstreifen zeigt, wie sensibel sie auf das enthaltene Antibiotikum Streptomycin bzw. auf die Konzentration dieses Antibiotikums reagieren. Versuch 18 Mittwoch Melanie Thompson C. B. Gruppe 2 Mikroorganismen, die einen sehr geringen Abstand aufweisen (bspw. P. fluorescens) zeigen eine höhere Toleranz gegenüber größeren Konzentrationen von Streptomycin, als Mikroorganismen, die nur in sehr weitem Abstand zum Streptomycin-getränkten Filterpapierstreifen wachsen können (bspw. B. subtilis, E. coli). Da das Antibiotikum durch den Agar diffundiert kann davon ausgegangen werden, dass in geringem Abstand zum Filterpapierstreifen eine höhere Konzentration herrscht als in größerem Abstand. Die größere Toleranz einzelner Mikroorganismen auf das verabreichte Streptomycin könnte auf sich entwickelnde oder bereits bestehende Resistenzen zurückgeführt werden. Diese Resistenzen würden bspw. Veränderungen der eigentlich betroffenen ribosomalen Untereinheit betreffen, zu einer verminderten Aufnahme oder gar zur Inaktivierung des Antibiotikums führen oder andere Stoffwechselreaktionen auf das Antibiotikum bedeuten. Versuchsteil 18B: Konzentrationsabhängige Wirkung von Antibiotika In diesem Versuchsteil soll die Wirkung von Antibiotika auf Mikroorganismen quantitativ untersucht werden. Die Wirkung von Antibiotika ist, wie schon erwähnt, konzentrationsabhängig, darum wird in diesem Versuchsteil die Verdünnungsreihe einer Antibiotika-Stammlösung, enthaltend 2mg/ml Chloramphenicol, hergestellt. Die vier verschiedenen Konzentrationen werden mit Hilfe von Filterpapierplättchen auf eine Agar-Platte mit Micrococcus luteus ausgebracht und anhand der entstehenden Hemmhöfe, deren Größe Konzentrationsabhängig ist, die Konzentration eines Antibiotikums unbekannter Konzentration berechnet, welches ebenfalls ausplattiert wurde. Material und Methoden Siehe Skript. Auswertung Die vier Reagenzgläser C1-C4 enthielten zunächst 500l steriles Wasser. Versuch 18 Mittwoch Melanie Thompson C. B. Gruppe 2 In Reagenzglas C1 wurden anschließend 500l der Antibiotika-Stammlösung gegeben und die Probe gut durchgemischt. Anschließend wurden 500l aus Reagenzglas C1 in C2 übertragen, dann 500l von C2 in C3 usw., sodass die Reagenzgläser ausgehend von der Antibiotika-Stammlösung folgende Verdünnungen enthielten: o C1: ½ (500l Stammlösung mit ca. 1mg bzw. 1000g Chloramphenicol) o C2: ¼ (250l Stammlösung mit ca. 0,5mg bzw. 500g Chloramphenicol) o C3: 1/8 (125l Stammlösung mit ca. 0,25mg bzw. 250g Chloramphenicol) o C4: 1/16 (62,5l Stammlösung mit ca. 0,125mg bzw. 125g Chloramphenicol) Es wurde ein Plättchen ausgelegt, welches zur Kontrolle nur Wasser enthielt. Zwei Plättchen X1 und X2 enthielten zum einen die Antibiotikalösung unbekannter Konzentration unverdünnt und 1:1 verdünnt. Nachdem die Platten über Nacht bei 37°C inkubiert wurden, waren am nächsten Tag deutliche Hemmhöfe um die einzelnen Plättchen C1-C4 sowie X1 und X2 erkennbar, das Plättchen K zeigte keinen Hemmhof auf, was anhand der Tatsache, dass das Plättchen K zur Kontrolle nur Wasser enthielt zu erwarten war. Die Hemmhöfe zeigten keine glatten Ränder, sondern je näher M. luteus dem Plättchen kam, desto kleiner wurden die Kolonien, bis irgendwann kein Wachstum mehr stattfand. Die Hemmhöfe zeigten schon optisch eine stete Verkleinerung auf, die durch anschließendes Ausmessen der Zone vom Rand des Plättchens bis zur Zone beginnenden Wachstums von M. luteus bestätigt werden konnte. Nach Ausmessen der einzelnen Hemmhöfe konnte folgende Tabelle erstellt werden: lnc [g/ml] x2 [mm2] c [g/ml] x [mm] C1 6,908 64 1000 8mm C2 6,251 16 500 4mm C3 5,521 4 250 2mm C4 4,828 1 125 1mm X1 5,68 16 292,95 4mm X2 5,264 4 193,25 2mm Versuch 18 Mittwoch Melanie Thompson C. B. Gruppe 2 Da der Versuch unter konstanten Bedingungen durchgeführt wurde, ist das Quadrat der Hemmzone (x2) dem Logarithmus der Antibiotikakonzentration im Plättchen direkt proportional. Wird die Antibiotikakonzentration variiert, kann anschließend x2 (y-Achse) in Abhängigkeit von ln c0 (x-Achse) aufgetragen werden: 70 60 50 x 2 40 30 20 10 0 4,5 5,0 5,5 6,0 6,5 7,0 ln c0 Resultat ist eine Gerade, die die x-Achse bei ln cx schneidet, in diesem Fall also 5,14. Nun kann man anhand dieses Wertes die Antibiotika-Konzentration berechnen, die mindestens notwendig ist um den Testorganismus am wachsen zu hindern: ln ck eck e5,14 170,72 ck Damit beträgt die Antibiotika-Konzentration, die mindestens benötigt wird um den Testorganismus am wachsen zu hindern 170,72g Chloramphenicol in 1ml bzw. 0,170mg/ml. Versuchsteil 18C: Identifizierung von Antibiotikaproduzenten Im letzten Versuchsteil soll die Sensibilität von Mikroorganismen auf Antibiotika ausgenutzt werden, um Antibiotika-produzierende Mikroorganismen zu identifizieren. Es werden drei Bacillus subtilis-Wildtypstämme auf ihre Fähigkeit untersucht, antibiotisch wirksame Substanzen zu bilden und damit das Wachstum anderer Mikroorganismen, in diesem Fall des Testorganismus Micrococcus luteus, zu inhibieren. Versuch 18 Mittwoch Melanie Thompson C. B. Gruppe 2 Material und Methoden Siehe Skript. Auswertung Auf eine M. luteus beinhaltende Agar-Platte wurden die drei B. subtilis-Stämme DSMZ 347, DSMZ 402 und DSMZ 2277 ausgestrichen. Am darauf folgenden Kurstag war eine Hemmhof-Bildung um alle drei B. subtilis-Stämme zu erkennen, was darauf schließen lässt, dass alle drei ausgestrichenen Stämme antibiotisch wirksame Substanzen produzieren, auf die M. luteus unterschiedlich empfindlich reagiert, was sich anhand der Beobachtungen ausmachen lässt: Der milchig-weiß erscheinende B. subtilis-Stamm DSMZ 347 zeigt den ausgeprägtesten Hemmhof, einen durchschnittlich 3mm breiten Rand komplett um die B. subtilis-Kolonie herum. Der Rand ist fransig und eindeutig abgegrenzt, was darauf schließen lässt, dass das hier produzierte Antibiotikum auch in geringer Dosis äußerst toxisch auf M. luteus wirkt und letzterer damit nur in einem Abstand wachsen kann, in dem kein Antibiotikum mehr zu finden ist. Der zweite milchig-weiße B. subtilis-Stamm DSMZ 402 zeigt einen durchschnittlich 2mm breiten Hemmhof, der jedoch nicht ganz eindeutig abgegrenzt ist, sich kleine M. luteusKolonien also dem Hemmhof bzw. dem fransigen Rand des B. subtilis-Stamm nähern. Dies lässt darauf schließen, dass das hier produzierte Antibiotikum nur in hoher Dosis, also direkt am Ursprungsort der B. subtilis-Kolonie toxisch auf M. luteus wirkt, in größerer Entfernung, also nach einer weiteren Diffusionsstrecke bei Vermindern der Konzentration eingeschränktes Wachstum also wieder möglich ist. Der dritte B. subtilis-Stamm DSMZ 2277 weißt eine orange/lachsfarbene Färbung und, im Gegensatz zu den beiden anderen Stämmen, einen glatten Kolonie-Rand auf. Auch um diesen Stamm hat es eine Hemmhof-Bildung gegeben, doch ist diese an den breitesten Stellen höchstens 1mm breit und liegt durchschnittlich eher unter dieser Breite. Versuch 18 Mittwoch Melanie Thompson C. B. Gruppe 2 Damit ist das hier produzierte Antibiotikum als sehr schwach anzusehen und befähigt B. subtilis gerade dazu, sich einen minimalen Bereich abzustecken. Das Antibiotikum entfaltet seine Wirkung also nur direkt in bzw. um die Kolonie, ist aber so schwach konzentriert, dass es gerade diesen 1mm diffundieren kann und dann keinerlei wachstumsbegrenzende Wirkung auf M. luteus mehr ausübt. Literaturhinweis Praktikumsskript Mikrobiologisches und Genetisches Praktikum der Johann Wolfgang Goethe-Universität Frankfurt a. M., Sommersemester 2006 Michael T. Madigan, John M. Martinko, Brock – Biology of Microorganisms, 11. Auflage, Pearson Prentice Hall, United States of America, 2006 Bruce Alberts, Dennis Bray, Karen Hopkin, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter, Lehrbuch der Molekularen Zellbiologie, 3. Auflage, Wiley-VCH Verlag, Weinheim, 2005 Neil A. Campbell, Jane B. Reece, Biologie, 6. Auflage, Spektrum Akademischer Verlag, Heidelberg – Berlin, 2003