Document
Werbung
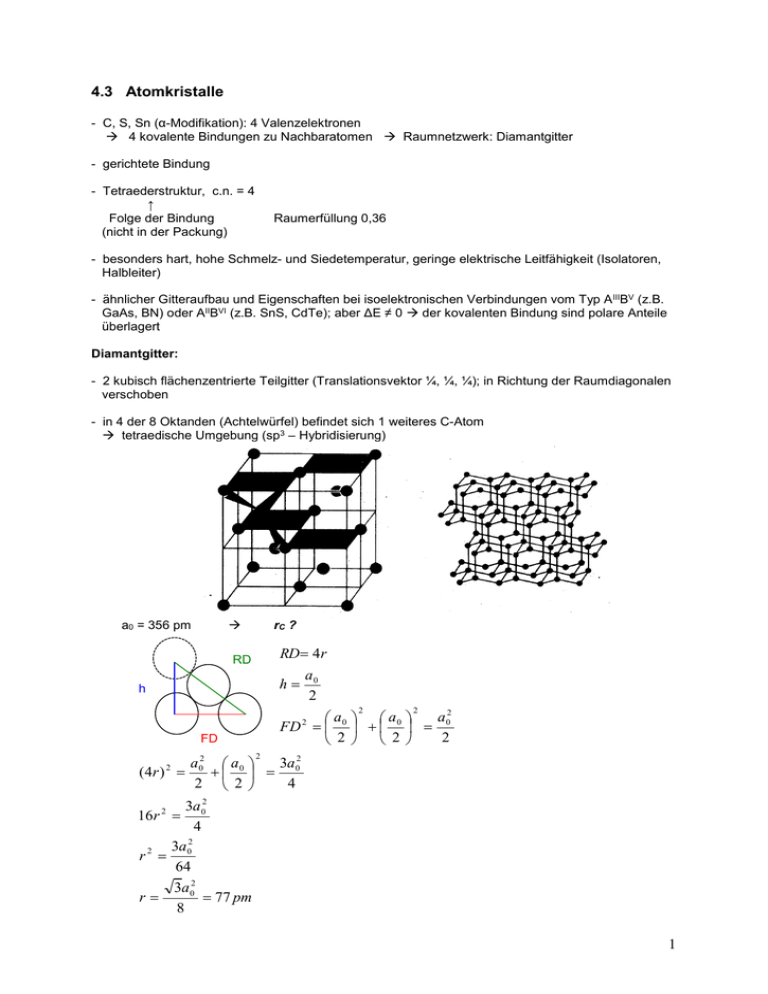
4.3 Atomkristalle - C, S, Sn (α-Modifikation): 4 Valenzelektronen 4 kovalente Bindungen zu Nachbaratomen Raumnetzwerk: Diamantgitter - gerichtete Bindung - Tetraederstruktur, c.n. = 4 ↑ Folge der Bindung (nicht in der Packung) Raumerfüllung 0,36 - besonders hart, hohe Schmelz- und Siedetemperatur, geringe elektrische Leitfähigkeit (Isolatoren, Halbleiter) - ähnlicher Gitteraufbau und Eigenschaften bei isoelektronischen Verbindungen vom Typ A IIIBV (z.B. GaAs, BN) oder AIIBVI (z.B. SnS, CdTe); aber ΔE ≠ 0 der kovalenten Bindung sind polare Anteile überlagert Diamantgitter: - 2 kubisch flächenzentrierte Teilgitter (Translationsvektor ¼, ¼, ¼); in Richtung der Raumdiagonalen verschoben - in 4 der 8 Oktanden (Achtelwürfel) befindet sich 1 weiteres C-Atom tetraedische Umgebung (sp3 – Hybridisierung) a0 = 356 pm rC ? RD 4r RD h h a0 2 2 2 a2 a a FD 2 0 0 0 2 2 2 FD 2 ( 4r ) 2 16r 2 r2 r a2 a 3a 2 0 0 0 2 2 4 3a 2 0 4 2 3a 0 64 3a 02 77 pm 8 1 in aliphatischen Verbindungen beträgt die C-C-Bindungslänge 154 pm - Schmelztemperatur Diamant: 3773 K, härtestes Element 4.4. Molekülkristalle - Bindungskräfte zwischen valenzmäßig abgesättigten Atomen und Molekülen van-der-Waals-Bindungskräfte ↓ Aggregation erfolgt im flüssigen und festen Zustand - Bindungsenergien klein (≈ 20 kJ/mol) - Moleküle mit bestimmten funktionellen Gruppen Wasserstoffbrückenbindungen (≈ 40 kJ/mol) - Van-der-Waals-Radius >> kovalenter Radius 4.4.1. Die zwischenmolekulare Bindung 4.4.1.1. van-der-Waals-Bindung - 3 Anteile: a) Orientierungskräfte: o zwischen Molekülen mit permanenten Dipolmoment (μ) oder zwischen Ionen- und Dipolmolekülen o Orientierung in einer bestimmten Raumrichtung (Ursache: positiver und negativer Ladungsschwerpunkt) Coloumbsche Kräfte bewirken Orientierung + - + - b) Induktionskräfte (DEBYE-Kräfte): o zwischen Dipolmolekülen (erzeugt ein elektrisches Feld) und Molekülen mit symmetrischer Ladungsverteilung (im elektrischen Feld des Dipolmoleküls) Dipolmoment wird induziert (Ladungsverschiebung im Molekül) ind * E α = Polarisierbarkeit des Moleküls E = elektrische Feldstärke des Dipols oder Ions c) Dispersionskräfte (LONDON-Kräfte): o zwischen allen Atomen und Molekülen o nur quantenmechanisch erklärbar, ständige e- - Bewegung momentane unsymmetrische Ladungsverteilung o resultierende Dipolmomente kompensieren sich zu Null im zeitlichen Mittel - für einfache Molekülkristalle gilt: 4 3 2 c 2 U U Or U ind U disp 2ind 4 3k BT kB = BOLTZMANN-Konstante c = Konstante (aus Ionisierungsenergie ableitbar) 2 Beispiele: Ar CO HI HCl NH3 Uor 0 0,0004 (0,11) 0,024 (0,38) 3,3 (1,08) 13,30 (1,47) Uind 0 0,008 0,113 0,241 1,547 Udisp 8,48 8,74 25,83 16,8 14,71 Uges (kJ/mol) 8,48 8,75 25,9 21,1 29,5 (µ in Debye in Klammern) Schlussfolgerungen: 1. Meist dominieren die Dispersionskräfte. 2. Wesentlicher Beitrag von Orientierungskräften nur bei Molekülen mit hohem Dipolmoment. 3. Beitrag der Induktionskräfte meist gering 4.4.1.2. Wasserstoffbrückenbindung (Proteine, DNA !) - Voraussetzungen: a) acides H–Atom an ein (stark) elektronegatives Atom X gebunden (X = O,N,S,Hal; teilweise auch C) b) H tritt mit nichtbindendem Elektronenpaar eines anderen elektronegativen Atoms in Wechselwirkung X H .........Y elektrostatisch; c.n. (H) = 2 c) sterisch günstig - Beispiele: intermolekulare H-Brückenbindung H H H O O H 276 pm H2O: flüssig; Anomalie des Wassers O H H O C C O H H O 272 pm Methansäure (Ameisensäure) intramolekulare H-Brückenbindung H O O H O 260 pm Salicylsäure 3 - Stärke der Wasserstoffbrückenbindung = f ( Winkel X – H …. Y , X ….. Y) ↑ ↑ starke H-Brückenbindung: nahe 180 ° 220 - 320 pm - beeinflusst chemische und physikalische Eigenschaften 4.4.2. Strukturprinzipien und Beispiele Edelgase: - ungerichtete Dispersionskräfte (U = Udis) - Gitterparameter nimmt für größer werdende Atomradien zu a0 ( He) 357 pm bei 20 K a0 Xe 624 pm - cn = 12 hexagonale Elementarzelle (He) oder kubische Elementarzelle (alle anderen) Iod: - orthorhombisches C-Gitter (auch Cl2, Br2, CO) - a0 = 479 pm, b0 = 725 pm, c0 = 978 pm V = 3,396 108 pm3 - Iodmolekül: I I 268 pm kovalenter Radius = 134 pm - van-der-Waals Radius >> kovalenter Radius (siehe Abbildung) - Packungsdichte: 0,67 Abstand sich berührender Atome verschiedener Moleküle = Summe der van-der-Waals-Radien. Wenn der gemessene Abstand zwischen zwei Atomen kleiner ist, als die Summe der van-der-WaalsRadien kann auf eine kovalente Bindung geschlossen werden (< 15%). CO2 (Trockeneis): - kubisches Kristallsystem - a0 = 564 pm 4 - C-Atome besetzen Ecken und Flächenmitten - Packungsdichte 0,71 (für viele organische Molekülkristalle ≈ 0,7 !) Schwefel: 95, 6C - orhorhombischer Schwefel (α-S8) monokliner Schwefel (β-S8) - gewellte Struktur („Kronenform“) o - S-S-Bindungslänge = 2,05 A , S-S-S-Bindungswinkel = 108°, S-S-S-S-Torsionswinkel = 99° - 5 Eis: - 11 kristalline Modifikationen - bei Normaldruck: hexagonales Eis Ih - tetraedische Anordnung, H-Brücken - „lockere“ Struktur mit Hohlräumen; ρ(0°C) = 0,92 g/cm 3 - Schmelzen: dichtere Zusammenlagerung der Moleküle ρ(H2O) > ρ(Eis) Dichtemaximum bei 4 °C (ρ = 1,000 g/cm 3) „Anomalie des Wassers“ - Gefrieren: Ausdehnung um ca. 9% Sprengwirkung - Eis schwimmt auf Wasser, Gewässer frieren nicht bis zum Grund zu 6