DOC - bei EQIOOKI ••• eqiooki.de
Werbung

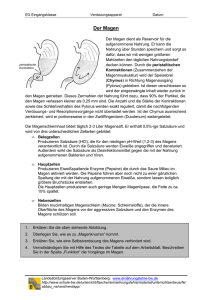
eqiooki.de | Salzsäure | Seite 1 von 3 Salzsäure Salzsäure ist ein wichtiger Stoff in der Chemieindustrie. Man nennt sie auch Chlorwasserstoffsäure. Chemische Reaktion von Wasserstoff mit Chlor Reaktionsgleichung → Reaktion von jeweils einem Wasserstoffmolekül und Chlormolekül zu einem Chlorwasserstoffmolekül: H2 + Cl2 → 2 HCl ; exotherm Details → Reaktionsgleichung mit Aggregatzuständen und Reaktionswärme H2(g) + Cl2(g) ⇌ 2 HCl (g) ; ΔH = -184 kJ/mol Sicherheitshinweise → Gemische aus Chlor und Wasserstoff [Chlorknallgas] explodieren z.B. bei Belichtung [Chlorknallgasreaktion]; Chlorwasserstoff ist giftig und ätzend, Chlor giftig und Wasserstoff brennbar Formel und Bau des Chlorwasserstoffmoleküls Name → Chlorwasserstoff [Hydrogenchlorid] Beschreibung → Molekül aus einem Wasserstoff- und einem Chloratom bestehend, die durch eine polare Elektronenpaarbindung [polare Atombindung] verbunden sind; das größere Chloratom [mit 17 Protonen im Atomkern] zieht das gemeinsame [bindende] Elektronenpaar [rot] stärker zu sich und vom kleinen Wasserstoffatom [mit nur einem Proton] weg - dadurch entstehen Ladungsschwerpunkte am Molekül [Dipolmolekül]; am Chloratom existieren außerdem noch 3 nicht-bindende Elektronenpaare Summenformel → HCl chemisches Zeichen für 1 Molekül Chlorwasserstoff und für das Gas (also den Stoff) Chlorwasserstoff Strukturformel (LEWIS-Formel, Formel in Elektronenschreibweise) → siehe nebenstehende Abbildung rechts Eigenschaften von Chlorwasserstoff Eigenschaften bei 20°C → farbloses, giftiges, stechend riechende Gas; stark ätzend und giftig; starke Säure; bildet mit Luftfeuchtigkeit weiße Nebel [feinste Salzsäuretröpfchen]; nicht brennbar; gut wasserlöslich; Dichte ρ=1,64 g/m3 Reaktion mit Wasser → reagiert mit Wasser unter Bildung einer sauren Lösung [Chlorwasserstoffsäure, Salzsäure] Reaktion von Chlorwasserstoff mit Wasser, Bau von Salzsäure Reaktionsgleichung ausführlich → Jeweils ein Chlorwasserstoffmolekül reagiert mit einem Wassermolekül zu einem Oxoniumion H3O+ sowie einem Chloridion Cl- [exotherm]: HCl + H2O ⇌ H3O+ + Cl- ; ΔH = -75 kJ/mol Erläuterung der Reaktion → Dabei gibt das HCl-Molekül ein Proton [H+] an das Wassermolekül ab [Protolyse]: Protonenabgabe: HCl ⇌ H+ + Cl- Protonenaufnahme: H+ + H2O ⇌ H3O+ Reaktionsgleichung vereinfacht (ohne Berücksichtigung des Wassers) → Jeweils ein Chlorwasserstoffmolekül dissoziiert [in wässriger Lösung] in je ein Wasserstoffion und ein Chloridion: HCl ⇌ H+ + Cl- ; ΔH = -n kJ/mol oder mit Angabe des Lösungsmittels Wasser auch HCl (aq) ⇌ H+(aq) + Cl-(aq) einprotonige Säure → je HCl-Molekül kann nur 1 Proton H+ abgegeben werden elektrische Leitfähigkeit → wässrige Lösung leitet den elektrischen Strom infolge frei beweglicher Ionen Chlorwasserstoff → Gas, besteht aus Molekülen; Formel HCl eqiooki.de | Salzsäure | Seite 2 von 3 Salzsäure [Chlorwasserstoffsäure] → wässrige Lösung des Gases Chlorwasserstoff; Formel HCl; enthält sowohl Moleküle [restliche HCl-Moleküle, H2O-Moleküle] als auch frei bewegliche Ionen [Cl- sowie H3O+ bzw. vereinfacht H+; Ursache für elektrische Leitfähigkeit] chemisches Zeichen für Salzsäure damit eigentlich H3O+ + Cl- (vereinfacht H+ + Cl-), da das Zeichen HCl für ein Chlorwasserstoffmolekül steht englischer Name → Hydrochlorid Acid Löslichkeit → maximal 37%-ige Salzsäure ist möglich; die nicht reagierenden HCl-Reste entweichen aus der Lösung [Ursache für stehenden Geruch der Salzsäure; weiße Nebel rauchende Salzsäure] Eigenschaften von Salzsäure Eigenschaften konzentrierter (rauchender) Salzsäure [37%-ig] bei 20°C → farblose bis leicht gelbliche Flüssigkeit; stark stechender Geruch; stark ätzend sowie gesundheits- und umweltschädlich; Dichte ρ=1,19 g/cm3; wirkt ätzend auf unedle Metalle und Carbonate; bringt Eiweiße zum Gerinnen [Denaturierung]; weißliche Nebel mit Luftfeuchtigkeit bildend Entdeckung → vermutlich bereits im 2. Jahrhundert durch Alchimisten Einige typische Säurereaktionen Reaktion mit unedlen Metallen (Beispiel) → Reaktion von Magnesium mit Salzsäure zu Magnesiumchlorid und Wasserstoff [Redoxreaktion] Mg + 2 HCl → MgCl2 + H2 ; exotherm Reaktion mit Hydroxidlösungen [Neutralisation] (Beispiel) → Reaktion von Natriumhydroxidlösung mit Salzsäure zu Natriumchloridlösung und Wasser [Protolyse] NaOH + HCl → NaCl + H2O ; exotherm Reaktion mit Carbonaten (Beispiel) → Reaktion von Calciumcarbonat [Marmor, Kreide, Kalkstein] mit verdünnter Salzsäure zu Calciumchloridlösung, Kohlenstoffdioxid und Wasser [Protolyse] CaCO3 + 2 HCl → CaCl2 + CO2 + H2O ; exotherm Nachweisreaktionen zur Identifizierung Reaktion mit Indikatoren → Salzsäure reagiert mit Universalindikator unter Rotfärbung [Ursache: frei bewegliche Oxoniumionen H3O+ bzw. vereinfacht Wasserstoffionen H+]; siehe Reaktion mit Wasser Reaktion mit Silbernitratlösung → weißer Niederschlag wegen der Chloridionen Cl- in der Lösung [Bildung von schwerlöslichem Silberchlorid]: Ag+ + Cl- → AgCl Info → durch Nachweis der Wasserstoffionen sowie der Chloridionen ist Salzsäure eindeutig identifiziert Natürliche Vorkommen Vorkommen von Chlorwasserstoffgas → in geringen Mengen in Vulkanabgasen Vorkommen von Salzsäure → in geringen Mengen in Kraterseen; im Magensaft der Wirbeltiere [etwa 0,1-0,5%-ig; zur Schaffung des sauren Milieus für die Wirkung des Eiweiß spaltenden Enzyms Pepsin] Verwendung Info → u.a. als Lötwasser, Entkalker, zur Metallätzung und -reinigung, Entfernung von Kesselstein [siehe Reaktion mit Carbonaten], Leimherstellung, zur Herstellung von Chloriden [also diversen Salzen] und organischen Chlorverbindungen wie z.B. Kunststoffen [speziell PVC, Polyvinylchlorid] und Lösungsmitteln; zur Neutralisation von alkalischen Abwässern Darstellung im Labor Schritt 1 → z.B. Reaktion von Natriumchlorid mit konzentrierter Schwefelsäure zur Chlorwasserstoff und Natriumsulfat: 2 NaCl + H2SO4 → 2 HCl + Na2SO4 Schritt 2 → Einleiten von Chlorwasserstoff in Wasser: HCl + H2O ⇌ H3O++ Cl- [ vereinfacht HCl ⇌ H+ + Cl- ] eqiooki.de | Salzsäure | Seite 3 von 3 Herstellung in der Industrie Schritt 1 → Synthese von Chlorwasserstoff aus den Elementsubstanzen: H2 + Cl2 → 2 HCl Schritt 2 → Einleiten von Chlorwasserstoff in Wasser HCl + H2O ⇌ H3O++ Cl- [ vereinfacht HCl ⇌ H+ + Cl- ] Einige Fachbegriffe dieses Themas saure Lösung → wässrige Lösung, die Wasserstoffionen H+ enthält; diese bilden gemeinsam mit je einem Wassermolekül die frei beweglichen Oxoniumionen H3O+ H+ + H2O ⇌ H3O+ pH-Wert ist kleiner als 7 Säure [nach ARRHENIUS] → Stoffe die Protonen abspalten und so in wässriger Lösung in frei bewegliche positiv geladenen Wasserstoffionen H+ und negativ geladenen Säurerestionen dissoziieren [Säurerestionen der Salzsäure sind Chloridionen] Dissoziation [dissoziieren] → Zerfall von Stoffen in frei bewegliche Ionen durch Einwirkung von Wassermolekülen Säure [nach BRÖNSTED] → Teilchen, die Protonen H+ abgeben können [Protonendonatoren] Aggregatzustände in Reaktionsgleichungen → (g) gasförmig [gaseous], (l) flüssig [liquid], (s) fest [solid]; (aq) wässrige Lösung Reaktionswärme [Reaktionsenthalpie] → exotherm [Abgabe von Wärmeenergie] ΔH = -n kJ/mol; endotherm [Aufnahme von Wärmeenergie] ΔH = +n kJ/mol; manchmal auch mit Q = ... statt ΔH angegeben (Q für Wärmemenge); Schreibweise der Einheit kJ/mol auch als kJ · mol-1 möglich ΔH → Änderung der Enthalpie bei einer Reaktion, also Energiebilanz bei einer chemischen Reaktion unter konstantem Druck [Differenz der Enthalpie der Produkte und Ausgangsstoffe, d.h. ihrer chemischen Energien] Elektronenpaarbindung [Atombindung] → Art der chemischen Bindung, die auf Anziehungskräften zwischen einem gemeinsamen Elektronenpaar [negativ geladen] und den positiv geladenen Atomkernen der beteiligten Atome beruht; typische Bindung in Molekülen polare Elektronenpaarbindung [polare Atombindung] → Atombindung, bei der das gemeinsame Elektronenpaar von einem Atom stärker angezogen wird als vom anderen; typische Bindung in Molekülen aus verschiedenartigen Atomen Dipol → Molekül mit Ladungsschwerpunkten, die infolge polarer Bindung entstanden [negativer Ladungsschwerpunkt δ- an dem Atom, zu dem das gemeinsame [bindende] Elektronenpaar stärker hingezogen wird; positiver Ladungsschwerpunkt δ+ an dem Atom mit der geringeren Anziehungskraft] Protolyse [nach BRÖNSTED] → Reaktion mit Protonenübergang; mindestens ein Proton H+ wird von einem Teilchen abgegeben [Protonendonator; Säure], das von einem anderen Teilchen [Protonenakzeptor; Base] wieder aufgenommen wird Redoxreaktion → Reaktion mit Elektronenübergang; mindestens ein Elektron wird von einem Teilchen abgegeben [Reduktionsmittel; wird oxidiert], das von einem anderen Teilchen [Oxidationsmittel, wird reduziert] wieder aufgenommen wird umkehrbare Reaktion → Einstellung eines chemischen Gleichgewichts zwischen Hinund Rückreaktion; gekennzeichnet mit einem Doppelpfeil ⇌ Quellenangaben Die Inhalte dieser Webseite wurden urheberrechtlich durch den Autor zusammengestellt und eigenes Wissen sowie Erfahrungen genutzt. Bilder und Grafiken sind ausschließlich selbst angefertigt. Für die Gestaltung dieser Internetseite verwendeten wir zur Information, fachlichen Absicherung sowie Prüfung unserer Inhalte auch folgende Internetangebote: wikipedia.de, schuelerlexikon.de, seilnacht.com. Zitate oder Kopien erfolgten nicht.