Cyclobutadien Benzol Cyclooctatetraen Azulen Naphthalin Anth
Werbung
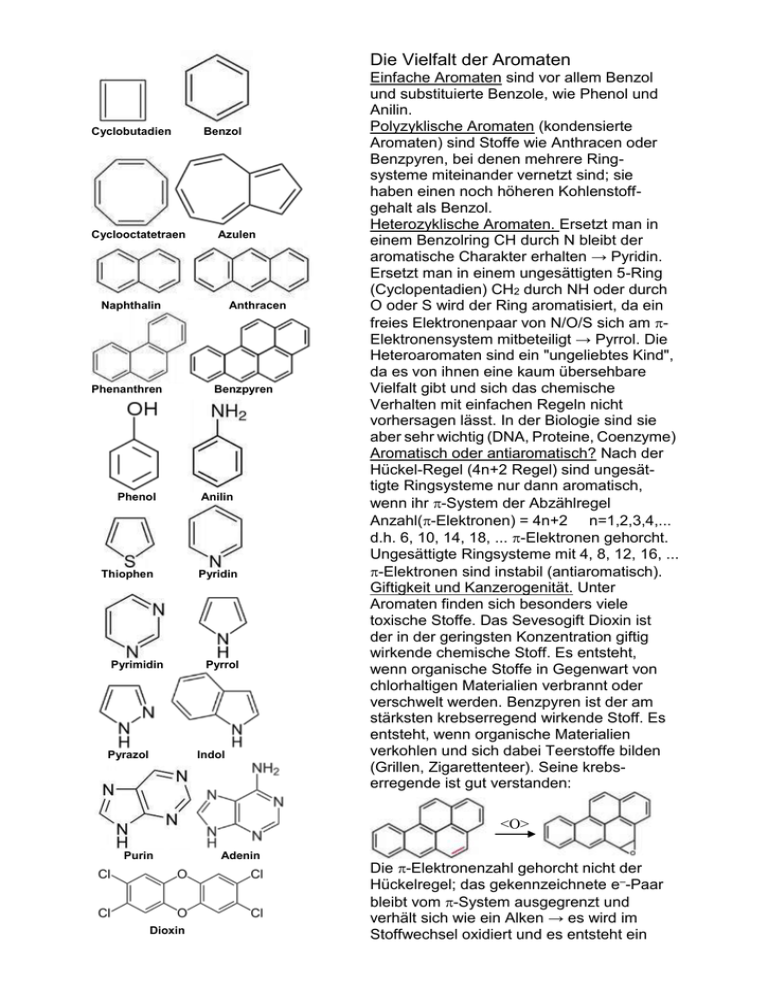
Die Vielfalt der Aromaten Cyclobutadien Cyclooctatetraen Benzol Azulen Naphthalin Phenanthren Phenol Thiophen Pyrimidin Pyrazol Anthracen Benzpyren Anilin Pyridin Pyrrol Indol Einfache Aromaten sind vor allem Benzol und substituierte Benzole, wie Phenol und Anilin. Polyzyklische Aromaten (kondensierte Aromaten) sind Stoffe wie Anthracen oder Benzpyren, bei denen mehrere Ringsysteme miteinander vernetzt sind; sie haben einen noch höheren Kohlenstoffgehalt als Benzol. Heterozyklische Aromaten. Ersetzt man in einem Benzolring CH durch N bleibt der aromatische Charakter erhalten → Pyridin. Ersetzt man in einem ungesättigten 5-Ring (Cyclopentadien) CH2 durch NH oder durch O oder S wird der Ring aromatisiert, da ein freies Elektronenpaar von N/O/S sich am Elektronensystem mitbeteiligt → Pyrrol. Die Heteroaromaten sind ein "ungeliebtes Kind", da es von ihnen eine kaum übersehbare Vielfalt gibt und sich das chemische Verhalten mit einfachen Regeln nicht vorhersagen lässt. In der Biologie sind sie aber sehr wichtig (DNA, Proteine, Coenzyme) Aromatisch oder antiaromatisch? Nach der Hückel-Regel (4n+2 Regel) sind ungesättigte Ringsysteme nur dann aromatisch, wenn ihr -System der Abzählregel Anzahl(-Elektronen) = 4n+2 n=1,2,3,4,... d.h. 6, 10, 14, 18, ... -Elektronen gehorcht. Ungesättigte Ringsysteme mit 4, 8, 12, 16, ... -Elektronen sind instabil (antiaromatisch). Giftigkeit und Kanzerogenität. Unter Aromaten finden sich besonders viele toxische Stoffe. Das Sevesogift Dioxin ist der in der geringsten Konzentration giftig wirkende chemische Stoff. Es entsteht, wenn organische Stoffe in Gegenwart von chlorhaltigen Materialien verbrannt oder verschwelt werden. Benzpyren ist der am stärksten krebserregend wirkende Stoff. Es entsteht, wenn organische Materialien verkohlen und sich dabei Teerstoffe bilden (Grillen, Zigarettenteer). Seine krebserregende ist gut verstanden: <O> Purin Dioxin Adenin Die -Elektronenzahl gehorcht nicht der Hückelregel; das gekennzeichnete e–-Paar bleibt vom -System ausgegrenzt und verhält sich wie ein Alken → es wird im Stoffwechsel oxidiert und es entsteht ein reaktionsfähiges Epoxid. Dieser Metabolit hat eine hohe Tendenz sich mit der Base Guanin in der DNA zu verbinden. → Dadurch wirkt es als starkes chemisches Mutagen, was wiederum die krebserzeugende Wirkung begründet. Graphit sind, umso höher der Kohlenstoffgehalt und umso ausgedehnter das delokalisierte Elektronensystem, desto höher die optische Dichte. Die plättchenförmigen Kristalle werden immer stärker glänzend, je größer die Moleküle des Aromaten sind. Beim Graphit erreicht die optische Dichte einen so großen Wert, dass alles Licht an seiner Oberfläche reflektiert wird und er metallisch glänzt. Da sich die Elektronendelokalisation über die gesamte Gitternetzebene erstreckt ist der Graphit wie ein Metall elektrisch- und wärmeleitfähig (→ Elektronengas). Zwischen den Netzebenen herrschen "nur" Van-der-Waals-Kräfte → die Ebenen sind gegeneinander verschiebbar → Verwendung als Schmiermittel und als Bleistiftmine zum Schreiben (→ Name Graphit = Schreibstein) Die chemische Struktur der Steinkohle hochreiner Graphit-Einkristall Graphit besitzt eine hexagonale Kristallstruktur. Diese ist darauf zurückzuführen, dass der Graphit aus übereinander geschichteten hexagonalen Gitternetzebenen aufgebaut ist: perspektivische Ansicht Netzebenenausschnitt in der Draufsicht Eigenschaften von Graphit: Die Netzebenen im Graphit stellen so etwas wie einen ausgedehnten polyzyklischen Aromaten dar. Bei diesen Stoffen ist bereits zu beobachten, dass je mehr Benzolringe miteinander vernetzt Kohlenhydrate und Proteine in Pflanzenleichen, die dem Inkohlungprozess ausgesetzt sind, erleiden fortschreitend H2O-, NH3- und H2S-Abspaltungen, sodass vernetzte heteroaromatische Ringstrukturen entstehen. Ist die Inkohlung vollständig abgeschlossen, führt dies zu der regelmäßigen Wabenstruktur der Graphitnetzebenen. Wird Steinkohle unter Luftabschluss erhitzt, kommt es zu Bindungsspaltungen und es werden einerseits die das Kohlegas bildenden Kleinmoleküle (H2, H2O, NH3, H2S, CO, N2) abgespalten, andererseits zerfällt die oben gezeigte Struktur in die verschiedensten aromatischen Moleküle; diese bilden im Gemisch den Steinkohlenteer. Sie lassen sich hieraus isolieren und sind wichtige Grundstoffe für die Farbstoffund Medikamentensynthese. Namen wie Phenol, Thiophen oder Anthracen weisen auf die Herkunft aus der Steinkohle hin. Fragen zum Text: 1. Ist Phenol ein einfacher Aromat oder ein heterozyklischer Aromat? 2. Damit ein organisches Molekül aromatisch ist, müssen folgende drei Bedingungen erfüllt sein: a) das Molekül muss völlig eben sein; b) alle C-Atome müssen ....-hybridisiert sein; c) ……………………………….. ………………………………….. 3. Unter den auf der ersten Seite gezeigten Kohlenwasserstoffen sind zwei Moleküle, die nicht aromatisch, sondern vielmehr antiaromatisch sind. Um welche Moleküle handelt es sich dabei? 4. Zeichnen Sie die Formel von Cyclo-penta-1,3-dien. Erklären Sie anhand der Hybridisierung der C-Atome, warum dieser Stoff nicht aromatisch ist. Vergleichen Sie mit dem aromatischen Pyrrol. 5. Unter welchen Bedingungen entsteht der extrem giftige Stoff Dioxin? 6. Worauf beruht die krebserregende Wirkung von Benzpyren? 7. Warum besitzt Graphit mehrere Eigenschaften, die für ansonsten als typisch für Metalle gelten; zählen Sie solche Eigenschaften auf und begründen Sie! 8. Ein Graphiteinkristall (s. Abb. oben) leitet den elektrischen Strom in der Abbildungsebene, also z.B. “von rechts nach links“, sehr gut; in der Richtung senkrecht dazu, d.h. “in die Abbildung hinein“, wird der Strom schlecht geleitet. Schlagen für diese Beobachtung, die man bei Metallen nicht machen kann, eine Erklärung vor! 9. Vergleichen Sie den oben gezeigten Strukturausschnitt aus der Steinkohle mit einer Netzebene im Graphitkristall. Nennen Sie dazu eine Gemeinsamkeit und einen Unterschied! Ein Einkristall ist ein Kristall ein perfekt gebauter Kristall ohne Fehler oder Störungen im Gitter