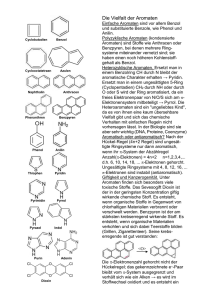
Reaktionen der Aromaten Übersicht
Werbung

Basiswissen | Aufgaben und Lösungen ◮ Aromaten | Reaktionen der Aromaten Skript Reaktionen der Aromaten Übersicht 1 Einführung 1 2 Elektrophile Substitution am Aromaten 1 2.1 Allgemeine Betrachtung der Elektrophilen Substitution . . . . . . . . . . . . . . . . 2.2 Die Bromierung von Benzol . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 4 3 Säure-Base-Chemie von Phenol und Anilin 3.1 Säurewirkung von Phenol . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6 6 3.2 Basizität von Anilin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 © Karlsruhe 2014 | SchulLV www.ChemieLV.net Vervielfältigung nur innerhalb einer Lehrer-/Klassen- oder Schullizenz und mit Hinweis auf ChemieLV erlaubt. Basiswissen | Aufgaben und Lösungen ◮ Aromaten | Reaktionen der Aromaten Skript 1 Einführung In diesem Skript werden wir uns mit der Reaktivität von aromatischen Kohlenwasserstoffen beschäftigen. Wie alle chemischen Verbindungen geht auch Benzol spezielle Reaktionen ein (bspw. die Elektrophile Substitution) bzw. weist in bestimmten Situationen spezifische Eigenschaften auf (Säure–Base–Chemie). Die Grundlagen für dieses Skript findest du im ChemieLV–Skript Aromatische Kohlenwasserstoffe. In diesem Skript wollen wir uns mit zwei wichtigen Themen beschäftigen: der Elektrophilen Substitution am Aromaten, wo wir beispielhaft Benzol als Prototyp einer aromatischen Verbindung betrachten, und der Säure–Base–Chemie der Benzolderivate Anilin und Phenol. Anmerkung: Insbesondere die Substitution am Aromaten enthält einige neue Aspekte, die nicht zwangsweise Teil des Schulstoffs sein müssen. Du wirst hier einige wichtige Inhalte der organischen Chemie kennen lernen und sehen, wie hier Reaktionen betrachtet werden. Deshalb kannst du diese Inhalte als Zusatzinformationen ansehen, wenn sie nicht Bestandteil deines Lehrplans sind. 2 Elektrophile Substitution am Aromaten Wir wollen uns hier mit einer wichtigen Reaktion von aromatischen Kohlenwasserstoffen beschäftigen, der Elektrophilen Substitution am Aromaten. Diese Reaktion ist deshalb so wichtig, weil wir damit die Wasserstoffatome durch andere Substituenten ersetzen können. Doch zunächst wollen wir die neuen Begriffe klären. Der Begriff der Substitution kommt vom lateinischen substituere, was ersetzen be- deutet. In Substitutionsreaktionen werden bestimmte Teile eines Moleküls ersetzt. In unserem Fall werden wir ein Wasserstoffatom am Benzolring „ersetzen“, also substituieren. Den Begriff elektrophil wollen wir zunächst etwas auseinander nehmen. Dieses Adjek- tiv kommt von Elektrophilie, was auf gr. philos = Freund zurück geht. „Elektro“ weist auf Elektronen hin. Wenn wir diese Informationen kombinieren, dann erhalten wir ungefähr die Übersetzung elektronenliebend. Als elektrophil werden Atome oder Moleküle (auch Ionen) bezeichnet, welche einen Elektronenmangel aufweisen. Diese „fühlen“ sich in diesem Zustand nicht „wohl“ und sind bestrebt, ihren Elektronenmangel auszugleichen. Wir wollen nun klären, warum ein Elektrophil, also eine elektrophile Verbindung, mit Benzol reagieren sollte. Dazu erinnern wir uns an die Bindungsverhältnisse in Aromaten, beispielhaft an Benzol (vgl. Abb. 1). © Karlsruhe 2014 | SchulLV Seite 1/8 Vervielfältigung nur innerhalb einer Lehrer-/Klassen- oder Schullizenz und mit Hinweis auf ChemieLV erlaubt. www.ChemieLV.net Basiswissen | Aufgaben und Lösungen ◮ Aromaten | Reaktionen der Aromaten e- H 1 H Skript H 2 4 3 5 H eH H 6 e- 3 C H C 4 e- H Abbildung 1: Delokalisierte π–Elektronen in Benzol Die delokalisierten π–Elektronen befinden sich über und unter dem Benzolring. Hier sind folglich relativ viele Elektronen auf relativ geringem Raum vorhanden. Diese Eigenschaft macht das Benzol anfällig für die Reaktion mit einem Elektrophil. Man spricht hier auch von einem möglichen Angriff des Elektrophils am Aromaten. Wir wollen uns diese Reaktion nun in zwei Schritten klar machen. Zunächst formulieren wir eine Reaktionsgleichung, die uns aufzeigt, welche Edukte reagieren und welche Produkte entstehen. Das dient dazu, dass du das allgemeine Prinzip hinter diesem Reaktionstyp erkennst. Im zweiten Schritt schauen wir uns eine spezielle elektrophile Substitution an: die Bromierung von Benzol. 2.1 Allgemeine Betrachtung der Elektrophilen Substitution Ganz allgemein wollen wir ein Elektrophil hier mit E+ bezeichnen. Das große E gibt uns den Hinweis auf den Namen und das + liefert die Info, dass hier Elektronen fehlen (vgl. ChemieLV Skript Redoxreaktionen und Oxidationszahlen). Anmerkung: Die Formulierung des Elektronenmangels und die Bezeichnung des Elektrophils als E+ können zusammen irreführend sein. Das Elektrophil muss nicht geladen sein, aber es kann. Was auch möglich ist, ist das Vorhandensein einer positiven Formalladung, welche durch einen Unterschied in der Elektronegativität hervorgerufen wird. Ganz grundsätzlich benötigen wir einen Elektronenmangel, inwieweit dieser zustande kommt bzw. wie dieser sich genau darstellt (Kation oder nicht), ist hier nicht so relevant. Die Reaktionsgleichung einer elektrophilen Substitution am Aromaten kann folgendermaßen formuliert werden. E H H H H H + E+ H + H+ H H H H H Abbildung 2: Reaktionsgleichung der elektrophilen Substitution am Aromaten Die wichtigsten Komponenten sind in Abbildung 2 eingefärbt: Die π–Elektronen sind rot, © Karlsruhe 2014 | SchulLV Seite 2/8 Vervielfältigung nur innerhalb einer Lehrer-/Klassen- oder Schullizenz und mit Hinweis auf ChemieLV erlaubt. www.ChemieLV.net Basiswissen | Aufgaben und Lösungen ◮ Aromaten | Reaktionen der Aromaten Skript das zu substituierende H–Atom blau und das Elektrophil orange. Anmerkung: Wir verwenden diese Schreibweise des Benzols, da sie zweckmäßiger ist. Wir werden relativ schnell sehen, warum. Es ist jedoch sehr wichtig, dass du dir darüber im klaren bist, wie die Bindungsverhältnisse in Aromaten wirklich aussehen: Es gibt keine Doppelbindungen! Wenn wir uns diese Reaktionsgleichung anschauen, dann wissen wir zwar welche Edukte und Produkte beteiligt sind, was aber im Detail passiert, wissen wir nicht. Wir werden uns nun die einzelnen Schritte dieser Reaktion im Detail anschauen. Die elektrophile Substitution ist eine Reaktion, die in zwei Schritten abläuft. Zunächst kommt es zum Angriff des Elektrophils und im Anschluss zur Abspaltung des Protons. 1. Angriff des Elektrophils + H E E H E H E+ H + + Angriff des Elektrophils Intermediat: Cyclohexadienyl-Kation Abbildung 3: Das Elektrophil kann am Aromaten angreifen Nachdem das Elektrophil am Benzolring angegriffen hat, bildet sich ein geladenes Zwischenprodukt aus (vgl. Abb. 3). Ein solches wird im Allgemeinen als Intermediat bezeichnet. In diesem Fall trägt es den Namen Cyclohexadienyl–Kation. Mithilfe der Pfeile verdeutlichen wir uns Änderung in der Anordnung der Elektronen. Wir sprechen hier vom Klappen der Elektronen. Im Falle der mesomeren Grenzformeln des Cyclohexadienyl–Kations „klappen“ die Elektronen einer Bindung immer eine Position weiter. Somit erhalten wir alle drei Grenzformeln. 2. Abspaltung des Protons + E E H E H E H + H+ + + Intermediat: Cyclohexadienyl-Kation Substituiertes Benzol Abbildung 4: Das Proton spaltet sich vom Benzol ab Wie du sehen kannst, ist hier die Bindung des H–Atoms rot eingefärbt (vgl. Abb. 4). Das hängt damit zusammen, dass diese nach der Abspaltung des H–Atoms die neue Bindung im Benzolring darstellen wird. Damit in unserem Molekül die Oktettregel nicht verletzt wird, klappen wir alle Elektronenpaare im Ring eine Position weiter, bis wir in der dritten Struktur © Karlsruhe 2014 | SchulLV Seite 3/8 Vervielfältigung nur innerhalb einer Lehrer-/Klassen- oder Schullizenz und mit Hinweis auf ChemieLV erlaubt. www.ChemieLV.net Basiswissen | Aufgaben und Lösungen ◮ Aromaten | Reaktionen der Aromaten Skript die letzte ausstehende Bindung neu bilden können, wobei sich das H–Atom als Proton (H+ ) abspaltet. Wir konnten hier lernen und erkennen, dass eine solche Reaktion verhältnismäßig einfach aussehen kann, wenn wir uns nicht für den genauen Mechanismus interessieren. Oft sind aber die entscheidenden Schritte die Details einer Reaktion und wenn wir diese kennen, dann können wir die Reaktion auch nach unseren Vorstellungen gestalten. Das ist eine der großen Stärken der Organischen Chemie. Das detaillierte Wissen um Reaktionsmechanismen, also wie diese im Detail ablaufen, macht es möglich, eine extreme Bandbreite an Verbindungen herzustellen, die die moderne Welt geprägt haben und prägen. Hierzu zählen Wirkstoffe, Kunststoffe etc.. Nachdem wir den allgemeinen Mechanismus der elektrophilen Substitution am Aromaten kennen gelernt haben, wollen wir diesen jetzt an einem konkreten Beispiel, der Bromierung von Benzol, anwenden. 2.2 Die Bromierung von Benzol Die Bromierung von Benzol beschreibt die Reaktion von Brom (Br2 ) mit Benzol. Im Rahmen dieser Reaktion werden wir noch einige weitere spezielle Aspekte kennen lernen, die im Zusammenhang mit Reaktionen von Aromaten auftreten. Zunächst ist Brom als Halogen nicht besonders elektrophil. Wir haben hier keinen Unterschied in der Elektronegativität und somit auch keine Formalladungen. In diesem Zusammenhang ist Benzol viel zu träge, um eine Reaktion eingehen zu wollen. Wir haben ja schon gesehen, dass die Elektronenkonfiguration von Benzol relativ stabil ist, es gibt hier also keinen Grund für dieses, eine Reaktion einzugehen. Um dieses Problem zu beheben, setzen wir einen Katalysator ein (vgl. ChemieLV Skript Der Katalysator): Eisentribromid (FeBr3 ). Nun starten wir die Reaktion, welche in drei Schritten ablaufen wird. Am Anfang steht die Aktivierung von Brom. Dieser Schritt ist hier neu und nicht direkter Bestandteil der Substitutionsreaktion. Den Begriff der Aktivierung können wir uns ganz bildlich vorstellen. Brom ist in Gegenwart von Benzol sehr träge und inaktiv. Damit die Reaktion ablaufen kann, müssen wir dem Brom salopp ausgedrückt „in den Hintern treten“ oder etwas präziser und fachlich korrekter, wir müssen es aktivieren. Das können wir durch die Verwendung des Katalysators möglich machen: 1. Aktivierung von Brom + Br Br FeBr3 Br Br + FeBr3 Br Br FeBr3 Katalysator Komplexverbindung Abbildung 5: Elementares Brom wird durch den Katalysator aktiviert Brom reagiert mit dem Katalysator zu einer Komplexverbindung (vgl. Abb. 5). Bei dieser schaust du dir am besten die rechte der beiden Grenzformeln an. Hier kannst du sehen, dass ein endständiges Brom–Atom eine positive Formalladung aufweist. Wenn wir uns an den Begriff des Elektrophils erinnern, dann sehen wir, dass es sich hierbei genau darum handelt: Wir haben einen Elektronenmangel durch den Einsatz des Katalysators bewerk© Karlsruhe 2014 | SchulLV Seite 4/8 Vervielfältigung nur innerhalb einer Lehrer-/Klassen- oder Schullizenz und mit Hinweis auf ChemieLV erlaubt. www.ChemieLV.net Basiswissen | Aufgaben und Lösungen ◮ Aromaten | Reaktionen der Aromaten Skript stelligen können – das Brom wurde aktiviert. Hier kannst du sehen, dass ein Elektrophil auch ein Molekül sein kann bzw. insbesondere ein aktivierte Teil eines Moleküls. Dieses aktivierte Brom–Atom ist unser Substituent, also das Atom, das Wasserstoff am Benzolring ersetzen wird. Nun gehen wir zur elektrophilen Substitution über. 2. Angriff des Elektrophils + H + Br Br Br H Br Br H H + FeBr4- FeBr3 + + Abbildung 6: Das Elektrophil greift am Aromaten an Hier siehst, du wie das Elektrophil in Form der Komplexverbindung am Benzolring angreift (vgl. Abb. 6). Ein Brom-Atom wird an den Benzolring gepackt, während das andere zusammen mit dem Katalysator eine negative Verbindung bildet (FeBr− ). Wieder haben wir drei 4 mesomere Grenzformeln für das gebildete Intermediat. Nun zum letzten Schritt: Der Abspaltung von H+ . 3. Abspaltung des Protons Br Br H Br FeBr3 + HBr + FeBr3 + Abbildung 7: Das Proton spaltet sich vom Benzol unter Bildung des Produkts ab In diesem Schritt spaltet sich das Proton (H+ ) ab und wir erhalten unser Produkt Brombenzol (vgl. Abb. 7). Wichtig ist hierbei noch die Anwesenheit des Katalysators. Die Verbindung FeBr− ist negativ geladen, das bedeutet, dass hier das Bestreben besteht, diese negative 4 Ladung auszugleichen. Das ist mithilfe des Protons möglich. Die Abspaltung des letzteren wird also durch die Anwesenheit von FeBr− gefördert. Das Ergebnis sind zwei Moleküle: 4 Bromwasserstoff HBr und der regenerierte Katalysator FeBr3 . Das stimmt auch damit überein, dass Katalysatoren unverändert aus der Reaktion hervorgehen. Was konntest du hier sehen und lernen? In der Organischen Chemie spielen die Details der Reaktionen oft eine entscheidende Rolle und ohne diese Informationen wären wir nicht in der Lage, die ablaufenden Prozesse richtig zu verstehen. Aromaten sind zwar eher reaktionsträge, können aber durch die Verwendung geeigneter Katalysatoren trotzdem zur Reaktion gebracht werden. © Karlsruhe 2014 | SchulLV Seite 5/8 Vervielfältigung nur innerhalb einer Lehrer-/Klassen- oder Schullizenz und mit Hinweis auf ChemieLV erlaubt. www.ChemieLV.net Basiswissen | Aufgaben und Lösungen ◮ Aromaten | Reaktionen der Aromaten Skript Anmerkung: Ein Hinweis zur Organischen Chemie außerhalb der Schule. Es mag zunächst nicht besonders motivierend sein, wenn man alle Reaktionen im Detail kennen muss, insbesondere vor dem Hintergrund, dass diese alle auswendig gelernt werden müssten. Das ist aber nicht der Fall. Du wirst einige grundlegenden Mechanismen und die Einflüsse von wichtigen Substituenten kennen lernen und die Grenzen der Reaktivität verstehen können. Mit diesem Satz an „Werkzeugen“ wirst du dann in der Lage sein zu erkennen und zu verstehen, was möglich sein wird und was nicht. 3 Säure-Base-Chemie von Phenol und Anilin Die Säure–Base–Chemie behandeln wir ausführlich im ChemieLV Themengebiet Säure–Base– Gleichgewichte. Hier wollen wir uns eine Besonderheit anschauen, die auf den aromatischen Benzolring zurückgeht und die Säurewirkung von Phenol bzw. die Basenwirkung von Anilin entscheidend beeinflusst. 3.1 Säurewirkung von Phenol Phenol ist ein Alkohol (vgl. Abb.14). Alkohole sind im Allgemeinen sehr schwache Säuren mit pKS –Werten von ungefähr 15. Warum das so ist, liegt an der Struktur von Alkoholen. Eine Protolyse würde eine negative Ladung verursachen, die energetisch gesehen ungünstiger wäre, wie der ungeladene Fall. Wenn wir uns anschauen, was bei Phenol passiert, wenn die OH-Gruppe deprotoniert wird, dann wird uns klar, warum dieses einen niedrigeren pKS –Wert besitzt und somit eine bessere Säure darstellt. H O O H H + O + O H H H Abbildung 8: Protolysereaktion von Phenol und Wasser Der entscheidende Punkt ist die Stabilität des Phenolat–Anions. Im Gegensatz zu aliphatischen (nicht–aromatischen) Kohlenwasserstoffen ist hier eine Mesomeriestabilisierung möglich. Wir können hier mesomere Grenzformeln zeichnen, während uns das für aliphatische Alkoholate nicht möglich ist. Diese Tatsache führt dazu, dass eine Deprotonierung unter energetischen Gesichtspunkten für Phenol gewinnbringend ist. © Karlsruhe 2014 | SchulLV Seite 6/8 Vervielfältigung nur innerhalb einer Lehrer-/Klassen- oder Schullizenz und mit Hinweis auf ChemieLV erlaubt. www.ChemieLV.net Basiswissen | Aufgaben und Lösungen ◮ Aromaten | Reaktionen der Aromaten Skript O O O O Abbildung 9: Mesomere Grenzformeln des Phenolat–Anions Du siehst, dass wir vier mesomere Grenzformeln zeichnen können. Diese erklären die Stabilität des Phenolat–Anions sowie die Säureeigenschaften von Phenol. 3.2 Basizität von Anilin Anilin ist ein Derivat von Benzol. Hier ist ein H–Atom durch eine Aminogruppe R–NH2 substituiert. Aminogruppen kennst du beispielsweise von den Aminosäuren, wo sie einen basischen Charakter aufweisen. Dies ist auf das freie Elektronenpaar zurückzuführen. Im Falle des Anilins haben wir jedoch noch den Benzolring, der beachtet werden muss: Anilin ist mesomeriestabilisiert. H N H H N H H H N H N H Abbildung 10: Mesomere Grenzformelen von Anilin Wir können hier wieder vier mesomere Grenzformeln zeichnen. Das heißt, dass Anilin so relativ stabil ist. Wir wollen nun schauen, was passiert, wenn wir die Aminogruppen protonieren d.h. wenn diese ihre Basenwirkung entfaltet. H H H N H N H H H O + H + O H H Abbildung 11: Protolysereaktion von Anilin und einem Oxonium–Ion Auf der Produktseite siehst du die protonierte Form von Anilin. Bei dieser ist es uns nicht möglich mesomere Grenzformeln zu zeichnen: Die protonierte Form von Anilin ist © Karlsruhe 2014 | SchulLV Seite 7/8 Vervielfältigung nur innerhalb einer Lehrer-/Klassen- oder Schullizenz und mit Hinweis auf ChemieLV erlaubt. www.ChemieLV.net Basiswissen | Aufgaben und Lösungen ◮ Aromaten | Reaktionen der Aromaten Skript energetisch gesehen die ungünstigere Konfiguration. Wo die Mesomeriestabilisierung bei Phenol dazu führte, dass hier die Säurewirkung begünstigt wird, ist bei Anilin genau der Gegenteil der Fall. Die Basizität der Aminogruppe von Anilin fällt geringer aus, als beispielsweise in Aminosäuren. Wiederum ist der Benzolring das entscheidende Kriterium. © Karlsruhe 2014 | SchulLV Seite 8/8 Vervielfältigung nur innerhalb einer Lehrer-/Klassen- oder Schullizenz und mit Hinweis auf ChemieLV erlaubt. www.ChemieLV.net