G. Alkine Ethin (C sp): Atomkerne auf einer Geraden, 2 π
Werbung
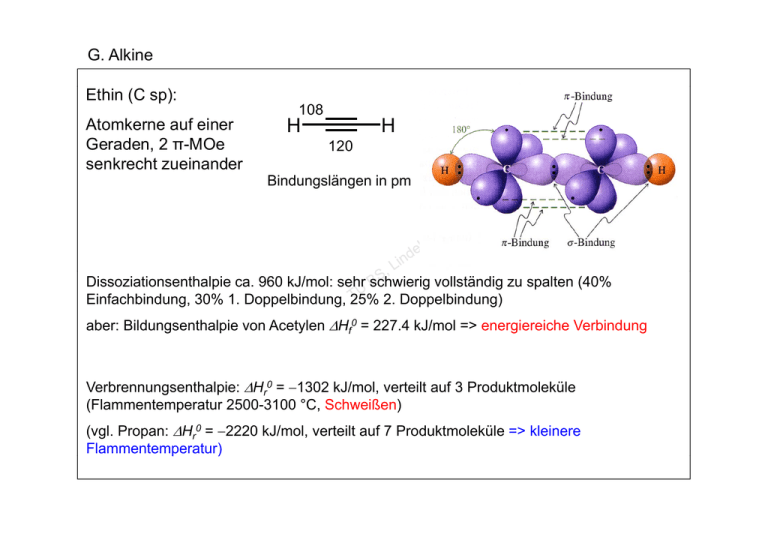
G. Alkine Ethin (C sp): Atomkerne auf einer Geraden, 2 π π-MOe MOe senkrecht zueinander 108 H H 120 Bindungslängen in pm Dissoziationsenthalpie ca. 960 kJ/mol: sehr schwierig vollständig zu spalten (40% Einfachbindung, 30% 1. Doppelbindung, 25% 2. Doppelbindung) g p von Acetylen y Hf0 = 227.4 kJ/mol => energiereiche g Verbindung g aber: Bildungsenthalpie Verbrennungsenthalpie: g p Hr0 = 1302 kJ/mol,, verteilt auf 3 Produktmoleküle (Flammentemperatur 2500-3100 °C, Schweißen) (vgl. Propan: Hr0 = 2220 kJ/mol, verteilt auf 7 Produktmoleküle => kleinere p ) Flammentemperatur) G. Alkine Spezifische Primärflammenleistung = Zündgeschwindigkeit x freiwerdende spezifische Wärme G. Alkine Stammverbindung Acetylen ungiftig explosiv, aber handhabbar Darstellung über Calciumcarbid: sublimiert bei -85 °C C 3 C + CaO -(2000 °C, Lichtbogen)-> CaC2 + CO CaC2 + 2 H2O -> Acetylen + Ca(OH)2 (Wöhler) oder direkt aus C und H2 im Lichtbogen. Darf nicht mit Kupferleitungen in Berührung kommen, da sonst Bildung von explosivem Kupferacetylid. Inhalation führt zur Teilnahmslosigkeit. Bei 2000 °C im Lichtbogenplasma (Kathode: W; Anode: Cu) wird Wasserstoff mit Kohlepartikeln (100 m)) wenige i ms umgesetzt. t t Kohleumsatz 50 %; y ((25 %), CO ((20 %), H2 ((35 %). %) Produkte: Acetylen G. Alkine Schrittweise Hydrierung von Acetylen: H + H H H H Kat. H Ho = -175.4 175 4 kJ/mol H H H + H H H Kat. H H H H H H H Ho = -136.9 kJ/mol H Internale Alkine stabiler als terminale: Et H + 2 H H Kat. Ho = -292.7 kJ/mol Et + 2 H H Kat. H H H H H Ho = -272.6 kJ/mol G. Alkine Selektive Hydrierung zu Alkenen Z-selektiv (Lindlar-Hydrierung) Strukturen von Chinolin, Isochinolin und Pyridin? aus: Brückner, Reaktionsmechanismen G. Alkine Selektive Hydrierung zu Alkenen E-selektiv E-konfiguriertes Alkenylanion sterisch ungehinderter Abwechselnd ein Elektron aus Na und ein Proton aus NH3. aus: Brückner, Reaktionsmechanismen G. Alkine pKs ca. 25 Ein Carbanion ist desto stabiler, je größer sein s-Charakter (El kt (Elektronen iin s-Orbitalen O bit l werden d stärker tä k angezogen als l iin pOrbitalen). H H H NaNH2, NH3(l) - NH3 CH3I N Na (i) LiNH2, NH3(l) - NH3 - NaI Li O (ii) H2O, -LiOH O H G. Alkine Synthese aus Alkenen durch Dihalogenierung/doppelte Dehydrohalogenierung Br2 H Br Br NaNH2, NH3(l) - NH3 Warum werden hier 3 Ä i B Äquiv. Base b benötigt? öti t? Br2 H Br NaNH2, NH3(l) - NH3 Br H E2-anti Br Newman-Projektion? G. Alkine Elektrophile Addition an Alkine 1 Äquiv. Br2, HOAc, LiBr Br 1 Äquiv. Br2, CCl4 Br Br Br Br Br H2O, O H2SO4, kat. HgSO4 OH Keto-Enol-Tautomerie O Genutzt wird die große Affinität von Hg2+ zu Alkinen. Terminale Alkine liefern Ketone, Ketone keine Aldehyde (Markovnikov!) H2O, O H2SO4, kat. kat Hg(OAc)2 Oxymercurierung HO O HgOAc Markovnikov G. Alkine Cycloalkine Cycloheptin: kleinstes isoliertes unsubstituiertes Cycloalkin HWZ in CH2Cl2 bei -25 °C: C: < 1 min; bei -78 °C: C: 1 h G. Alkine Industrielle Chemie des Acetylens, z. B. Hydroxyalkylierung mit Formaldehyd: Cu2C2-SiO2, 125 °C, °C 5 bar b H O + HO H H2, Kat. Kat OH H3PO4, pH 2, 270 °C, 100 bar HO OH Lösungsmittel THF - H2O O Synthese von Acrylnitril (Monomer von Polyacrylnitril, "Orlon") + H N Cu+, NH4Cl N G. Alkine Walter Reppe (1892-1969) aus: Chem. Unserer Zeit 2009, 43, 376-383 Polyvinylpyrrolidon: früher im Prittstift (heute stärkebasiert) G. Alkine Und noch etwas aus der Biologie OH H H H HO 17-Ethinylöstradiol Synthese: Inhoffen, 1938 (Schering) Endiin-Antibiotikum Neocarzinostatin aus Streptomyces macromomyceticus OH H H Spaltet p DNA über radikalischen Mechanismus H HO Sexualhormon Östradiol G. Alkine Die Zentralatome von Allenen sind ebenfalls sp-hybridisiert. 131 pm H KOH, EtOH, 170 °C C C H H H 1,1-Dimethylallen 131 pm H C H chiral: aS oder aR? 1 3 Di th l ll 1,3-Dimethylallen St Stammverbindung bi d H. Aromaten Benzol 140 140 pm Bindungslängen-Ausgleich planar delokalisierte d l k li i t -Wolke H. Aromaten hypothetisches Cyclohexatrien Benzen (=Benzol) Aromatische Stabilisierung: keine Addition von Brom! Friedrich August von Kekulé (1829-1896) H. Aromaten Experiment zur Quantifizierung der Mesomeriestabilisierung von Benzol: Hydrierung! www.chemgapedia.de "Bhut jolokia" (Indien) H. Aromaten SHU: Scoville Heat Unit 1.001.304 SHU Chemiker Wilbur Lincoln Scoville 1912: Capsicum annum Man übergießt M üb i ßt ein i grain i (64 (64,8 8 mg)) vermahlene hl P Paprikafrucht ik f ht mit it 100 mll reinem i Eth Ethanoll und lässt es über Nacht stehen. Nach sorgfältigem Schütteln wird filtriert. Das Filtrat wird solange mit gesüßtem Wasser verdünnt, bis die Schärfe auf der Zunge nicht mehr spürbar ist. Der so gemessenen Verdünnungsgrad ist ein Maß für die Schärfe. aus: Chem. Unserer Zeit 2009, 43, 100–114 H. Aromaten TRPV1 ist ein durch hohe Temperaturen schaltbarer Ionenkanal. Der S D Schaltungspunkt h lt kt liliegtt b beii über 42 °C, erniedrigt sich aber nach dem Anbinden von Liganden wie Capsaicin auf W t unterhalb Werte t h lb d der Kö Körpertemperatur. Dies führt Di füh t iim F Falle ll von Capsaicin zur ständigen Aktivierung und Auslösen einer Schmerzempfindung. Das abgebildete Molekülmodell stellt den TRPV1Re eptor mit einem anderen Rezeptor gebundenem Liganden (Phosphatidylinositol-4,5bisphosphat) dar aus: Chem. Unserer Zeit 2009, 43, 100–114 H. Aromaten Hückel-Regel (1931): Ein Aromat weist ein zyklisch konjugiertes Doppelbindungssystem mit (4n+2) π Elektronen auf (n ≥ 0), welches nicht weit von der Planarität abweichen darf. Ungeladene Aromaten O 6 10 14 18 H. Aromaten R N N N N N FeIII Mg N PhytylO2C CO2Me O N Herbst: Chlorophylle werden als Stickstoffquelle abgebaut, abgebaut Carotinoide/Anthocyan-Farbstoffe (Flavylium) werden sichtbar. Cl HO2C Hämin aus Hämoglobin, Phytyl = 3 N erhalten durch Abspaltung vom Proteinteil und Fällung g mit NaCl. CO2H H. Aromaten asiatische Hühnerrassen aus: Chem. Unserer Zeit 2009, 43, 100–114 H. Aromaten Hückel-Regel Hü k lR l (1931) (1931): Ein Aromat weist ein zyklisch konjugiertes Doppelbindungssystem mit (4n+2) π Elektronen auf (n ≥ 0), welches nicht weit von der Planarität abweichen darf. Geladene Aromaten 2 2 Cyclopropylium 6 Tropylium 10 Cyclopentadienid CyclooctadienidCyclooctadienid Dianion H. Aromaten Ein Antiaromat weist ein zyklisch konjugiertes Doppelbindungssystem mit 4n π Elektronen auf (n ≥ 1), welches nicht weit von der Planarität abweichen darf. Antiaromat Nicht-Aromat 148 4 Cyclobutadien y (Grundkörper bei Raumtemp. nicht beständig) 134 pm 4 Alkene Cyclooctatetraen: C l t t t kein Bindungslängenausgleich, nicht planar H. Aromaten Was passiert bei der Reaktion von Benzol und Brom? Br Br Wäre Benzol ein normales Alken, so fände elektrophile Addition statt. Benzol ist aber kein normales Alken. Br2, FeBr3 Br stattdessen: Elektrophile aromatische Substitution (SEAr) und: keine Epoxidierung von Benzol mit mCPBA H. Aromaten SEAr: Elektrophile aromatische Substitution Gemeinsamer Reaktionsmechanismus (X=H, tert.-Bu, SO3H): Triebkraft: A Aromatisierung ti i Man formuliere diesen Mechanismus für die Bromierung von Benzol mit Br2/kat. /kat FeBr3! +0.25 H +0.10 0.10 E +0.30 +0.25 para (p) +0.10 meta t (m) ( ) ortho (o) relative Ladungsverteilung im Wheland-Komplex H. Aromaten SEAr A an B Benzoll Friedel-Crafts Friedel CraftsAcylierung, katalysiert durch Lewissäure AlCl3 O O O Cl HNO3, H2SO4 AlCl3 O N Nitriersäure Nitrobenzol O SO3-H2SO4 AlCl3 Oleum Cl Acetophenon (=Acetylbenzol) O H O O S Benzolsulfonsäure H. Aromaten Erzeugung des Nitronium Nitronium-Ions Ions aus SalpeterSalpeter und Schwefelsäure O 2N NO2 NO2 Sprengstoff TNT: 2,4,6-Trinitrotoluol kann nur durch Initialsprengung zur Explosion gebracht werden. 2 C7H5N3O6 → 3 N2 + 5 H2O + 7 CO + 7 C H. Aromaten Farbstoffsynthese durch Diazotierung Diazotierung, gefolgt von Azokupplung Diazotierung Azokupplung Methylorange (Edukt: N,N'-Dimethylanilin statt -Naphthol) Azofarbstoff Orange I H. Aromaten Mechanismus der Diazotierung Phenyldiazoniumchlorid: reagiert weiter als N-Elektrophil Cl NH2 N2 NaNO2 HCl 0-5°C -H2O Cl NO H H+ N O H N N O H H N H OH O N N N HCl N H. Aromaten Friedel-Crafts-Alkylierung: SEAr aus Sicht des Elektrophils: SN1 SN2 H. Aromaten Friedel-Crafts-Alkylierung Alkylierung nach Bildung des Carbeniumions aus einem tertiären Alkohol: H. Aromaten Bakelit Leo Hendrik Baekeland (1863 1944) (1863-1944) Kondensation von Phenol und Formaldehyd H. Aromaten SEAr-Reaktionen: Ar Reaktionen: Zweitsubstitution O OH O OH O OH N H O O Acetylsalicylsäure (("Aspirin") Aspirin ) N-(4-Hydroxyphenyl)acetamid (("Paracetamol" Paracetamol , "Acetaminophen") Acetaminophen ) Ibuprofen H. Aromaten SEAr-Reaktionen: Ar Reaktionen: Zweitsubstitution Akzeptor Donor ortho t meta para Donorsubstituenten erhöhen die Nukleophilie von Benzol, erleichtern also die Bildung von -Komplexen (in allen Positionen) und damit die Reaktivität in SEAr-Reaktionen. Akzeptorsubstituenten: umgekehrt. Regioselektivitäten! H. Aromaten Mesomere (M) und induktive (I) Effekte dirigieren die Zweitsubstitution. Zweitsubstitution aus: Brückner, Reaktionsmechanismen H. Aromaten SEAr-Reaktionen: Ar Reaktionen: Zweitsubstitution a) an donorsubstituierten Aromaten: in para- und ortho-Stellung Ladungsdichte Donorsubstituierte Aromaten sind elektronenreicher als Benzol. para ortho meta aus: Brückner, Reaktionsmechanismen H. Aromaten SEAr-Reaktionen: Ar Reaktionen: Zweitsubstitution a) an donorsubstituierten Aromaten: in para- und ortho-Stellung "Gegenläufige" Substituenteneffekte: der Stärkere gewinnt. aus: Brückner, Reaktionsmechanismen H. Aromaten SEAr-Reaktionen: Ar Reaktionen: Zweitsubstitution b) an akzeptorsubstituierten Aromaten: in meta-Stellung ("das kleinste Übel") Akzeptorsubstituierte Aromaten sind elektronenärmer als Benzol. Ladungsdichte aus: Brückner, Reaktionsmechanismen H. Aromaten SEAr-Reaktionen: Ar Reaktionen: Zweitsubstitution b) an akzeptorsubstituierten Aromaten: in meta-Stellung aus: Brückner, Reaktionsmechanismen H. Aromaten Regioselektivität der Zweit-S Zweit SEAr (formulieren Sie alle mesomeren Grenzstrukturen der -Komplexe!) CH3 Br2, FeBr3 CH3 CH3 CH3 Br CCl4 + + Br - HBr Br 39 % CO2H 1% CO2H CO2H NO2 HNO3-H2SO4 - H2O 60 % CO2H + + NO2 NO2 18 % 80 % 2% H. Aromaten Geschwindigkeit und Regioselektivität der Zweit Zweit-S SEAr X X X NO2 HNO3-H H2SO4 - H2O X + + NO2 NO2 ortho meta para X= Geschw Geschw. OH 1000 40% 2 58 CH3 25 58 4 38 H 1 CH2Cl 07 0.7 32 16 52 Propionyl 0.004 24 72 4 NO2 0.00000006 5 93 2 H. Aromaten SEAr-Reaktionen: Ar Reaktionen: Zweitsubstitution Protonierung wandelt donor- in akzeptorsubstituierten Aromaten! N,N-Dimethylanilin ist basischer als Anilin und wird unter den Reaktionsbedingungen vollständig protoniert protoniert. aus: Brückner, Reaktionsmechanismen H. Aromaten Nukleophile Aromatische Substitution ((SNAr)) Im Detail: Angriff d. Nukleophils in o- und pStellung, da bei m-Angriff die negative Ladung nicht auf den elektronenziehenden l kt i h d S Substituenten b tit t delokalisierbar ist. Additions-EliminierungsM h i Mechanismus H. Aromaten Nukleophile Aromatische Substitution (SNAr) Meisenheimer-Salze, isolierbar, farbig Jakob Meisenheimer (1876-1934) H. Aromaten Best. d. Best d N-terminalen N terminalen A A.-s. s mit Sangers Reagenz (noch kein Lehrstoff): NO2 F R2 O H 2N R1 N H NO2 O 2N OH H N Sangers Reagenz Sir Frederick Sanger (*1918) R2 O N H R1 NO2 O 2N R3 O O 2N O H N O H N O OH R 1 6 M HCl, R3 O H N R2 O OH + OH + H N 2 zur Vergleichsanalyse 2 Nobelpreise für Chemie 1958 und 1980! O H 2N OH R3 H. Aromaten Eli i i Eliminierungs-Additions-Mechanismus Additi M h i "*": 13C-Markierung im Detail: J. Alkohole Nomenklatur: a) OH-Gruppe an der möglichst niedrigen Position g Länge g Priorisierung g der Kette mit der g größten Substituentenzahl b)) bei gleicher HO OH ((3R)-2,2,5-Trimethylhexan-3-ol ) , , y OH ((3R)-5-Methyl-3-propylhexan-1-ol ) y p py OH HO Br Cyclohexanol 1-Ethylcyclopentanol cis-3-Bromcyclobutanol Wie unterscheiden sich primäre, sekundäre und tertiäre Alkohole? Strukturen S u u e von o Ethylenglykol ye gy o u und dG Glycerin? yce J. Alkohole Physikalische Eigenschaften Höhere Siedepunkte als Halogenalkane wg. Ausbildung von g ((ca. 20-mal schwächer als kovalente Bindungen)! g ) Wasserstoff-Brückenbindungen OH n-Butanol: kleinster nicht vollständig mit Wasser mischbarer Monoalkohol OH tert.-Butanol: Butanol: vollständig mit Wasser mischbar OH W Wasser Neopentylalkohol: größter vollständig mit Wasser mischbarer aliph. Monoalkohol J. Alkohole pKa in Wasser: Physikalische Eigenschaften HDiss 435 kJ/mol H3C 143 pm H O 96 pm HDiss 410 kJ/mol H3C 154 pm H C H2 110 pm Wasser 15.7 Methanol 15.5 Ethanol 15.9 Isopropanol 17.1 tert.-Butanol 18 Wasser und primäre Alkohole sind (in Wasser) azider als sekundäre und tertiäre Alkohole. Alkohole Was liegt vor, wenn man festes NaOH in einem Überschuss MeOH löst? J. Alkohole Aromatische Alkohole H O H H O O NO2 O2N NO2 pKa 15.5 pKa 10.0 pKa 0.3 Pikrinsäure: Formulieren Sie die M Mesomere d der A Anionen! i ! Auslöser der Halifax-Explosion (1917) (2300 t an Bord des Frachters Mont Blanc, Kollision, > 1600 Tote) J. Alkohole Synthesegas wird erzeugt aus Kohle durch Behandlung mit Luft und Wasser. Verhältnis einstellbar H2O,, O2, Kat. 900 °C C O + H H Synthesegas Kohle, alternativ Erdgas Cu Zn Al Kat., Cu-Zn-Al-Kat., 240 °C, 75 bar CH3OH FischerTropschProzess CnH2n+2 + H2O J. Alkohole Methanol ist giftig (10 mL können zur Erblindung führen, 30 mL tödlich sein). Grund: Metabolische Oxidation zu Formaldehyd und Ameisensäure (=> Azidose). MeOH in Getränken: mangelhafte Abtrennung. GEFAHR "Holzgeist" MeOH: Holzdestillat enthält 1.5–3 % MeOH, 10 % HOAc, 0.5 % Aceton, MeOAc, MeCHO, Holzteer,, H2, CO,, C2H4. J. Alkohole Ethanol Zuckerrohr in Brasilien Alkoholische Gärung J. Alkohole Oxidation von Alkoholen OH H H H Methanol O Oxidation H O Oxidation H Formaldehyd y www.aquarium-kosmos.de Formalin: 35proz. wässr. Lösung H Oxidation O C O OH Ameisensäure (Salze: Formiate) Kohlendioxid J. Alkohole Oxidation von Alkoholen OH Oxidation O H H H Ethanol OH Oxidation Acetaldehyd Oxidation O O OH Essigsäure Speiseessig: 5-15-proz. wäßr. HOAc-Lösung H I Isopropanol l OH A t Aceton primäre Alkohole zu Aldehyden p y zu Carbonsäuren sekundäre Alkohole zu Ketonen tert.-Butanol tertiäre Alkohole nicht unzersetzt oxidierbar J. Alkohole Oxidation mit Chrom(VI)-Reagenzien (nur noch selten verwendet): CrO3-verd. H2SO4 od. HOAc in Aceton (Jones-Oxidation (Jones Oxidation, ungeeignet ungeeignet, wenn Selektivität nötig nötig, "sledge sledge hammer method") method ) Pyridiniumchlorochromat (PCC, schwach sauer) O Mech.: O C CrVI H R OH OH O O H CrO3Cl– O X - H2O R H O CrVI OH X O R + X O OH CrIV OH Cr3+ grün nur zum Aldehyd: CrO3·2 Pyr in DCM (wasserfr. => Ox. nur zum Aldehyd, "Collins-Reag.") J. Alkohole Hydratisierung O R1 + H2O R2 - H2O HO OH R1 R2 Gleichgewichtskonstante K in Wasser Trichloracetaldehyd: y > 104 Formaldehyd: > 103 Acetaldehyd: 1 Aceton: 10-22 Je elektronenärmer die Carbonylgruppe, desto stabiler das geminale Diol (1,1-Diol). Ketone sind normalerweise gegenüber 1,1-Diolen bevorzugt (z. B. Aceton), aber: O OH OH O Ninhydrin u Nachweis ac e s von o Aminosäuren osäu e im zum Dünnschichtchromatogramm J. Alkohole Oxidation KMnO4: ein Praktikumsversuch KMnO4, CH2Cl2, H2O OH O OH "Aliquat 336" N Cl Hauptbest. v. Hauptbest v "Aliquat Aliquat 336" Phasentransferkatalysator: in DCM (aber n. in Wasser) lösl. Tetraalkylammonium-Ion schleppt MnO4 in die org. Phase. Mechanismus: zuerst Oxidation zum Aldehyd, dann Hydratisierung zum Acetal, dann erneute Oxidation zur Carbonsäure. J. Alkohole Oxidation: allgemeiner Mechanismus Ladung H Y Oxn H Y O Ox+n R H O O m X H X prim. Alkohol gem. Diol sek. Alkohol + m+2 R R Carbonsäure Keton Y Oxn-2 + H+ X Aldehyd H2O Ladung-1 H m,, n: Oxidationsstufen. Wenn Y einfach an das Oxidationsmittel Ox gebunden, dann Freisetzung von HY. J. Alkohole Häufige Variante: Swern-Oxidation; Agens "aktiviertes DMSO": O O O Cl Cl S Cl O S O Cl R1 R2 S O Alkohol S Cl S O +O C O C Cl + C O R2 H O R1 Cl O DMSO Oxalylchlorid OH Aktives Reagenz O , + Cl R2 NEt3 H R1 R2 H O S CH2 R1 + S O Aldehyd, Keton Reaktion bei -78 °C; zuerst Bildung von CO2 und CO abwarten, dann Zugabe des Edukts und nach ca. 30 min Zugabe g von NEt3.