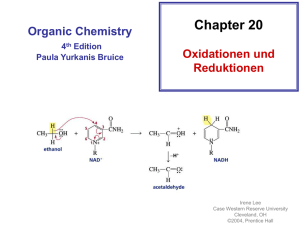
Oxidationen von
Werbung

Cer in der organischen Chemie Seminarvortrag zum Schwerpunktkurs Metallorganik Johannes Drexler & Daniel Wieland 1 Inhalt Allgemeines über Cer Anwendungen in der Synthese Ce3+ bei Reduktionen Oxidationen mit Ce4+ Katalytische Variante Oxidation von Alkoholen Oxidative Kupplung Oxidation der Seitenketten am Aromaten Zusammenfassung 2 Das Element Cer 0,0046% Massenanteil an der Erdhülle Natürliche Oxidationsstufen: 3+, 4+ Wichtige Cerverbindungen (NH4)2CeIV(NO3)6 „CAN“ CeO2 Ce(SO4)2 CeX3 X=Br, Cl, F, NO3 Starkes Einelektronenoxidanz Ce 4+ + e − ↔ Ce 3+ E = +1,61V 3 Reduktionen mit Ce3+ Reduktion mit Hydridüberträgern O OH O NaBH4 (1eq.) MeOH 51 % 49 % Ce3+ wirkt als Lewissäure Aktivierung des Carbonylsauerstoffs Selektivität der Reduktion mit CeCl3 O OH OH >99 % in Spuren 1eq.CeCl 3 1eq.NaBH4 MeOH Luche J. L. J. Am. Chem. Soc., 1978, 100 (7), 2226-2227 4 Reduktionen mit Ce3+ Aldehyde normalerweise reaktiver als Ketone H 1eq. NaBH4 O H O OH O kann mit CeCl3 umgedreht werden: H 1eq. CeCl3, 1eq. NaBH4 O O H O OH 5 Oxidationen von β-Diketonen zu α-Hydroxy-β-Diketonen z.B. auch mit Pb(OAc)4, Dimethyldioxiran DMD,etc. möglich, aber schlechte Ausbeuten und Nebenprodukte Einsatz von schwach toxischem CeCl3 als Katalysator Sauerstoff als Oxidationsmittel O O X O Y 1 atm O2 5 mol% CeCl3*7H2O O X Y OH 23°C, i-PrOH, 16h n 4a-i n 5a-i Christoffers et al. Eur. J. Org. Chem. 2003, 425-31 6 Oxidationen von β-Diketonen zu α-Hydroxy-β-Diketonen Allerdings bei aliphatischen Systemen nur moderate Ausbeuten, bzw. auch „advanced materials“ α-ständiger Alkylrest R stabilisiert Radikal O X β O α β Y R Christoffers et al. Eur. J. Org. Chem. 2003, 425-31 7 „Postulierter Mechanismus“ 1. Sauerstoff oxidiert Ce3+ zu Ce4+ 2 H ⊕ + 2Ce III + 1 / 2O2 ⎯ ⎯→ H 2O + 2Ce IV 2. Bildung des Komplex A 3. Oxidation durch weiteres äquivalent Ce4+ mit Anlagerung von Wasser (BÆ5) Christoffers et al. Eur. J. Org. Chem. 2003, 425-31 8 Oxidation von sekundären Alkoholen in Anwesenheit von primären Alkoholen OH O cat. CAN R OH R OH Mechanismus nicht vollständig überprüft R OH R NaBrO3 + Ce4+ 3+ - Ce - H+ R R OH R OH R + Ce4+ 3+ - Ce - H+ R O R S. Kanemoto, H. Tomioka, K.Oshima*, H. Nozaki; Bull. Chem. Soc. Jpn., 59, 105-108, 1986 9 Oxidative Kupplung Si-t-BuMe2 O O Ce(NH4)2(NO3)6 NaHCO3 CH3CN, 25°C (H2C)n H H (H2C)n H n = 1,2 C-C-Bindungsknüpfung unter der Verwendung von CAN Stereoselektive Reaktion Reaktion auch unter Verwendung von Cu(OTf)2/Cu2O möglich B. B. Snider*, T. Kwon; J. Org. Chem., 55, 4786-4788, 1990 10 Oxidative Kupplung Mechanismus kann über verschiedene Kation-/RadikalZwischenstufen formuliert werden 11 Oxidationen der Seitenketten am Aromaten Me CHO Me Me CAN Hauptprodukt Me CHO wird nicht gebildet Es wird selektiv das α–Produkt gebildet L. K. Sydnes*, S. H. Hansen, I. C. Burkow, L. J. Saethre; Tetrahedron, 41, 5205-5208, 1985 12 Oxidationen der Seitenketten am Aromaten Allg. Reaktionsmechanismus: ArCH3 Ce4+ Ce3+ (ArCH3) X -HX ArCH2 A +Ce4+ -Ce3+ ArCHO 2Ce4+ -2Ce3+ -2H+ ArCH2X X ArCH2 B 13 Oxidationen der Seitenketten am Aromaten 14 Oxidationen der Seitenketten am Aromaten Grund für die selektive Bildung des des α–Produkts: Protonen der α–Methylgruppe sind elektropositiver und werden daher bevorzugt von der Base abstrahiert (Zwischenstufe A) Bessere Stabilisierung von Kationen in α-Position der Zwischenstufe B vor dem Angriff des Nucleophils Es liegt ein Energieunterschied von etwa 20 kJ/mol zwischen Kationen in der α-Position und der β-Position vor 15 Anwendungsbeispiel der Oxidation der Seitenketten am Aromaten Herstellung von 19-Norsteroiden: OR OR OR CHO MeO MeO MeO T.L. Ho; Synthesis, 06, 347-354, 1973 16 Zusammenfassung Vorteile Cerverbindungen relativ billig und nur schwach toxisch (Auch katalytische Varianten möglich) Regioselektiv Häufig gute Ausbeuten Nachteile Normalerweise nicht stereoselektiv Keine aufgeklärten Reaktionsmechanismen Meist äquimolarer Einsatz an Ce-Salzen 17