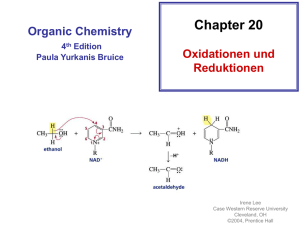
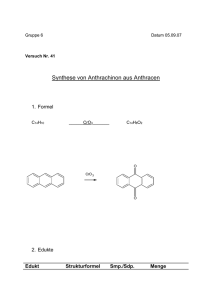
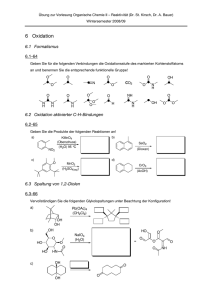
Oxidation von Alkoholen mit Kaliumpermanganat
Werbung

Chemie – Klasse 5 Lektion: Redoxreaktionen organischer Verbindungen Oxidation von Alkoholen mit Kaliumpermanganat Aufgabe 1: Übernehmen Sie die Skizze von der Wandtafel Reaktion 1 Reaktion 2 Reaktion 3 Aufgabe 2: Stellen Sie die Redoxgleichungen aller Reaktionen im demonstrierten Experiment auf. Dabei gehen Sie nach folgendem Schema vor: 1. 2. 3. 4. 5. Sie zeichnen für die organischen Moleküle die Lewisformel und bestimmen die Oxidationszahlen der reaktiven C-Atome. Sie bestimmen die Oxidationzahlen der Manganatome in den entsprechenden Verbindungen. Sie gleichen sowohl beim Oxidations- als auch beim Reduktionsteilschritt den Unterschied in den Oxidationszahlen der beteiligten Atome durch Elektronen in der Reaktionsgleichung aus Auf beiden Seiten der jeweiligen Teilreaktion muss in Summe die gleiche Ladung vorhanden sein. Da die Reaktionen im Alkalischen ablaufen, gleichen Sie Ladungsunterschiede in beiden Teilreaktionen durch Hydroxidionen (OH-) aus. Zuletzt müssen aufgrund der Massenerhaltung auf beiden Seiten der jeweiligen Teilreaktion die Summe der einzelnen Atome gleich sein. Gleichen Sie hier auftretende Unterschiede mit H2O aus 1.) CH3CH2CH2OH wird zu CH3CH2CHO oxidiert. Dabei werden Kalium-permanganatIonen (MnO4-) zu MnO3 reduziert (grün). Reduktion: Oxidation: Gesamt: 2.) CH3CH2CHO wird zu CH3CH2COOH oxidiert. Dabei wird MnO3 zu MnO2 reduziert. Reduktion: Oxidation: Gesamt: 3.) CH3CHOHCH3 wird zu CH3COCH3 oxidiert. Dabei wird MnO4- zu MnO3 reduziert. Reduktion: Oxidation: Gesamt: