7.3. Reaktionen der Alkanole (Auswahl
Werbung

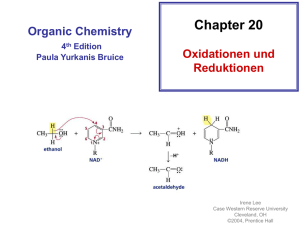
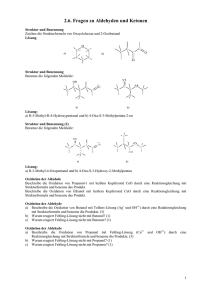
Oxidation der Alkanole und soll die Oxidation der Alkanole mit Hilfe der Oxidationszahl von C, mit Berücksichtigung der vollständigen Atombilanz und Elektronenbilanz abgehandelt werden? Ziel sollte sein: Wie kann ich aus org. Molekül A Molekül B bilden? 7.3. Reaktionen der Alkanole (Auswahl) 7.3.1 Oxidation der Alkanole Versuch A: Nachweis von Alkohol in Ausatemluft mit dem Teströhrchen (Bezugsquelle shop.alkohit. de oder pearl.ch) Ein Schüler spült den Mund mit Schnaps. Orange Cr(VI) Beobachtung: Reaktion beim Einblasen von Ethanol: grün Cr(III) 7.3. Reaktionen der Alkanole (Auswahl) 7.3.1 Oxidation der Alkanole Versuch A: Nachweis von Alkohol in Ausatemluft mit dem Teströhrchen Ein Schüler spült den Mund mit Schnaps. Orange Cr(VI) Beobachtung: Reaktion beim Einblasen von Ethanol: Teilreaktion Reduktion: Cr(VI) + 3 e → Cr(III) Teilreaktion Oxidation: der Ethanol gibt Elektronen ab grün Cr(III) Versuch B. Oxidation eines primären, sekundären und tertiären Alkanols Informationen zu Mangan Mn Oxidationsstufen Mn(VII) in MnO4- violett Mn(VI) in MnO4 2- grün Mn(IV) in MnO2 braun 1-Propanol Reduktionen: Mn(VII) → Mn(VI) → Mn(IV) Mn(VI) 2-Propanol 2-Methyl-2-propanol 1.Schritt 2. Schritt Folgerungen Aufgaben: Welche der folgenden Alkanole reagieren mit Mn(VII)? Welche Abkömmlinge entstehen aus den Alkanolen? Falls eine stufenweise Oxidation der Alkanole möglich ist, die Zwischenprodukte angeben. 2-Pentanol, 2-Methyl-2-butanol, 1-Butanol, 3-Methyl-2-butanol Experiment (Experiment des Monats Juli 1999) Material: drei Petrischalen, drei Pipetten 1-Propanol, 2-Propanol, 2-Methyl-2-propanol 35 ml 0.006 M Kaliumpermangonatlösung 35 ml NaOH 2 M Hellraumprojektor Durchführung: 35 ml der Kaliumpermangonatlösung mit 35 ml der Natronlauge vermischen und auf die drei Petrischalen, welche auf dem Hellraumprojektor stehen, verteilen. Je 2-3 Tropfen der verschiedenen Alkanole den drei Petrischalen zugeben Nach ein paar Minuten ist die Grünfärbung sichtbar, für die Bildung von Braunstein braucht es etwa 8 Minuten. OH Propanol 1. Schritt Zweimalige Oxidation 2. Schritt 1. Schritt a) Teilreaktion der Reduktion 2 Mn(VII) + 2e = 2 Mn(VI) b) Teilreaktion der Oxidation H C C H O H O C C C H + 2 H+ + 2 e ein Aldehyd ( ev . Neutralisationsreaktion 2OH- + 2 H+ → 2 H2O Teilreaktion der Oxidation 1-Propanol + 2 OH- → Propanal + 2 H2O + 2 e-) 2. Schritt a) Teilreaktion der Reduktion: Mn (VI) + 2e = Mn(IV) b) Teilreaktion der Oxidation Addition von Wasser H O O + O H H H H OH Oxidation O C H H O + OH OH eine Carbonsäure (Ev. Neutralisationsreaktion) 2 H+ +2e C C C 2-Propanol H O H nur ein Schritt Teilreaktion der Reduktion 2 Mn (VII) + 2 e = 2 Mn(VI) Teilreaktion der Oxidation: C C C H O H C C O C + 2 H+ + 2e ein Keton (ev. Neutralisationsreaktion) 2-Methyl-2-propanol • Keine Reaktion, weil ….. C C C O C H Folgerungen • Ein primärer Alkanol lässt sich über das Aldehyd zur Carbonsäure oxidieren • Ein sekundärer Alkanol lässt sich zum Keton oxidieren • Ein tertiärer Alkanol lässt sich nicht oxidieren Primary alcohol VII Secondary Alcohols Tertiary Alcohols Wie kompliziert soll eine Redoxreaktion mit Molekülen sein? Welche Schwierigkeiten treten auf? Alternativen zur 2 H+ + 2 e Abspaltung Easy : Mg → Mg 2+ + 2 e Fall Oxidation Propanol Propanal O O H H C3H8O H +? H C3H6O + 2 H (?) Ohne OZ von C: Oxidation: rechts fehlen Elektronen, woher kommen die? Problem: H als: H +I, H 0 oder H-I ? Kein Gas ersichtlich, wahrscheinlich H +I ev. Neutralisation von H+ mit OHC3H8O + 2OH- → C3H6O + 2 H2O + 2 e Mit OZ von C O O H H C (-I) + 2e +? H H C (+I) Schwieriger Umgang mit OZ für H und O Atombilanz: Wasser als Produkt angeben (rechts) und Ausgleichen der Atombilanz mit OH- (links) C3H8O + 2 OH- →C3H6O + 2 H2O + 2 e Fall : Oxidation Propanal zu Propansäure O O +? +? O H H Mit OZ: OZ-Aenderung von C: C(+I) → C (+III) + 2 e Gleichung mit Atombilanz richtig stellen: C3H6O → C3H6O2 + 2 e wir nehmen OH-, H2O C3H6O + 2 OH- →C3H6O2 + H2O + 2 e- Oder wie vorher mit Addition von Wasser H O O + H O H H H OH