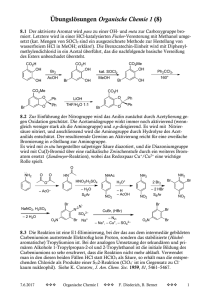
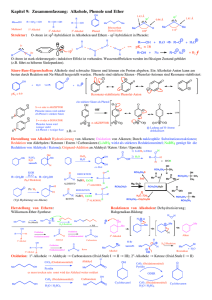
6 Oxidation
Werbung
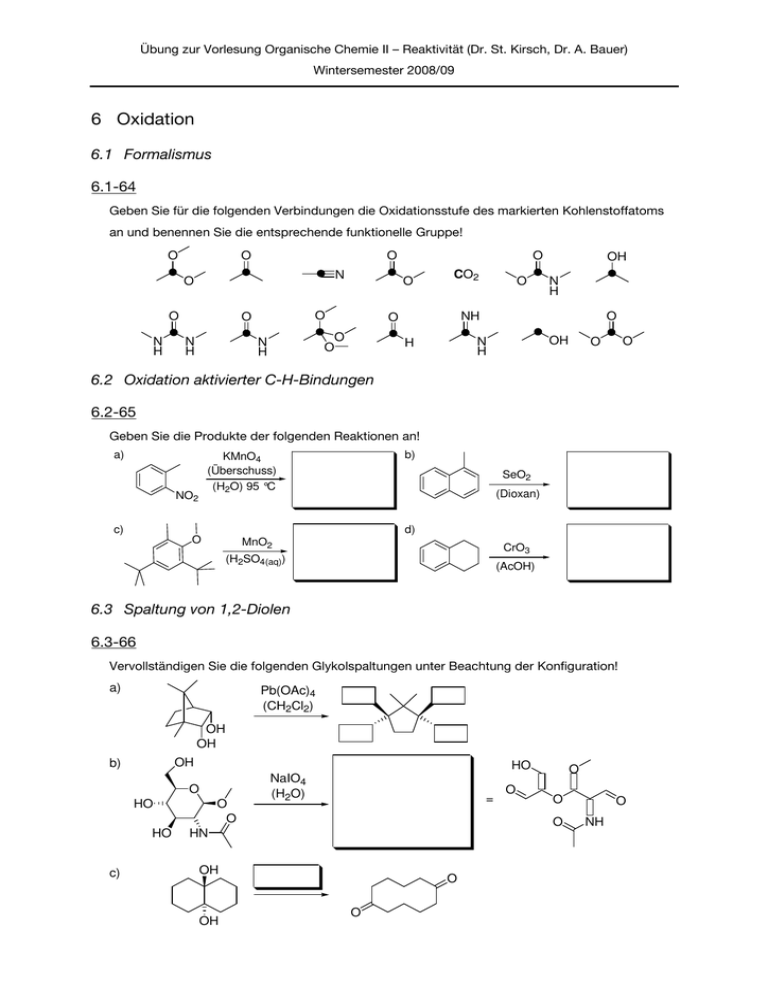
Übung zur Vorlesung Organische Chemie II – Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) Wintersemester 2008/09 6 Oxidation 6.1 Formalismus 6.1-64 Geben Sie für die folgenden Verbindungen die Oxidationsstufe des markierten Kohlenstoffatoms an und benennen Sie die entsprechende funktionelle Gruppe! O O O N O O N H N H O O O O OH N H O NH O O O N H O CO2 OH N H H O O 6.2 Oxidation aktivierter C-H-Bindungen 6.2-65 Geben Sie die Produkte der folgenden Reaktionen an! a) b) KMnO4 (Überschuss) NO2 c) SeO2 (H2O) 95 °C (Dioxan) d) O MnO2 CrO3 (H2SO4(aq)) (AcOH) 6.3 Spaltung von 1,2-Diolen 6.3-66 Vervollständigen Sie die folgenden Glykolspaltungen unter Beachtung der Konfiguration! a) Pb(OAc)4 (CH2Cl2) OH OH OH b) O HO HO c) O O HO NaIO4 (H2O) = O O HN OH OH O O O O O NH Übung zur Vorlesung Organische Chemie II – Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) Wintersemester 2008/09 6.4 Oxidation von Alkoholen und gemischte Aufgaben 6.4-67 Geben Sie das Produkt der folgenden Reaktion an! Formulieren Sie einen detaillierten Mechanismus! Geben Sie einen Trivialnamen für diese milde Oxidationsmethode an! OH 1. DMSO, (COCl)2 -78 °C 2. NEt3 -78 °C - RT (CH2Cl2) Name: _______________________________________ 6.4-68 Um Alkohole mit dem billigen Oxidationsmittel Natriumhypochlorit zu den entsprechenden Aldehyden oder Ketonen oxidieren zu können ist ein Katalysator nötig. Benennen Sie diesen Katalysator (Abkürzung und ausgeschriebenen Namen) und formulieren Sie einen detaillierten Mechanismus der Reaktion und den Katalysezyklus der katalytisch aktiven Verbindung! 6.4-69 Vervollständigen Sie die folgenden Reaktionsschemata! a) Si [TEMPO] OH O (CH2Cl2/H2O) b) O [OsO4] O c) O O O OH (Swern-Oxidation) d) [KMnO4] C6H10O4 CrO3 (AcOH) e) OH