Kapitel 9: Zusammenfassung: Alkohole, Phenole und Ether
Werbung

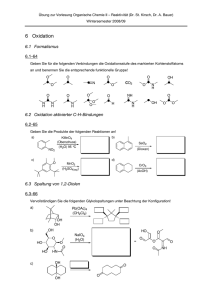
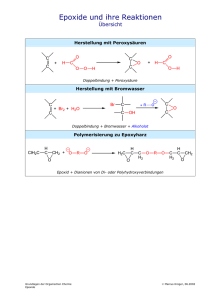
Kapitel 9: Zusammenfassung: Alkohole, Phenole und Ether OH 1.43 Å R Me R OH CH2 OH R OH R C R 1o-Alkohol Methanol CH OH Me R 2o-Alkohol 3o-Alkohol Me Me H 109o 1.41 Å O O Me Ethoxyethan Diethyl-Ether Phenol sp3 0.96 Å Me 112o O-Atom ist sp3 -hybridisiert in Alkoholen und Ethern - sp2-hybridisiert in Phenole: Struktur: R R δ- O O δ+ H R O sp3 H sp2 H O H H R O H O O R R OH + H2O R O + H3O pKa ≈ 16 usw. R OH + R O Na Na + H2 O-Atom ist stark elektronegativ; induktiver Effekt ist vorhanden. Wasserstoffbrücken werden im flüssigen Zustand gebildet (z.B. führt zu höheren Siedepunkten). Säure-Base-Eigenschaften: Alkohole sind schwache Säuren und können ein Proton abgeben. Ein Alkoholat-Anion kann am besten durch Reaktion mit Na-Metall hergestellt werden. Phenole sind stärkere Säuren - Phenolat-Anionen sind Resonanz-stabilisiert: O OH + + O O O O H2 O H3 O pKa ≈ 9.9 Resonanz-stabilisierte Phenolat-Anion ein stärkere Säure als Phenol OH S = σ oder π-AKZEPTOR Phenolat Anion wird stabiler d.h Phenol = stärkere Säure O O O O OHUSW. S S = σ oder π-DONATOR Phenolat Anion wird weniger stabil d.h Phenol = weniger Saur O S N O O π-AKZEPTOR O N O O N O N O O Ladung auf O-Atome delokalisiert z.B.→ Herstellung von Alkohol: Hydratisierung von Alkenen; Oxidation von Alkenen; Durch nukleophile Substitutionsreaktionen; Reduktion von Aldehyden / Ketonen / Estern / Carbonsäuren (LiAlH4 wirkt als stärkeres Reduktionsmittel; NaBH4 genügt für die Reduktion von Aldehyde / Ketone); Grignard-Addition an Aldehyd / Keton / Ester / Epoxide: 1) LiAlH4 in Ether O OH OsO4 H2 O Me H2SO4 H2O Me OH O R CH2 OH (SN 2 Reaktion) O REDUKTION C O H R (Vgl. Hydrierung von Alkene) OH Na (Metall) Me C H C R C R' NaBH4 EtOH KETON 2O-ALKOHOL H O Na Oxidationsmittel H 1o-Alkohol Me O O O Oxidation R H Oxidationsmittel R H O Me OH C CH3 CH3 RCH2CH2 Me RCH2CH2MgBr O Me O H2C CH2 OEt OH Me RCH2CH2 RCH2CH2 CH2CH 2OH RCH2CH2 R R' O O H Me Me Me Me H Alken Carbonsäure R' Oxidationsmittel OH H 3o-Alkohol OH H H-Br O Oxidation 2o-Alkohol H Me RCH2CH2Br R' H + NaI OH C H O D2O H (SN2-Reaktion) Aldehyd R RCH2CH2D H I Oxidation H RCH2CH2 C CH3 Mg, Et2O O REDUKTION H + R'OH Reaktionen von Alkoholen: Dehydratisierung; Halogenalkan-Bildung: OH R C OH H Herstellung von Ethern: Williamson-Ether-Synthese: Me R H H R C H NaBH EtOH 4 H ALDEHYD 1O-ALKOHOL R O H Pt / H2 2) H2O cis-Diol KOH H2 O O OR' OH H R CH2 Br C R H O Me Keton OH O Me Alkohol H SN2-Reaktion Br Me Bromalkan Br + H2 O Oxidation: 1°-Alkohole → Aldehyde → Carbonsäuren (Oxid.Stufe I → II → III); 2°-Alkohole → Ketone (Oxid.Stufe I → II) CrO3 (Oxidationsmittel) Me OH H OH Me O Pyridin es muss trocken sein sonst wird das Aldehyd weiter oxidiert CrO3 (Oxidationsmittel) Me Aldehyd OH H2O / H2 SO4 Carbonsäure Me CrO3 (Oxidationsmittel) Pyridin O ODER OH O Cyclohexanol CrO3 (Oxidationsmittel) H2O / H2SO4 Cyclohexanon Reaktionen von Ethern: Ether sind meistens inert, können aber mit HI gespalten werden. tButyl-Ether sind ein Spezialfall - sie können mit TFA (CF3-COOH) gespalten werden (E1-Mechanismus) (nützlich in der Peptid-Synthese): Me O H Me Me H O HI I Me O Me Me Ein tBu-Ether I Me OH R Me H O H H3 O+ Me O O H H H H2O SN 2-Reaktion -H Me Me Me H H Me -H Me Epoxide ergeben trans-vicinal-Diolen in H3O+ (SN2-Reaktion): H CH2 + Trifluoroacetic acid (TFA) Me H OH CF3COOH OH H OH Me ein 3o-Carbokation Me