Redoxreaktionen Allgemeines, Definitionen Ursprünge der Begriffe
Werbung

Redoxreaktionen
Allgemeines, Definitionen
Redoxreaktionen sind Grundlage fü
für die chemische EnergieEnergiespeicherung und -umwandlung: Brennstoffzelle
Sowohl in der
Batterie
Technik:
als auch
in der Natur:
Verbrennung
Gä
ärung
alkoholische G
Photosynthese
Ursprü
Ursprünge der Begriffe
Oxidation/Reduktion
Ursprü
Ursprünglich bezeichnete man als Oxidation vor die Reaktion
von organischen Stoffen, Metalle etc. mit (Luft
(Luft--)Sauerstoff;
)Sauerstoff;
also die Verbrennung von
Holz, Öl, Wachs oder Kohle oder das Rosten von Eisen
4 Fe + 3 O2
→ 2 Fe2O3
C + O2 → CO2
Als Reduktion (Zurü
(Zurückfü
ckführung) bezeichnete man die Gewinnung
von Metallen aus ihren Oxiden, z. B.: 2 HgO → 2 Hg + O2
Da es viele ähnliche Prozesse ohne Beteiligung von Sauerstoff gibt,
wird der Begriff Oxidation heute weiter gefasst.
1
Heutige Definition von
Oxidation/Reduktion
Als Oxidation bezeichnet man Prozesse, bei denen
ein Atom, Ion oder Molekü
Molekül Elektronen abgibt:
abgibt:
Oxidation = Elektronenabgabe:
Dabei ändern ich die Eigenschaften der Materie deutlich:
Bsp:
Bsp: Kupfer (rot glä
glänzendes Metall) geht über in Kupfer(Cu2+)Ionen.
2+
Cu -Ionen bilden mit Anionen Salze oder liegen gelö
gelöst vor.
Solvatisierte Cu2+-Ionen besitzen Hydrathü
Hydrathülle und sind blau gefä
gefärbt.
Der Prozess ist
umkehrbar =
reversibel
Bei der Reduktion , lä
läuft der umgekehrte Vorgang ab;
ein Atom, Ion oder Molekü
Molekül nimmt Elektronen auf:
auf:
Reduktion = Elektronenaufnahme:
4.3.2 Redoxreaktion
Beispiele
Da Elektronen nicht frei existieren, sind Oxidation und Reduktion
stets gekoppelt.
gekoppelt.Redoxreaktion = Elektronenübergabe:
Es kö
können auch – je nach Reaktionspartner - mehrere Elektronen
übertragen werden.
In der Redoxreaktion mü
müssen bei der Reduktion genau so viel ElektroElektronen aufgenommen werden, wie bei der Oxidation abgegeben wurden!
Daher tauchen in der Gesamtgleichung nie Elektronen auf!
Oxidation:
Zn → Zn2+ + 2eReduktion: S + 2 e-→ S2Redoxreaktion: Zn + S → Zn2+ + S2- = ZnS
Man kann die Redoxreaktion formal in Oxidation und Reduktion
unterteilen. Die Teilschritte laufen aber nie einzeln ab!
Erhaltung der Masse und Ladung: Auf beiden Seiten der Reaktionspfeile
Reaktionspfeile
muss die gleiche Anzahl jeder Atomsorte und gleiche Ladung sein.
Hinweise: Keine Elektronen "abziehen": Zn - 2e- → Zn2+
Keine halben Molekü
:
Moleküle
½ Cl 2
Beispiel: Zink + Schwefel:
2
ThermitThermit-Reaktion
(eine bekannte Redoxreaktion)
Eisenoxidpulver wird mit Aluminiumpulver fein vermischt.
Die Reaktion wird mit einer Wunderkerze gezü
gezündet.
Exotherme
Reaktion!
Energie wird
in Form von
Wärme und
Licht abgegeben.
Wie kann man überprü
berprüfen
ob das ausgelaufene Metall
Eisen ist, und nicht Aluminium?
ThermitThermit-VerVerfahren zum
Verschweissen
von Schienen
Knallgasprobe
Viele Redoxreaktion laufen exotherm ab, d. h. unter Energieabgabe.
Energieabgabe.
Eine weitere solche Reaktion ist die KnallgasKnallgas-Probe (auf Wasserstoff)
Größ
te Knallgasreaktion aller Zeiten?
Größte
2 H2 + O2 → 2 H2O + Energie
Luftschiff "Hindenburg"
Lakehurst 1937
Oxidation:
H2 → 2 H+ + 2 eReduktion: O2 + 4 e- → 2 O2Redox:
2 H2 + O2 → 4H+ + 2O2-→ 2H2O
H (I. HG) gibt 1 e- ab,
O (VI. HG) nimmt 2 e- auf,
um Oktettregel zu erfü
erfüllen.
Beides zweiatomige Gase!
3
Weitere Redoxreaktionen
Reduktion von EisenEisen-(II)(II)-oxid zu Eisen:
Redox : 2 FeO + C → CO2 + 2 Fe
Oxidation : C + 2 O2→ CO2 + 4 e2+
Reduktion: 2 Fe + 4 e → 2 Fe
Redoxreaktion ohne Sauerstoff:
Redox:
2 Na + Cl2 → 2 NaCl
Oxidation:
2·(Na → Na+ + e-)
Reduktion: Cl2 + 2 e- → 2 Cl-
Na (I. HG) gibt 1 e- ab,
Cl (VII. HG) nimmt 1 e- auf,
um Oktettregel zu erfü
erfüllen.
Chlor zweiatomiges Gas.
Redoxreaktion mit komplexer Stö
Stöchiometrie:
chiometrie:
Redox: 16 Al + 3 S8→8 Al2S3={2Al3+3S2-}
Oxidation:
16·(Al → Al3+ + 3 e-)
Reduktion: 3·(S8+16 e-→8S2-)
Al (III. HG) gibt 3 e- ab,
S (VI. HG) nimmt 2 e- auf,
um Oktettregel zu erfü
erfüllen.
Schwefel als S8-Ring.
Die stö
stöchiometrischen Faktoren ergeben sich aus der Bilanz
der Teilreaktionsschritte.
Oxidationsmittel/Reduktionsmittel
Ein Stoff, der andere Verbindungen oxidieren (Elektronen entziehen)
entziehen)
kann, nennt man Oxidationsmittel = Elektronenakzeptor
Er selbst wird dabei reduziert!
Typische Oxidationsmittel:
• Sauerstoff O2 + 4 e-→ 2 O2Cl2 + 2 e-→ 2 Cl• Chlor
• Oxoanionen z.B.: MnO4- (Permanganat),
Permanganat), Cr2O72- (Dichromat)
• Anionen der Halogensauerstoffsä
Halogensauerstoffsäuren, z.B. ClO3- (Chlorat)
Chlorat)
• Edelmetallionen,
Edelmetallionen, z. B. Ag+ + e-→ Ag
Ein Stoff, der andere Verbindungen reduzieren (Elektronen abgeben)
abgeben)
kann, nennt man Reduktionsmittel = Elektronendonator
Er selbst wird dabei oxidiert!
Typische Reduktionsmittel:
H2 → 2 H+ + 2 e• Wasserstoff
• Zink
Zn → Zn2+ + 2e• Kohlenstoff
4
Bauprinzipien und Klassifizierung
organischer Verbindungen
• Kohlenstoff bildet in der Regel 4 Bindungen zu anderen Atomen aus
aus
4 EinfachEinfach-; 1 DoppelDoppel- +2 Einfach; (2 DoppelDoppel-); 1 EinfachEinfach- + 1 DreifachDreifachH
H C H
H
H
H
C O
H
H
H
H C C H
O C O
C C
H
• In org. Verb. kö
können nahezu beliebig viele CC-Atome verknü
verknüpft sein,
von einem (s. o.) bis viele Tausend (DSN, Proteine, synth. Polymere)
Polymere)
• Organische Verbindungen bestehen aus KohlenstoffKohlenstoff-Grundgerü
Grundgerüst
(z.B. -Kette) und sog. funktionellen Gruppen (Rest = R aus O,N,H, etc.)
⇒ chem. Verhalten
CH2
CH2
H3C
R
CH2
CH2
CH2
• Entsprechend der funktionellen Gruppen Zuordnung zu Stofffamilien
Stofffamilien
(Alkohole, Carbonsä
Carbonsäuren, Amine, ...
• Die Stofffamilien lassen sich durch org.org.-chem.
chem. Reaktionen auseinander
entwickeln, wä
während das Grundgerü
Grundgerüst oft gleich bleibt.
• Molekü
Molekülreihen mit sukzessive steigender CC-Anzahl im Grundgerü
Grundgerüst,
aber gleichen funkt. Gruppen (⇒
(⇒ chem. Verhalten) = Homologe Reihe.
Homologe Reihe der Alkane
Alkane bestehen aus (geraden o. verzweigten) Ketten von sp3-hybridihybridisierten Kohlenstoffatomen, die mit Wasserstoffatomen abgesä
abgesättigt sind.
Zwischen den Atomen liegen nur Einfachbindungen (σ
(σ-Bindungen) vor.
Kurzschreib
*
Alle Alkane haben
Name Summen- Strukturformel
Halbstruk-weise **
formel *
turformel
die Summenformel:
H
Methan CH4
H
C
H
MethylMethylGruppe
H
Ethan
C2 H6
H
H
H
C
C
H
Propan C3H8
H
Butan
C4H10
Pentan C5H12
H
H
H
H
H
H
C
C
C
H
H3C CH3
H
H
MethylenMethylenH3C CH2 CH3
H
H
H
H
H
H
C
C
C
C
H
H
H
H
H
H
H
H
H
H
C
C
C
C
C
H
H
H
H
H
CH2
H3C
CH2
H H C
3
CH3
CH2
CH2
CH2
CH3
CnH2n+2
Mit jedem weiteren
C-Atom kommt eine
Methylengruppe
-CH2- dazu.
** Die KurzschreibKurzschreibweise zeigt nur die
C-C-Bindungen.
C6H14 Hexan
C7H16 Heptan
C8H18 Octan
C9H20 Nonan
C10H22 Decan
5
Isomerie
Konstitutionsisomerie der Alkane
Kohlenwasserstoffe mit mehr als 3 CC-Atomen können verzweigte Ketten
bilden. Ab Butan mehrere Isomere gleicher Summenformel;
unterschiedliche Konnektivitä
Konnektivität = KonstituionsKonstituions-Isomerie.
Isomerie.
Chemisch und physikalisch unterschiedliches Verhalten.
Mehr CC-Atome ⇒ exponentiell mehr Isomere.
Das Auftreten unterschiedlicher Substanzen mit gleicher Summenformel
wird als Isomerie bezeichnet, die Verbindungen selbst als Isomere
n-Butan
Summenformel
iso-Butan
2-Methyl-propan
2,2-Dimethyl-propan
C4H10
C5H12
C4H10
Strukturformel
H
H
H
H
H
C
C
C
C
H
H
H
H
H
H
H
H
C
H
C
H
H
C
C
MethinMethin- H H H
neo-Pentan
H
H
H
H
H
C
H
H
C
C
C
H
H
C
H
H
H
H
quartäres C-Atom
5.2 Aliphatische Kohlenwasserstoffe
5.2.1 Alkane: chemische Struktur
1858 Friedrich Kekulé
Kekulé: Vierbindigkeit Molekülorbitalmodell des Methan (CH4)
des Kohlestoffs; bindet 4 einbindige
Atome. Tetraedrische Ausrichtung
(109°
(109°-Winkel) 1874 von van't Hoff
postuliert, spä
später exp.
exp. bestä
bestätigt.
Erklä
Erklärung durch Hybridisierung:
Das s, px,
px, py,
py, pzpz-Orbitale →
4 energiegleiche sp3-Hybridorb.
sp3-hybridisierter Kohlenstoff kann
falsches MO-Modell Tetraedermodell
4 EinfachEinfach-(σ-)Bindungen ausbilden.
Ethan:
Stereochemische
Schreibweise
σ-Bindungen sind drehbar
6
Funktionelle Gruppen
- Übersicht Bindungen in KW unpolar. Sind Heteroatome (O, N, S,...) gebunden
⇒ polare Bindungen ⇒ reaktive, funktionelle Gruppen
Vielzahl org. Verb. mit unterschiedlichen Eigenschaften+Reaktionen
Funktionelle Gruppen
Funktionelle Gruppen mit
mit Einfachbindungen
C=O-Doppelbindung
Ersetzt man
in Wasser
H- durch
Alkylrest
⇒ Alkohol
O
O
H
R
H
Aldehyde
O
H
R
R
Thiole
(Mercaptane)
Thioether
S
S
R
(Carbonyl-Verbindungen)
zwei
Alkylreste
⇒ Ether
R
H
Ketone
Carbonsäuren
R
Funktionelle Gruppen bestimmen
phys. Eigenschaften: (Schmelz(Schmelz-,
Siedepunkt, Lö
Löslichkeit) und die
chem. Eigensch.
Eigensch. (Reaktionen)
Amine
R
H
N
N
R
R
R
H
N
H
R
R
5.3.1
Alkohole: Chemische Struktur
Alkohole besitzen mindestens eine HydroxylHydroxyl-Gruppe (-OH), an ein
Kohlenstoffatom gebunden, das keine weitere funktionelle Gruppe trä
trägt.
δ- δ+
R-O-H
Abhä
Abhängig davon, wieviele weitere CC-Atome gebunden sind,
unterscheidet man primä
primäre, sekundä
sekundäre und tertiä
tertiäre Alkohole:
1-Butanol
2-Butanol
tert.-Butanol
primär
sekundär
tertiär
7
Nachweis von Alkohol
im Teströ
Teströhrchen
Frü
Früher wurde bei Verkehrskontrollen Alkohol nachgewiesen
durch Grü
Grünfä
nfärbung im Pusterö
Pusteröhrchen:
-I
+VI
+I
+III
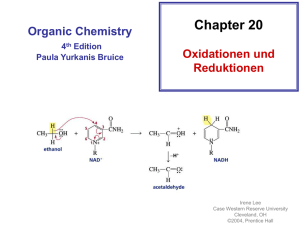
Redoxreaktion: Ethanol wird oxidiert zum Acetaldehyd
Das gelbgelb-orange Dichromat wird zum grü
grünen Chrom (III) reduziert.
Der Alkohol wird oxidiert nicht durch Sauerstoffaufnahme
(Oxigenierung), sondern durch Entzug von 2 Wasserstoffatomen
(Dehydrogenierung).
Das Produkt ist ein Aldehyd (Alcoholus
(Alcoholus dehydrogenatus)
dehydrogenatus)
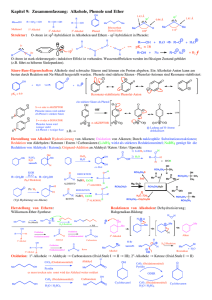
Reaktionen der Alkohole
Oxidierbarkeit von Alkoholen
Primä
Primäre Alkohole
lassen über das
Aldehyd weiter bis
zur Carbonsä
Carbonsäure
oxidieren;
Sekundä
Sekundäre nur bis
zum Keton;
Tertiä
Tertiäre Alkohole
können nicht oxidiert
werden, weil der
Wasserstoff fü
für die
Dehydrierung fehlt.
8