Synthese von Anthrachinon aus Anthracen
Werbung
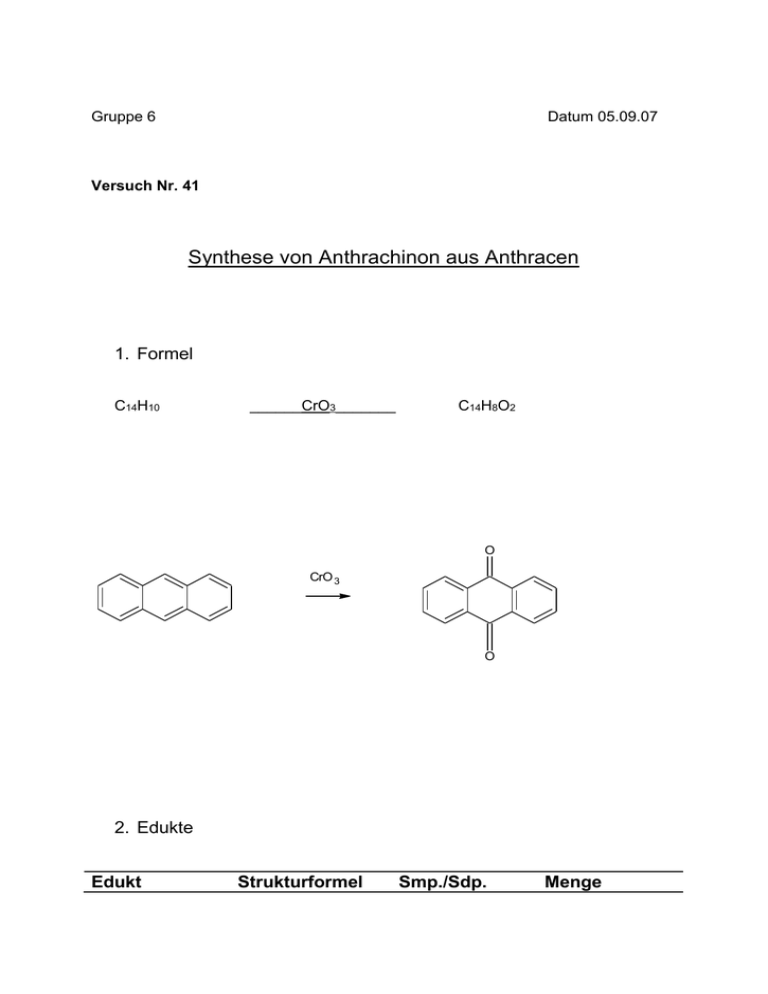
Gruppe 6 Datum 05.09.07 Versuch Nr. 41 Synthese von Anthrachinon aus Anthracen 1. Formel C14H10 ______CrO3_______ C14H8O2 O CrO 3 O 2. Edukte Edukt Strukturformel Smp./Sdp. Menge Anthracen O Eisessig H3C 215-218°C/340°C 0,9g 16-17°C/117118°C 52g/50ml OH Chromtrioxid (in wässriger Lösung als Chromat vorliegend) 2,5g O Cr O O bzw. in wässriger Lösung: O O - Cr O - O O Essigsäure H3C 16-16,5°C/117118°C 10,48g/10ml OH 3. Durchführung 0,9g Anthracen wird in siedendem Eisessig gelöst und heiß in einen 250ml Rundkolben filtriert und anschließend 2,5g Chromtrioxid in 10ml Essigsäure zu der heißen Lösung gegeben. Dieses Reaktionsgemisch wird zwei Stunden unter Rückfluss erhitzt, anschließend abgekühlt und nach und nach mit der gleichen Menge Wasser versetzt. Nach erfolgtem Abkühlen wird der entstandene Niederschlag des Anthrachinons abfiltriert und mit 2x20ml Wasser gewaschen. 4. Beobachtung Das gelbliche Anthracenpulver wird in klarem, siedenden Eisessig gelöst und heiß in einen Rundkolben filtriert. Dieses klare Reaktionsgemisch wird anschließend mit einem rostfarbenen Gemisch aus Chromtrioxid und Essigsäure versetzt, woraufhin es sich dunkelgrün verfärbte. Die Lösung ist grün, weil Cr3+ als Aquakomplex grün ist. Sobald es grün ist, kann es nicht mehr als Oxidationsmittel fungieren. Nach den zwei Stunden Erhitzen unter Rückfluss war die Flüssigkeit weiterhin dunkelgrün, der Niederschlag etwas heller, gelblich-grün. Der Niederschlag wurde nach dem Waschen etwas heller, blieb jedoch alles in allem gelblich grün. Anschließend wurde das Anthrachinon zum Trocknen in den Trockenschrank gelegt. 5. Ergebnis/Produkt Produktname: Anthrachinon Ausbeute: 0,5g Schmelzpunkt (bei Normaldruck): 292°C gemessen (285°C Literaturwert) Gefahrenbezeichnung: Xi R-/S-Sätze: R36-38, R43, S24, S26, S37-39 Strukturformel: O O 6. Reaktionsmechanismus Bei der Reaktion handelt es sich um eine RedOx-Reaktion. Reduktion und Oxidation treten immer gleichzeitig auf (daher auch der Name RedOx), d.h. wird eine Substanz oxidiert, wird gleichzeitig eine andere reduziert und umgekehrt. Wird eine Verbindung oxidiert, gibt sie Elektronen ab und ihre Oxidationsstufe steigt, bei einer Reduktion werden Elektronen aufgenommen. Oxidationsmittel sind Substanzen, die andere Verbindungen oxidieren, sie selbst werden bei der Reaktion reduziert, nehmen also Elektronen auf; umgekehrt reduzieren Reduktionsmittel andere Verbindungen und werden dabei selbst oxidiert, geben also Elektronen ab. Oder anders ausgedrückt: Reduzierte Verbindung oxidierte Verbindung + e – Um die Elektronenbilanz für RedOx-Reaktionen von organischen Verbindungen berechnen zu können werden Oxidationszahlen benutzt. Als Bezugssystem für die Oxidationszahlen dient Wasser (H2O). Da Wasser nicht geladen ist, muss die Summe der Oxidationszahlen Null sein, der elektronegativere Sauerstoff bekam damit die Oxidationszahl –II, der elektropositive Wasserstoff die Zahl +I. Sauerstoff tritt meist mit dieser Oxidationszahl auf, außer in Verbindungen, die eine O-O-Gruppierung enthalten (H2O2, Peroxide, Persäuren), hier bekommt er die Oxidationszahl –I. Für jedes Kohlenstoffatom werden die Oxidationszahlen der Substituenten zusammengezählt und das C-Atom bekommt dann die Oxidationszahl, die nötig ist, um die Summe Null zu ergeben, ein benachbarter Kohlenstoffsubstituent wird dabei mit Null gerechnet. In diesem Fall werden zwei C-Atome des mittleren Benzolringes mit Hilfe von Chromtrioxid als Oxidationsmittel oxidiert, hier, wie häufig in der organischen Chemie vorkommend, durch den Ersatz von C-H-Bindungen durch C=O-Bindungen. Dass bei dieser Reaktion die genau mittelständigen C-Atome oxidiert werden, rührt daher, dass die zwei äußeren Benzolringe die positive Ladung, die durch den elektronegativeren Sauerstoff entsteht, besser stabilisieren können. Die Oxidationsstufen in diesem Versuch sehen wie folgt aus: O + 2 O - Cr O + - 10H + O O + 3+ 2Cr 3+ + 6H 2O O Die zwei C-Atome des Anthracens werden bei dieser Reaktion oxidiert, erkennbar daran, dass ihre Oxidationsstufe von –I auf +II steigt. Das Chromat-Ion als Oxidationsmittel wird reduziert, erkennbar daran, dass die Oxidationsstufe des Chroms von +VI auf +III sinkt. In wässriger Lösung liegt Chromtrioxid (CrO3) als Chomat (CrO42-) vor, bei niedrigem pH-Wert auch als Dichromat (Cr2O72-)