Chemie-Grundlagen
Werbung

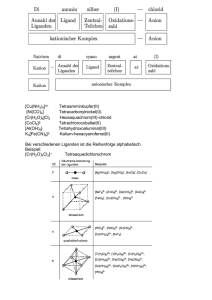
Chemie-Grundlagen Sitzung 6 Wintersemester 2009/10 Dr. Alexander Kohly Oxidationszahlen Lernziele Bedeutung von Oxidationszahlen erkennen Angaben zur Wertigkeit verstehen Wie können Bindungen eingegangen werden – die Bindigkeit von Stoffen verstehen Nachtrag zu den Redoxreaktionen Die Redoxreihe der Metalle Metalle werden in edle und unedle Metalle unterschieden. Edle Metalle wie Gold, Silber, Quecksilber oder Platin geben ungern ihre Valenzelektronen ab. Sie sind schwer zu oxidieren. Ihre Ionen sind aber gute Oxidationsmittel, die gern Elektronen aufnehmen. Unedle Metalle wie Alu, Zink oder Eisen geben gern Valenzelektronen ab. Dabei werden sie oxidiert und reduzieren zugleich ihren Reaktionspartner. Unedle Metalle geben ihre Elektronen an edle Metalle ab. Dadurch wird ein Elektronenfluss erzeugt. Trennt man die Oxidation und die Reduktion voneinander und verbindet die Reaktionen nur durch eine Elektronenbrücke, erhält man eine Batterie. Der Begriff „Wertigkeit“ CH4 Kohlenstoff ist in der Verbindung Methan vierwertig Immer einwertig: Wasserstoff H Alkalimetalle: Li; Na; K; Rb; Cs; Fr ( 1. Hauptgruppe) Halogene: F; Cl; Br; I; At ( 7. Hauptgruppe) Silber Ag Gold Au Immer zweiwertig: Erdalkalimetalle: Be; Mg; Ca; Sr; Ba; Ra ( 2. Hauptgruppe) Sauerstoff O Zink Zn Quecksilber Hg Immer dreiwertig: Aluminium Al Bor B • Fe Eisen • Wie bekommen wir nun heraus, wo hier die Reduktion und wo die Oxidation stattfindet? Dazu brauchen wir die Oxidationszahlen… • + + 2HCl Salzsäure -> -> FeCl2 + H2 Eisenchlorid + Wasserstoff Der Begriff „Oxidationszahl“ Atome im elementaren Zustand haben die Oxidationszahl Null. Dies gilt auch für die Elemente, die als Moleküle vorliegen. Oxidationszahlen können positive oder negative Vorzeichen tragen Bei Ionenverbindungen ist die Oxidationszahl eines Elementes identisch mit seiner Ionenladung. Die Summe der Oxidationszahlen aller Atome einer mehratomigen Verbindung ist gleich Null. Die Summe der Oxidationszahlen aller Atome eines mehratomigen Ions ist gleich der Gesamtladung dieses Ions. Merke: Einige wichtige Elemente weisen in den meisten Verbindungen die gleichen Oxidationszahlen auf: Sauerstoff: fast immer -2 (außer in H2O2, dort -1) Wasserstoff: fast immer +1 (außer in Hydriden, NaH, dort -1) Alkalimetalle (Na+, K+, ...): +1 Erdalkalimetalle (Ca2+, Ba2+, ...): +2 Halogene (F-, Cl-, ...): -1 Wertigkeit und Oxidationszahl Im Kohlenstoffdioxid (CO2) erhalten die zwei Sauerstoff-Atome jeweils die Oxidationszahl -2. Damit die Summe aller drei Atome null ist, muss das Kohlenstoff-Atom im Kohlenstoffdioxid die Oxidationszahl +4 erhalten. Das Kohlenstoff-Atom im Kohlenstoffdioxid ist vierwertig. Im Kohlenstoffmonooxid (CO) erhält das Sauerstoff-Atom die Oxidationszahl -2, das KohlenstoffAtom erhält +2. Das KohlenstoffAtom im Kohlenstoffmonooxid ist nur zweiwertig. Auch hier beträgt die Summe aller Oxidationszahlen null. Das heißt aber nicht, dass Kohlenstoff immer diese Oxidationszahl hat. Wird ein bestimmtes Atom oxidiert so steigt seine Oxidationszahl und wenn es reduziert wird so sinkt seine Oxidationszahl. Somit ist jede Oxidation und jede Reduktion eindeutig zu kennzeichnen. Welche Oxidationszahl hat Kohlenstoff in der Verbindung Methan? Welche im Ethan oder im Dichlormethan? Methan Ethan Die Oxidationszahl von Kohlenstoff im Methan beträgt ? Die Oxidationszahl von Kohlenstoff im Ethan beträgt ? Kohlenstoff kann die Oxidationszahlen -4, -3, -2, -1, 0, +1, +2, +3 und +4 besitzen! Oxidation: Oxidationszahl der C-Atome steigt Reduktion: Oxidationszahl der C-Atome sinkt Die Oxidationszahl • • Die Oxidationszahl gibt die formale Ladung eines Atoms an. Aus der Differenz der Oxidationszahlen vor und nach der Reaktion ist ersichtlich, wie viele Elektronen ein Atom (bzw. Ion) abgegeben oder aufgenommen hat. • 2Fe0 + O0 2 • Fe0 + 2H+1Cl-1 -> Fe+2Cl-12 -> 2Fe+2O-2 + H20 Beispiel aus der Wiederholung Die Oxidation des einen Stoffes geht immer einher mit der Reduktion des anderen Stoffes. Wichtig dabei ist die Übertragung von Elektronen. Aufgaben: Mg + O K +O Bestimme die Oxidationszahlen -> MgO -> KO Ca + Cl -> CaCl Al + Fe2O3 -> Fe + Al2O3