Modul 04 - Oxidationszahlen - St. Ursula
Werbung

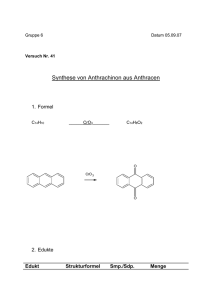
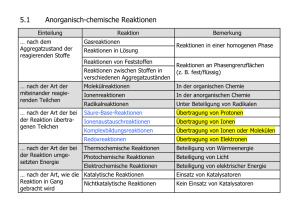
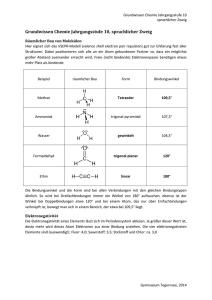
05.12.12 Oxidationszahlen © H. Wünsch 2012 Begriffsklärungen • • • • Elektronenabgabe: Oxidation Elektronenaufnahme: Reduktion Elektronenübertragung: Redoxreaktion Notwendig: formale Ladung eines Atoms als Atom, in einer Verbindung oder in einem Ion. • Die Oxidationszahl entspricht der tatsächlichen oder formalen Ionenladung, wobei das elektronegativere Element immer im reduzierten Zustand vorliegt. Sie wird mit römischen Ziffern geschrieben, das Vorzeichen wird immer mit angegeben. Modul 4v3 © H. Wünsch 2012 Oxidationszahlen 2 1 05.12.12 Vorbemerkungen zum Regelwerk • Wichtig: Weiter oben stehende Regeln haben Vorrang vor weiter unten stehenden Regeln! • Schwarze Oxidationszahlen ergeben sich aus den Regeln. • Rote bzw. graue Oxidationszahlen sind mit Hilfe des Regelwerks berechnet worden. Modul 4v3 © H. Wünsch 2012 Oxidationszahlen 3 Regeln (1) 1. Elemente und Elementmoleküle haben immer die Oxidationszahl 0. 2. In einem Molekül ist die Summe der Oxidationszahlen immer gleich 0. Modul 4v3 © H. Wünsch 2012 Oxidationszahlen 4 2 05.12.12 Regeln (2) 3. In einem Ion ist die Summe der Oxidationszahlen stets gleich der Ionenladung. 4. Fluor hat in Verbindungen oder Ionen immer die Oxidationszahl -I. Modul 4v3 © H. Wünsch 2012 Oxidationszahlen 5 Regeln (3) 5. Metalle haben in Verbindungen immer positive Oxidationszahlen, die Metalle der ersten Hauptgruppe immer +I, die der zweiten Hauptgruppe immer +II, Aluminium immer +III. 6. Wasserstoff hat in Verbindungen oder Ionen fast immer die Oxidationszahl +I. Modul 4v3 © H. Wünsch 2012 Oxidationszahlen 6 3 05.12.12 Regeln (4) 7. Sauerstoff hat in Verbindungen oder Ionen fast immer die Oxidationszahl -II. 8. Nur in den Halogeniden haben die Halogene immer die Oxidationszahl -I. Modul 4v3 © H. Wünsch 2012 Oxidationszahlen 7 Regeln (5) • In organischen Verbindungen beträgt die Summe der Oxidationszahlen eines Kohlenstoffatoms und der daran gebundenen Atome Null. Sauerstoff ist zwar in Verbindungen in der Regel –II, aber aufgrund der obigen Regel erhält O formal die Oxidationszahl 0 da zu N nichts bekannt, wird der Rest –NH2 mit 0 angenommen Modul 4v3 © H. Wünsch 2012 Oxidationszahlen 8 4 05.12.12 Übung macht den Meister CrO4– ClO2 SOCl2 (NH4)2SO3 NaAlH4 [Ag(NH3)2]OH N2O4 N 2O SbH3 Fe2(SO4)3 S8 HCO3– Modul 4v3 © H. Wünsch 2012 Oxidationszahlen 9 5