5.1 Anorganisch-chemische Reaktionen
Werbung
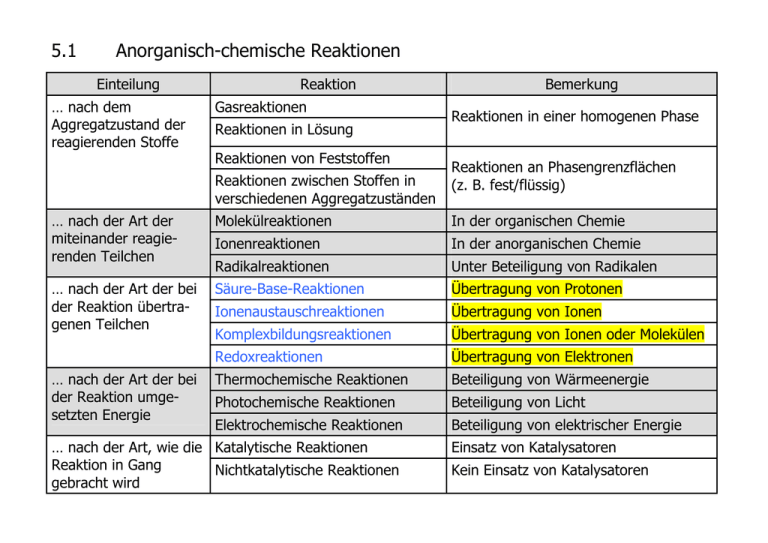
5.1 Anorganisch-chemische Reaktionen Einteilung … nach dem Aggregatzustand der reagierenden Stoffe Reaktion Gasreaktionen Reaktionen in Lösung Reaktionen von Feststoffen Reaktionen zwischen Stoffen in verschiedenen Aggregatzuständen Bemerkung Reaktionen in einer homogenen Phase Reaktionen an Phasengrenzflächen (z. B. fest/flüssig) … nach der Art der miteinander reagierenden Teilchen Molekülreaktionen In der organischen Chemie Ionenreaktionen In der anorganischen Chemie Radikalreaktionen Unter Beteiligung von Radikalen … nach der Art der bei der Reaktion übertragenen Teilchen Säure-Base-Reaktionen Übertragung von Protonen Ionenaustauschreaktionen Übertragung von Ionen Komplexbildungsreaktionen Übertragung von Ionen oder Molekülen Redoxreaktionen Übertragung von Elektronen Thermochemische Reaktionen Beteiligung von Wärmeenergie Photochemische Reaktionen Beteiligung von Licht Elektrochemische Reaktionen Beteiligung von elektrischer Energie … nach der Art der bei der Reaktion umgesetzten Energie … nach der Art, wie die Katalytische Reaktionen Reaktion in Gang Nichtkatalytische Reaktionen gebracht wird Einsatz von Katalysatoren Kein Einsatz von Katalysatoren ● Säure-Base-, Ionenaustausch-, Komplexbildungs- und Redoxreaktionen Nach der Art der bei der Reaktion übertragenen Teilchen werden SäureBase-Reaktionen, Ionenaustauschreaktionen, Komplexbildungs- und Redoxreaktionen unterschieden. Art der Reaktion/ Beispiel Säure-Base-Reaktion H3O+(aq) + OH-(aq) s. 5.3 2 H2O Charakteristik Übertragung von Protonen keine Änderung der Oxidationszahlen Ionenaustauschreaktion/Fällung s. 5.4 Übertragung von Ionen keine Änderung der Oxidationszahlen Ag+(aq) + NO3-(aq) + Na+(aq) + Cl-(aq) AgCl(s) + Na+(aq) + NO3-(aq) Komplexbildungsreaktion s. 5.4 AgCl(s) + 2 NH3(aq) [Ag(NH3)2]2+(aq) + Cl-(aq) Übertragung von Ionen oder Molekülen keine Änderung der Oxidationszahlen Redoxreaktion s. 6.1, 6.2 Übertragung von Elektronen Änderung von Oxidationszahlen Cu2+(aq) + Zn(s) Cu(s) + Zn2+(aq) Beschreibung der Reaktion zwischen HCl und NaOH H3O+(aq) + Cl-(aq) + Na+(aq) + OH-(aq) 2 H2O + Na+(aq) + Cl-(aq) Reaktion in Lösung Ionenreaktion Säure-Base-Reaktion (keine Änderung der Oxidationszahlen) Thermochemische Reaktion Nichtkatalytische Reaktion ● Umsatzberechnungen s. 0.4 Umsatzberechnungen erfolgen unter Berücksichtigung der Stöchiometrie. Als Berechnungsbasis dienen die Massen oder die Stoffmengen der Reaktionspartner. Volumina von Gasen sind mit guter Näherung mit Hilfe des idealen Gasgesetzes zu berechnen. X Y 2 H2 (g) + Z O2 (g) 2 mol 2 H2O (g/l) 1 mol 4g 2 mol 32 g 44,8 L (p0,T0) 36 g 22,4 L (p0,T0) 44,8 L (p0,T0) X : Y : Z = 2 mol : 1 mol : 2 mol = 4g : 32 g : 36 g = 44,8 L : 22,4 L : 44,8 L











