Oxidationzahlen substituierter Kohlenstoffverbindungen
Werbung

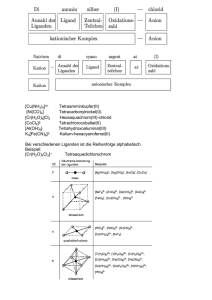
Oxidationzahlen substituierter Kohlenstoffverbindungen Bei organischen Verbindungen sind die Oxidationszahlen von Kohlenstoffatomen nicht so einfach zu bestimmen wie bei anorganischen Elementen, Atomkombinationen und Ionen. Hier liegen vorwiegend kovalente Bindungen vor, die zwar oft polarisiert sind, wo aber die bindenden Elektronenpaare nicht so einfach einem Atom zugeordnet werden können. Dennoch kann man eindeutige unterschiedliche Oxidationsstufen des Kohlenstoffs unterscheiden. In einer vereinfachten Form wollen wir dies für die Kohlenstoffatome in Verbindungen, die ausschließlich C-C-Einfachbindungen enthalten, ableiten. Bei Verbindungen mit C=C-Mehrfachbindungen sind die Verhältnisse weniger übersichtlich. Klassifizierung der Atome Wir betrachten die Gesamtheit dieser Kohlenstoffverbindungen und lassen alle üblichen Substituenten mit Heteroatomen zu. Unter Heteroelementen verstehen wir hier alle Atome außer C und H. In der Organischen Chemie sind dies im Wesentlichen Stickstoff (N), Sauerstoff (O), Schwefel (S) und die Halogene Fluor (F), Chlor (Cl), Brom (Br) und Iod (I). Für die Elemente ergibt sich auf Grund ihrer Stellung im Periodensystem der Elemente die folgenden Valenzzahlen: Element H C N O S F Cl Br I Hauptgruppe 1 4 5 6 6 7 7 7 7 Valenzzahl 1 4 3 2 2 1 1 1 1 Man beachte, dass bei allen Elementen die Summe der Zahl der maximal möglichen Valenzelektronen (8) entspricht. Im Vergleich zu Kohlenstoff ist der Wasserstoff elektropositiv, alle anderen Elemente dagegen elektronegativ. Kovalente Bindungen dieser Elemente zu C sind also bei H in Richtung auf C, bei allen anderen jedoch in Richtung auf die elektronegativen Heteroelemente hin polarisiert. Damit erhält Wasserstoff die Oxidationszahl +1, Stickstoff -3, Sauerstoff und Schwefel -2 und die Halogene -1. Wir wollen im folgenden die Oxidationszahl/-stufe des Kohlenstoffs in diversen Verbindungen ermitteln und beschränken uns dabei auf die Prototypen mit nur einem Kohlenstoffsubstituenten, nämlich dem zu betrachtenden C, indem wir alle daran befindlichen Alkylreste (R = –CH3, –C2H5 usw.) durch H ersetzen. Die Oxidationsstufen des Kohlenstoffs Die niedrigst mögliche Oxidationsstufe einer organischen Verbindung mit nur einem Kohlenstoffatom ist Methan, CH4, weil hier das Maximum an Substituenten mit positiver Oxidationszahl (H: +1) vorliegt. +1 H +1 -4 H C H H +1 +1 Da sich die Oxidationszahlen aller Atome in einer neutralen Verbindung zu Null ergänzen müssen, resultiert für den Kohlenstoff die Oxidationszahl -4. Methan steht hier repräsentativ für alle Alkane CnH2n+2, die gesättigten Kohlenwasserstoffe. 1 Die nächsthöhere Oxidationsstufe wird erreicht, wenn ein Wasserstoffatom (+1) beispielsweise durch eine –OH-Gruppe ersetzt wird: +1 H +1 -2 H C +1 -2 O H H +1 Die –OH-Gruppe selbst hat die Oxidationszahl -1, weil sie aus einem Sauerstofftom (-2) und einem Wasserstoffatom (+1) zusammengesetzt ist. Wir sehen also, dass einwertige Heterosubstituenten immer die Oxidationszahl -1 tragen, gleich welches Heteroatom vorliegt: +1 -3 H N H -2 O +1 +1 H H -2 S -1 X X = F, Cl, Br oder I +1 -1 -1 -1 -1 Damit ergibt sich für Alkohole (hier: Methanol, CH3-OH), aber auch für Amine (hier: Methylamin, CH3NH2), für Thiole (hier: Methanthiol, CH3-SH) und die Halogenalkane (hier: Methylhalogenide, CH3-X), dass der Kohlenstoff immer die Oxidationszahl -2 hat. Auch andere Derivate wie z.B. die Ether gehören in diese Klasse. In der nächsten Oxidationsstufe wird ein zweites Wasserstoffatom aus dem Methan durch eine -1-Gruppe ersetzt. Damit ist gleichbedeutend, dass man die gleiche Stufe erreichen kann, wenn man zwei Wasserstoffatome durch ein Atom oder eine Gruppe mit der Oxidationszahl -2 ersetzt: H +1 +1 H O -2 +1 -2 O H 0 C H +1 A +1 +1 H H 0 C H +1 B 0 -2 O -3 N C H H +1 +1 C Bei Verbindung B handelt es sich um Formaldehyd, den Prototyp der Carbonylverbindungen (Ketone und Aldehyde), bei A um dessen (wenig beständiges) Hydrat und bei C um Methylenimin, den Prototyp der Imine. Aber auch die Halbacetale und Acetale gehören als Alkylderivate der Hydrate dazu. In allen diesen Verbindungsklassen hat der Kohlenstoff die Oxidationszahl 0. 2 Nach dem gleichen Muster können wir fortfahren, indem wir auch ein drittes Wasserstoffatom des Methans ersetzen. Folgende Prototypen sind dann u. a. erreichbar: H +1 H O H +1 +1 +2 O -2 C -2 O H +1 H +2 +1 H +1 +1 H O C O H +2 -2 H -2 +1 -3 C N H E D +1 +1 +2 -2 O +1 +2 -3 H C N -2 O C X -1 +1 H G F Damit kommen wir zu den Carbonsäuren; hier Ameisensäure (E), ihrem (unbeständigen) Hydrat (Orthoameisensäuren, D), aber auch zu Derivaten wie den Carbonsäurenamiden (F) und den sehr reaktionsfähigen Carbonsäurehalogeniden (G). Auch die Blausäure (H) mit dem freifach gebundenen Stickstoff und ihre Alkylderivate, die Nitrile, gehören dazu. In allen diesen Verbindungen hat der Kohlenstoff die Oxidationszahl +2. Auch andere Derivate wie Ester und Carbonsäureanhydride gehören hierher. Die letzte und höchste Oxidationsstufe wird erreicht, wenn alle Wasserstoffe des Methans durch elektronegative Substituenten ersetzt sind. Damit werden Verbindungen erhalten wie z. B. H +1 +1 -2 H O +4 +1 H O C +1 O -2 -2 +1 O H +1 -2 H O +1 H N +4 C +1 H O O -2 +3 +1 -3 C H -2 H +1 N H I J R" +1 +1 R' +4 -1 C -2 O +1 +3 +4 -2 R N C O Cl N +3 +1 -2 C R L M +1 K -1 Cl -2 O -2 O O N die unbeständige Kohlensäure (J), die ebenfalls unbeständige Orthokohlensäure (I), aber auch so wichtige Verbindungen wie Harnstoff (K), Phosgen (L), Isocyanate (M) und Carbamate (Urethane, N). Alle diese Verbindungen sind Kohlensäurederivate, und der Kohlenstoff hat die Oxidationszahl +4. 3 Mit Hilfe der Oxidationszahlen ist man also in der Lage, Ordnung in die Vielfalt der organischen Verbindungen mit ihren zahlreichen funktionellen Gruppen zu bringen:a Oxidationszahl: +4 +2 0 -2 Kohlensäure, CO 2, Harnstoffe Phosgen, Isocyanate, Urethane Carbonsäuren, Ester, Amide Nitrile, Anhydride Carbonsäurehalogenide Aldehyde, Ketone, Imine Acetale, Halbacetale Alkohole, Thiole, Amine Alkylhalogenide Alkane -4 4