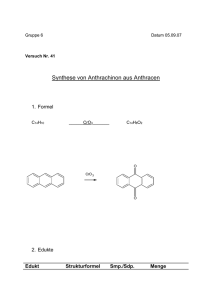
lh_chemie_ws06-07_arbeitsmaterial
Werbung

[Cu(NH3)4]2+ [Ni(CO)4] [Cr(H2O)6]Cl3 [CoCl4]2[Al(OH)4]K4[Fe(CN)6]2- Tetraamminkupfer(II) Tetracarbonylnickel(0) Hexaaquachrom(III)-chlorid Tetrachlorocobaltat(II) Tetrahydroxoaluminat(III) Kalium-hexacyanoferrat(II) Bei verschiedenen Liganden ist die Reihenfolge alphabetisch. Beispiel: [Cr(H2O)4Cl2]+ Tetraaquadichlorochrom(III) Redox-Glossar Elektronegativität: Maß für die Fähigkeit eines Atoms, Elektronen anzuziehen. Oxidation: Reaktion unter Abgabe von Elektronen Reduktion: Reaktion unter Aufnahme von Elektronen Oxidationsmittel: Substanz, die dem Reaktionspartner Elektronen entzieht (oxidiert) und selbst reduziert wird. Reduktionsmittel: Substanz, die dem Reaktionspartner Elektronen liefert (reduziert) und selbst oxidiert wird. Oxidationszahl: gibt die Oxidationsstufe eines Elements an elementarer Zustand: Oxidationszahl ist Null (z.B. I2, C, O2, P4, S8) Ionenverbindung: Oxidationszahl ist identisch mit der Ionenladung kovalente Bindung: Bindungselektronen werden dem elektronegativeren Bindungspartner zugeteilt, gleiche Bindungspartner erhalten je die Hälfte der Bindungselektronen; die Oxidationszahl entspricht den zugeteilten Bindungselektronen Redoxrektion: chemische Reaktion, bei der ein Reaktionspartner Elektronen abgibt (Oxidation) und der andere Reaktionspartner diese Elektronen aufnimmt (Reduktion). Regeln zum Aufstellen von Redoxgleichungen: Einsetzen der Reaktanden und der Produkte Festlegen der betreffenden Oxidationszahlen Aufspaltung in Oxidations- und Reduktions-Teilschritte Ermitteln des Elektronenübergangs aus den Oxidationszahlen Ladungsausgleich mittels Oxonuim-Ionen (in saurer Lösung), HydroxidIonen (in alkalischer Lösung) oder O2- (in Schmelzen) Ausgleich der Sauerstoff-Atome durch Wasser-Moleküle Stöchiometrische Richtigstellung der Gleichungen Ausgleich der Elektronenübergänge in den Teilgleichungen (gemeinsamer Faktor) Addition der Teilgleichungen zur gesamten Redoxgleichung Disproportionierung: Redoxreaktion, bei der aus einer Verbindung mit einem Element in mittlerer Oxidationszahl zwei Produkte (mit höherer und niedrigerer Oxidationszahl) entstehen; das Edukt wirkt zugleich als Oxidations- und Reduktionsmittel. Komproportionierung: Redoxreaktion, bei der zwei Edukte mit einem Element in unterschiedlicher Oxidationszahl (Oxidations- und Reduktionsmittel) unter Bildung eines Produktes (mit mittlerer Oxidationszahl) reagieren. HCl + HClO ————> Cl2 + 3 H2O Spannungsreihe Die oxidierte Stufe des Redoxpaares mit dem positiveren Potential reagiert mit der reduzierten Stufe des Redoxpaares mit dem negativeren Potential