Struktur der Proteine - jagemann
Werbung
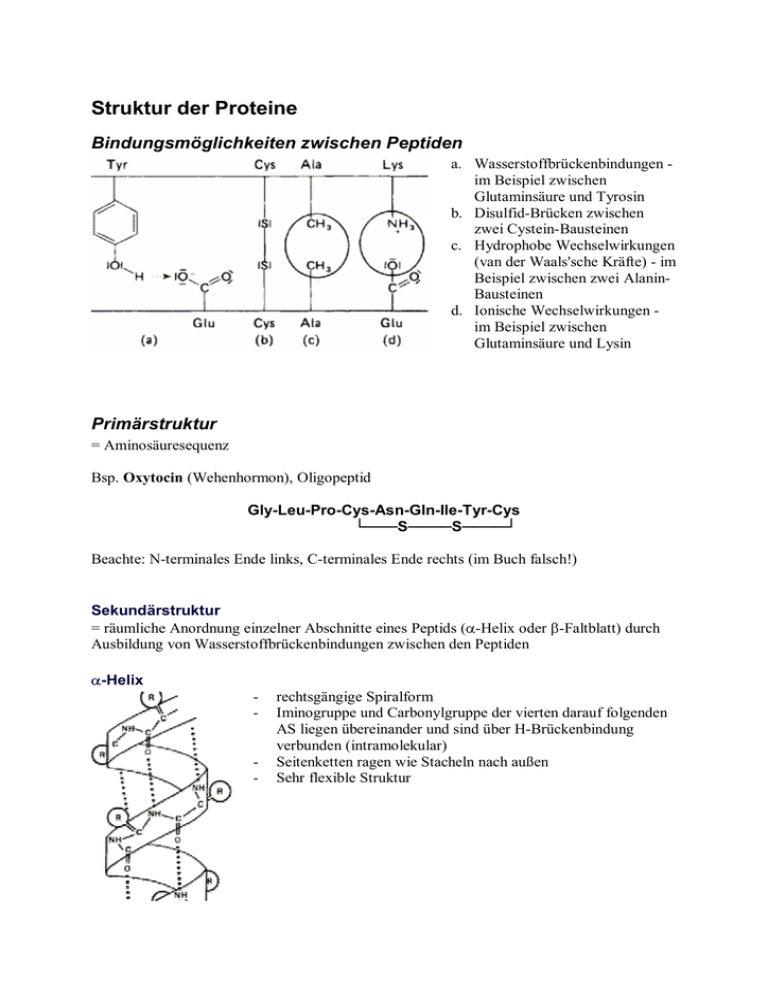
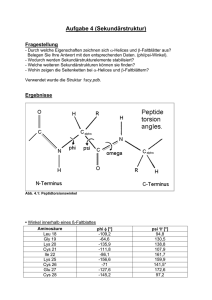
Struktur der Proteine Bindungsmöglichkeiten zwischen Peptiden a. Wasserstoffbrückenbindungen im Beispiel zwischen Glutaminsäure und Tyrosin b. Disulfid-Brücken zwischen zwei Cystein-Bausteinen c. Hydrophobe Wechselwirkungen (van der Waals'sche Kräfte) - im Beispiel zwischen zwei AlaninBausteinen d. Ionische Wechselwirkungen im Beispiel zwischen Glutaminsäure und Lysin Primärstruktur = Aminosäuresequenz Bsp. Oxytocin (Wehenhormon), Oligopeptid Gly-Leu-Pro-Cys-Asn-Gln-Ile-Tyr-Cys └───S────S────┘ Beachte: N-terminales Ende links, C-terminales Ende rechts (im Buch falsch!) Sekundärstruktur = räumliche Anordnung einzelner Abschnitte eines Peptids (α-Helix oder β-Faltblatt) durch Ausbildung von Wasserstoffbrückenbindungen zwischen den Peptiden α-Helix - - rechtsgängige Spiralform Iminogruppe und Carbonylgruppe der vierten darauf folgenden AS liegen übereinander und sind über H-Brückenbindung verbunden (intramolekular) Seitenketten ragen wie Stacheln nach außen Sehr flexible Struktur β-Faltblatt - - vergleichbar mit Leporello, lang gestreckte Zickzackform durch die Geometrie der Peptidbindung knicken die einzelnen Seiten immer an den α-Kohlenstoffatomen ab H-Brücken zwischen jeweils gegenüber liegenden Iminound Carbonylgruppen Peptide liegen sehr dicht zusammen Struktur sehr fest Tertiärstruktur = räumliche Anordnung einer ganzen Peptidkette, bedingt durch chemische E - fibrillär aufgrund β-Faltblatt-Struktur globulär aufgrund von α-Helix bzw. mit β-Faltblatt-Sequenzen in der Sekundärstruktur stabilisiert durch Wechselwirkungen zwischen den Seitenketten der Aminosäuren - H-Brücken (z.B. Tyrosin und Serin, beide mit -OH) - Ionenbindungen (zwischen Aminogruppen der basischen und Carboxylgruppen der sauren AS) - Van-der-Waals-Bindungen zwischen unpolaren Seitenketten (=hydrophobe WW) - Disulfidbrücken (je zwei Moleküle Cystein) Leghämoglobin: Die Polypeptidkette faltet sich überwiegend zu α-Helices. Quartärstruktur - Zusammenschluss mehrerer Peptide zu einer Funktionseinheit Hämoglobin besteht aus 4 Untereinheiten Insulin besteht aus 2 Untereinheiten (A-Kette und B-Kette) Sequenzanalyse von Aminosäuren Aufbrechen der Disulfidbrücken mit Peroxyameisensäure Aminosäureanalysator Bestimmung, welche AS vorliegen Hydrolyse der Amidbindungen mit Salzsäure AS-Analysator ist eine Ionenaustauschersäule AS werden nach steigendem pKS-Wert eluiert Ammoniak als Vergleichssubstanz unterschiedliche Farbumschläge eines Indikators Messung der Absorption Fläche unter Peaks ist Maß für relativen Anteil der AS im Gemisch Bsp. Glutathion: 3 Peaks gleicher Größe Glu, Gly und Cys Bestimmung der Sequenz vom N-terminalen Ende (Edman-Abbau) Aminogruppe reagiert mit Phenylthioisosyanatmolekül (C6H5N=C=S) chemische Veränderung der N-terminalen AS (Markierung) Abspaltung der markierten AS chromatographische Identifizierung der AS Nachteil: nur bei kürzeren Polypeptiden einsetzbar Fragmentierung durch enzymatischen Abbau Selektive hydrolytische Spaltung von Peptiden mit bestimmten Enzymen (Proteasen) Enzym Trypsin Clostripain Chymotrypsin Pepsin Thermolysin Ort der Spaltung Lys, Arg, Carboxy-Ende Arg, Carboxy-Ende Phe, Trp, Tyr, Carboxy-Ende Asp, Glu, Leu, Phe, Trp, Tyr, Carboxy-Ende Leu, Ile, Val, Amino-Ende Aufgabe: Ein Polypeptid, das aus 21 Aminosäuren besteht, wird durch Thermolysin hydrolysiert. Als Produkte erhält man Cly, Ile, Val-Cys-Ser, Leu-Tyr-Cln, Val-Clu-CIn-Cys-Cys-Ala-Ser und Leu-Clu-Asn-Tyr-Cys-Asn. Hydrolysiert man dasselbe Polypeptid mit Chymotrypsin, entstehen Cys-Asn, Cln-Leu-Clu-Asn-Tyr und Gly-lleVal-Glu-Gln-Cys-Ala-Ser-Val-Cys-Ser-Leu-Tyr. Geben Sie die Aminosäurensequenz dieses Moleküls an.