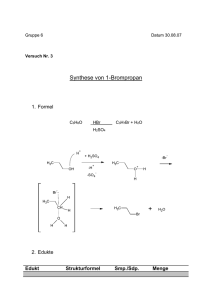
Stoff-Übersichten
Werbung

Materialien (Version: 26.06.2001) Diese Materialien dienen zur Überprüfung des Wissens und sind keine detailierten Lernunterlagen. Vorschlag: fragen Sie sich gegenseitig entsprechend dieser Listen ab. - Liste wichtiger Trivialnamen - Liste wichtiger Begriffe - Liste häufiger Abkürzungen - Übersicht: Reaktion - Übersicht: Stoffklassen - Übersicht: Konzepte - Analogien und Vergleiche - Leitfragen Aufbau OC 1 Std. 2 2 2 Stoffklassen 6 Halogenalkane 2 1 1 2 1 4 Alkohole Amine Ether Alkene Alkine Aromaten 6 Carbonyle - Aldehyde & Ketone - Säuren & Ester Amide, Aminosäure, Peptide 1 2 1 Alkane Cycloalkane Konzepte & Methoden Struktur und Bindung Radikale Konfiguration & Konformation Nukleophilie & Basizität Reaktionskinetik Reaktionen π-Systeme, Konjugation Eliminierung, Addition Mesomerie aromatischer Zustand M/I Effekte Tautomerie SE, Zweisubstitution NMR-Spektroskopie Kohlenhydrate Radikal- Reaktionen Stereochemie (Chiralität) SN1/S N2 Acetalisierung Aldol Wittig Liste wichtiger Trivialnamen (unvollständig) Acetaldehyd Aceton Acetylen Alanin Ameisensäure Benzaldehyd Benzen Benzoesäure Benzol Essigsäure Ethylacetat Formaldehyd Glucose Glycerin Glycol Phenol Pyridin Toluen Toluol o-Xylol m-Xylol p-Xylol Liste wichtiger Begriffe * = vorausgesetzt aus der anorganischen Grundvorlesung Additionsreaktionen Aktivierungsenergie AO * Base CIP Chiralität Diastereomer Elektronegativität * Elektrophil Eliminierungsreaktionen Enol Enantiomer Fischer-Projektion Grignard-Verbindung Hybridisierung Konfiguration Konformation Konstitution Massenwirkungsgesetz * Mesomerie MO Newman-Projektion Nukleophil Orbitale * Reaktionskoordinate Substitutionsreaktionen Stereozentrum Tautomerisierung Übergangszustand Umpolung Wasserstoffbrücken Zwischenprodukt Liste häufiger Abkürzungen Häufig verwendete und empfohlene Abkürzungen in Strukturzeichnungen Gruppe -CH3 -CH2-CH3 -CH2-CH2-CH3 -CH(-CH3 )2 -CO-CH3 -C6 H5 -CO-C6 H5 -CH2-C6 H5 -SO2-CH3 -SO2-C6 H4 -CH3 -SO2-CF3 -Alkyl -Hal -Metall -Aryl Shortcut -Me -Et -Pr -iPr -Ac -Ph -Bz -Bn -Ms -Ts -Tf -R -X -M -Ar Base Elektrophil Nucleophil - Kommentar nicht Metall ! Achtung: in der AC: -O-CO-CH3 Mesyl Tosyl Triflat beliebiger Rest, oder Alkyl Halogen aromatischer Ring, z.B. Phenyl B E |Nu + Häufig verwendete, nicht empfohlende Abkürzungen -CH2-C6 H5 -Bzl Übersicht: Reaktion Ursache der Reaktivität Überlagerung teilbesetzter AOs zu MOs einfach + einfach besetzt (sehr häufig) leer + doppelt besetzt Schiemenzsche Hauptsätze der Organischen Chemie I) Kohlenstoff ist vierbindig II) Elektrophil reagiert mit Nukleophil III) Wo immer sich Fünf- und Sechsringe bilden können, tuen sie es. Reaktionstypen - 'Paarungswille von Single-Elektronen' Radikalische Reaktionen Radikalische Substitutionen der Paraffine Radikalische Addition: HBr unter Antimarkovnikov - Ladungsausgleich Polare Reaktionen elektrophile/nukleophile Substitutionen/Eliminierung/Addition - Konzertierte Umgruppierung von Orbitalen elektrocyclische Reaktionen Diels-Adler-Reaktion - 'Klassisches aus der AC' Redox-Reaktionen Säure-Base-Reaktionen - radikalische Substitution der Alkane - nukleophile Substitutionen (SN1, SN2) - Elimierungsreaktionen Sayzev, Hofmann - Additionsreaktionen an Alkene Markovnikov, Antimarkovnikov - elektrophile Substitution der Aromaten Zweitsubstitutionsregeln - Diels-Alder-Reaktionen - Darstellung von Grignard-Verbindungen - Hydrierungen - Oxidationen der Alkohole - Reduktionen der Carbonylverbindungen - Darstellung cyclische Thioacetale - Veresterung von Carbonsäuren Übersicht: Stoffklassen Alkane Cycloalkane Halogenalkane Alkohole Thiole Amine Alkene Alkine Aromaten Aldehyde Ketone Carbonsäuren Salze Ester Amide Kohlenhydrate Aminosäuren Acetale Halbacetale Übersicht: Konzepte MOs aus AOs Mesomerie Hydridisierung Reaktionsdiagramme Nukleophile (Pearson: hart/weich) SN1, SN2 Induktive + mesomere Effekte Chiralität Aromatischer Zustand Zweitsubstitutionsregeln Umpolung Schutzgruppen Analogien und Vergleiche Überlegen sie die Gemeinsamkeiten und Unterschiede folgender Substrukturen: - -H, -CR3 , -SiR3 z.B. in CH3 -H, CH3 -CH3 , CH3-SiMe3 z.B. in Ph-H, Ph-CH3 , Ph-SiMe3 → alle drei Gruppen bilden eher Elektrophile, +I Effekte - sp3-Heteroatome: O, N, S z.B. in CH3 -OH, CH3 -NH2 , CH3 -SH → all drei Gruppen bilden eher Nukleophile → elektonegative Gruppen (-I) mit freien Elektronenpaaren (+M) Säure- und Base-Eigenschaften, N: eher Base, O,S: eher Säure → mögliche Reaktionen - sp2-Atome: C, O, N - Alkane ↔ Alkene ↔ Aromaten ↔ Carbonyle - Salze ↔ Ester Leitfragen Was sind s, p, sp3 - Orbitale Was sind σ, π, n - Orbitale Vergleichen Sie: Mesomerie ↔ Tautomerie Übergangszustand ↔ Zwischenprodukt Benzyl ↔ Phenyl Konfiguration ↔ Konformation ↔ Konstitution Enantiomer ↔ Diastereomer Nukleophil ↔ Base E/Z ↔ cis/trans Diskutieren Sie die elektronische Struktur und Geometrie von: - Ethan, Ethen, Acetylen, Formaldehyd, Benzol Schreiben Sie eine Reihenfolge der Nukleophile. Schreiben Sie eine Reihenfolge der Stabilitäten von Carbeniumkationen. Welche Substituenten-Gruppen gibt es bei aromatischen Zweitsubstitution ?






![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)