Grundwissen Chemie 10 - humboldt
Werbung

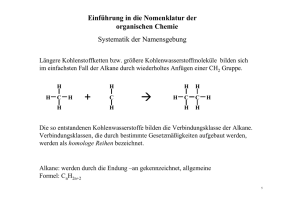
Grundwissen Chemie 10. Jahrgangsstufe 1. Kohlenwasserstoffe - Alkane ∗ gesättigte Kohlenwasserstoffe (nur Einfachbindungen) mit der allgemeinen Summenformel Cn H2n+2 ∗ homologe Reihe (= Gruppe chemisch verwandter Verbindungen, die sich um jeweils ein Kettenglied unterscheiden) ∗ Nomenklatur: ( IUPAC ) 1. Suche nach der längsten Kette der Kohlenstoffatome (=Hauptkette). 2. Der Name des Alkans, das die Hauptkette bildet, liefert den Stammnamen mit der Endung –an. 3. Die Kohlenstoffatome werden nummeriert, beginnend mit dem Ende, das einer Verzweigung (= Seitenkette) am nächsten liegt. 4. Die Seitenketten werden als Alkylreste bezeichnet ( Methyl-, Ethyl-,…) und dem Stammnamen vorangestellt 5. Die Lage der Seitenkette wird durch die Nummer des Kohlenstoffatoms, mit welchem sie verbunden ist angegeben. 6. Treten gleiche Alkylreste mehrfach auf, wird das entsprechende griechische Zahlwort (di-, tri-, tetra-, penta-) verwendet und der Bezeichnung der Seitenkette vorangestellt. 7. Unterschiedliche Seitenketten werden alphabetisch nach dem Namen der Alkylreste geordnet. ∗ Konstitutionsisomerie: gleiche Summenformel, unterschiedliche Verknüpfung der Atome (=Konstitution) z.B. Butan / 2-Methylpropan ∗ Physikalische Eigenschaften •Siedetemperatur: → Allgemein: Je größer die zwischenmolekularen Kräfte, desto höher der Energiebedarf, um die Moleküle von einander zu trennen und desto höher die Siedetemperatur. → Für unverzweigte Alkane gilt: Je länger die Kohlenstoffkette → umso größer die Oberfläche → umso stärker die Van-der-Waals-Kräfte → umso höher die Siedetemperatur → Für verzweigte isomere Alkane gilt: Je stärker verzweigt → desto kleiner die Oberfläche → umso geringer die Siedetemperatur • Löslichkeit: → „Ähnliches löst sich in Ähnlichem.“ → Alkane sind unpolar => Löslichkeit in unpolaren Lösungsmitteln ∗ Chemische Eigenschaften → Reaktion mit Sauerstoff: Brennbarkeit (Produkte: CO2, H2O) → Radikalische Substitution (Substitution = Austausch einzelner Atome oder Atomgruppen in einem Molekül gegen andere Atome oder Atomgruppen) → Beispiel: Halogenierung (unter Lichteinfluss) von Methan → Reaktionsgleichung: CH4 + Br2 → CH3Br + HBr → Reaktionsmechanismus: Start: Br⎯ Br → 2 Br* Kette: Br* + CH4 → HBr + *CH3 *CH3 + Br⎯ Br → CH3Br + Br* usw. Abbruch: z.B. *CH3 + Br* → CH3Br - Alkene ∗ungesättigte Kohlenwasserstoffe (Doppelbindungen) mit der allgemeinen Summenformel Cn H2n ∗ Endung –en ∗ Bindungsisomerie: Dem Stammnamen wird die Lage der Doppelbindung in der Kohlenstoffkette hinzugefügt. CH3 – CH = CH – CH3 z.B. CH2 = CH – CH2– CH3 But-1-en But-2-en ∗ E/Z-Isomerie → gleiche Summenformel, gleiche Konstitution, unterschiedliche Konfiguration (=Anordnung der Atome) → nur bei Doppelbindungen → z.B. E-But-2-en / Z-But-2-en ∗ Chemische Eigenschaften Elektrophile Addition (Addition = Anlagerung von Atomen oder Atomgruppen an ein ungesättigtes Molekül, so dass ein Produkt entsteht. Die Mehrfachbindung wird dabei aufgespalten) Beispiel: Reaktion von Ethen mit Brom (ohne Lichteinwirkung) C2H4 + Br2 → C2H4Br2 - Alkine ∗ ungesättigte Kohlenwasserstoffe (Dreifachbindungen) mit der allgemeinen Summenformel Cn H 2n-2 ∗ Endung –in ∗ Bindungsisomerie: Dem Stammnamen wird die Lage der Dreifachbindung in der Kohlenstoffkette hinzugefügt z.B. CH C – CH2– CH3 CH3 – C C – CH3 But-1-in But-2-in 2. Sauerstoffhaltige organische Verbindungen - Alkohole ∗ Funktionelle Gruppe : Hydroxy(l)gruppe (-OH) (Funktionelle Gruppe = Molekülteil, der das Reaktionsverhalten einer organischen Verbindung bestimmt) ∗ Allgemeine Formel: ∗ Nomenklatur: Endung –ol ∗ Einteilung: - ein- und mehrwertige Alkanole (je nach Anzahl der Hydroxylgruppen im Molekül) - primäre, sekundäre und tertiäre Alkohole (je nachdem, ob das C-Atom, welches die Hydroxylgruppe trägt mit einem, zwei oder drei weiteren C-Atomen verbunden ist) ∗ Physikalische Eigenschaften: Dipolcharakter der Hydroxylgruppe => Wasserstoffbrücken => höhere Siedetemperatur und Viskosität, bessere Wasserlöslichkeit als Alkane ∗ Chemische Eigenschaften: Oxidierbarkeit primärer und sekundärer Alkohole z.B. mit KMnO4 oder K2Cr2O7 primärer Alkohol => Aldehyd => Carbonsäure sekundärer Alkohol => Keton - Aldehyde ∗ Funktionelle Gruppe: Aldehydgruppe ∗ Allgemeine Formel: ∗ Nomenklatur: Endung –al ∗ Physikalische Eigenschaften: Dipol-Dipol-Kräfte → höhere Siedetemperaturen als Alkane (→ geringere Siedetemp. als Akolhole, da keine H-Brücken-Bdg.) → Löslichkeit zwischen Alkanen und Alkoholen ∗ Chemische Eigenschaften: → Νucleophile Addition an die Aldehydgruppe Bei nucleophiler Addition von Alkoholen (R-OH) entstehen im ersten Schritt Halbacetale, die zu (Voll-)Acetalen weiterreagieren können. → Oxidierbarkeit zu Carbonsäuren → Nachweisreaktionen: ∗ Fehlingprobe (Reduktion von Cu 2+ zu Cu2O im Alkalischen, roter Niederschlag) ∗ Silberspiegelprobe (Reduktion von Ag+ zu Ag) - Ketone ∗ Funktionelle Gruppe: Ketogruppe (Carbonylgruppe) ∗ Allgemeine Formel: ∗ Nomenklatur: Endung –on ∗ Physikalische Eigenschaften: Siehe Aldehyde ∗ Chemische Eigenschaften: → Nucleophile Addition an die Carbonylgruppe Bei nucleophiler Addition von Alkoholen (R-OH) entstehen im ersten Schritt Halbketale, die zu (Voll-)Ketalen weiterreagieren können freie Elektronenpaare sind nicht angegeben! → Oxidierbarkeit: durch milde Oxidationsmittel nicht oxidierbar → Fehling-Probe und Silberspiegel-Probe negativ - Carbonsäuren ∗ Funktionelle Gruppe: Carboxy(l)gruppe ∗Allgemeine Formel: ∗ Physikalische Eigenschaften: Starke Wasserstoffbrückenbindungen zwischen den Carboxygruppen mit Dimerenbildung → höhere Siedetemperaturen als Alkohole ∗ Chemische Eigenschaften: Saurer Charakter der Carboxylgruppe → Abgabe eines Protons der COOH-Gruppe, aber nur schwache Protolyse in Wasser: z.B. CH3COOH + H2O → H3O+ + CH3COO- - Ester ∗ Funktionelle Gruppe: Estergruppe ∗Allgemeine Formel: ∗Darstellung: Bei der Kondensation von Carbonsäuren mit Alkoholen entstehen Ester: (Kondensation = Reaktion unter Wasserabspaltung) Die säurekatalysierte Esterbildung und -spaltung ist eine Gleichgewichtsreaktion, d.h. es laufen Hin- und Rückreaktion gleichzeitig ab. 3. Biomoleküle - Fette ∗ Darstellung: Fette sind Ester zwischen dem dreiwertigen Alkohol Glycerin (Propan-1,2,3-triol) und drei meist verschiedenen Fettsäuren. ∗ Physikalische Eigenschaften: • Νatürliche Fette sind keine Reinstoffe → sie weisen keinen Schmelzpunkt, sondern einen Schmelzbereich auf. • Μit steigender Kettenlänge und abnehmender Anzahl an Doppelbindungen steigt der Schmelztemperaturbereich. • Feste Fette enthalten hohe Anteile langer und gesättigter Fettsäuren, während die Fettsäuren in den Ölen überwiegend ungesättigt (essentiell) sind. ∗ Chemische Eigenschaften: Fette lassen sich wie alle Ester hydrolysieren. Die alkalische Hydrolyse eines Fettes bezeichnet man als Verseifung. Die dabei entstehenden Alkalisalze der Fettsäuren nennt man Seifen. - Kohlenhydrate ∗ Einteilung: Nach der Anzahl z der Bausteine (Monomeren) lassen sich die Kohlenhydrate (die auch als Saccharide bezeichnet werden) in vier Gruppen einteilen: • Monosaccharide (Einfachzucker) z=1 • Disaccharide (Zweifachzucker) z=2 • Oligosaccharide (Mehrfachzucker) z=3, …., 10 • Polysaccharide (Vielfachzucker) z= 11, ….100000 ∗ Monosaccharide: Beispiel: Glucose Glucosemoleküle liegen sowohl als offenkettige Moleküle (Aldehydgruppe → positive Fehling-Probe) als auch in Ringform vor. Der Übergang von der Ketten- in die Ringform erfolgt als nukleophile Addition zwischen dem ersten C-Atom der Aldehydgruppe und der Hydroxylgruppe am fünften C-Atom. (→ intramolekularen Halbacetalbildung) ∗ Polysaccharide: Beispiel: Stärke Polysaccharid, das zu ca. 20 % aus Amylose (wasserlösliche Stärke) und zu ca. 80% aus Amylopektin (wasserunlösliche Stärke) besteht. Bei der Bildung der Amylose reagieren einige hundert Glucose-Moleküle unter Wasserabspaltung (Polykondensation). ↓ Das Makromolekül bildet eine schraubig gewundene, unverzweigte Kette (→ Helix) und zeigt mit Lugolscher Lösung (Iod-Kaliumiodid-Lösung) eine charakteristische Blaufärbung (Nachweis-Reaktion) - Aminosäuren und Proteine ∗ Amino(carbon)säuren: (AS) • Bausteine der Proteine • AS enthalten zwei funktionelle Gruppen: die Carboxyl- und die Aminogruppe • In wässeriger Lösung sowie im festen Kristall liegen AS als Zwitterionen vor, die durch intramolekulare Protolyse entstehen • Allgemeine Formel: • Eigenschaften: salzartiger Charakter, kristalline Feststoffe, die sich beim Erhitzen zersetzen ohne zu schmelzen, gute Wasserlöslichkeit • wichtigste Reaktion: Peptidbindung (eine Kondensationsreaktion) Die Bindung zwischen zwei AS-Molekülen entsteht, indem die Carboxylgruppe des einen Moleküls mit der Aminogruppe des anderen Moleküls reagiert. Die dabei entstehende Atomgruppierung -CO-NH- nennt man Peptidgruppe. • Durch Verknüpfung vieler AS entstehen Polypeptide (bis ca. 100 AS) • Sind mehr als 100 AS miteinander verknüpft, spricht man von Proteinen (Eiweißen) ∗ Proteine: • Primärstruktur: Reihenfolge der AS-Bausteine (AS-Sequenz), die Struktur und Funktion des Proteins bestimmt • Sekundärstruktur: Räumliche Struktur, die den Bau eines Proteins bestimmt und vorwiegend durch Wasserstoffbrückenbindungen bewirkt wird; man unterscheidet die schraubenförmige Anordnung (Helix) von der Faltblattstruktur • Tertiärstruktur: Räumliche Anordnung der Helix- bzw. Faltblattstruktur
![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)