Chromatografie
Werbung

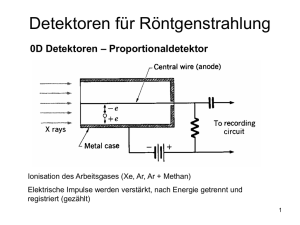
Analytische Chemie Chromatographie und Elektrophorese Trennstufenzahl: N = 16 (tr/wb)2 Effektive Trennstufen: Neff = 16 ((tr – t0)/wb)2 Auflösung: R = 2 (tr2-tr1)/(w1+w2) Bodenhöhe: H = L/N , L = Länge der Säule Weitere siehe p 21 Dissoziationsgrad von Säuren: a = K /( [H+] + K) , a’ = (K1 [H+] + 2K2) / ([H+]2 + K1 [H+] + K1 K2) Mobilität ueff = ui / a , mit ui = scheinbare Mobilität Abkürzungen und Systeme : GC = Gas- , Gasflüssigkeitschromatographie p 24 HPLC = high performance/pressure liquid chromatographie p 36 LLC = Liquid liquid chromatographie p 46 BPC = bonded phase chromatographie p 47 IEC/IPC = ion exchange/pair chromatographie p 49/53 Electrophorese p 61 EOF = elektroosmotischer Fluss Chromatographie: GC: Probenzuführung: Verdampfen der Probe in der Säule selbst oder in einem seperaten Verdampfer Trennsystem: apolar, nach Siedepunkten (mit Apiezon) oder Polar, durch WW mit der stationären Phase (mit Carbowax) Detektoren 1. GC/MS, GC/IR: gekoppelt, empfindlich, grosser dynamischer Bereich, linear, stabil, reproduzierbar, sehr selektiv oder völlig unselektiv, Probe bleibt erhalten 2. WLD, Wärmeleitfähigkeitsmesszelle: Nachweisgrenze ~1E-8g/ml, Signal ist proportional zur # Mole 3. FID, Flammenionisationsdetektor: Nachweisgrenze ~1E-11g/s, Signal ist proportional zur # Mole effektiver Kohlenstoffatome, über Flammenionisation der Kohlenstoffverbindungen 4. ECD, Electron capture detector: Nachweisgrenze 1E-12/s, Ionisation der Trägergasmoleküle, Entstehung eines konstanten Stroms, Probe fängt elektronen auf, Strom nimmt ab, Signal stark vom Probenmolekül abhängig 5. TID, Thermionischer Detektor, für Stickstoff Verbindungen, Nachweisgrenze ~1E-12g, über thermische Pyrolyse der Verbindungen LC / HPLC: Apparatur: Pumpen sorgen für eine flusskonstante und pulsfreie Strömung Probeneinführung: mittels Schleifenventil oder Injektionsspritze Trennsystem: Auswahl von stationärer (zB Silicagel, Aluminiumoxid) und mobiler Phase, Wahl der Parameter: Auflösung, Belastbarkeit und Geschwindigkeit Detektoren: p 39 Stationäre Phase: Vollkommen poröse Materialien oder Dünnschichtteilchen (porous beads) Entwicklungstechnik: Isokratische Elution: keine Parameter werden verändert, Gradienten Elution: Veränderung der mobilen Phase (Lsm- oder pHGradient), meist polar -> aolar, schneller, schärfere Peaks LSC, liquid solid Chromatographie Stationäre Phase: polar: Silicagel oder Aluminiumoxid, apolar: Aktivkohle, Polyamide Trennung aufgrund von Polaritätsunterschieden Wassereinfluss: p 44, meist ist eine Lsm verdünnung ideal Einfluss der Porengrösse: je grösser desto längere Retentionszeit LLC Trennung auf Grund von unterschiedlicher Verteilung der Probe zwischen Stationärer Phase ( Trennflüssigkeit aufgesogen von porösen Festkörpern, Trägern) und mobiler Phase Normale und Umkehrphasen LLC, siehe p 46 BPC, bonded phase chromatographie Einsatz von chemisch gebundenen organischen Gruppen an Trägeroberfläche Normal und Umkehrphasen BPC, siehe p 47 IEC, ion exchange chromatographie Trennung auf Grund von Konkurenz zwischen Ionen in der mobilen Phase und de ionisierten oder stark polaren Proben an den aktiven Stellen des iondntauschers IPC, ion pair chromatographie Grosses Gegenion bildet mit der ionisierten Probe ein Ionenpaar in der mobilen Phase und wird von der Säule zurückgehalten (Umkehrphasen IPC) GPC, Gelpermeations Chromatographie = SEC, size exclusion chrom. Trennung auf Grund der Grösse der Probemoleküle, Ausnützung der Porengrösse des Packungsmaterials Elektrophorese: CZE, Kapillarzonenelektrophorese: Gleichmässige Strömung, plug flow, induziert durch Potentialdifferenz Trennstufenzahl und Auflösung sind unabhängig von der Kapillarlänge, sehr kurze Analysedauer Trennung auf Grund von unterschiedlicher Wanderungsgeschwindigkeit Detektoren: Absorption, Fluoreszenz, MS, NMR CEC, Kapillarelektrochromatographie: Fluss wie bei CZE, durch Elektroosmose, Packung wie bei HPLC mit stat. Phase Trennung von neutralen Molekülen auf Grund von unterschiedlicher Affinität für das Trägermaterial KCE, Klassische Zonen Elektrophorese Trägerstreifen werden in Pufferlösung getränkt und beide enden in die Elektrodenkammern gehängt Trägerstreifen aus: Filterpapier, Celluloseacetat- oder Polyacrylamidgel Detektion: optisch nach anfärben der Proben Itachophorese Besonderheit: Nach Auftrennung der Komponenten bildet sich ein selbststabiles System von wandernden Elektrolytzonen, das mit konstanter Geschwindigkeit durch die Kapillare wandert, keine weitere Aufspaltung. Detektoren: 1. UV Absorption 2. Thermische Detektoren, erfassen Joulsche Wärmeentwicklung der Zonen 3. Potentialgradient Detektor, misst elektrische Feldstärke der Zonen 4. Leitfähigkeitsdetektor, misst lokale Leitfähigkeit Verbesserung der Auflösung durch zugabe einer Substanz, deren Beweglichkeit zwischen 2 Zonen liegt, Detektor sollte blind sein für jene Substanz Isoelektrische Fokussierung PH gradient auf Polyacryl oder Agarosegel Auftrennung von Proteinen nach ihrem Isoelektrischen Punkt FFF, field flow fractionation Auftrennung auf grund von einem angelegten Feld senkrecht zur Fliessrichtung Auftrennung der Partikel auf grund von grösse und gewicht Felder: Crossflow , Thermisches Feld ( Temperaturunterschied zwischen den Wänden), Elektrische oder magnetische Felder, Gravitation (über Zentrifuge)