Quantitative T1-Bildgebung des Gehirns
Werbung

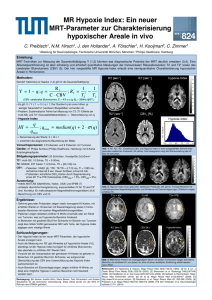
Quantitative T1-Bildgebung des Gehirns Preibisch, Christine Universitätsklinikum Frankfurt, Brain Imaging Center Einleitung In den letzten Jahren hat das Interesse an der so genannten quantitativen Magnetresonanz-Tomographie (qMRT) enorm zugenommen (1). Dabei werden Parameterbilder berechnet, deren Intensität nur den Wert eines einzelnen MR Parameters repräsentiert. Dadurch werden die Messergebnisse unabhängig von speziellen Messparametern und der Gerätehardware. Dies ist von Vorteil bei der Durchführung von longitudinalen und multizentrischen Studien. Klinische Bedeutung erhalten die Verfahren durch die Möglichkeit der Erhebung normaler Kontrollwerte zur Aufdeckung diffuser Pathologien, die zu einer globalen Veränderung der Parameterwerte führen. Insbesondere für die Messung der longitudinalen Relaxationszeit T1 wurden schnelle Methoden entwickelt, die die Aufnahme eines 3D Datensatzes des gesamten Gehirns in akzeptabler Zeit ermöglichen. Neben Methoden zur schnellen Abtastung der Signalerholung nach einer Sättigung oder Inversion (2,3), wurden in den letzten Jahren vor allem Methoden weiterentwickelt, die auf der Aufnahme von T1gewichteten spoiled FLASH Datensätzen mit verschiedenen Flipwinkeln beruhen (4,5). Anwendungen In den letzten Jahren wurden einige Arbeiten zum diagnostischen Wert der quantitativen T1 Bildgebung vorgestellt. Bei Untersuchungen an Patienten mit Multipler Sklerose konnte gezeigt werden, dass die T1 Werte nicht nur in Läsionen, sondern auch in normal erscheinender weißer Substanz (NAWM) erhöht sind (6). Bei Patienten mit Multisystem Atrophie und Parkinson’scher Krankheit wurde festgestellt, dass die T1-Werte in Kortex, Putamen und Thalamus gegenüber den Normalwerten erniedrigt sind (7), und bei Patienten mit hepatischer Enzephalopathie korrelieren die T1-Werte im Globus Pallidus, Nucleus Caudatus, und im hinteren Teil der Capsula Interna mit der Schwere der Erkrankung (8). Andere Anwendungen der quantitativen T1 Bildgebung sind die Untersuchung der Lungenfunktion (9,10) und anatomische Bildgebung. Bestimmte Hirnstrukturen, z.B. der Nucleus Dentatus, sind in T1- und Spindichte-gewichteten Bildern unsichtbar, können aber in quantitativen T1-Karten abgebildet werden (11). Techniken Wie schon erwähnt, besteht eine Möglichkeit zur Kartierung der T1 Relaxationszeit in der Abtastung des Signalzeitverlaufs nach einer Inversion oder Sättigung (Inversion oder Saturation Recovery) (2,3). Um eine gute Messgenauigkeit zu erreichen, müssen normalerweise lange Erholungszeiten ( 5 T1) eingehalten werden (2), oder zusätzliche Sättigungspulse angewendet werden (3), um eine stabile Gleichgewichtsmagnetisierung zu erreichen. Dadurch benötigen auch schnelle Methoden relativ lange Messzeiten von ca. 19 sec/Schicht (2), sodass in der Regel entweder relativ dicke Schichten (3-4 mm) verwendet werden, oder nur Teilbereiche des Gehirns abgebildet werden. Kürzere Messzeiten und damit eine höhere Volumenabdeckung ermöglichen Methoden, die auf der Aufnahme von T1-gewichteten spoiled FLASH Datensätzen mit verschiedenen Flipwinkeln beruhen (4,5). Diese Methoden basieren darauf, dass das Signal in spoiled FLASH vom Flipwinkel abhängt. Dabei kann schon aus zwei Datensätzen mit verschiedenen Flipwinkeln ein quantitativer T1-Datensatz berechnet werden (12). Allerdings müssen die Flipwinkel den zu messenden T1-Werten und der verwendeten Repetitionszeit angepasst sein. Ein Problem dieser Methode ist die räumliche Inhomogenität des Flipwinkels über das Bildgebungsvolumen. Deswegen ist es notwendig Abb. 1: Simulation: Abhängigkeit des gemessenen die Flipwinkelverteilung zu kartieren (13) und die scheinbaren T1-Wertes vom Phaseninkrement. Für = 118.2° und 121.8° stimmen gemessenes und wahres T1 T1-Parameterkarten entsprechend zu korrigieren (horizontale Linie) überein. = 50° liegt in einem (4). Trotzdem erscheinen die mit dieser Methode Plateaubereich in weißer Substanz gemessenen Werte von mehr als 1000 ms (4,14) zu lang im Vergleich zu Werten von etwa 800-900 ms, die mit Inversion Recovery Methoden gemessen werden (15,16). Eine wahrscheinliche Ursache dieser Diskrepanz ist eine unvollständige Auslöschung (Spoiling) der transversalen Restmagnetisierung. Neben Spoiler-Gradienten wird bei spoiled FLASH RFSpoiling (17) eingesetzt, um Restmagnetisierungen vor der nächsten Anregung völlig zu beseitigen. Bei diesem Verfahren werden aufeinander folgende Hochfrequenzpulse mit verschiedenen Orientierungen der Drehachse („Phasen“) eingestrahlt. Allerdings hängen die erreichte Gleichgewichtsmagnetisierung (18) und damit auch das gemessene scheinbare T1 (19), stark vom verwendeten Phaseninkrement ab. Simulationen (siehe Abb. 1) zeigen, dass es Werte für das Phaseninkrement gibt, für die das gemessene scheinbare T1 dem wahren T1-Wert entspricht. Allerdings ändert sich das gemessene scheinbare T1 in diesen Bereichen sehr stark mit , sodass zumindest in vivo starke Instabilitäten auftreten. Es gibt aber Plateaubereiche, in denen stabile Messungen möglich sind. In diesen Bereichen wird zwar das wahre T1 durch die gemessenen Werte stark überschätzt, allerdings ist auf Grundlage von Simulationen die Berechnung von Korrekturwerten möglich, die aber wiederum vom aktuellen Flipwinkel abhängen (20). Mittels Phantom und in vivo Messungen konnte gezeigt werden, dass spoiled FLASH mit zwei verschiedenen Flipwinkeln und einem Phaseninkrement von 50° stabile und zuverlässige T1 Werte liefert wenn eine entsprechende zusätzliche Korrektur durchgeführt wird. Die erhaltenen T1 Werte von etwa 940 ms in weißer Substanz stimmen gut mit T1 Werten eines Referenzexperimentes (IR-EPI) (etwa 900 ms) (20) und Literaturwerten (15) überein. Referenzen 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. Tofts P. Quantitative MRI of the Brain: Measuring Changes Caused by Disease. Chichester: John Wiley and Sons; 2003. Deichmann R. Fast high-resolution T1 mapping of the human brain. Magn Reson Med 2005;54(1):20-27. Shah NJ, Zaitsev M, Steinhoff S, Zilles K. A new method for fast multislice T(1) mapping. NeuroImage 2001;14(5):1175-1185. Deoni SC. High-resolution T1 mapping of the brain at 3T with driven equilibrium single pulse observation of T1 with high-speed incorporation of RF field inhomogeneities (DESPOT1-HIFI). J Magn Reson Imaging 2007;26(4):1106-1111. Venkatesan R, Lin W, Haacke EM. Accurate determination of spin-density and T1 in the presence of RF-field inhomogeneities and flip-angle miscalibration. Magn Reson Med 1998;40(4):592-602. Stevenson VL, Parker GJ, Barker GJ, Birnie K, Tofts PS, Miller DH, Thompson AJ. Variations in T1 and T2 relaxation times of normal appearing white matter and lesions in multiple sclerosis. Journal of the neurological sciences 2000;178(2):81-87. Vymazal J, Righini A, Brooks RA, Canesi M, Mariani C, Leonardi M, Pezzoli G. T1 and T2 in the brain of healthy subjects, patients with Parkinson disease, and patients with multiple system atrophy: relation to iron content. Radiology 1999;211(2):489-495. Shah NJ, Neeb H, Zaitsev M, Steinhoff S, Kircheis G, Amunts K, Haussinger D, Zilles K. Quantitative T1 mapping of hepatic encephalopathy using magnetic resonance imaging. Hepatology (Baltimore, Md 2003;38(5):1219-1226. Arnold JF, Fidler F, Wang T, Pracht ED, Schmidt M, Jakob PM. Imaging lung function using rapid dynamic acquisition of T1-maps during oxygen enhancement. Magma (New York, NY 2004;16(5):246-253. Jakob PM, Hillenbrand CM, Wang T, Schultz G, Hahn D, Haase A. Rapid quantitative lung (1)H T(1) mapping. J Magn Reson Imaging 2001;14(6):795-799. Deoni SC, Catani M. Visualization of the deep cerebellar nuclei using quantitative T1 and rho magnetic resonance imaging at 3 Tesla. NeuroImage 2007;37(4):1260-1266. Deoni SC, Rutt BK, Peters TM. Rapid combined T1 and T2 mapping using gradient recalled acquisition in the steady state. Magn Reson Med 2003;49(3):515-526. Yarnykh VL. Actual flip-angle imaging in the pulsed steady state: a method for rapid three-dimensional mapping of the transmitted radiofrequency field. Magn Reson Med 2007;57(1):192-200. Cheng HL, Wright GA. Rapid high-resolution T(1) mapping by variable flip angles: accurate and precise measurements in the presence of radiofrequency field inhomogeneity. Magn Reson Med 2006;55(3):566-574. Wansapura JP, Holland SK, Dunn RS, Ball WS, Jr. NMR relaxation times in the human brain at 3.0 tesla. J Magn Reson Imaging 1999;9(4):531-538. Zhu DC, Penn RD. Full-brain T1 mapping through inversion recovery fast spin echo imaging with time-efficient slice ordering. Magn Reson Med 2005;54(3):725-731. Zur Y, Wood ML, Neuringer LJ. Spoiling of transverse magnetization in steady-state sequences. Magn Reson Med 1991;21(2):251-263. Ganter C. Steady state of echo-shifted sequences with radiofrequency phase cycling. Magn Reson Med 2006;56(4):923-926. Yarnykh VL. Improved accuracy of variable flip angle T1 measurements using optimal radiofrequency and gradient spoiling. Proc Intl Soc Mag Reson Med 2008;16:234. Preibisch C, Deichmann R. The influence of RF spoiling on the stability and accuracy of T1 mapping based on spoiled FLASH with varying flip angles. Magn Reson Med 2008;submitted.