Zink - Iod - Zinkiodid - Lehrer-Uni
Werbung

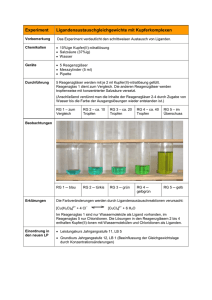
CH / Bs PRAKTIKUM: REDOX Zinkiodid Versuch 1: Herstellung einer Zinkiodid-Lösung Geräte: Spatel, 2 Erlenmeyerkolben (100 mL) + Stopfen, Filtriergestell, Filtertrichter, Filterpapier, Schutzunterlage für Tische, Schutzbrillen Chemikalien: Zinkpulver, Iod [Xn], dest. Wasser Durchführung (Beobachtungen notieren!): ▫ Geben Sie in den Erlenmeyerkolben ca. 50 mL dest. Wasser und fügen Sie drei kleine Spatel Iod zu. ▫ Geben Sie nun nach und nach unter leichtem Umschwenken Zinkpulver zu. Die Reaktion ist beendet, wenn die Lösung farblos ist und noch etwas Zink als Bodensatz übrig ist. ▫ Filtrieren Sie die klare Lösung von dem übrig gebliebenen Zink ab. Füllen Sie diese Lösung in den zweiten Erlenmeyerkolben, verschließen Sie diesen und bewahren Sie die Lösung für weitere Versuche auf. Entsorgung + Nachbereitung: ▫ Das Filterpapier mit den Zinkresten in den vom Lehrer bereit gestellten Entsorgungsbehälter geben. ▫ Alle Glasgeräte gründlich reinigen, mit dest. Wasser abspülen und auf das Trockengestell hängen. Versuch 2: Untersuchung der Zinkiodid-Lösung Geräte: Reagenzgläser, Spatel Chemikalien: Stärke, Silbernitratlösung [Xi], Iod, dest. Wasser Durchführung (Beobachtungen notieren !): ▫ Herstellung der Stärke-Lösung Geben Sie in ein Reagenzglas ca. 4 cm hoch warmes Wasser und lösen Sie darin eine kleine Spatelspitze Stärke "löslich" auf. Teilen Sie diese Lösung auf vier Reagenzgläser auf. Verschließen Sie zwei der Reagenzgläser und bewahren Sie diese für eine weitere Untersuchung in Versuch 3 auf. ▫ Geben Sie in eines der Reagenzgläser mit der Stärke-Lösung einige Tropfen der Lösung aus Versuch 1. ▫ Geben Sie in ein anderes Reagenzglas mit der Stärke-Lösung einen kleinen Iod-Kristall und schütteln Sie durch. ▫ Geben Sie in ein weiteres Reagenzglas 1-2 mL der Lösung aus Versuch 1 und geben Sie zu dieser Lösung tropfenweise Silbernitrat-Lösung zu. ACHTUNG: Silbernitratlösung nicht auf Haut, Kleidung oder Tische bringen !!! Das gibt nach einiger Zeit schwarze Flecken. Entsorgung und Nachbereitung: ▫ Inhalt der Reagenzgläser in den Entsorgungsbehälter "Schwermetallsalze" geben. ▫ Reagenzgläser gründlich reinigen, mit dest. Wasser ausspülen und auf das Trockengestell hängen. Auswertung + Fragen: 1 Formulieren Sie für die Reaktion von Zink mit Iod eine Reaktionsgleichung in Ionenschreibweise. Informieren Sie sich über die Begriffe Reduktion, Oxidation, Reduktionsmittel, Oxidationsmittel und Redox-Reaktion. Geben Sie jeweils eine Definition an und wenden Sie diese Begriffe auf die Reaktion von Zink mit Iod an. 2 Erklären Sie die Beobachtungen bei den Ihnen durchgeführten Versuchen. Formulieren Sie zur Reaktion der Zinkiodid-Lösung mit der Silbernitrat-Lösung eine Reaktionsgleichung in Ionenschreibweise. Erläutern Sie die Vorgänge bei der Iod-Stärke-Reaktion. D:\75807900.doc Seite 1 von 3 CH / Bs PRAKTIKUM: REDOX Zinkiodid Versuch 3: Elektrolyse der Zinkiodid-Lösung Geräte: U-Rohr mit Fritte, 2 Graphit-Elektroden, 1 Netzgerät (Gleichstrom), 2 Vielfachmessinstrumente mit Digitalanzeige, Reagenzgläser, Pasteur-Pipette, Stativmaterial Chemikalien: Zinkiodid-Lösung aus Versuch 1; Stärke-Lösung aus Versuch 2 Durchführung (Beobachtungen notieren!): ▫ Bauen Sie die Apparatur gemäß nebenstehender Skizze auf. Stellen Sie den Spannungsmesser auf den Messbereich 10 V Gleichspannung, den Strommesser auf 200mA Gleichstrom ein. Lassen Sie die Schaltung vor Inbetriebnahme durch den Lehrer kontrollieren ! ▫ Füllen Sie in beide Schenkel des U-Rohres so viel Zinkiodid-Lösung, dass die Elektroden ca. 1 cm tief eintauchen. ▫ Elektrolysieren Sie nun jeweils ca. 1 Minute lang bei U = 1 V, U = 2 V und U = 3 V. Notieren Sie Spannung und Stromstärke sowie sonstige Beobachtungen. ▫ Lassen Sie nun die Elektrolyse ca. 10 Minuten lang bei U = 3 V weiter laufen. ▫ Entnehmen Sie nun mit Hilfe einer Pasteurpipette dem Anodenraum und dem Kathodenraum jeweils eine kleine Probe der Lösung - nehmen Sie dazu die Graphit-Elektrode vorsichtig aus der Lösung und setzen Sie diese danach sofort wieder ein - und geben Sie diese in ein Reagenzglas. Fügen Sie zu jeder der beiden Lösungen jeweils etwas Stärke-Lösung zu. Versuch 4: Zink-Iod-Element Durchführung: ▫ Schalten Sie in der Apparatur von Versuch 3 die Spannungsquelle aus und trennen Sie diese vom Netz und von der Elektrolyse-Anordnung. ▫ Entfernen Sie das Spannungsmessgerät und verbinden Sie die beiden Kohlestäbe mit dem Strommessgerät. Vertauschen Sie dabei nicht die Anschlüsse gegenüber V3. ▫ Notieren Sie Ihre Beobachtungen. Nachbereitung und Entsorgung: ▫ Geben Sie die Lösungen aus allen Reagenzgläsern, die Lösung aus dem U-Rohr in den Abfallbehälter "Schwermetallsalze". ▫ Eventuell übrig gebliebene Zinkiodid-Lösung geben Sie in das vom Lehrer bereit gestellte Vorratsgefäß "Zinkiodid-Lösung". ▫ Alle Glasgeräte gründlich reinigen, mit dest. Wasser nachspülen und auf das Trockengestell hängen. ▫ Alle anderen Geräte an ihren Platz zurückbringen; Schutzbrillen in die Hülle (!!) einpacken und in die richtige (!!) Box zurücklegen. ▫ Die Schutzunterlage reinigen, trocken reiben und an ihren Platz zurückbringen. Auswertung und Fragen: 3 Berechnen Sie für die Elektrolyse in V3 aus den Spannungs- und Stromwerten jeweils den Ohmschen Widerstand R in sowie die elektrische Leitfähigkeit ( = 1/R) in Siemens (S). Angabe: 1 Siemens = 1 -1 4 Erläutern Sie detailliert die Vorgänge an den Elektroden bei der Elektrolyse. Verwenden Sie Reaktionsgleichungen und die "Redox-Begriffe" aus der Auswertung 1. 5 Erklären Sie die Beobachtung in Versuch 4. Verwenden Sie dazu ebenfalls Reaktionsgleichungen und die "Redox-Begriffe" aus 1. D:\75807900.doc Seite 2 von 3 CH / Bs PRAKTIKUM: REDOX Zinkiodid 6 Definieren Sie die Begriffe: Anode, Kathode, Elektrolyse, Galvanisches Element (sh. Buch!) D:\75807900.doc Seite 3 von 3