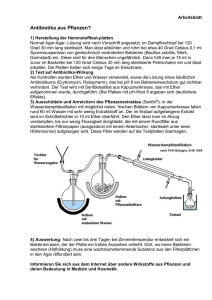
Zusammenfassung
Werbung

Synthesetechnik – „Ether“ 14. Februar 2007 Ether – Alkoxyalkane Versuch 5 10 15 Man erhitzt ein Gemisch aus 1mL Ethanol denat. und 0,5mL Schwefelsäure (konz.) in einem Reagenzglas in siedend heißem Wasser für 2-3 Minuten. Der Geruch des Gemisches ist nach dem Erhitzen leicht narkotisch und intensiv. Der Wassernachweis verläuft positiv. Es wurde Wasser gebildet. Ein neuer Stoff ist entstanden: Der bekannte Diethylether (IUPAC: Ethoxyethan). Diese Synthese hat aber einen Haken: Man kann nur „gleichartige“ Ether synthetisieren durch diese Syntheseweise. D.h. nur Ether aus gleichen Alkoholen. Nähme man nun zwei gemischte Alkohole, würden drei Produkte entstehen. Der gemischte Ether und die beiden gleichartigen Ether der beteiligten Alkohole. Daher ist in der Praxis, besonders außerhalb des Labors, ein anderer Syntheseweg neben der relativ wenig genutzen Alkoholyse verbreiteter: Die Williamson’sche Ethersynthese 20 Sie wurde im 19. Jahrhundert entwickelt und die Synthese von aliphatischen Ethern im industriellen Maßstab wird größtenteils nach ihrem Mechanismus durchgeführt. O Na Alkoholat 25 30 35 C (positiviert) + Br + Halogenalkan O Ether NaBr Salz Bei dieser Reaktion greift das nucleophile Teilchen, das O-Atom, das elektrophile C-Atom des Bromalkans an und bindet sich. Das Halogen wird abgespalten und bildet mit dem Alkoholatkation das anorganische Salz. Als Reaktionsmedium wird entweder der Alkohol des Alkoholats genommen (sofern er billig ist) oder meistens DMSO. Die Ausbeuten steigen vom Alkohol zum DMSO von 60% auf 95%(!) der Theorie. Man nennt dies die INTERMOLEKULARE WILLIAMSON’SCHE Ethersynthese. Im Gegensatz dazu steht die INTRAMOLEKULARE Synthese. Man vereint das Nucleophil und das Elektrophil in einem Molekül, so dass es „mit sich selber reagieren“ kann. Dies wird in stark verdünnter Lösung durchgeführt, damit keine intermolekularen Reaktionen eintreten können. Man führt die Reaktion in alkalischer Lösung durch. Dargestellt ist die Bildung von Oxacyclopentan aus 4-Brombutan-1-ol. 40 Ebenso ist der nucleophile Angriff des Hydroxidions dargestellt. Diese Reaktion ist aber viel langsamer. Daher kann kein Butandiol gebildet werden. Das Bemerkenswerte an dieser intramolekularen Reaktion ist die Tatsache, dass die Bildung eines Cyclopropan(!)-Rings am schnellsten verläuft, kurz darauf folgt die Bildung eines Fünferringes. -1- Synthesetechnik – „Ether“ 45 14. Februar 2007 Vierer-, Sechser- und größere Ringe verlaufen langsamer. Dies hat komplizierte Enthalpie- und Entropiegründe. Nomenklatur der Ether 50 Im normalen Sprachgebrauch wird unter Ether meist nur der spezielle Diethylether (Ethoxyethan) verstanden. Daneben ist noch der Dimethyl- und Ethylmethylether geläufig. Die läufigen Trivialnamen basieren dabei auf dem formalen Ersatz des Wasserstoffatoms durch die Alkylgruppen. Nach IUPAC sind Ether allerdings Alkane mit den sog. „Alkoxy“-Gruppen. Die Formel der einfachen, aliphatischen Ether ist ähnlich der der Alkohole: Cn H2n+2 O 55 Beispiele: O Methoxyethan bzw. Ethylmethylether CH3 O 2-Ethoxy-2-Methyl-propan bzw. 2-Ethyl-2-Methypropylether (MTBE) CH3 Bei zyklischen Ethern ist die Benennung wie beim homologen Cyclopropan. Für ein durch ein OAtom ersetztes C-Atom wird die Silbe Oxa- verwendet. O Oxacyclopropan bzw. Ethylenoxid Beispiele und Anwendung 60 65 70 Ether zeichnen sich vor allem durch ihre im Gegensatz zum homologen Alkanol niedrigen Siedepunkte aus, welche durch die fehlenden Wasserstoffbrückenbindungen zu erklären sind. Die kleineren Vertreter sind noch mit Wasser mischbar. Beim Wachsen der organischen Arme nimmt die Löslichkeit rasch ab. Diethylether ist nur noch zu 10% in Wasser löslich. Chemisch zeichnen sie sich durch ihre Inertheit aus und werden daher gerne als Lösemittel bei Synthesen benutzt. Dies gilt aber vor allem bei aliphatischen Ethern. Bei den zyklischen Vertretern sind nämlich gravierende Unterschiede zu beobachten: Vor allem die kleinen, aufgrund der Molekülsymmetrie stark unter „Spannung Stehenden“ ringförmigen Ether, sind sehr reaktionsfreudig. Ebenso sind ihre Siedepunkte leicht höher und sie sind deutlich besser in Wasser löslich, da das O-Atom im Ring besser Wasserstoffbrückenbindungen ausbilden kann. Beim Umgang mit Ethern ist vor allem mit länger an der Luft stehenden Ethern äußerste Vorsicht zu beachten! Peroxidbildung! Bekannte Vertreter: Bezeichnung IUPAC Dimethylether Diethylether Methoxymethan Ethoxyethan Tetrahydrofuran 1,4-Dioxan MTBE Oxacyclopentan 1,4-Dioxacyclohexan 2-Methoxy-2Methylpropan Ethylenoxid Oxacyclopropan Verwendung z.B. als Kühlmittel oder Treibgas. Völlig ungiftig. Früher: Narkotikum Heute: Lösemittel, Droge, Extraktionsmittel Lösemittel, reaktionsträge + wassermischbar Lösemittel, reaktionsträge + wassermischbar Gute Löslichkeit in Wasser, Klopfschutzmittel, Starterhilfespray, ersetzt in immer mehr Bereichen Diethylether (keine Peroxidbildung) Äußerst reaktionsfreudiger Reaktand, zur Synthese von Ethylenglykol und Polyestern, zur Desinfizierung und Sterilisation von Lebensmitteln 75 -2- Dirk Loose