8.8 Verwandte Stoffklassen
Werbung

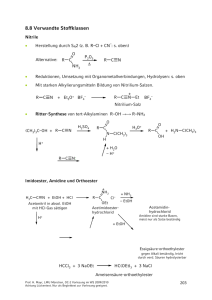
8.8 Verwandte Stoffklassen Nitrile Herstellung durch SN2 (z. B. R–Cl + CN–: s. oben) • O Alternative: R C P2O5 NH2 R C N Δ • Reduktionen, Umsetzung mit Organometallverbindungen, Hydrolysen: s. oben • Mit starken Alkylierungsmitteln Bildung von Nitrilium-Salzen. R C N R + Et3O+ BF4– + C N Et BF4– Nitrilium-Salz • Ritter-Synthese von tert-Alkylaminen R–OH →→ R–NH2 Imidoester, Amidine und Orthoester + NH2 H3C C N + EtOH + HCl Acetonitril in absol. EtOH mit HCl-Gas sättigen R C Cl– + NH3 – EtOH OEt Acetimidoesterhydrochlorid H+ Acetamidinhydrochlorid Amidine sind starke Basen, meist nur als Salze beständig + EtOH Essigsäure-orthoethylester gegen Alkali beständig, leicht durch verd. Säuren hydrolysierbar HCCl3 + 3 NaOEt HC(OEt)3 + 3 NaCl Ameisensäure-orthoethylester Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2010/2011 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 200 Ketene (Wiederholung von Kap. 3/4) R R C C O C C O H R' Aldoketene Ketoketene • Aldoketene und Ketoketene mit kleinen Resten R und R’ dimerisieren leicht. • Allgemeine Darstellungsverfahren: NEt3 + – HNEt3 Cl– R C C O R' R Zn C – ZnBr2 C O R' Häufig werden Ketene nach diesen Methoden in situ hergestellt. • Die Stammverbindung besitzt als technisches Zwischenprodukt große Bedeutung. CH3–CO2H [Triethylphosphat] 700 °C H2C C O + H2O nucleophiles Zentrum H2C (Wacker-Verfahren) vgl. Kap. 3 elektrophiles Zentrum O ·· C O ·· H2C elektrophiler Angriff Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2010/2011 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. C O C C nucleophiler Angriff 201 R C C O + R''–OH R' O R''–OH = H–OH, Alk–OH, Ar–OH, R C OH R C C O + R''–NH2 R' Keten und die meisten Aldoketene dimerisieren unter Bildung von β-Lactonen H2C C O Das β-Lacton wird technisch in Acetessigester überführt H2C C O β-Lacton H2C EtOH O O Ketoketene dimerisieren i. A. unter Bildung von Cyclobutan-1,3-dionen R2C C O O C CR2 [2+2]-Cycloadditionen mit elektronenreichen Doppelbindungen + R2C C O Der Donor gelangt dabei in 3-Position des Cyclobutanons (vgl. Kap. 4, S. 91) Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2010/2011 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 202 Kohlensäure und Derivate O HO • C Hydrat des CO2, liegt in wässriger Lösung nur in kleiner Gleichgewichtskonzentration vor. OH Phosgen (= durch Licht erzeugt) O hν CO + Cl2 Cl C Cl Die technische Synthese verwendet Aktivkohle als Katalysator bei 100 °C. O CH3OH Cl C 2 CH3OH Cl Chlorameisensäureester H3C O Cl C Dimethylcarbonat (Kohlensäuredimethylester) CH3 H3C C Cl C O + OH HO C CH3 O O Bisphenol A Polycarbonat Amide der Kohlensäure O O HO C NH2 H2N Carbamidsäure instabil • C NH2 Harnstoff Ester der Carbamidsäure (= Urethane) aus Chlorameisensäureestern oder Isocyanaten. O RO C Cl + HCl + NH3 Urethan Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2010/2011 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 203 O C Cl O Cl + R-NH2 Cl C N R – HCl Base H Isocyanat Chlorformamid R N C O + R'OH Urethan Diisocyanate + Diole → Polyurethane N C O + HO O C N OH + O C N O Cl C Cl + R2NH N C O R2NH – HCl – HCl Harnstoff-Derivat Carbamoylchlorid Unsubstituierter Harnstoff • Technische Synthese: CO2 + 2 NH3 NH2 O O– NH4+ 150 °C 40 bar NH2 O + H2O NH2 Ammoniumcarbamat R N C O + R'2NH Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2010/2011 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 204 Thio-Derivate der Kohlensäure • Bei Kohlensäure-Derivaten, wie auch bei Carbonsäure-Derivaten, kann der Sauerstoff durch Schwefel ersetzt werden. => Thioderivate • Schwefelkohlenstoff = Kohlendisulfid C + 2S • 900 °C S=C=S Xanthogenate = Alkalisalze der Xanthogensäureester S RO– Na+ + C S (vgl. Kap. 1) • Synthese des Thioharnstoffs analog der Wöhlerschen Harnstoff-Synthese durch Erhitzen von Ammoniumthiocyanat. NH4+ – ·· :S ·· C N: ·· S ·· ·· – C N ·· 140-180 °C Thioharnstoff • Technisch aus Calciumcyanamid und H2S: S Ca N C N + 2 H2S 150-180 °C Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2010/2011 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. CaS + H2N C NH2 205