4.2.6 Phasen der klinischen Forschung
Werbung
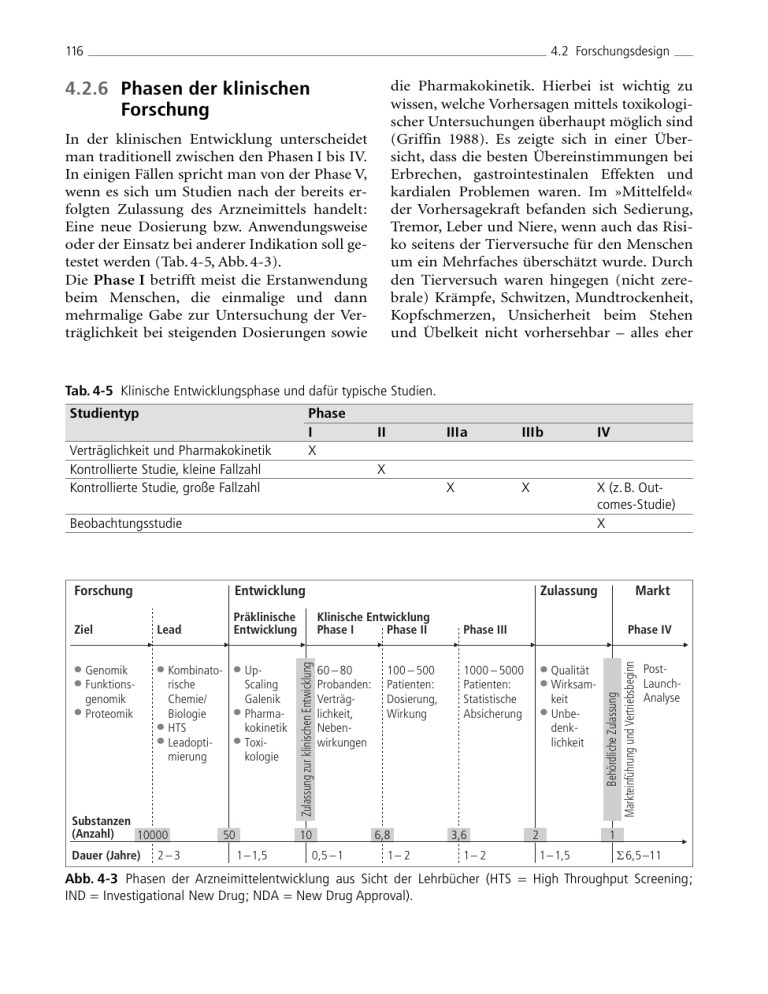
116 4.2 Forschungsdesign 4.2.6 Phasen der klinischen Forschung die Pharmakokinetik. Hierbei ist wichtig zu wissen, welche Vorhersagen mittels toxikologischer Untersuchungen überhaupt möglich sind (Griffin 1988). Es zeigte sich in einer Übersicht, dass die besten Übereinstimmungen bei Erbrechen, gastrointestinalen Effekten und kardialen Problemen waren. Im »Mittelfeld« der Vorhersagekraft befanden sich Sedierung, Tremor, Leber und Niere, wenn auch das Risiko seitens der Tierversuche für den Menschen um ein Mehrfaches überschätzt wurde. Durch den Tierversuch waren hingegen (nicht zerebrale) Krämpfe, Schwitzen, Mundtrockenheit, Kopfschmerzen, Unsicherheit beim Stehen und Übelkeit nicht vorhersehbar – alles eher In der klinischen Entwicklung unterscheidet man traditionell zwischen den Phasen I bis IV. In einigen Fällen spricht man von der Phase V, wenn es sich um Studien nach der bereits erfolgten Zulassung des Arzneimittels handelt: Eine neue Dosierung bzw. Anwendungsweise oder der Einsatz bei anderer Indikation soll getestet werden (Tab. 4-5, Abb. 4-3). Die Phase I betrifft meist die Erstanwendung beim Menschen, die einmalige und dann mehrmalige Gabe zur Untersuchung der Verträglichkeit bei steigenden Dosierungen sowie Tab. 4-5 Klinische Entwicklungsphase und dafür typische Studien. Studientyp Phase I X Verträglichkeit und Pharmakokinetik Kontrollierte Studie, kleine Fallzahl Kontrollierte Studie, große Fallzahl II IIIa IIIb IV X X X (z. B. Outcomes-Studie) X X Beobachtungsstudie Entwicklung Lead Präklinische Entwicklung ● ● ● Genomik Funktionsgenomik ● Proteomik ● Kombinatorische Chemie/ Biologie ● HTS ● Leadoptimierung Substanzen (Anzahl) 10000 Dauer (Jahre) 2–3 UpScaling Galenik ● Pharmakokinetik ● Toxikologie 50 Klinische Entwicklung Phase I Phase II 60 – 80 Probanden: Verträglichkeit, Nebenwirkungen 10 1–1,5 0,5 –1 100 – 500 Patienten: Dosierung, Wirkung 6,8 1– 2 Markt Phase III Phase IV ● Qualität Wirksamkeit ● Unbedenklichkeit 1000 – 5000 Patienten: Statistische Absicherung 3,6 1– 2 ● 2 Behördliche Zulassung Markteinführung und Vertriebsbeginn Ziel Zulassung Zulassung zur klinischen Entwicklung Forschung PostLaunchAnalyse 1 1–1,5 Σ6,5–11 Abb. 4-3 Phasen der Arzneimittelentwicklung aus Sicht der Lehrbücher (HTS = High Throughput Screening; IND = Investigational New Drug; NDA = New Drug Approval). 4 Interventionelle Studien subjektive Phänomene. Auch schlecht vorhersehbar waren (seltene) Probleme des blutbildenden Systems, z. B. Agranulozytose. In einigen Fällen, etwa in der Onkologie, findet die Phase I fast ausschließlich am Patienten statt. In der Phase I wird auch nicht selten die Bioverfügbarkeit nach oraler Gabe untersucht, um sicher zu stellen, dass die Substanz bei den Patientenstudien auch vom Körper aufgenommen wird (Tab. 4-6). In der Phase II wird an kleinen Populationen die Wirkung gegen Placebo sowie die DosisWirkungs-Beziehung untersucht (Abb. 4-4). Dabei kommt es noch immer vor, dass diese Studien nicht randomisiert werden. Aus wissenschaftlichen wie ethischen Gründen ist das kein akzeptables Vorgehen. Offene, nicht kon- 117 trollierte Studien sollten in einer Arzneimittelentwicklung in der Regel nur dann durchgeführt werden, wenn in sie Patienten aus einer vorhergehenden randomisierten Studie eingeschlossen werden, um die Langzeitwirkung einer Substanz zu beobachten und die Motivation zu erhöhen, an der randomisierten Studie teilzunehmen (Spodick 1982). Gelegentlich unterscheidet man zwischen Phase IIa und IIb, wenn man eine kleine IIa-Studie dazu nutzen will, die Entscheidung über die Fortführung der Entwicklung zu erleichtern, etwa dann, wenn die Substanz dem Placebo nicht überlegen ist. In der Phase III werden die entscheidenden großen Studien zur Wirksamkeit durchgeführt, wobei eine einzelne Studie ausreichen Tab. 4-6 Vergleich der Entwicklungsphasen bei Arzneimitteln und Medizinprodukten. Phase Präklinik Phase I Phase II Phase III Phase IV Postmarketing Surveillance Zusätzliche Verfahren Arzneimittel 쐌 Pharmakologisch-toxikologische Prüfung 쐌 Pharmazeutische Qualität 쐌 Pharmakokinetik am Tier 쐌 Probandenstudien zur Verträglichkeit und Pharmakokinetik, ggf. Surrogatparameter 쐌 Kontrollierte Studien an Patienten zur Verträglichkeit und Wirksamkeit, Dosisfindung (ca. 50−100 Patienten pro Arm) 쐌 Konfirmatorische Studien zum Nachweis der Wirksamkeit und Unbedenklichkeit 쐌 Klinische Prüfungen, z. B. Postmarketing Surveillance 쐌 PASS 쐌 Pharmakoepidemiologie 쐌 Anwendungsbeobachtung 쐌 Einzelfallberichte 쐌 Reviews 쐌 Meta-Analysen 쐌 Anwendungsbeobachtungen 쐌 Registerstudien CE = Communauté Européenne; MPG = Medizinproduktegesetz Medizinprodukt 쐌 Biologische Sicherheitsprüfung 쐌 Sicherheitstechnische Unbedenklichkeit 쐌 Anwendungstests bei gesunden Probanden oder Patienten (z. B. Stents) 쐌 Dosisfindungsstudien 쐌 Kontrollierte kleine Studien zur Wirksamkeit und Verträglichkeit 쐌 Konfirmatorische Studien zum Nachweis der vorgegebenen Leistungen und Unbedenklichkeit 쐌 In-vitro-Diagnostika Leistungsbewertungsprüfungen 쐌 Nach CE: klinische Prüfung nach § 23 MPG 쐌 Anwendungsbeobachtung 쐌 Field Monitoring 쐌 쐌 쐌 쐌 쐌 Einzelfallberichte Reviews Meta-Analysen Anwendungsbeobachtungen Registerstudien 118 4.2 Forschungsdesign kann, sofern diese auch einen Vergleich mit der derzeit besten wirksamen Substanz enthält. Studien, die vor der Zulassung begonnen werden, deren Ergebnisse aber nicht mehr in die Zulassungsakte eingehen, werden als Phase IIIb bezeichnet. Zu der Phase IV gehören streng genommen nur Studien, die exakt in der zugelassenen Indikation durchgeführt werden. Der Begriff ist jedoch inzwischen aufgeweicht, so dass die meisten Studien nach der Zulassung heute dazu gerechnet werden (Abb. 4-5). Die frühe Entwicklungsphase wird oft auch für so genannte Proof-of-Concept(POC)-Studien benutzt. Hierbei soll nachgewiesen werden, dass ein neuer Wirkmechanismus tatsächlich beim Menschen ähnlich wie beim Tier vorhanden ist. Damit ist jedoch oft nichts über die klinische Wirksamkeit ausgesagt. In POC-Studien werden oft nur eine oder zwei Dosierungen getestet und nicht klinisch validierte Biomarker als Endpunkte verwendet. Der Zeitgewinn durch diese Studien wird oft überschätzt, zumal sich bei der wahrscheinlichen Fortführung des Programms eine ausführliche Phase IIb anschließt. Immer öfter werden klinische Phasen miteinander kombiniert (Abb. 4-6). Während die Phase noch allein steht, werden Phase II und IIIa gerne miteinander verbunden, da die End- Thrombozytenzahl 1,80 1,60 1,40 1,20 Anzahl der vom Markt zurückgenommenen Substanzen 1,00 Placebo 5 10 20 30 Eltrombopag-Dosis (mg) 50 75 Abb. 4-4 Dosis-Wirkungs-Studien sind essentiell für die Phase II (Dosis-Wirkungs-Studie Eltrombopag bei der Werlhof-Krankheit). 15 10 5 0 1 2 3 Zeitraum seit Einführung (in Jahren) 4 Abb. 4-5 Arzneimittelprobleme werden meist in den ersten vier Jahren nach Einführung erkannt (Anzahl von Rücknahmen von Markt in Relation zum Einführungsjahr – bis 4 Jahre nach Einführung, entspricht 80 % aller Rücknahmen). Verwendet wurden die Daten aus den Jahren 1960 bis 2001.











