Chemie Stoff im Jahrgang 6 (einstündig) Thema Basis
Werbung
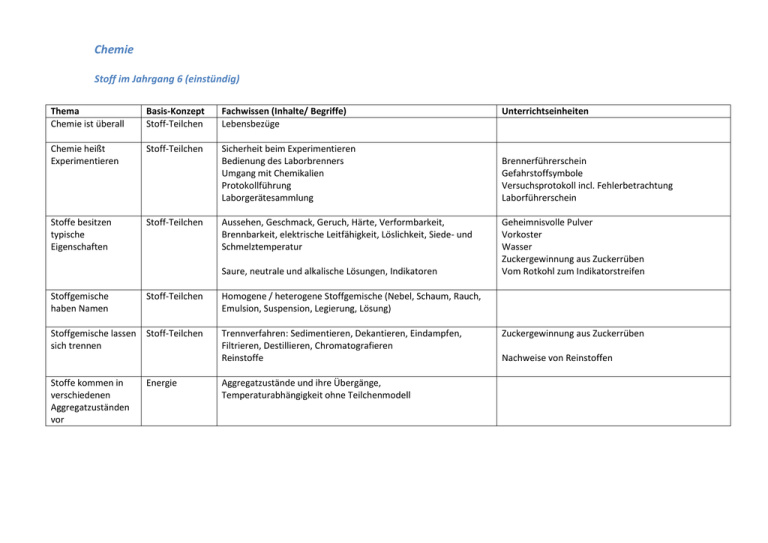
Chemie Stoff im Jahrgang 6 (einstündig) Thema Chemie ist überall Basis-Konzept Stoff-Teilchen Fachwissen (Inhalte/ Begriffe) Lebensbezüge Chemie heißt Experimentieren Stoff-Teilchen Sicherheit beim Experimentieren Bedienung des Laborbrenners Umgang mit Chemikalien Protokollführung Laborgerätesammlung Stoffe besitzen typische Eigenschaften Stoff-Teilchen Aussehen, Geschmack, Geruch, Härte, Verformbarkeit, Brennbarkeit, elektrische Leitfähigkeit, Löslichkeit, Siede- und Schmelztemperatur Saure, neutrale und alkalische Lösungen, Indikatoren Stoffgemische haben Namen Stoff-Teilchen Stoffgemische lassen Stoff-Teilchen sich trennen Stoffe kommen in verschiedenen Aggregatzuständen vor Energie Unterrichtseinheiten Brennerführerschein Gefahrstoffsymbole Versuchsprotokoll incl. Fehlerbetrachtung Laborführerschein Geheimnisvolle Pulver Vorkoster Wasser Zuckergewinnung aus Zuckerrüben Vom Rotkohl zum Indikatorstreifen Homogene / heterogene Stoffgemische (Nebel, Schaum, Rauch, Emulsion, Suspension, Legierung, Lösung) Trennverfahren: Sedimentieren, Dekantieren, Eindampfen, Filtrieren, Destillieren, Chromatografieren Reinstoffe Aggregatzustände und ihre Übergänge, Temperaturabhängigkeit ohne Teilchenmodell Zuckergewinnung aus Zuckerrüben Nachweise von Reinstoffen Stoff im Jahrgang 7 (einstündig) Thema Zwischen Stoff und Struktur besteht ein Zusammenhang Basis-Konzept Struktur Eigenschaften Teilchen bewegen sich Chemische Reaktionen Energiegehalt chemischer Systeme Verbrennung - eine chemische Reaktion mit Sauerstoff Dichte Unterrichtseinheiten Modell und Wirklichkeit, Lernen an Stationen: Teilchenmodell Dichtebestimmungen Stoff-Teilchen Teilchengeschwindigkeit, Diffusion Luftkissentisch Chemische Reaktion Definition: Totale Stoffvernichtung bei gleichzeitiger totaler Stoffneubildung. Erkennungsmerkmale chemischer Reaktionen -Farbänderung -Gasentwicklung -Niederschlagsbildung -Energieänderung Energie Chemische Reaktion Fachwissen (Inhalte/ Begriffe) Aggregatzustände im Kugelteilchenmodell exotherme und endotherme Reaktionen, Aktivierungsenergie Katalyse Sauerstoff- Reaktionspartner aus der Luft chemische Reaktionsgleichung (Reaktionsschema) als Wortgleichung Metalloxid, Oxidation Metallbrände, Fettbrände, Brandarten, Brandbekämpfung Lernen an Stationen: Vom Ablauf einer chemischen Reaktion (Blaues/weißes Kupfersulfat) Herstellen von Kältemischungen Katalysen im Alltag Stoff im Jahrgang 8 (einstündig) Thema Korrosion, die langsame Oxidation Metalloxide Basis-Konzept Chemische Reaktion, Energie Chemische Reaktion Nichtmetalloxide Umkehrung chemischer Reaktionen Anwendung von Redoxreaktionen Chemische Reaktionen im Kugelteilchenmodell nach DALTON Atomkreisläufe Chemische Reaktion Chemische Reaktion Chemische Reaktion, StrukturEigenschaften Chemische Reaktion Quantitative Chemische Betrachtungen Reaktion, die Formel einer StrukturEigenschaften chemischen Verbindung Fachwissen (Inhalte/ Begriffe) Metallkorrosion und ihre Verhinderung Unterrichtseinheiten Eisenkorrosion in der Thermosflasche Vom Metall zum Rost, Rostschutz Oxidation von Magnesium, Aluminium → wässrige Lösungen sind Laugen Oxidationen von Schwefel und Kohlenstoff → wässrige Lösungen sind Säuren Aufspaltung von Metalloxiden durch endotherme Reaktionen: Reduktion Elementbegriff, Periodensystem der Elemente als Ordnungsschema, Erläuterung der Elementsymbolik, Leistungen des Periodensystems Anwendung der Symbolik: chemische Formelsprache Beispiele für weitere Reduktionen → Redoxreihe der Metalle Eisenverhüttung, Stahlerzeugung Wiederholung Indikatoren (6. Jahrgang), pH-Wert nur qualitativ, Anwendung auf Säuren/Laugen Aufbau der Stoffe: Atome und Moleküle Chemische Reaktion als Umgruppierung von Atomen Gesetz von der Massenerhaltung: Anknüpfung →Atomkreisläufe Teilchenmodell nach DALTON - Masse von Atomen, von Molekülen - Anzahl von Atomen , von Molekülen in Stoffportionen => AVOGADRO-Zahl, molare Masse Konstanz der Anzahl der Atome und Moleküle auf der Erde: Rohstofferschöpfung, Recycling-Problem Massenverhältnis, Atommassenverhältnis, Atomzahlverhältnis Erweiterung: Koeffizientenfindung in Reaktionsgleichungen Silber aus Silberoxid „Erfindung“ des Periodensystems, Historie, Elementrecherche Thermit-Versuch Vom Erz zum Metall, Eisenerzeugung in Isernhagen (Raseneisenstein), „Ötzis Kupferbeil“ „Fotoreise in die Welt der Atome“ Vom Massenverhältnis zur Formel: Atomverbände in LEGO-Version , AB: Sofies Welt „Das genialste Spielzeug der Welt“ Formel von Kupfersulfid; Einfache Massenberechnungen aus der chemischen Technologie Stoff im Jahrgang 9 (zweistündig) Thema Elementfamilien Alkalimetalle Erdalkalimetalle Basis-Konzept Chemische Reaktion, StrukturEigenschaften Eigenschaften und Reaktionen ausgewählter Halogene (Chlor, Brom), Eigenschaften im Vergleich Halogenide, Nachweise, Halogenwasserstoffverbindungen, Säuren als wässrige Lösungen (aq) Salzbildungsreaktionen (Zusammenfassung) - Säure + Metall; Säure + Metalloxid; Metall + Halogen Halogene Edelgase (fakultativ) Periodensystem und Wertigkeit Salze bestehen aus Ionen Fachwissen (Inhalte/ Begriffe) Eigenschaften und Reaktionen ausgewählter Alkali- und Erdalkalimetalle, Gruppeneigenschaften, Laugen, Nachweise durch Flammenfärbungen StrukturEigenschaften StrukturEigenschaften Atombau Anwendungen: Ballongas, Leuchtröhren, Leuchtstoffröhren, Schutzgasschweißen Stellung der Elemente im Periodensystem → Wertigkeit → Formel einer Verbindung Elektrische Leitfähigkeit von Salzschmelzen: Anionen, Kationen RUTHERFORD Streuversuch, Radioaktivität, Kern-Hülle-Modell , Bau des Atomkerns (klassisch), Isotope und Atommasse Energie Bildung und Bau von Ionen StrukturEigenschaften Elektrochemie I Elektrolyse Elektrochemie II Galvanische Zelle Redoxreaktionen als Elektronenverschiebungen Energie Energie Unterrichtseinheiten Laugengebäck ist essbar Projekt „Erdalkalimetalle“ Silberfotografie Nützliche Faustregel bei zweiatomigen Verbindungen: Tabellenschema Internetexperiment Isernhagen (verlagert nach München) Ionisierungsenergien → Struktur der Atomhülle, Gruppenpuzzle „Atombau“ Schalenmodell, Atomradien Atommodell nach LEWIS: freies Elektron, freies Elektronenpaar, „Leuchtende Essiggurke“ Edelgaskonfiguration Ionenbildung im Energiestufenmodell, Metalle als Elektronendonatoren, Nichtmetalle als Elektronenakzeptoren, Oktettregel, Ionengittermodell, Gitterenergie, Ionenbindung Erzwungener Ablauf: Elektrolyse von Salzen in wässrigen Lösungen Selbstständiger Ablauf: Abscheidung von Metallen aus ihren Salzlösungen Oxidation und Reduktion als Elektronenaustauschreaktionen Regeln zur Bestimmung von Oxidationszahlen Vom Atom zum Ion Gruppenarbeit zum Periodensystem (Karten) Ionen auf Durchreise Stoff im Jahrgang 10 (zweistündig) Thema Elektronenpaarbindung Basis-Konzept Stoff-Teilchen Raumstruktur von Molekülen StrukturEigenschaften Saure und alkalische Lösungen chemische Reaktion Fachwissen (Inhalte/ Begriffe) Unterrichtseinheiten Bindungsenergien, Bindungslänge, Einfach-, Mehrfachbindungen, Anwendung der Oktettregel unpolare und polare Elektronenpaarbindungen, Elektronegativität, Charakterisierung einer Elektronenpaarbindung anhand von EN, Dipole Molekülbeispiele mit den Formen Dreieck, Tetraeder, Pyramide, Molekülbaukasten Anomalie des Wassers, Wasserstoffbrücken, Dipol-DipolWechselwirkungen Rückbezug Salzsäure Lernfirma „Max Sauer“ Schweflige Säure, Schwefelsäure, Salpetersäure, Kohlensäure: Saurer Regen, Steinfraß, Chemie am Bau + Hydratisierte Wasserstoffionen H (aq), BROENSTEDT Definition, Säurerestionen, auch Hydrogensalze Rückbezug Natronlauge, Kalilauge Hydratisierte Hydroxid-Ionen OH̄ (aq), Ammoniak NH3 nach BROENSTEDT Neutralisation: Anwendung der Titration Veranschaulichung der pH-Skala Verdünnungsreihen von Säuren und Laugen Energie Hydration, Hydrationsenergie (nur phänomenologisch) Exothermes und endothermes Lösen von Salzen Stoff-Teilchen Vielfalt der Kohlenstoffverbindungen qualitative Elementaranalyse (C, H, O, N, Halogen) Alkane aus Rohöl: Fraktionierte Destillation homologe Reihe der Alkane, Alkene, Alkine Lernort: Erdölmuseum Wietze Nomenklatur und Isomerie, Nachweis der C/C-Mehrfachbindung Tendenzen der Stoffeigenschaften, Van-der-Waals-Kräfte pH-Wert Lösen von Salzen in Wasser Chemie des Kohlenstoffs Organische Chemie I Titration von Haushaltsessig StrukturEigenschaften Organische Chemie II StrukturEigenschaften homologe Reihe der Alkanole Wasserstoffbrücken, Van–der-Waals-Kräfte Lernort: Brauerei Herrenhausen Suchtgefährdung, Alkohol und Fahrtüchtigkeit