10_ Zusatzstoffe-Additive
Werbung

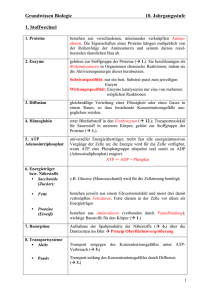
0.5 Zusatzstoffe, Additive, Prozesshilfsmittel Keine begrifflich klare Trennung der Bezeichnungen oft sind Zusätze von ihrer Wirkung her verschiedenen Klassen zuzuordnen. Auch muss zwischen Stoffen unterschieden werden, die gleich beim Compoundeur (Hersteller des Kunststoffkörpers) in den Kunststoff eingearbeitet werden. und den Zusätzen die der Kunststoffverarbeiter hinzufügt unterschieden werden. Auch hier sind die Grenzen zwischen Compoundeur und Verwender fließend. Einige wichtige Klassen sollen nachfolgend kurz betrachtet werden. 0.10.1. Antioxidantien Verschiedene Umwelteinflüsse (radioaktive Strahlung, UV-Strahlung, Chemikalien, Ozon) führen zu Brüchen in der Polymerkette. Die Bruchstellen tragen an ihren Enden äußerst reaktive Radikale (ungepaarte Elektronen), die mit Sauerstoff zu Peroxiden, Hydroxide, Carbonsäuren usw. reagieren und den Kunststoff in seiner Struktur zerstören (Korrosion). Die freien Radikale können durch so genannte primäre Antioxidantien (H-Donatoren, Radikalfänger) oder sekundäre Antioxidantien (Hydroperoxidzersetzer) abgefangen und weitgehend unschädlich gemacht werden. H-Donatoren sind Stoffe, die verhindern, dass die obigen Peroxiradikale sich Wasserstoffatome aus den Polymerketten herausreißen. Werden den Peroxiradikalen Wasserstofflieferanten angeboten bleiben die Polymerketten intakt. Chemisch sind solche Stoffe meist aromatische Amine oder Phenole. Aromatische Amine Phenole Die von diesen Stoffen aufgenommenen Radikale sind durch die Mesomeriestabilisierung der aromatischen Kerne bei Weitem energieärmer und weniger reaktionsfreudig. Handelsnamen sind Igranox™ (Ciba SC), Anox PP18™ (Great Lakes), Naugard™ (Uniroyal) oder Adekastab™ (Asahi Denka Co.). Hydroperoxidzersetzer reagieren mit den Peroxiden zu weniger reaktiven Verbindungen. Hier werden vornehmlich Phosphite und Phosphonite (Abkömmlinge der Phosphorsäure) und Thioether sowie Thioester in Verbindung mit H-Donatoren eingesetzt. Als stabile Reaktionsprodukte werden Alkohole gebildet. Auch hier ist das Wirkprinzip wie oben, es soll verhindert werden, dass die Peroxyradikale auf die Wasserstoffatome anderer Polymerketten losgehen. Radikalfänger greifen noch früher in den Prozess ein. Sie müssen reaktiver als der Sauerstoff sein und noch bevor es zur Ausbildung von Peroxiradikalen kommt mit den Alkylradikalen reagieren. Meist sind es ähnliche Verbindungen wie die H-Donatoren. 0.10.2. UV-Stabilisatoren UV-Strahlung mit Wellenlängen von 300 bis 400nm ist energiereich genug um chemische Bindungen zu spalten. Dabei werden wie eben besprochen Alkylradikale gebildet, die mit Sauerstoff zu Peroxiradikalen weiter reagieren. Der Wirkmechanismus ist hier aber ein anderer. UV-Stabilisatoren sollen nicht wie die Antioxidantien mit den entstandenen Reaktionsprodukten reagieren sondern sie sollen schon deren Entstehung verhindern. Es werden drei verschiedene Typen von UV-Stabilisatoren unterschieden: 1. UV-Absorber (Hydroxybenzophenon, Hydroxybenzotriazole, Zimtsäureester) 2. Sterisch gehinderte Amine als Radikalfänger (HALS: Hindered Amine Light Stabilizer) 3. UV-Quencher Die Wirkungsweise beruht ähnlich wie bei Sonnenschutzcremes auf einer abdeckenden und reflektierenden Wirkung (Zusätze von ZnO und TiO2). Ebenso kann eine zusätzliche Aufnahme von Strahlung durch dunkle Kunststoffe (Einarbeitung von Ruß in das Polymer) erreicht werden. Ein zweiter Effekt kann durch die Umwandlung der UV-Strahlung erreicht werden, diese Stoffe funktionieren ähnlich wie optische Aufheller oder Sonnenschutzmittel. Optische Aufheller sind chemische Verbindungen, die ultraviolette Strahlung absorbieren und die absorbierte Energie im blauvioletten Bereich wieder abgeben - sie fluoreszieren. Optische Aufheller werden verwendet, um Materialien wie z. B. Baumwolltextilien und Papier weißer erscheinen zu lassen. Zu den natürlichen Fluoreszenzfarbstoffen gehören z.B. Cumarin (im Waldmeister) und Aesculin (in Rosskastanien). Diese werden Waschmitteln in geringen Mengen zugesetzt und ziehen direkt auf die Faser auf. Die Wirkungsweise der optischen Aufheller unterscheidet sich vom traditionellen „Bläuen" der Wäsche. Beim Bläuen der Wäsche entsteht durch Zugabe geringer Mengen eines blauen Farbstoffs durch das „Auslöschen" der Komplementärfarbe Gelb und durch das zugegebene Blau ein heller Grauton.Die Wäsche ist genauso „dreckig“, wie vorher. Sonnenschutzmittel sollen die menschliche Haut schützen, indem sie schädigende UV-Strahlen absorbieren. Ein körpereigenes Sonnenschutzmittel ist die Urocansäure, die durch UV-Strahlung in die cis- Form umgewandelt wird. UV-Absorber oder Lichtfilter, z.B. Zimtsäureester (3-Phenyl-2-propensäureester), wandeln die UVStrahlung in Wärme um. Allen UV-Absorbern ist gemeinsam, dass ihre Moleküle Doppelbindungen enthalten. Sonnenschutzmittel auf natürlicher Basis sind u.a. Avocado-, Mandel-, Sesam-, Erdnuss- und Olivenöle. Die Sonnenschutzwirkung gegen UV a und UV b kann durch Abdeckstoffe wir Titanoxid und Zinkoxid noch verstärkt werden. Name Abkürzung Wellenlängenbereich in nm Nahes UV („Schwarzlicht“) UV-A 400−320 nm Mittleres UV (Dornostrahlung) UV-B 320−280 nm Fernes UV UV-c 280−180 nm Die Wirkung der UV-Stabilisatoren kann mit einem UVVIS-Spektrometer vermessen werden. Beachten Sie bitte, dass in der Abbildung die Transmission in % angegeben ist, im Praktikum messen Sie die Extinktion. Zunächst etwas Theorie zum Praktikum Spektroskopie: Sie werden die UV-VIS-Spektroskopie und die Infrarot-Spektroskopie (als FT-IR) kennenlernen. Es existiert eine Vielzahl von spektroskopischen Verfahren. Sie basieren auf Wechselwirkungen zwischen einem Analyt (Stoff der analysiert werden soll) und der elektromagnetischer Strahlung. - Radiowellen > 0,1 m - Mikrowellen 500 m < < 0,3 m Im Praktikum werden Sie die, für die praktischen Eigenschaften besonders wichtigen Bereiche vermessen. - Infrarot 800 nm < < 500 m - sichtbares Licht 400 nm < < 800 nm - UV 180 nm < < 400 nm Eine schöne Übersicht der praktisch genutzten Bereiche der elektromagnetischen Strahlung findet sich unter: http://www.drfreund.net/astronomy_spektrum.htm Der UV-Bereich liegt im Bereich von 180nm bis 400nm, daran schließt sich der VIS- Bereich zwischen 400 nm bis 800 nm an. 1nm entspricht 10-9 m. Das einfachste und durch die Entwicklung von Testkits für bestimmte Analyten verbreiteste Verfahren ist die Photometrie. Wie kann frau/man sich dieses Verfahren vorstellen? Schauen wir uns dazu den Aufbau solch eines Photometers etwas genauer an. Es gibt diese Geräte in den verschiedensten Ausführungen und Leistungsklassen. Laborgeräte Mobile Geräte Bausätze Quelle: www.uni-saarland.de www.medisport-lauf.de, www.koicarp.org.uk http://blog.makezine.com/archive/2009/03/more_on_building_sun_photometers.html Funktionsweise eines Photometers UV/VIS- Spektrometer Quelle: http://www.elhardt.de/matthias/chemie/photometer/Photometer.htm Die Küvetten sehen zum Beispiel so aus: Quelle: http://eurolab-medizintechnik.at/gfx/produkte/eurolyser/full/cuvetten.jpg Wir werden im Praktikum Folien oder Presslinge von feingemahlenen Kunststoffen mit KBr (Kaliumbromid) vermessen. Wie erfolgt die Messung? 1. Eine Lichtquelle erzeugt elektromagnetische Strahlung. 2. Aus dieser Strahlung wird eine ganz bestimmte Wellenlänge mit Hilfe eines drehbaren Prismas und einer Blende herausgefiltert. 3. Je nach Gerätetyp und Messaufgabe wird so bei nur einer Wellenlänge gemessen oder durch ein kontinuierliches Drehen des Prismas ein Scan über den gesamten Wellenlängenbereich durchgeführt. 4. Der Lichtstrahl hat so immer eine bekannte Wellenlänge und eine Anfangsintensität I0. 5. Der Analyt in der Probe wechselwirkt mit dem einfallenden Licht und es kommt zu einer Abschwächung des aus der Probe wieder austretenden Lichtstrahls. Der austretende Lichtstrahl hat jetzt die Intensität ID. 6. Ein Detektor misst die Intensität ID des austretenden Lichtstrahls. 7. Wichtig für die Messung sind die beiden Intensitäten des Lichtstrahls vor der Probe I0 und nach der Probe ID. Aus ihnen lässt sich die Konzentration des Analyten in der Probe bestimmen. Leider ist die Beziehung zwischen der Schwächung des Lichtstrahls und der Konzentration des Analyten in der Probe nicht linear. Etwas Theorie ist notwendig. Lambert – Beersche Gesetz Quelle: http://de.wikipedia.org/w/index.php?title=Datei:Beer_lambert.png&filetimestamp=20060129225701 Trifft ein Lichtstrahl der Intensität I 0 auf ein Medium, dann kann er durch die Absorption geschwächt werden. ID des austretenden Strahls ist dann: ID = I0 - IAbsorption oder differenziert dI = - α * I dx α beschreibt die analytspezifische Schwächung des Lichtes, α ist für jeden Stoff anders. 𝐼𝐷 𝑑𝐼 Außerdem gilt ∫𝐼 0 𝐼 𝑑 = − ∫0 𝑑𝑑 oder nach Integration ID = I0 * e-αd Das ist noch nichts für die tägliche Messung und eher von akademischem Interesse, wir wollen eine lineare Gleichung. Schauen wir auf ID = I0 * e-αd und stellen um 𝐼𝐷 𝐼0 = 𝑒 −𝛼𝑑 oder 𝐼 𝑙𝑛 𝐼𝐷 = −𝛼𝑑 𝑜 Da d die standardisierte Küvettenlänge (10 mm) oder die Dicke der Probe ist und sich während der Messung nicht ändert, ist die gesamte Schwächung des Lichtstrahls in α dem charakteristischen Absorptionskoeffizienten zusammengefasst. Hier können wir weiter vereinfachen: 1. Den natürlichen in den dekadischen Logarithmus umwandeln (Faktor 2,303) 2. α durch das besser handhabbare Produkt aus Stoffmengenkonzentration c und molarem dekadischen Extinktionskoeffizient ersetzen. So entsteht 𝐼 𝑙𝑔 𝐼𝐷 = − 𝜀 ∙ 𝑐 ∙ 𝑑 0 bzw. 𝐼 𝑙𝑔 𝐼 0 = 𝜀 ∙ 𝑐 ∙ 𝑑 𝐷 Das sieht nicht wirklich besser aus als das Obige hat aber einen entscheidenden Vorteil, es ist eine lineare Beziehung des Typs y = mx +b Schauen Sie her. Für den y-Wert der linearen Funktion wird die Kunstgröße Extinktion E eingeführt. 𝐸 = 𝑙𝑔 𝐼0 𝐼𝐷 = 𝜀∙𝑐∙𝑑 y = mx + b Die Extinktion E wird am Messgerät abgelesen, die Schichtdicke d bleibt konstant und wird 1 gesetzt. Es bleiben noch ε und c. c ist die Konzentration und entspricht x. Nun ε ist dann der Anstieg m und der wird durch Kalibration praktisch bestimmt. So, jetzt können wir die Wechselwirkungen von Zusätzen im Kunststoff mit UV- und sichtbarer Strahlung messen und deren Wirksamkeit zum Schutz des Kunststoffs, aber auch für die Anwendung (UVSchutz Sonnenbrillen) bestimmen. Einen weitergehenden Effekt gegenüber den Zusätzen für den UV-Schutz zeigen die HALS (HALS: Hindered Amine Light Stabilizer). Hals sind ziemlich komplex aufgebaute Verbindungen, die neben ihren UV-Eigenschaften auch als Radikalfänger wirken. Selbst ihre durch Radikale entstehenden Reaktionsprodukte wirken noch als Radikalfänger und haben so eine hervorragende Langzeitwirkung. Wegen der geringen Mengen, die zugesetzt werden müssen sind sie insbesondere für Folien geeignet, da bei höheren Konzentrationen es zu mechanischen oder chemischen Eigenschaftsänderungen des Kunststoffes kommen kann. 0.10.3. PVC-Stabilisatoren Einer der wichtigsten Massenkunststoffe ist das PVC. PVC sollte von der Stabilität seinen Bindungen her bis etwa 300°C stabil sein und die üblichen Verarbeitungstemperaturen von 170 – 200°C gut ertragen. Dem ist aber nicht so. Schon beim Compoundeur treten bei der radikalischen Polymerisation von Vinylchlorid Fehlbildungen in der Polymerkette des meist als Granulat angebotenen PVC auf. Diese irregulären Strukturen machen PVC anfällig für einen thermischen Abbau, durch Abspaltung von HCl (Dehydrochlorierung) und führen zur Gelbverfärbung bis hin zu braun. Die nachfolgenden PVC-Stabilisatoren werden in der Praxis eingesetzt. Die Wirksamkeit dieser Stoffe kann z.B. durch die Kongo-Rot-Methode (EN 60811) bestimmt werden. Siehe Praktikum Merseburg: Nachweis von sauren Dämpfen mittels pH-Papier. 0.10.4 Gleitmittel Bei den Gleitmitteln wird zwischen inneren Gleitmitteln, die die Viskosität des Kunststoffs verändern und äußeren Gleitmitteln die die viskoelastischen Eigenschaften des Kunststoffs verändern unterschieden. Stofflich sind diese Gleitmittel eng mit den Stoffen, die als Tenside oder Detergentien eingesetzt werden verwandt. Diese Stoffe haben einen unpolaren und einen polaren Molekülteil der je nach Polymer unterschiedliche Mischbarkeit hervorruft. Auch Entmischungsvorgänge während der Bearbeitung sind zu beobachten, was zum Teil erhebliche Probleme bereitet und zusätzliche Waschvorgänge vor dem nächsten Produktionsschritt initiiert. Solche Gleitmittel können auch zum dispergieren von Pigmente in Kunststoffen eingesetzt werden. Deshalb wollen wir uns diese Stoffe, die als Tenside, Detergenzien, Netzmittel, Gleitmittel oder auch als oberflächenaktive Substanzen bezeichneten Stoffe in ihrer universellen Anwendung etwas näher ansehen. Gut - die dem Kunststoff zugesetzten Stoffe lösen sich meist nicht in vollständig und verteilen sich nur mehr oder weniger fein im Kunststoff, es entsteht ein disperses System auch als kolloides System oder Kolloid bezeichnet. Disperse Systeme (kolloide Systeme, Kolloide) Systeme, die aus zwei oder mehreren nicht miteinander mischbaren Stoffen bestehen. Historisch bedingt sind die Begrifflichkeiten zum Teil problematisch. Dispergiermittel meist im Überschuss vorhandene Phase - geschlossene Phase - kontinuierliche Phase - äußere Phase Dispergierte Substanz in der anderen Phase verteilte Phase - disperse Phase - innere Phase betrachtet wird nur die Teilchengröße grobdisperse Systeme 10-3 – 10 -7 m typische kolloidale Lösungen 10 -7 – 10 -9 m Mikroemulsionen < 10 -9 m (äußerlich kein Unterschied zur echten Lösung) Sole Dispergiermittel Disperse Substanz Disperse Systeme Aerosole Gas Gas nicht realisierbar Gas Flüssigkeit Nebel Gas Feststoff Rauch Flüssigkeit Gas Schaum Flüssigkeit Flüssigkeit Emulsion Flüssigkeit Feststoff Suspension Feststoff Gas fester Schaum Feststoff Flüssigkeit feste Emulsion Feststoff Feststoff feste Dispersion Lyosole feste Sole Technisches Beispiel Emulsionen Disperse Systeme von zwei nicht oder nur wenig ineinander löslichen Flüssigkeiten Öl-in-Wasser-Emulsionen (O/W)-Emulsion Quelle:http://naturkosmetik-selbstgemacht.de/bilder/emulsion-ow-klein.jpg Quelle: http://www.dermaviduals.de/cms/upload/bilder/Publikationen/EmulMicroNano2.jpg Es geht aber auch umgekehrt. Wasser-in-Öl-Emulsionen (W/O)-Emulsion Quelle: http://naturkosmetik-selbstgemacht.de/bilder/emulsion-wo-klein.jpg Quelle: http://www.dermaviduals.de/cms/upload/bilder/Publikationen/EmulMicroNano2.jpg Es gibt auch Öl-in-Öl-Emulsionen (O/O)-Emulsionen und das Gegenstück (W/W)-Emulsionen. Emulsionen können stabilisiert und destabilisiert werden. Betrachten wir zunächst den Vorgang der Stabilisierung von Emulsionen Hier werden Tenside / Detergenzien so genannte oberflächenaktive Substanzen oder Emulgatoren eingesetzt. Quelle: http://upload.wikimedia.org/wikipedia/commons/thumb/d/d1/TensideHyrophilHydrophob.png/300px-TensideHyrophilHydrophob.png Roland.chem Original uploader was Roland.chem at de.wikipedia Je nach disperser Substanz und Dispergiermittel verhalten sich die Tensidmoleküle, an der Wasseroberfläche bilden sich monomolekulare Filme Quelle: http://www.knittelconsulting.com/das-hk-system/pix/schema.jpg Quelle: http://upload.wikimedia.org/wikipedia/commons/3/38/Oberfl%C3%A4chenschicht.svg Benutzer:Pfünder. Original uploader was Pfünder at de.wikipedia im Innern des Wassers Micellen. Quelle: http://upload.wikimedia.org/wikipedia/commons/e/e3/TensidOel.png Roland.chem Schäume bilden sich durch Lufteinschlüsse in Mizellen und sind Polyphasenemulsionen Luft-WasserLuft andere Polyphasenemulsionen W1/O/W2 -Emulsion O1/W/O2-Emulsion, Anwendung FlüssigMembran Permeationstechnik Quelle: http://upload.wikimedia.org/wikipedia/commons/2/23/Schaumbl%C3%A4schen.png Original uploader was Roland.chem at de.wikipedia Die Destabilisierung von Emulsionen wird als Koaleszenz bezeichnet, Idee ist das Zusammenfließen der dispergierten Teilchen und führt praktisch zum Entmischen der beiden Phasen. Quelle: http://upload.wikimedia.org/wikipedia/commons/1/10/Koaleszenz.svg Joël Gubler als Talos 21:28, 31. Mär. 2007 (CEST). Original uploader was Talos at de.wikipedia Für komplexere Vorgänge wird meist der Begriff Flockung oder auch Flokkulation verwendet. Idee ist das ein Sediment (Flocke) aus dem Dispersionsmittel ausgeschieden wird. Im übertragenden Sinne werden auch austretende Stoffe bei der Stahlherstellung als eine Art Flockung betrachtet. (Entschwefelung, Austritt von Wasserstoff) „Größere Werkstücke aus legiertem Stahl neigen zu einer unerwünschten Materialtrennung durch Ausscheiden von Wasserstoff aus fester Lösung bei verminderter Diffusionsfähigkeit. Die Flockung ist durch Vorwärmen der Zuschlagstoffe, durch Legierungszugaben und durch spezielle Umformungsprozesse mit verzögerter Abkühlung vermeidbar.“ Quelle: Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 424. Technisches Beispiel Suspension Disperse Systeme von einem nicht oder nur wenig in einer Flüssigkeiten löslichen Feststoff. Beispiel Schneidöle, Suspensionen aus Siliciumcarbid und Polyethylenglycol, die gleichzeitig abrasiv und kühlend wirken, Reinsilizium zu Wafern schneiden. Technisches Beispiel Bitumen ist ein dispersives bzw. kolloides System Dispergiermittel disperse Phase (die Micellen enthalten) Maltene (hochsiedende Öle) Erdölharze, Assoziation von hochmolekularer Erdölverbindungen enthalten basische Stickstoffverbindungen, kationenaktiv, Micellen wenige Nanometer Asphaltene, isoliert sind sie hart und spröde enthalten saure O- und S-Verbindungen, anionenaktiv, enthalten Salze, lassen sich durch Bitumenblasen aus Erdölharzen herstellen, Micellen bis etwa 30nm Die polaren Gruppen sind in das Innere der Micelle gerichtet, die Kohlenwasserstoffgruppen zeigen nach außen. Fließverhalten resultiert aus kolloidem Aufbau. Je mehr Ölbestandteile bei der Vakuumdestillation abgetrennt werden, umso höher wird die Konzentration der Erdölkolloide im Destillationsrückstand. Damit der Kolloidkonzentration die Wechselwirkungen zwischen den polaren Molekülen zunehmen, wird das Bitumen härter. Nadelpenetration (DIN EN 1426), Maß für die Härte von Bitumen, ist definiert als die Anzahl der Zehntelmillimeter, um die eine mit 100 g belastete Nadel bei 25°C in 5 Sekunden in das Bitumen eindringt. Quelle: http://www.arbit.de/alles-ueber-bitumen/pruefverfahren/ Destillationsbitumen werden nach ihrer Penetration bezeichnet: B 200 ist ein weiches Bitumen, B 25 ist ein hartes Bitumen. Bitumen zeigt thermoplastisches Verhalten. Beim Erwärmen wird es erst knetbar, dann zähflüssig und schließlich dünnflüssig. Erweichungspunkt Ring und Kugel (DIN EN 1427), ist die Temperatur, bei der eine Bitumenschicht unter genormten Bedingungen unter dem Gewicht einer Stahlkugel eine definierte Verformung erleidet. Quelle: http://www.arbit.de/alles-ueber-bitumen/pruefverfahren/ Oberhalb des Erweichungspunktes verhält sich Bitumen weitgehend wie eine Newtonsche Flüssigkeit. Die Temperaturabhängigkeit der Viskosität erhöht sich mit zunehmendem Gehalt an Erdölharzen. Die Abweichungen vom Newtonschen Verhalten vergrößern sich, wenn der Asphaltengehalt steigt und die Temperatur sinkt. Bitumen nimmt dann ein viskoelastisches Verhalten an, d. h. bei Einwirkung einer Schubspannung tritt nicht nur ein Fließen, sondern auch eine elastische Verformung auf. Das Verhältnis von viskosem zu elastischem Verformungsanteil ist zeitabhängig. Bei sehr kurzfristigen Belastungen, wie sie z. B. bei schnellem Straßenverkehr auf Asphalt einwirken, überwiegt der elastische Anteil. Bei Iängeren Belastungszeiten, wie sie z. B. für das Anfahren und Bremsen an Kreuzungen typisch sind, überwiegt der viskose Anteil, der zu bleibenden Verformungen führt. Brechpunkt nach Fraass (DIN EN 12593) beschreibt den Übergang des Bindemittels vom zähplastischen in den spröden Zustand und gibt diejenige Temperatur an, bei der eine auf einem Stahlblech aufgebrachte dünne Bitumenschicht bei gleichmäßiger Abkühlung bricht oder Risse bekommt. Quelle: http://www.arbit.de/alles-ueber-bitumen/pruefverfahren/ Haftungseigenschaften erhält Bitumen durch Erdölharze, die in reiner Form nahezu alle Festkörperoberflächen benetzen, wobei die Randwinkel kleiner als 10°C sind. Die Haftung an silicatischen Mineralstoffen wird durch die basischen Gruppen der Erdölharze begünstigt. Asphaltene zeigen extrem schlechtes Benetzungsverhalten. Als hydrophober Stoff, dessen Moleküle durch Dispersionskräfte oder schwache Richtkräfte zusammengehalten werden, wird Bitumen von Wasser oder wässrigen Lösungen von Salzen (z. B. Tausalze) und Säuren nicht gelöst. Unbeständig ist Bitumen gegenüber Mineralölen, Benzin und apolaren Lösemitteln. Hochkonzentrierte Schwefel- und Salpetersäure gehen Substitutionsreaktionen mit aromatischen Ringsystemen ein und greifen deshalb Bitumen an. Wie Funde zeigen, ist in Mesopotamien Bitumen bereits in prähistorischer Zeit zum Kleben, Abdichten und als Bindemittel für Mörtel verwendet worden. Der weitaus größte Teil der Bitumenproduktion wird heute zu Asphaltmischgut für den Straßenbau verarbeitet. Asphaltmischgut wird aus Mineralstoffen und Bitumen hergestellt, die dabei eine grenzflächenaktive Verbindung miteinander eingehen. Enthält das Mischgut noch Hohlräume, so dass es nach dem Einbau verdichtet werden muss, spricht man von Walzasphalt. Gussasphalt hat einen Bitumenüberschuss und ist hohlraumfrei. Bei der industriellen Verwendung von Bitumen steht die Herstellung von Dach- und Dichtungsbahnen an erster Stelle. Bitumenemulsionen werden durch intensives Mischen von Destillationsbitumen und Wasser in Gegenwart von Emulgatoren hergestellt: Brechen einer Bitumenemulsion an quarzhaltigem Gestein (NH3+______ kationischer Emulgator) Der Brechvorgang wird durch die Art des Emulgators sowie durch den Mineral- und Kornaufbau der Gesteine beeinflusst. Im Straßenbau werden Bitumenemulsionen vor allem für Oberflächenbehandlungen und Unterhaltungsarbeiten verwendet. 0.10.5 Prozesshilfmittel Diese Stoffe werden meist einer eigenen Klasse von Stoffen zugeordnet, die bestimmte Parameter während der Verarbeitung der Kunststoffe umfasst. Oft können diese Stoffe auch den eben besprochenen Klassen zugeordnet werden, nur liegt hier der Betrachtungswinkel auf der optimalen Verarbeitung der Kunststoffe zu Konsumprodukten. So lassen sich bestimmte negative Oberflächeneigenschaften (Haifischhaut) während der Verarbeitung (hier Extruder)vermeiden. Eingesetzt werden (A) Teflon- und (B) Siloxan-Abkömmlinge um die Oberflächen zu glätten, Anhaftungen an Düsen zu verhindern oder Gelbildung zu unterdrücken. 0.10.6 Antistatika Kunststoffe haben einen sehr hohen elektrischen Widerstand von bis zu 1016 und eine sehr geringe Dielektrizitätskonstante (besser sehr kleine Permittivität). Deshalb laden sie sich sehr gut elektrostatisch auf und verursachen so Probleme: schnelle Verschmutzung der Oberfläche (Monitor, Fernsehgeräte, Computer), kann aber auch genutzt werden für spezielle Anwendungen z.B. Swiffer ungewolltes Zusammenkleben von Folien durch Wärme oder Druck elektrische Schläge Explosionsgefahr Praktisch haben sich zwei Arten von Antistatika durchgesetzt, nicht leitende Antistatika und elektrisch leitende Antistatika. Nicht leitende Antistatika lassen sich als innere Antistatika in den Kunststoff einarbeiten oder werden auf die Oberfläche des Werkstücks als äußere Antistatika aufgebracht. Zusammen mit der Umgebungsfeuchte bilden sie, obwohl selber nicht leitend, elektrisch leitende Oberflächenfilme bzw. setzen den elektrischen Widerstand erheblich herab. Vornehmlich werden Tenside hierfür eingesetzt. In Weich-PVC meist Fettsäureester und ethoxylierte Amine und Alkohole. In PS und Hat-PVC meist Alkylsulfonate oder quartäre Amine. Leitende Antistatika werden ebenfalls als innere oder äußere Antistatika eingesetzt. der wichtigste dauerhaft wirkende Vertreter ist leitender Ruß. 0.10.7 Biozide Kunststoffe unterliegen einem natürlichen Abbau. Mikroorganismen haben bestimmte Anforderungen für ihr Wachstum. Kunststoffe erfüllen mehr oder weniger an ihren Eisatzorten diese Bedingungen und können als Substrat dienen. Die wichtigsten Biozide (ca. 70% ) stellen nach wie vor noch die äußerst giftigen aber preisgünstigen Arsenverbindungen des Typs OBPA dar. Obwohl in zunehmenden Maße auch Alternativen eingesetzt werden. Diese müssen aber bei gleicher Wirkung oft in erheblich größeren Mengen zugesetzt werden. Die Wirksamkeit der Biozide wird mit Bewuchsprüfungen nach EN ISO 846 „Bestimmung der Einwirkung von Mikroorganismen auf Kunststoffe“ geprüft. 0.10.8 Flammschutzmittel Flammen sind brennende Gase. Verbrennung ist eine Gasphasenoxidation, die als Kettenreaktion über Radikale abläuft. Wichtig ist das Luftverhältnis. Schauen wir und dazu den Ablauf einer Verbrennung an. a) Knallgasreaktion 2 H2 + O2 2 H2O Start: 𝐻2 → 𝐻 ∙ + 𝐻 ∙ Kette: 𝐻 ∙ + ∙ 𝑂 − 𝑂 ∙ → 𝐻𝑂 ∙ + ∙ 𝑂 ∙ ∙ 𝑂𝐻 + ∙ 𝑂𝐻 → ∙ 𝑂 ∙ + 𝐻2 𝑂 Abbruch: 𝐻 ∙ + ∙ 𝑂𝐻 → 𝐻2 𝑂 Die zunächst benötigte Zufuhr von Aktivierungsenergie fördert die Bildung von sehr reaktiven freien Radikalen (∙). Diese ungepaarten Elektronen reagieren mit so ziemlich allem, was in ihrer Reichweite ist. Eine besondere Rolle spielt der Sauerstoff bei der Verbrennung. Seine Moleküle sind Biradikale (∙ 𝑂 − 𝑂 ∙) und können deshalb die Kettenreaktion in gang halten und führen oftmals zu einer lawinenartigen Radikalvermehrung, die bis hin zur Explosion geht. Bei höheren Temperaturen können selbst Stoffe, wie der an sich reaktionsträge Stickstoff, mit Sauerstoff reagieren und die in der Technik unerwünschten Stickoxide bilden. b) Stickoxidbildung (NOx): > 1000 oC: ∙ 𝑂 ∙ + 𝑁2 → ∙ 𝑁𝑂 + ∙ 𝑁 ∙∙ ∙ 𝑁 ∙∙ + 𝑂2 → ∙ 𝑁𝑂 + ∙ 𝑂 ∙ < 650 oC: Warum ist das ein Problem? 2 𝑁𝑂 ∙ + 𝑂2 → 2 𝑁𝑂2 Viele thermische Prozesse haben bei höheren Temperaturen einen besseren Wirkungsgrad oder laufen schneller ab. Unsere Verbrennungsmotoren erreichen etwa 850°C. Höhere Temperaturen wären besser, sind aber wegen der Abgasproblematik nicht gewünscht. Denken Sie neben der Stickoxidbildung auch an das Boudouard-Gleichgewicht zwischen CO2 und CO, das bei höheren Temperaturen zum giftigen CO verschoben wird. CO2 + C ⇄ 2 CO Die in Automobilen eingesetzten Katalysatoren tun nichts anderes, als das Zuviel an Sauerstoff bei den Stickoxiden zu dem Zuwenig Sauerstoff beim Kohlenmonoxid zu transferieren. Verbrennungsreaktionen sind Gasphasenoxidationen, wie laufen denn Verbrennungen von Flüssigkeiten und Feststoffen ab? Bei diesen Stoffen muss erst die Erzeugung eines Brenngases vorgeschaltet werden, d. h. Flüssigkeiten und feste Brennstoffe müssen erst verdampft werden. Schauen wir uns dazu die Vorgänge bei einer Kerze an. Kerzen bestehen aus Paraffin (billige Erdölprodukte) oder in den teureren Varianten aus Stearin (Mischung verschiedener gereinigter Mineralfette) oder Bienenwachs (Bienenwaben). Diese Stoffe haben Schmelz- bzw. Erweichungspunkte von 40 – 65 °C. Quelle: http://de.wikipedia.org/wiki/Datei:Kerze_zonen.png In der Kerzenflamme erkennen wir vier Bereiche. Das geschmolzene Kerzen wachs steigt im Docht auf und wird im Bereich 1 verdampft. In Zone 2 herrscht eine hohe Konzentration an verdampftem Brennstoff, da aber kaum Sauerstoff vorhanden ist kommt die eigentliche Reaktion der Verbrennung nur wenig zum tragen und die Lichtausbeute ist gering. In Zone 3 werden die Kohlenstoffketten in Wasser- stoff und Kohlenstoff aufgespalten (Crackreaktionen) , die verglühenden Rußteilchen führen in Verbindung mit Natriumatomen dann zur eigentlichen Leuchten der Kerze. Der blaue Kerzensaum 4 ist mit etwa 1400°C der sauerstoffreichste und dadurch auch heißeste Teil der Flamme. Krackreaktionen (hier ß-Spaltung) H3C CH2 CH CH2 CH2 CH2 CH3 H H3C CH2 CH CH2 CH2 CH2 CH3 H3C CH2 CH CH2 ß-Spaltung CH2 CH3 Verbrennung von Kohlenwasserstoffen: CH4 + OH CH3 + H2O CH3 + O CH2O + H CH2O + OH CHO + H2O HO + O2 CO + HO2 CO + O CO2 + H Das Rußen der Kerzen hängt von ihren Rohstoffen ab. Ungesättigte Verbindungen haben ein ungünstiges Verhältnis zwischen Kohlenstoff und Wasserstoff. Für die Verbrennung von Kohlenstoff wird mehr Sauerstoff (1:2) als bei der Verbrennung von Wasserstoff (2:1) benötigt was zu einem Luftmangel und zur Rußbildung führt. 4H 2 CH3 CH3 - CH3 HC CH -nH Aromaten -mH Ruß Schauen wir uns dazu eine wichtige technische Größe für Verbrennungsreaktionen, das Luftverhältnis etwas näher an. 𝐿𝑢𝑓𝑡𝑣𝑒𝑟ℎä𝑙𝑡𝑛𝑖𝑠 𝜆 = 𝑉𝐿𝑢𝑓𝑡 𝑝𝑟𝑎𝑘𝑡𝑖𝑠𝑐ℎ 𝑉𝐿𝑢𝑓𝑡 𝑡ℎ𝑒𝑜𝑟𝑒𝑡𝑖𝑠𝑐ℎ vollständige Verbrennung Luftverhältnis > 1 Luftüberschuss C, H, O werden zu CO2 und H2O unvollständige Verbrennung Luftverhältnis < 1 Luftmangel C, H, O werden neben CO2 und H2O zu CO, H2, Aldehyden, Arenen u.a. oxidiert Die Menge an Luft (Sauerstoff) für die Verbrennung wird aus ihrer Reaktionsgleichung ermittelt. Mindestsauerstoffbedarf nach Reaktionsgleichung Normkubikmeter Sauerstoff pro Normkubikmeter Brenngas (Gasgesetze beachten!) Mindestluftbedarf = Mindestsauerstoffbedarf / 0,21 (da Luft ca. 21Vol.% O2 und 79Vol.% N2) Die gleichen Prozesse, wie beim Brennen einer Kerze führen bei Kunststoffen auch zu einer Pyrolyse, die sich meist durch die bei der Verbrennung der Gase entstehenden Strahlungswärme selbst erhält. Dieser Kreislauf kann in Prinzip auf zwei Arten unterbrochen werden, entweder wird die Diffusion brennbarer Gase durch ein Absenken der Temperatur des Kunststoffs vermindert oder das Eindringen der Strahlungswärme in den Kunststoff wird unterbunden. Dazu wurden vier unterschiedliche Flammschutzmitteltypen entwickelt: 1. Halogenverbindungen: Sie finden in vielen Kunststoffen Verwendung; häufig auch in Kombination mit Antimontrioxid (Sb2O3). 2. Metallhydroxide (Mg(OH)2 bzw. Al(OH)3) Sie finden aufgrund der geringen zulässigen Verarbeitungstemperatur vor allem in Polyolefinen (PE und PP) Anwendung. 3. Phosphorhaltige Flammschutzmittel: Ihr hauptsächlicher Einsatz ist in technischen Thermoplasten wie PC, PC/ABS oder PPE. 4. Intumeszenz-Flammschutzmittelsysteme Ihre Wirkung basiert auf der Ausbildung einer wärmeisolierenden Kohleschicht. Diese Systeme bestehen meist aus drei Komponenten: 1. einem „Kohle“-Spender meist sind das Polyalkohole 2. einem Säurespender, meist Ammoniumpholyphosphat und 3. einem Treibmittel zu Aufschäumen der Kohleschicht, meist ist dies Melamin. Viele Produkte unterliegen in Deutschland einer Brandprüfung, z.B. nach DIN 4102, die eine Einteilung der Baustoffe nach Klassen vorsieht. A1, A2 für nicht brennbare und B1 und B2 für brennbare Stoffe. 0.10.9 Weichmacher Weichmacher sind eine Art Füllstoffe, die den Abstand der Makromoleküle zueinander erhöhen und so die thermischen und mechanischen Eigenschaften von Kunststoffen verändern. Es lassen sich die Härte, die Dehnbarkeit und die Schlagfestigkeit von Kunststoffen gezielt verändern. Der Einsatzbereich von Weichmachern ist weit gefächert. Weichmacher werden für PVC (Hauteinsatzgebiet) meist in drei Kategorien eingeteilt: Primärweichmacher sind in jedem Verhältnis mit PVC mischbar. Der wichtigste Vertreter ist das mit etwa 75% die führende Phthalat Sekundärweichmacher sind nur begrenzt mit PVC mischbar und werden meist in Kombination mit Primärweichmachern eingesetzt. Wichtige Vertreter sind die Diester von höheren Dikarbonsäuren Diese Stoffe finden hauptsächlich in Folien Verwendung. Extender sind die dritte Gruppe von Weichmachern, die allerdings allein mit PVC unverträglich sind und generell nur mit primären Weichmachern eingesetzt werden. Als Chlorparaffine mit Chlorgehalten um die 50% kann gleichzeitig eine hohe Flammwidrigkeit erreicht werden. 0.10.10 Farbmittel Viele Farbmittel müssen nach rein praktischen Überlegungen ausgewählt werden und eine gewisse Stabilität und ein gutes Langzeitverhalte gegen über Umwelteinflüssen ausweisen. Pigmentum (lat. = Farbe) Oker (Steinzeit) Verwitterungsprodukt des Feldspats (ein Aluminiumsilkat) mit Einschlüssen von basischem, gelben Eisenoxid Umbra braunrot, nach Brennen Eisen und manganhaltige Erde (Zypern, Kleinasien) Eisenblau oder BB Fe4[Fe(CN)6]3 1704 technische Herstellung durch Malor Ultramarin Na8Al6Si6O24S2 ein blaues Natriumaluminiumsilikat für die Malerei Die Mineralfarben sind kristalline Verbindungen ohne Haftung auf dem Untergrund. Fixierung ist erforderlich, in Steinzeit, feuchte kalkhaltige Gesteine reagierten mit Pigmenten und fixierten, antike und mittelalter Freskomalerei al fresko (ital. = auf das Frische, auf frisch gekalkte Wände) Bindemittel Dextrine, Wasserglas, Mischungen aus Dextrinen mit Casein und Leinöl, später auch Baumharze von Nadelbäumen glänzen diese Schichten wird die Bezeichnung Lack gewählt, moderne Bindemittel sind synthetische Alkydharze und die wasserlöslichen Polyacrylharze „Acrylfarben“ Sonderstellung nehmen die Massefärbungen von Kunststoffen ein, wo die Pigmente direkt in die Masse des zu färbenden Kunststoffes eingearbeitet werden Kupfer- Phthalocyanien