PowerPoint
Werbung
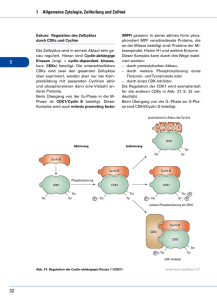
Zellzykluskontrolle und Tumorentstehung Katja Arndt, 29.11.2005 Eukaryotischer Zellzyklus Mitose und Cytokinese: Trennung der Chromatiden Teilung der Zelle G2 = gap (ca. 4 h) Wachstum, Kontrolle und Korrektur Apoptose (Zelltod) G1 = gap (mind. 9-12 h) Zellwachstum Entscheidung: Zellteilung G0 Phase Differenzierung zwei SchwesterChromatide S = DNA Synthese (7-10 h) Verdopplung der 46 Chromosomen K. Arndt, 11/2005 Kontrollstellen im Zellzyklus M-Restriktionspunkt G1-Restriktionspunkt Alle Chromosomen an Spindel angeheftet? Umgebung günstig? Verfügbarkeit von Substraten für Protein und DNA Synthese? G2-Restriktionspunkt DNA repliziert? Umgebung günstig? zwei SchwesterChromatide Apoptose (Zelltod) K. Arndt, 11/2005 Regulation durch Cycline und Cyclin-abhängige Kinasen Cyclin-dependent Kinase (CDK): • hoch konserviert. • phosphorylieren Proteine. • Aktivierung durch Cycline und Dephosphorylierung. • Deaktivierung durch CDKInhibitoren und Phosphorylierung. K. Arndt, 11/2005 Regulation des Zellzyklus Wachstumsfaktoren z.B. Plättchen-Wachstumsfaktor PDGF, Epidermaler Wachstumsfaktor EGF, Fibroblasten Wachstumsfaktor FGF, Insulinähnliche Wachstumsfaktoren IGF-I, IGF-II Rb: Rb E2F Retinoblastomprotein; "Ruhebringer“ Tumorsuppressor E2F: Transkriptionsfaktoren K. Arndt, 11/2005 Regulation des Zellzyklus Zerfall Kernlamina Reorganisation Cytoskelett Wachstumsfaktoren Rb E2F Cyclin B CDK1 P Cyclin A CDK1 P Rb Ubiquitinylierung Degradation P Wachstumsfaktor unabhängig ! DNA Synthese E2F Cyclin A CDK2 Stimulation Inhibition stimuliert Zellzyklus inhibiert Zellzyklus K. Arndt, 11/2005 Inhibitoren von Cyclin-CDKs CIP: CDK Inhibitor-Protein • P21 wichtig für Reaktion auf DNA Schäden • P27 hemmt G1-Cyclin/CDKs und reguliert damit G0 G1 Übergang – Immunmediator Interleukin-2 – Immunmediator TGF-β – Kontaktinhibitoren P27Zellteilung von Leukozyten P27Stopp von Virusvermehrung P27 Wachstumshinderung INK4: Inhibitor der CDK4 • P16 Tumorsuppressor • Viele Tumore zeigen zwei mutierte P16 Allele K. Arndt, 11/2005 Regulation des Zellzyklus Zerfall Kernlamina Reorganisation Cytoskelett Wachstumsfaktoren INK4 P16 Rb E2F Cyclin B CDK1 P Cyclin A CDK1 P CIP P21,P27 Rb Ubiquitinylierung Degradation P E2F DNA Synthese Cyclin A CDK2 Stimulation Inhibition stimuliert Zellzyklus inhibiert Zellzyklus K. Arndt, 11/2005 DNA Schaden P53 Tumorsuppressor, "Wächter des Genoms" • DNA Schaden bewirkt P53 vermittelten – Zellzyklus-Arrest: G1-S- und S-G2-Übergang (P21) – Einleitung der Apoptose (Zelltod) • Steuerung von P53 durch Konzentrationsänderung und Phosphorylierung. G1-Arrest P21 CIP Cyclin B CDK1 aktiv p53 Apoptose P21 CIP P16 INK Cyclin G2-Arrest Seneszenz CDK K. Arndt, 11/2005 Regulation des Zellzyklus Zerfall Kernlamina Reorganisation Cytoskelett Wachstumsfaktoren DNA Schäden INK4 P16 Rb E2F Cyclin B Ubiquitinylierung Degradation CDK1 p53 CDK1 P CIP P21,P27 Apoptose Rb P Cyclin A P E2F DNA Synthese Cyclin A CDK2 Stimulation Inhibition stimuliert Zellzyklus inhibiert Zellzyklus K. Arndt, 11/2005 Tumorsuppressor Gene — Proto-Onkogene Tumorsuppressor Gene Proto-Oncogene = alle Gene, die das Zellwachstum NEGATIV beeinflussen = alle Gene, die das Zellwachstum POSITIV beeinflussen. • • z.B. Rb, p53, P16 (INK) z.B. Ras, Cyclin D, CDK4 In Tumoren ist meistens eine der Komponenten des P16 – CyclinD/CDK4 - Rb Weges verändert. K. Arndt, 11/2005 Tumorsuppressor Gene — Proto-Onkogene Proto-oncogen: eine Mutation ist ausreichend. Tumorsuppressorgen: zwei Mutation sind nötig. K. Arndt, 11/2005 Retinoblastom Protein • Rb Protein normalerweise in hoher, konstanter Konzentration in Zellen • erbliche Vorbelastung: – Träger haben ein gesundes Allel und ein mutiertes Allel. – durch Defekt des gesunden Allels wird kein funktionales Rb Protein hergestellt. – tritt in der Regel bei Sinneszellen der Netzhaut auf: Retinoblastom. • Rb in mehr als 60% aller beim Menschen auftretenden Tumoren deletiert oder inaktiviert. normales Rb Gen Mutation am Rb locus K. Arndt, 11/2005 Entwicklung eines Darmtumors Tumor = unkontrolliertes Wachstum gutartiges (benignes) oder bösartiges (malignes) Wachstum K. Arndt, 11/2005 Erworbene Fähigkeiten bösartiger Tumore • Tumorzellen synthetisieren Wachstumsfaktoren • Wachstumsfaktor-Rezeptoren immer aktiv p53 Rb, TGF-β, CDK4 p53 Rb, p53, P16 (INK4), Ras Hanahan & Weinberg (2000). Cell 100, 57-70. K. Arndt, 11/2005 Tumortherapie • • • Chirurgische Entfernung des Tumors Strahlentherapie Chemotherapie – – – • • • DNA Schäden: z.B. Alkylantien, Platinanaloga, Antibiotika Mitosehemmer (pflanzliche Alkaloide) Anti-Metabolite (z.B. Purin-, Pyrimidinanaloga) Antikörper Kinasehemmer "Oncolytische Viren": z.B. Papillomavirus; großes T antigen von SV40 "Onkolytische Viren": vermehren sich nur in Zellen mit defektem Rb bzw. p53 K. Arndt, 11/2005 Zusammenfassung • Zellkontrollpunkte: G1, G2, M • Kontrolle über Cycline und Cyclin-abh. Kinasen (CDK) • weitere Kontrolle über CDK-Inhibitoren (CIP, INK) • Rb und p53 wirken als Tumorsuppressor und sind in den meisten Tumoren verändert (beide Allele). • Proto-Oncogene können durch Mutation oder veränderte Regulation zu Oncogenen werden (ein Allel). • Zur Entstehung maligner Tumore sind mehrere Ereignisse erforderlich, die eine autonome Vermehrung bewirken. • Chemotherapeutika greifen an verschiedenen Stellen im Zellzyklus ein. K. Arndt, 11/2005 Literatur Bücher: • Löffler & Petrides: Biochemie & Pathobiochemie, Springer Verlag, 7. Auflage, 2003. • Horn, et al.: Biochemie des Menschen, Thieme Verlag, 3. Auflage, 2005. • Alberts et al.: Molekularbiologie der Zelle, Wiley-VCH, 4. Auflage, 2003. (http://www.ncbi.nlm.nih.gov/books) • Lodish et al.: Molecular Cell Biology, W.H. Freeman & Co, 5. Auflage, 2004. (http://bcs.whfreeman.com/lodish5e/) • Campbell & Reece: Biology, Benjamin-Cummings, 7. Auflage, 2004. Artikel: • Insight "Cell Division and Cancer" (2004). in Nature 432:7015, 293-338. • Hanahan & Weinberg (2000). Cell 100, 57-70. Vorlesung: http://www.molbiotech.uni-freiburg.de/ka/lehre/dat/Zellzyklus_Tumor.ppt K. Arndt, 11/2005