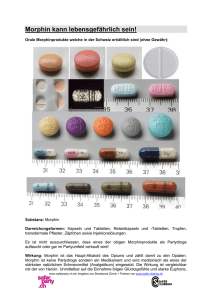
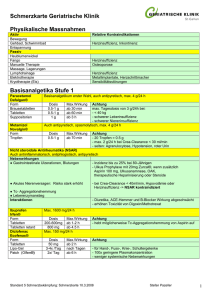
Document
Werbung
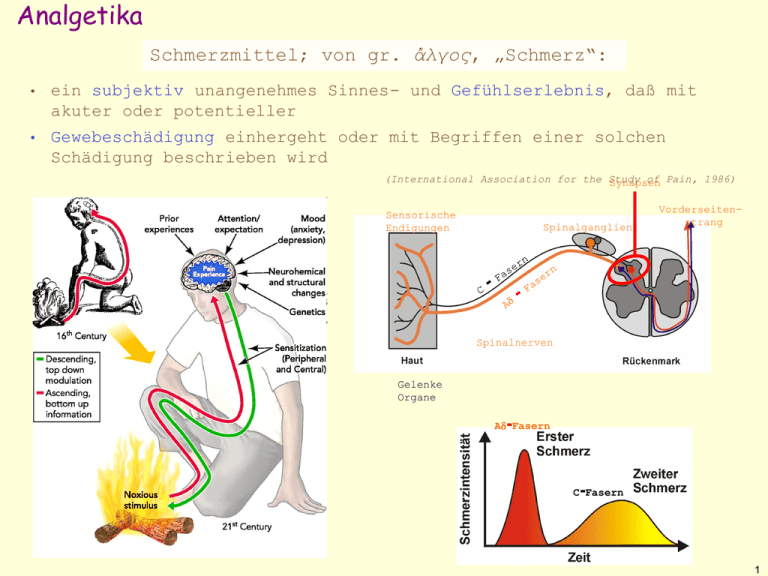
Analgetika Schmerzmittel; von gr. ἄλγος, „Schmerz“: • ein subjektiv unangenehmes Sinnes- und Gefühlserlebnis, daß mit akuter oder potentieller • Gewebeschädigung einhergeht oder mit Begriffen einer solchen Schädigung beschrieben wird (International Association for the Study of Pain, 1986) Synapsen Sensorische Endigungen Spinalganglien Vorderseitenstrang Spinalnerven Gelenke Organe - Ad Fasern - C Fasern 1 Die molekulare Mechanismen von Nozizeption Nozizeptoren umwandeln Schmerzreizen in ein depolarisierendes elektrisches Potential Spannungsabhängige und/oder ligandengestäuerte Ionenkanäle (Na+, K+, Ca2+) TRPV1 = transient receptor potential vanilloid receptor 1 (Isoformen TRPV1-6) DEG = Aktionspotential Degenerin Proteinfamilie ENaC = epithelial Na channel ASIC = acid-sensing ion channel (Isoformen ASIC 1-4) Rezeptorpotential TRPV1 P2X3R = purinergic rec. TRPV2 DEG / ENaC ASIC P2X3R TRPA1 2 „physiologische“ Schmerzen Schmerz autonome Reaktion Rückzugreflex Spontanschmerzen Schmerzsensibilisierung „pathologische“ Schmerzen Spontanschmerzen Schmerzsensibilisierung Spontanschmerzen Schmerzsensibilisierung 3 Deszendierendes anti-nozizeptives System • Ursprungskerne Periaquäduktales Grau Locus coeruleus (NA) Nucleus raphe magnus (5-HT) • Aktivierung inhibitorischen opioiderger Interneurone im Hinterhorn (Laminae I,II,V) • Freisetzung von endogenen Opioid-Peptide: • • Enkephaline 5AS (1975) • Endorphine 13-31AS (1979) • Dynorphine 17AS (1982) prä- und post-synaptische Hemmung nozizeptiver Synapsen 4 Opioide: Molekulare Wirkungen Opiate: Substanzen isoliert aus dem Extrakt des Schlafmohns (Opium): Morphin, Codein etc. Opioide: alle Substanzen, die eine agonistische oder antagonistische Wirkung an Opioidrezeptoren entfalten Zelluläre Wirkungen von Opioiden • Aktivierung von Rez.- Gi-Proteinen m,d,k-Opioidrezeptoren • Abnahme der Ca2+ -Leitfähigkeit Transmitterfreisetzung • Abnahme der cAMP-Produktion • Zunahme der K+-Leitfähigkeit Hyperpolarisation 5 Zentrale Wirkungen • Analgesie • • • hauptsächlich m-Rezeptoren auf spinaler (Tractusspinothalamicus) und supraspinaler Ebene (periaquäductales Grau, N. raphe magnus, L. coeruleus) Psyche Euphorie, Sedation, Indifferenz, Psychotomimetik, Dysphorie m-Agonisten: Freisetzung von Dopamin k-Agonisten: Hemmung der Dopaminfreisetzung (nigrostriatal) Hypothalamus Thermoregulation: leichter Abfall der Temperatur bei chronischer Gabe: leichte Temperaturerhöhung Neuroendokrinium Reduktion der GnRH- und CRH-Freisetzung Abfall von LH, FSH und ACTH 6 Zentrale Wirkungen • Miosis: Exzitation parasympatischer Kerne • Konvulsion: Auslösung von Krämpfen bei hohen Morphindosen, wahrscheinlich durch Hemmung GABA-erger Systeme • Atmung Reduktion der CO2-Ansprechbarkeit des Atemzentrums Atemfrequenz und Atemvolumen betroffen unabhängig von Sedierung bei Schmerz: Effekt reduziert, da Schmerz Atemzentrum aktiviert bei obstruktiven Lungenerkrankungen sowie Emphysem Vorsicht ! • Husten: Hemmung des Hustenzentrums in der Medulla oblongata • Erbrechen: Reizung der Area postrema der Medulla oblongata 7 Periphere Wirkungen • • Analgesie (über periphere Opioid-Rezeptoren) Histamin-Freisetzung • Herz-Kreislauf • Inhibition des Barozeptoren-Reflexes periphere Vasodilatation (Histaminfreisetzung) Gefahr ortho-statischer Reaktionen ausgeprägtere Effekte bei Herzkranken! Magen-Darmtrakt • Hautrötung, Urtikaria und Juckzeiz bei Asthmatikern: Bronchospasmen Magen: Verminderung der Motilität, Tonussteigerung Verlängerung der Passage, Reflux Dünndarm: Verminderung der Sekretion, Tonussteigerung, Spasmen Passageverlängerung, Eindickung des Inhalts Obstipation ! Dickdarm Verminderung der Motilität, Tonussteigerung des Analsphinkters, Hemmung des Defäkationsreflexes (ZNS-verstärkt) Obstipation ! Galle: Konstriktion des Sphincter oddi Gallenkolik Harnblase Tonussteigerung des Ureters, Hemmung des Miktionsreflexes Tonussteigerung des Sphincter urethrae Harnverhaltung 8 Therapeutischer Einsatz von Opioiden Indikationen Analgesie o Karzinomschmerz o postoperativer Schmerz trockener Reizhusten (Codein) Diarrhoe UAW bei Dauerschmerztherapie Obstipation (dosisabhängig) Übelkeit, Erbrechen (Früheffekt erste Wo.) 20% Sedierung (dosisabhängig, mit der Zeit ) Verwirrtheit, Halluzinationen 100% 20% 1-2% praktisch nie Atemdepression oder Abhängigkeit! Kontraindikationen E Lungenerkrankungen (pCO2) E Geburt (Plazentaschranke) E Schädelhirntraumen, Hypovolämie E Gallen- oder Nierenkolik 9 Einteilung der Opioid-Analgetika: partielle Agonisten reine Antagonisten Morphin (nat.) (1) Buprenorphin (30) Naloxon Codein (nat.) (0,2) Pentazocin (0,5) Methylnaltrexon reine Agonisten Heroin (nat.) (2,5) Dihydrocodein (halbsynthetisch) (0,2) Tilidin (0,1) Tramadol (0,1) schwache analgetische Potenz Pethidin (0,1) Methadon (2) Oxycodon (halbsynthetisch) (3) Hydromorphon hohe analgetische Potenz (halbsynthetisch) (7) Fentanyl (100) 10 Morphin (Btm) parenteral Einzeldosis 10 mg s.c., i.v. Bioverfügbarkeit oral 15 mg als Tropflsg. 30 mg als Retardtbl. 20 - 40% Wirkungsmaximum 60 min s.c., 20 min i.v. Plasma-HWZ 1,9 h etwas länger Wirkdauer 4–5 h,retard 8–12h Metabolismus 2–5 h M o r p h i n - 6- G l u c u r on i d ( a k t i v e r M e t a b o l it ) Elimination Morphin-3-Glucuronid (renal) Glucuronidspiegel höher 11 Heroin (Diacetylmorphin) Heroin (und Aspirin) beide synthetisiert von Adolph von Bayer (1800s) H 3C CO Heroin (Diacetylmorphin) H O O O O N H 3C CO CH3 O N H 3C CO C H3 O • penetriert die Bluthirnschranke schneller als Morphin • im Gehirn nach i.v. Applikation ins 6-Acetylmorphin metabolisiert “Kick” 12 Synthetische Opioide (Btm) - Agonisten Opioid Levomethadon relat. analg. Potenz 4 Dosis 2,5–5 mg oral, s.c., i.m. Wirkdauer Plasma HWZ 6 – 7 h 7,5 4-100mg oral 1-15 mg i.v. langsame Toleranzentwicklung 35±12 h Substitutionstherapie (92% BV) Hydromorphon Bemerkungen 3 -5 h 2-3h geringere Nebenwirkungen als Morphin (keine aktive 6-Glucuronid-Metabolite) (30-50% BV) Fentanyl Durogesic® 100 0,3-0,5 mg i.v. 20-30 min. Neuroleptanalgesie 2,5-10mg transdermal 72 h chronische Tumorschmerztherapie, HWZ 3,5 h Wirkungseintritt nach 12 h 13 partielle Agonisten (Btm) Opioid Buprenorphin relat. analg. Potenz 30-40 Dosis 0,3 mg Wirkdauer 6-8 h Bemerkungen partieller µ-Agonist, oral, s.l., i.m. k-Antagonist (BV< 20 %) geringeres Abhängigkeitspotenzial maximale analgetische Wirkung < Morphin stärkere Atemdepression, nur partiell Naloxon-reversibel Pentazocin 0,3 30-50 mg oral, i.m. (BV 20-40%) 2-3 h k-Agonist, µ-schwacher partieller Agonist stärkere Dysphorie (Angst, Alpträume, Halluzinationen-k) Tachykardie, Blutdruckanstieg geringeres Abhängigkeitspotenzial Entzugssymptome bei Abhängigen in D. nicht mehr im Handel 14 Schwache Opioidanalgetika (nicht Btm) relat. analg. Potenz Opioid Dosis 30-50 mg oral Codein Wirkdauer /HWZ 4-6 h 0,1 BV 40-60% 3-6 h Bemerkungen µ-Agonist, Prodrug (CYP2D6) Morphin (812%) Sedierung, Obstipation Hustendämpfung Tilidin + Naloxon 0,2 50 mg + 4 mg oral oral BV 6070% + 1-2% 3-5 h + 1 h Wirksubstanz: Nortilidin (µ-OR Agonist) keine Abhängigkeit dank Naloxonzusatz Sedierung 15 µ-Opioidagonisten mit hemmender Wirkung auf NA/5-HT-Wiederaufnahme Opioid Tramadol relat. analg. Potenz Dosis 0,1 25-100 mg oral, sc., i.v. BV 60-70% (nicht Btm) Tapentadol neu (Btm) Wirkdauer /HWZ 6-10 h 6 h 0,3 – 0,5 seit Mitte Sept. 4-6 h 2 x 50 (max. 2010 dem Markt: 500)auf mg/d BV ~ 30% 4 h Bemerkungen Metabolit O-Demethyl-Tramadol höhere µ-OR Affinität als Tramadol selbst keine Abhängigkeit geringer spasmogener Effekt geringe Atemdepression auch bei chronischen Schmerzen wirksam besser verträglich als Oxycodon, v.a. weniger Erbrechen, Übelkeit, Obstipation und Juckreiz häufige Nebenwirkungen: Schwindel, Benommenheit, Kopfschmerzen, Übelkeit (laut Fachinformation) teuer! (ca. 2 x Oxycodon, 5 x Morphin ret.) 16 Antagonist Naloxon HO O Wirkungen OH N CH 2 HO CH CH2 • Aufhebung der Akupunktur- und Opioid-Analgesie • kein Effekt auf Normalpersonen • Entzugssyndrom bei Opiatabhängigen Pharmakokinetik • Antagonist an allen Opioid-Rezeptoren • orale Bioverfügbarkeit 2%, Plasma-HWZ 1-2 h • Dosis: • postoperativ: 0,1–0,2 mg i.v. alle 2–3 min • Intoxikation: 0,4–2 mg i.v., i.m. oder s.c., ggf. wiederholt Anwendung • akute Opioidintoxikation • Diagnose einer Opioidabhängigkeit • Neugeborene: Aufhebung der Atemdepression nach mütterlicher Opioidmedikation • Kombipräparate für Prophylaxe: • Missbrauchprophylaxe: Valoron N (mit Tilidin) • Obstipationsprophylaxe: Targin (mit Oxycodon) 17 Opioid–Toleranz Toleranz: Abnehmende Wirkung nach wiederholter Gabe bei gleicher Dosis; bei Opioid-Toleranz v.a. pharmakodynamische Mechanismen, z.B.: • Rezeptorzahl ↓; • vermindertes Ansprechen nachgeordneter Signaltransduktionsvorgänge stark gegen: • Analgesie • Atemdepression • Erbrechen • Euphorie ggf. schon nach 1–2 Wo. wenig gegen Miosis, Obstipation nach Entzug, wieder volle Wirkung 18 Physische (körperliche) Abhängigkeit nach chronischer Einnahme: bei abruptem Absetzen Auftreten von Entzugssymptomen (meist vegetativer Natur) nach: 8–12 h: Tränen Schnupfen Gähnen „Morphinhunger“ (Craving) 12–14 h:unruhiger Schlaf 48–72 h: volle Ausprägung: Erregtheit, Schlaflosigkeit, Schwächegefühl, Erbrechen, Diarrhö, Tachykardie, Blutdruckanstieg, Kollaps, Frieren, Schwitzen („Cold turkey“), Muskel- und Knochenschmerzen (Dauer 7–10 d) 19 Psychische Abhängigkeit 1. Opioide aktivieren das dopaminerge Belohnungssystem (andere „Rewards“: Essen,Trinken, Sex) 2. „Morphinhunger“ (Craving): fehlende Aktivierung des Belohnungssystems dopaminerges Belohnungssystem Glutamat exzitatorisches Neuron Dopamin Rez. dopaminerges Neuron VTA GABAA Rez. NAc Belohnung m-Opioid Rez. GABA Neurone prä-synaptische GABA inhibitorisches Neuron Opioid Rez. (m, d?) Ventral Tegmental Area (VTA) GABA inhibitorisches Feedback Nucleus Accumbens (NAc) 20