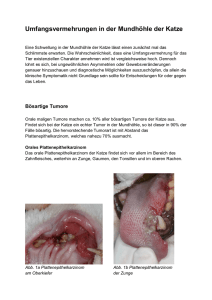
Kopf-Halskarzinome - TAKO | Tiroler Arbeitskreis für Onkologie
Werbung

Kopf-Halskarzinome Empfehlungen zu Diagnostik, Therapie und Nachsorgeuntersuchungen in Tirol Vorwort Kopf-Halstumore umfassen Neubildungen von der Lippe bis zum Eingang der Speiseröhre sowie Neubildungen der Nase und Nasennebenhöhlen, der Kopfspeicheldrüsen und der Haut von Kopf, Gesicht und Hals. Malignome der Schilddrüse werden in diesen Empfehlungen nicht behandelt. Bei den bösartigen Neubildungen der Kopf-Halsregion handelt sich ganz überwiegend um Karzinome. Diese sind Gegenstand der vorliegenden Empfehlungen zu Diagnostik, Therapie und Nachsorgeuntersuchungen in Tirol des Tiroler Arbeitskreises für Onkologie (TAKO). Den rechtlichen Rahmen für Diagnostik, Therapie und Nachsorge von Kopf-Halskarzinomen bilden neben zivil-, straf- und berufsrechtlichen Bestimmungen unter anderem das Krankenanstalten- und Kuranstaltengesetz, das Tiroler Krankenanstaltengesetz, die Vereinbarung zur Sicherstellung der Patientenrechte (Patientencharta), das Gesundheitsqualitätsgesetz, der Österreichische Strukturplan Gesundheit 2010 sowie der Rehabilitationsplan 2009 der GÖG. Der Österreichische Strukturplan Gesundheit (ÖSG) enthält Empfehlungen zur abgestuften integrierten Versorgung mit speziellen Strukturen auf ambulanter und stationärer Ebene mit dem Ziel einer flächendeckenden Verbesserung der onkologischen Versorgung unter Einbeziehung der gesamten Behandlungskette von der Früherkennung über die Diagnostik und Behandlung bis hin zur Nachsorge mit messbaren Ergebnissen. Im intramuralen Bereich unterscheidet der ÖSG zwischen onkologischem Referenz­zentrum (ONKZ), onkologischem Schwerpunkt (ONKS) und assoziier­­ter onkologischer Versorgung (ONKA). Kennzeichen von ONKZ und ONKS ist u.a. die Vorhaltung aller im interdisziplinären Team (Tumorboard) vorgesehenen Fachbereiche sowie weiterer zuständiger Sonderfächer und die Sicherstellung der Radioonkologie in räumlicher Nähe. Aufgaben der ONKA umfassen die Erbringung von Therapie und Übernahme weiterer Leistungen in Abstimmung mit kooperierenden ONKZ und/oder ONKS sowie Notfall­versorgung. Dies erfolgt in Kooperation mit dem ONKZ und/oder dem ONKS und dem jeweiligen Tumorboard. Im extramuralen Bereich sieht der ÖSG die Aufgaben primär bei Früherkennung, Diagnostik, Nachsorge sowie supportiver Therapie. Kern der Versorgung in einem ONKZ und ONKS ist ein interdisziplinäres Tumorboard, dem neben dem Organfach Vertreter der Inneren Medizin/ Hämato-Onkologie, der Radiodiagnostik, der Radioonkologie und der Pathologie unter Gleichberechtigung der beteiligten Fachrichtungen angehören. Im Tumorboard ist jede Person mit einer malignen Neuerkrankung Kopf-Halskarzinome Vorwort 3 anzumelden. Dabei ist jene Abteilung zunächst zuständig (Case manager), die den Patienten dem Tumorboard vorstellt. Das Tumorboard stellt zunächst das verbindliche TNM-Stadium fest und erstellt oder ändert vorhandene Behandlungsvorschläge. Es besteht Dokumentationspflicht. Schilddrüsenkarzinome werden in diesen Empfehlungen nicht abgehandelt Für den intra- und extramuralen Bereich soll mit den vorliegenden Empfehlungen das rasch wachsende Wissen auf dem Gebiet der Kopf-Hals Onkologie zusammengefasst, bewertet und unter Berücksichtigung der hoch entwickelten medizinischen Infrastruktur allen onkologisch tätigen Ärzten in Tirol angeboten werden. Für die Erstellung dieser Empfehlungen wurden eine Reihe von Empfehlungen und Leitlinien unter anderem der European Society for Medical Oncology (1), der Österreichischen Gesellschaft für Chirurgische Onkologie (2), der Deutschen Krebsgesellschaft (3), der Arbeitsgruppe für Hals- und Gesichtschirurgie der Schweizerischen Gesellschaft für ORL, Hals- und Gesichtschirurgie, des National Cancer Institute der USA (4) sowie die Practice Guidelines des National Comprehensive Cancer Networks der USA (5) berücksichtigt. Neben diesen Leitlinien wurden Review- Artikel aus Core-Journalen herangezogen (1;6). Für Patienten mit fortgeschrittenem Tumorstadium liegen zwei umfangreiche prospektive Untersuchungen der Eastern Cooperative Oncology Group (ECOG) und der European Organisation for Research and Treatment of Cancer (EORTC) zur postoperativen Radio- und Radiochemotherapie vor, die erheblichen Einfluss auf die Therapie von PatientenInnen mit Kopf-Halskarzinomen genommen haben (7-9). Ich möchte mich bei allen Autoren für die ausgezeichnete Zusammenarbeit bei der Erstellung dieser TAKO-Empfehlungen, aber auch im klinischen Alltag und bei gemeinsamen wissenschaftlichen Projekten bedanken. Univ.-Prof. Dr. Herbert Riechelmann Leitung und Koordination 4 Kopf-Halskarzinome Vorwort TAKO Vorstand und Mitwirkende TAKO Vorstand Univ.-Prof. DI Dr. Peter Lukas Strahlentherapie-Radioonkologie, Innsbruck Prim. Univ.-Prof. Dr. med. Klaus Gattringer Univ.-Prof. Dr. Günther Gastl Innere Medizin, Kufstein Hämatologie & Onkologie, Innsbruck Prim. Univ.-Doz. Dr. Ewald Wöll Innere Medizin, Zams ao. Univ.-Prof. Dr. Wolfgang Eisterer Innere Medizin, Innsbruck ao. Univ.-Prof. Dr. Reinhard Stauder Hämatologie & Onkologie, Innsbruck Univ.-Doz. Dr. Eberhard Gunsilius Hämatologie & Onkologie, Innsbruck Dr. Stefan Kastner Ärztekammer Tirol Obmann 1. Obmann-Stv. 2. Obmann-Stv. Schriftführer 1. Schriftführer-Stv. 2. Schriftführer-Stv. Kassier Ärztekammervertreter Mitwirkende in der Arbeitsgruppe Kopf-Halskarzinome Dr. Ulrike Beier Dr. Silvia Brunold Zahnersatz und Zahnerhaltung, Innsbruck Mund-, Kiefer- und Gesichtschirurgie, Innsbruck Doz. Dr. Michael Fiegl Hämatologie & Onkologie, Innsbruck Dr. Oliver Galvan HNO, Innsbruck Prim. Dr. Paul Goller Lisa-Maria Griesser HNO, Brixen Hör-, Stimm- und Sprachstörungen, Innsbruck Prof. Dr. Ingrid Grunert Doz. Dr. Frank Kloss Zahnersatz und Zahnerhaltung, Innsbruck Mund-, Kiefer- und Gesichtschirurgie, Innsbruck Andrea Kofler HNO, Innsbruck Julia Lobenwein HNO, Innsbruck Dr. Susanne Maislinger Medizinische Psychologie, Innsbruck Prof. Dr. Hans Maier Pathologie, Innsbruck Dr. Roland Moschen Medizinische Psychologie, Innsbruck Dr. Wilhelm Oberaigner Klinische Epidemiologie, Innsbruck Primar Dr. Peter Ostertag HNO, Kufstein Dr. Georg Pall Innere Medizin, Onkologie, Innsbruck Prof. Dr. Gerhard Pierer Plastische, Rekonstruktive und Ästhetische Chirurgie, Innsbruck Dr. Andrea Posch Prof. Dr. Michael Rasse Strahlentherapie-Radioonkologie, Innsbruck Mund-, Kiefer- und Gesichtschirurgie, Innsbruck Prof. Dr. Thomas Rettenbacher Dr. Ursula Riccabona Radiologie, Innsbruck Anästhesie und Intensivmedizin, Innsbruck Prof. Dr. Herbert Riechelmann HNO, Innsbruck Koordinator Dr. Ulrich Rieger Plastische, Rekonstruktive und Ästhetische Chirurgie, Innsbruck Dr. Markus Rungger Prof. Dr. Matthias Schmuth Hör-, Stimm- und Sprachstörungen, Innsbruck Dermatologie und Venerologie, Innsbruck Kopf-Halskarzinome TAKO Vorstand und Mitwirkende 5 Prof. Dr. Hans-Ulrich Strohmenger Anästhesie und Intensivmedizin, Innsbruck Dr. Arpad Sztankay Strahlentherapie-Radioonkologie, Innsbruck Dr. Hagen Thomas Hör-, Stimm- und Sprachstörungen, Innsbruck Dr. Christian Uprimny Nuklearmedizin, Innsbruck Prof. Dr. Irene Virgolini Nuklearmedizin, Innsbruck Doz. Dr. Gerlig Widmann Radiologie, Innsbruck Prim. Doz. Dr. Ewald Wöll Internistische Onkologie, Zams OA Dr. August Zabernigg Internistische Onkologie, Kufstein Prof. Dr. Patrick Zorowka Hör-, Stimm- und Sprachstörungen, Innsbruck Satz, Gestaltung und Version Dr. Eugen Preuß Version 1.0 Copyright: pdl 2011 6 Kopf-Halskarzinome TAKO Vorstand und Mitwirkende pdl, Innsbruck Inhaltsverzeichnis 1 Epidemiologie 1.1 Epidemiologische Daten in Tirol 1.2 Das Tumorregister des IET 1.3 Früherkennung und Prävention 13 15 16 1.3.1 Populations-basiertes Screening (Massenscreening) 1.3.3 Speichel-Screening 17 18 2 Ätiologie und Histopathologie 19 2.1 Ätiologie 2.2 Pathogenese 2.2.1 Genetisches Progressionsmodell 2.2.2 Tumorstammzellen 2.2.3 Tumorimmunologie 2.2.4 Tumorprogression 2.2.5 Prognosefaktoren 2.3 Histopathologie 2.3.1 Dysplasien, Carcinoma in situ, intraepitheliale Neoplasie 2.3.2 Plattenepithelkarzinome 2.3.3 Adenokarzinome 2.3.4 Maligne Speicheldrüsentumore 2.3.5 Andere Malignome 2.4 Häufige Lokalisation von Metastasen von Kopf-Hals-Tumoren 2.5 Bearbeitungsempfehlungen Pathologen 3 Tumor-Lokalisationen und Stadieneinteilungen 3.1 Tumor-Lokalisationen und T-Stadien nach UICC 2010 1.3.2 Selektives (inzidentes risikoorientiertes) Screening 20 21 22 24 27 29 3.1.1 Lippen 3.1.2 Mundhöhle 3.1.3 Oropharynx 3.1.4 Nasopharynx 3.1.5 Hypopharynx 3.1.6 Larynx 3.1.7 Nasenhöhle und Nasennebenhöhlen 3.1.8 Speicheldrüsen 3.1.9 Kopf- und Gesichtshaut 3.2 N-Stadien 30 31 32 33 34 36 37 38 39 3.2.1 N-Stadien außer Nasenrachen und Haut 3.2.2 N-Stadien Nasenrachen 3.2.3 N-Stadien Karzinome der Haut 40 Kopf-Halskarzinome Inhaltsverzeichnis 7 40 41 3.3 M-Stadien 3.4 UICC-Stadiengruppierung 3.4.1 UICC-Stadiengruppierung außer Nasenrachen und Haut 3.4.2 UICC-Stadiengruppierung Nasenrachenkarzinom 42 43 3.4.3 UICC-Stadiengruppierung Haut 3.5 R-Status (Residualtumor) 3.6 Fakultative Deskriptoren 3.6.1 Lymphgefäßinvasion 3.6.2 Veneninvasion 3.6.3 Perineurale Invasion (ab 2010) 3.7 44 Abgeleitete und andere Klassifikationschemata 3.7.1 Lokal begrenzt (limited), lokoregionär fortgeschritten (advanced) und rezidiviert oder metastatisch (recurrent or metastatic) 3.7.2 Klassifikation nach Prognose des AJCC Cancer Staging Manual 3.7.3 Klassifikation der Arbeitsgemeinschaft deutscher Tumorregister 45 3.8 Ersterkrankung, Rezidiv, Zweittumor 46 4 Diagnostisches Vorgehen 4.1 Diagnoseverzögerung 4.2 Komorbidität und Performance Status 4.3 Klinische Untersuchung 4.4 Bildgebende Verfahren 47 48 49 4.4.1 Halssonographie 4.4.2 Computertomographie Kopf-Hals 50 4.4.3 Computertomographie Thorax 4.4.4 Kernspintomographie 51 4.5 Sicherer Umgang mit CT, MR und US Kontrastmittel 4.6 Nuklearmedizinische Diagnostik 4.6.1 PET/CT 53 4.6.2 Knochenszintigraphie 4.7 Panendoskopie in Narkose 54 55 4.8 Sentinel-Lymphknotenbiopsie 4.9 Abklärung bei Verdacht auf Halslymphknotenmetastase bei 56 4.10 unbekanntem Primärtumor (CUP Syndrom) Zahnärztliche Diagnostik und Planung der dentalen Rehabilitation 4.10.1 Maßnahmen prä radiationem 57 58 4.10.2 Maßnahmen intra radiationem 4.11 Erheben des Ernährungsstatus, Ernährungstherapie, Perkutane endos­ko­pische Gastrostomie 8 Kopf-Halskarzinome Inhaltsverzeichnis 4.12 Diagnostik von Hören, Stimme, Sprechen, Schlucken 60 4.12.1 Erstuntersuchung 4.12.2 Stimmlosigkeit und Stimmersatz 61 4.12.3 Besonderheiten bei einzelnen Tumorlokalisationen 4.12.4 Chemotherapie/Radiochemotherapie 62 4.12.5 Zusammenfassung 5 Therapie 5.1 Therapiegrundsätze bei Erstdiagnose 5.2 Chirurgische Therapie 5.2.1 Indikation zur chirurgischen Therapie – Resektabilität und 64 65 Operationsrisiko 5.2.2 Empfohlene chirurgische Verfahren unter kurativem Ansatz 66 aufgeschlüsselt nach Tumorlokalisation 5.2.3 Prinzipien der chirurgischen Therapie des Halses 5.2.4 Präoperative anästhesiologische Untersuchung und gemeinsame 71 74 perioperative Planung 5.2.5 Indikation zur präliminaren Tracheotomie bei Kopf-Hals Eingriffen 75 5.2.6 Palliative chirurgische Verfahren 5.2.7 Empfehlung zur perioperativen Ernährung bei ausgedehnten tumorchirurgischen Eingriffen der Kopf-Halsregion 5.3 Radiotherapie, Radiochemotherapie und Radioimmuntherapie 77 5.3.1 Radiotherapie 5.3.2 Radiochemotherapie (RCT) 5.3.3 Radioimmuntherapie 5.4 Systemische Therapie 79 81 82 5.4.1 Palliative systemische Therapie 5.4.2 Präoperative neoadjuvante Chemotherapie bei Erstbehandlung 83 fortgeschrittener Tumorstadien 5.4.3 Induktionschemotherapie vor kombinierter Radiochemotherapie bei 84 Erstbehandlung fortgeschrittener Tumorstadien 5.5 Feststellung des Remissionsstatus 5.6 Phase I Rehabilitation 5.7 Therapiegrundsätze bei Rezidiv, Tumorpersistenz oder 85 Fernmetastasierung Kopf-Halskarzinome Untertitel 9 86 87 6 Nachsorge und Rehabilitation 6.1 Nachsorgeuntersuchungen 6.1.1 Erkennung von Rezidiven oder persistierender Tumorerkrankung 6.1.2 Erkrankungsfolgen 88 6.1.3 Laboruntersuchungen 6.1.4 Ernährung, Körpergewicht, Leistungsfähigkeit 6.1.5 Dentale Nachsorge 89 90 6.1.6 Sozialmedizinische Betreuung in der Nachsorge 6.2 Phase II Rehabilitation 6.2.1 Geeigneter Zeitpunkt und Dauer für Phase II Rehabilitation 91 10 6.2.2 Erforderliches Behandlungsangebot 6.3 Ambulantes Behandlungsangebot und Home-Care 92 6.4 Selbsthilfegruppen 93 7 Psychosoziale Aspekte und Psychoonkologie 7.1 Begriffsdefinition „Psychoonkologie“ 7.2 Grundprinzipien der psychoonkologischen Versorgung 94 96 7.3 Psychoonkologische Versorgungskonzepte und Interventionen 7.4 Behandlungsbedarf und Indikationsstellung in der Psychoonkologie 97 8 Literaturverweise Kopf-Halskarzinome Untertitel Abkürzungen AHB Anschlussheilbehandlung AJCC American Joint Committee on Cancer ASA American Association of Anesthsiologists CDDP Cis-Diaminodichloroplatin (Cisplatin) CR Vollständiges Ansprechen (complete response) Abkürzungen CUP Carcinoma of unknown primary DCO Death Certificate Only ECOG Eastern Cooperative Oncology Group EE enterale Ernährung EORTC European Organisation for Research and Treatment of Cancer GÖG Gesundheit Österreich GmbH HPV Humane Papillomaviren IET Institut für klinische Epidemiologie der TILAK KHT Kopf-Hals-Tumorboard mRND modifiziert radikale Halslymphknotendissektion NC Keine Veränderung (no change) ONKA assoziierte onkologische Versorgung ONKS onkologischer Schwerpunkt ONKZ onkologisches Referenzzentrum ORL Oto-Rhino-Laryngologie ÖSG Österreichischer Strukturplan Gesundheit PD Progressive Erkrankung (progressive disease) PE parenterale Ernährung PR Partielles Ansprechen (partial response) RCT Radiochemotherapie RND radikale Halslymphknotendissektion SL Sentinel Lymphknoten SLB Sentinel-Lymphknotenbiopsie SND selektive Halslymphknotendissektion TAKO Tiroler Arbeitskreis für Onkologie TILAK Tiroler Landeskrankenanstalten GmbH TIVA Total intravenöse Anästhesie UICC Union for International Cancer Control Kopf-Halskarzinome Abkürzungen 11 1 Epidemiologie Der Kopf-Hals-Region werden der ICD-O3 folgend Malignome der Regionen Lippen und Mundhöhle, Pharynx, Larynx, Nasenhöhle und Nasennebenhöhlen, Große Speicheldrüsen und Schilddrüse zugerechnet. Weltweit erkranken pro Jahr um die 310.000 Frauen und 800.000 Männer und versterben 210.000 Frauen und 500.000 Männer an einem Karzinom im HNO-Bereich. Damit liegen die Karzinome im HNO-Bereich weltweit in der Häufigkeit der Tumorgruppen an vierter Stelle. Die altersstandardisierte Rate (pro 100.000) ist bei den Frauen in Westeuropa mit 7 deutlich niedriger Karzinome im HNO-Bereich weltweit an vierter Stelle als in den weniger entwickelten Ländern (mit 12) und bei den Männern mit 37 etwas höher als in den weniger entwickelten Ländern (mit 30). In allen Regionen erkranken etwa drei Mal so viele Männer wie Frauen an einem Karzinom im HNO-Bereich. Das individuelle Risiko bis zum Alter 74 an einem HNO-Karzinom zu erkranken, liegt bei den Frauen bei 0.7% und bei den Männern bei 2.4%. 1.1 Epidemiologische Daten in Tirol In Tirol erkranken pro Jahr um die 140 Patienten (ca. 40 Frauen und 100 Männer) an einem Karzinom im HNO-Bereich, damit hat diese Karzinom­ gruppe einen Anteil von 4% an allen neudiagnostizierten bösartigen Erkrankungen und liegt an der siebten Stelle der Häufigkeit (10). Bezüglich der Krebsmortalität liegen die Karzinome im HNO-Bereich mit etwa 45 Todes­ In Tirol erkranken pro Jahr um die 140 Patienten an einem Karzinom im HNO-Bereich fällen (ca. 10 Frauen und 35 Männer) pro Jahr und einem Anteil von 3% an der zehnten Stelle in der Häufigkeit der Krebstodesfälle. Das Verhältnis von Frauen zu Männern ist in Tirol 1:3. Den größten Anteil nehmen die Larynxkarzinome ein (27%), gefolgt von Tonsillen (8%), Mundboden (7%), restliche Mundhöhle, Hypopharynx, rest­ Abbildung 1: Vergleich Inzidenz- und Mortalitätsrate HNO außer Larynx mit EU-Ländern (altersstandardisierte Rate pro 100 000, rot: bei Frauen; blau: bei Männern ) Kopf-Halskarzinome Epidemiologie 13 Abbildung 2: Zeitliche Entwicklung altersstandardisierte Rate HNO (außer Larynx) in Tirol (pro 100 000); 3-Jahres-Glättung licher Oropharynx und Lippen mit jeweils 6%. Im Vergleich zu den EU-Ländern liegen die altersstandardisierten Raten der Karzinome im HNO-Bereich ohne Larynx in Tirol bei den Frauen deutlich über dem EU-Durchschnitt (Inzidenz und Mortalität) und bei den Männern im EU-Durchschnitt (s. Abbildung 1), die Larynxkarzinome bei den Männern liegen unter dem EU-Durchschnitt. Knapp 1000 TirolerInnen haben ein Kopf-Halskarzinom (Prävalenz) Das durchschnittliche Alter bei Diagnose liegt bei 63 Jahren, 10% der weiblichen und 15% der männlichen Patienten sind jünger als 50. Die Anzahl der prävalenten Karzinome im HNO-Bereich beträgt in Tirol um die 250 Frauen und 700 Männer. Diese Schätzungen sind im Wesentlichen konsistent mit Prävalenzschätzung der Statistik Austria. Die altersstandardisierte Inzidenzrate der Karzinomen im HNO-Bereich ohne Larynx zeigt bei den Frauen im letzten Jahrzehnt eine Zunahme der Inzidenz und Mortalität um 3% pro Jahr und bei den Männern ebenfalls eine Zunahme von 1% pro Jahr (jeweils statistisch signifikant, siehe Abbildung 2). Die Inzidenz der Larynxkarzinome hat bei den Männern 3% pro Jahr statistisch 14 signifikant abgenommen. Die regionale Verteilung auf Bezirksebene zeigt Kopf-Halskarzinome Epidemiologie bei einigen Schwankungen keine statistisch signifikant erhöhten oder erniedrigten Raten im Vergleich zum Landesdurchschnitt. Das relative Fünfjahresüberleben der Karzinome im HNO-Bereich ohne Larynx liegt bei den Frauen bei 65% und ist fast identisch zu den Vergleichsdaten aus den USA und bei den Männern mit 50% statistisch signifikant schlechter als die Vergleichsdaten aus den USA mit 60%. Bei den Larynxkarzinomen beobachten wir in Tirol ein relatives Fünfjahresüberleben von 70% (besser als Das relative Fünfjahresüberleben liegt bei ca. 55% die Vergleichsdaten aus den USA mit 60%, aber nicht statistisch signifikant). Diese Überlebensdaten beruhen auf den Diagnosejahren 2001-2005 (wegen der fünfjährigen Nachbeobachtung bis 2010). In der Eurocare-4-Studie wurde basierend auf den Daten 1995-99 bei den Karzinomen im HNO-Bereich für Österreich ein relatives Fünfjahresüberleben von 37% berechnet, das unter dem EU-Durchschnitt mit 39% lag und bei den Larynxkarzinome ein relatives Fünfjahresüberleben von 63% und damit identisch mit dem EU-Durchschnitt. Die seit 2008 erhobenen 1-Jahresüberlebensraten liegen über dem EUDurch­schnitt und sind mit den Daten aus den USA vergleichbar. 1.2 Das Tumorregister des IET Das Tumorregister Tirol erhält Daten über neu auftretende Tumorfälle von den Tiroler Krankenhäusern und Sanatorien. Niedergelassene Fachärzte werden über die Sanatorien erfasst. Tumorfälle werden nur in Ausnahmefällen ausschließlich von Praktikern behandelt, über die Pathologie-Befunde werden auch solche Tumorfälle registriert (Basisdokumentation). Dies führt zu einem sehr hohen Grad an Vollständigkeit. Daneben führt das Tumorregister Tirol für einige Kliniken der Universitätsklinik Innsbruck ein Krankenhausregister für Tumoren mit einem wesentlich detaillierteren Dokumentationsumfang (Spezialdokumentation). Um einen möglichst hohen Grad an Vollständigkeit Zur möglichst vollständigen Erfassung in klinischen Registern eignen sich die ICD-10 Codes C00-C15, C30-C34, C39, C40, C41, C43, C44, C49, C69-C72, C76-C80, C97, D00-D04, D09, D37, D38 und D48 zu erreichen, werden Pathologiedaten, Krankenhausabgangsdiagnosen sowie Abteilungsdaten verwendet. Nach Abgleich mit der Datenbank werden solche Befunde, für die kein Tumor gemeldet wurde, nachrecherchiert. Schließ­lich werden in einem relativ aufwändigen Verfahren für diejenigen Tumor­todesfälle, für die keine Meldung eines Krankenhauses vorliegt, über Kranken­häuser und niedergelassene Ärzte nach medizinischen Daten recherchiert und gegebenenfalls nachdokumentiert. Falls keine weiteren Informationen gefunden werden, wird der Tumorfall als DCO-Fall ausgewertet (Death Certificate Only). Kopf-Halskarzinome Epidemiologie 15 1.3 Früherkennung und Prävention Die wichtigste Präventivmaßnahme sind allgemeine Programme gegen Nikotinkonsum. Es gibt nur wenige Daten zu Vorsorgeprogrammen speziell Risikogruppe: Raucher über 45 mit erhöhtem Alkoholkonsum bei Kopf-Hals-Tumoren. Ungefähr 70% der Patienten mit Kopf-HalsTumoren der Innsbrucker Universitäts-HNO-Klinik stellen sich erstmals mit fortgeschrittenen Tumorstadien vor. Da das Tumorstadium eng mit dem Überleben korreliert, erscheint es plausibel, dass Früherkennung die Prognose von Kopf-Hals-Tumoren verbessert. Hierzu liegen allerdings keine gesicherten Daten vor. Die relevante Risikogruppe sind Männer über 45 mit erhöhtem Alkohol- und Nikotinkonsum, Immunsupprimierte und Menschen, die schon mal ein Kopf-Halskarzinom hatten. 1.3.1 Populations-basiertes Screening (Massenscreening) Unter anderem für Haut- Mamma- und Prostatakrebs gibt es in Tirol ein sehr erfolgreiches Populationsscreening durch das Angebot für gezielte Vorsorgeuntersuchungen. Das Department für Hals-Nasen-Ohrenheilkunde der Universität Baltimore führte im April 2008 ein populations-basiertes kostenloses Kopf-Hals-Tumor Screening im Rahmen der von der Yul Brynner Foundation gesponserten Oral, Head and Neck Cancer Awareness Week durch. Die Mehrzahl der Teilnehmer waren weibliche Nicht­raucherinnen Populations-basierte Vorsorgeprogramme derzeit nicht zielführend (70%). Bei immerhin 10% der Teilnehmer fanden sich Verdachts­momente, die eine weiterführende Diagnostik auslösten. Dieses Ergebnis zeigt, dass die relevante Zielgruppe über Programme zur speziellen Vorsorge­ unter­suchung nur unzureichend erreicht wird. Außerdem sind gezielte Vorsorgeuntersuchungen wie Mamma- oder PSA-Screening bei Kopf-HalsTumoren ökonomisch kaum zu rechtfertigen. Es wurde kalkuliert, dass ca. 18.000 Bürgerinnen und Bürger gescreent werden müssten, um ein Leben zu retten. Dabei bezieht sich diese Zahl auf die leicht detektierbaren Mund­­ höhlen­­karzinome, nicht auf die schwieriger zu erfassenden Mund­rachen­ karzinome oder andere Kopf-Hals Tumorlokalisationen. Ein grundsätzliches Problem bei allen Screening-Untersuchungen ist, dass die oft zitierten 7 Warnsymptome (s. Tabelle) nicht Frühsymptome darstellen, sondern mit der Ausnahme der Heiserkeit bei Tumoren der Stimmlippe bereits ein fortgeschrittenes Tumorstadium anzeigen. Darüber hinaus sind diese Symptome unspezifisch, so dass eine hohe Fehldetektionsrate besteht. 16 Kopf-Halskarzinome Epidemiologie Typische 7 Warnzeichen für Kopf-Halstumoren laut American Cancer Society Schluckbeschwerden Fremdkörper- und Kloßgefühl im Hals ins Ohr ausstrahlende Schmerzen Husten, manchmal mit Blutauswurf Heiserkeit Schmerzen oder Kratzen im Hals Knotenbildung am Hals 1.3.2 Selektives (inzidentes risikoorientiertes) Screening Eine rezente Übersichtsarbeit kommt zu dem Ergebnis, dass eine sinnvolle Früherkennung von AllgemeinmedizinerInnen durchgeführt werden kann (incidental screening). Hierbei werden Patienten mit Risikofaktoren, die sich in der Regel aus Kopf-Hals unabhängigen Gründen vorstellen, einer standardisierten Untersuchung der Kopf-Hals-Region unterzogen. Weil Angehörige von Risikogruppen insgesamt eher selten zum Zahnarzt gehen, erfolgt inzidentes (also im Rahmen eines ohnehin stattfinden Arztbesuches) risikogruppen-orientiertes Screening am ehesten durch AllgemeinärzteInnen. Die Detektionsrate von Kopf-Hals-Tumoren bei Allgemeinärzten wird auf ca. 1:63000 Konsultationen geschätzt. Eine der umfangreichsten inzidenten risikogruppen-orientierten Screening Projekte wurde in Boston durchgeführt. Dabei wurden 4611 RaucherInnen über 40 Jahre von Allgemeinärzten (primary care physicians) in Stadtbezirken Risikogruppen-orientiertes Screening durch AllgemeinärzteInnen mit bekannt hoher Inzidenz von Kopf-Hals-Tumoren systematisch anhand eines Untersuchungsbogens erfasst. Der Untersuchungsbogen enthielt Fragen nach 4 von 7 Kopf-Halstumor-relevanten Warning-Signs der American Cancer Society, nämlich persistierende Halsschmerzen, Knoten am Hals, Schluck­schwierigkeiten und persistierende Heiserkeit. Außerdem wurde nach Gewichtsverlust gefragt und die Mundhöhle auf tumorverdächtige Veränderungen untersucht. Von den 4611 PatientenInnen wurden 318 Patienten wegen pathologischer Befunde zur weiterführenden fachärztlichen Unter­suchungen überwiesen. Von diesen 318 Patienten waren lediglich 4% auch wegen Kopf-Hals-Symptomen zum Allgemeinarzt gegangen. Die Fachuntersuchungen nahmen dann 208 Patienten auch tatsächlich in Anspruch. Zuletzt wurden 6 Krebsdiagnosen verifiziert, wobei 4 Diagnosen durch die Screening-Untersuchung festgestellt wurden und 2 Diagnosen erst 3 Jahre später. Somit ergibt sich in etwa eine Detektionsrate von ca. 1:1000 bei inzidentem, risikogruppen-orientiertem Screening. Dabei ist aber nicht bekannt, ob die 4 berichteten detektierten Tumore auch ein prognostisch günstiges, frühes Tumorstadium aufwiesen. Kopf-Halskarzinome Epidemiologie 17 1.3.3 Speichel-Screening Das Screening von Speichelproben wird in erster Linie bei Mund­höhlen­ karzinomen durchgeführt, gelingt aber möglicherweise auch für andere KopfHals-Tumorlokalisationen. SolCD44 war bei Tumorpatienten im Speichel zwar hochsignifikant erhöht, zeigte aber keine ausreichende Diskrimination zwischen Tumorpatienten und Kontrollen. Bahar und Koautoren konnten bei der Untersuchung von Antioxidantien im Speichel ebenfalls keine ausreichende Diskrimination erreichen. Mittels Microarry-Analysen identi­ fizierten Wong und Mitarbeiter 7 Transskripte im menschlichen Speichel (DUSP1, H3F3A, IL1B, IL8, OAZ1, SAT und S100P), die in Kombination mit einer Sensitivität und Spezifität von 90% Tumorpatienten von Kontrollen diskriminierten. Sethi und Koautoren konnten an Speichelproben von 27 Patienten mit Kopf-Hals-Tumoren und von 10 Kontrollen mittels multiplex ligation-dependent probe amplification (MPLA) an Hand der Genprodukte von 2 Genen (PMAIP1 und PTPN1) eine vollständige Diskrimination erreichen. Mittels quantitativer methylierungs-spezifischer PCR (Q-MSP) konnten Carvalho und Mitarbeiter Paneele hypermethylierter Promotersequenzen in Blutserum (CDH1, CCND2, TIMP3, HIC1 und PGP9.5) und Speichel (MINT31, CCNA1, DCC, p16) identifizieren, die Kopf-Tumorpatienten mit hoher Spezifität, allerdings geringer Sensitivität detektierten. 18 Kopf-Halskarzinome Epidemiologie 2 Ätiologie und Histopathologie 2.1 Ätiologie Risikofaktoren für die Entstehung von Plattenepithelkarzinomen der Kopf-­Hals-Region sind chemische Noxen, in aller erster Linie Alkoholund Tabakkonsum. Über die fatale Rolle von Alkohol und Rauchen für Entstehung und Rezidiv von Kopf-Hals-Karzinomen wissen lediglich 15% der Betroffenen Bescheid. Eine Sicherungsaufklärung über diese Risiken dient Alkoholkonsum und Rauchen sind die wichtigsten Risikofaktoren für Kopf-Halskarzinome der Gefahrenabwehr im Interesse des Patienten. Eine weitere wesentliche ätiologische Bedeutung haben Humane Papillomaviren (HPV). Sie spielen eine besondere Rolle in der Entstehung von Plattenepithelkarzinomen bei Nikotin- und Alkoholabstinenten. In 80-90% aller HPV-DNA-positiven Platten­ epithelkarzinome wird HPV Typ 16 gefunden. Weiterhin spielen physikalische Noxen (radioaktive Strahlen und chronische mechanische Irritation, z.B. durch scharfkantige Zähne), berufliche Schadstoffexposition (Schwarz­ deckenarbeiter, Maler, Schreiner, Asbestarbeiter) sowie Ernährungs­­ faktoren und familiäre sowie genetische Disposition eine Rolle. Arbeiter in der Holzindustrie haben ein erhöhtes Risiko für die Entwicklung von Adeno­­ karzinomen der Nasennebenhöhlen. Kopf-Hals-Karzinome treten bei immun­ supprimierten Patienten gehäuft auf. Generell treten Platten­epithel­karzinome des oberen aerodigestiven Trakts häufiger bei Männern auf. 2.2 Pathogenese 2.2.1 Genetisches Progressionsmodell Nach dem genetischen Progressionsmodell entstehen Kopf-Hals-Karzinome aus präneoplastischen Veränderungen. Dabei führen epigenetische Mechanismen, Genamplifikationen und Gendeletionen zur Aktivierung von Onkogenen und zu Funktionsverlust von Tumorsuppressorgenen. Da häufig DNAReparaturmechanismen und apoptoseinduzierende Mechanismen funktionell beeinträchtigt sind, entsteht eine hohe genomische Instabilität, in deren Folge zahlreiche weitere Mutationen auftreten. Obwohl der Tumor initial aus einem Zellklon entsteht, kommt es durch die genomische Instabilität zu einer hohen Zellheterogenität im Tumor. Dies äußert sich auch in der hohen Aneuploidie, Polyploidie und einer Vielzahl chromosomaler Anomalien von Kopf-HalsTumoren. Insbesondere unter dem selektiven Druck einer Therapie können strahlen- oder chemotherapieresistente Zellklone entstehen. Kopf-Halskarzinome Ätiologie und Histopathologie 19 Abbildung: Genetisches Progressionsmodell von Kopf-Hals Karzinomen 2.2.2 Tumorstammzellen Bei Tumorstammzellen handelt es sich um CD44+ Zellen in KopfHalskarzinomen, die extensiv proliferieren können und ca. 10% der Tumorzellen in Kopf-Hals-Tumoren ausmachen(11). Tumorstammzellen sind in der Lage, im Tiermodell Implantattumoren zu induzieren, während die übrigen Tumorzellen dies kaum vermögen. Es wird vermutet, dass diese Zellen für die Repopulation nach Strahlen- oder Chemotherapie ausschlaggebend sind. 2.2.3 Tumorimmunologie Kopf-Hals-Tumorzellen exprimieren einige weitgehend tumorspezifische Antikörper. Tumorantigene, die eine humorale Immunantwort induzieren, können mittels serologischer Analyse rekombinanter Expressions-Libraries (SEREX) und über Microarray-Analysen identifiziert werden. Zu den KopfHals-Tumorenantigenen gehören unter anderem der EGF-Rezeptor, VEGF-Rezeptor, Ep-CAM, einige CD44 Splice-Varianten, p16 sowie die Somatostatinrezeptoren 2 und 5. Nasenrachenkarzinome exprimieren gehäuft EBV-Antigene. Trotz der Expression von Tumorantigenen gelingt es dem Immunsystem nicht, die Tumorzellen zu eliminieren. Zu den Faktoren, die die Abwehrlage von Kopf-Halstumorpatienten beeinträchtigen gehören Alkohol- und Tabakkonsum, HPV-Infektion und schlechter Ernährungszustand. Kopf-Hals-Tumorzellen entgehen der humoralen und zellulären Immunüberwachung zusätzlich gezielt über unterschiedliche Mechanismen. Sie „verstecken“ sich vor dem Immunsystem, 20 unter anderem durch geringe HLA-Klasse I Rezeptor-Expression. Andererseits Kopf-Halskarzinome Ätiologie und Histopathologie supprimieren sie die Aktivität von Immunzellen systemisch und insbesondere lokal. Tumorinfiltrierende Lymphozyten (TIL) gehören überwiegend zu CD4+ CD25+ FoxP3+ regulatorischen T-Zellen, die Immuntoleranz induzieren. Darüber hinaus supprimieren Tumorzellen die Aktivität unterschiedlicher Immunzellen durch Freisetzung immunsupprimierender Faktoren wie IL-10, TGF-ß und PGE2. 2.2.4 Tumorprogression Unter Tumorprogression versteht man die Ausbreitung maligne transformierter Zellen im Organismus. Zu den Mechanismen der Tumorprogression zählen Invasion, Destruktion, Angiogenese, Ausbildung eines bindegewebigen Stromas (Desmoplasie), Verlust der Zelladhäsion und Einbruch in Lymphund Blutgefäße, Extravasation und Metastasenbildung. 2.2.5 Prognosefaktoren Prognosefaktoren ermöglichen Aussagen über die Überlebens­wahr­schein­ lichkeit. Relevante klinische Prognosefaktoren bei Platten­epithelkarzinomen umfassen Tumorgröße, Tumorlokalisation, Halslymphknotenstatus, Fern­ metastasierung, Performance-Status, und Erst- vs. Rezidiverkrankung. Alter und Geschlecht spielen eine untergeordnete Rolle. Nach chirurgischem Vorgehen sind R-Status und extrakapsuläres Lymphknotenwachstum als Klinische Prognosefaktoren: Tumorgröße, Tumorlokalisation, Halslymphknotenstatus, Fernmetastasierung weitere prognostisch relevante Parameter verfügbar. Prognostisch relevant ist auch das Vorliegen einer ausgeprägten desmoplastischen Stromareaktion in den Lymphknotenmetastasen. Ein positiver Lymphknotenbefund erhöht signifikant die Wahrscheinlichkeit von hämatogenen Fernmetastasen, stärker noch bei extranodaler Tumorinfiltration. Daneben gibt es zahlreiche tumorbiologische Parameter mit prognostischer Bedeutung wie z.B. das Ausmaß der EGFR Expression oder der p16-Status. Prädiktive Faktoren sollen Aussagen darüber ermöglichen, welche Therapieverfahren erfolg­ versprechend sind und eine individuell optimierte Therapieempfehlung ermöglichen. Die Datenlage zu prädiktiven Faktoren bei Kopf-Halstumoren ist inkonsistent. Kopf-Halskarzinome Ätiologie und Histopathologie 21 2.3 Histopathologie Als Grundlage der histopathologischen Klassifikation von Kopf-Halstumoren wird die World Health Organization Classification of Tumours, Pathology & Genetics, Head and Neck Tumours, empfohlen (12). 2.3.1 Dysplasien, Carcinoma in situ, intraepitheliale Neoplasie Zu den präneoplastischen Veränderungen werden die Leukoplakie mit den Unterformen verruköse Hyperplasie (früher: orale floride Papillomatose) und proliferative verruköse Hyperplasie sowie die Erythroplakie gezählt, aus der sich im Verlauf jeweils eine squamöse intraepitheliale Neoplasie (SIN) mit geringer (low grade) oder hochgradiger (high grade) Dysplasie (siehe Tabelle 1) und schließlich ein invasives Karzinom entwickeln können. Die Entartungsrate bei der Leukoplakie liegt abhängig vom Dysplasiegrad zwischen 3 und 10%, bei der Erythroplakie bei über 50%, wiederum variabel je nach Lokalisation der Präkanzerose (am höchsten an Mundboden, Zunge und Lippe). In Tirol wird für intraepitheliale Läsionen die Klassifikation der WHO (siehe z.B. Barnes 2005) empfohlen (s. Tabelle 1, Spalte links). Tabelle 1 2005 WHO Classification Squamous Intraepithelial Neoplasia (SIN) Squamous cell hyperplasia Ljubljana Classification Squamous Intraepithelial Lesions (SIL) Squamous cell (Simple) hyperplasia Mild dysplasia SIN 1 Basal/parabasal cell hyperplasia* Moderate dysplasia SIN 2 Atypical hyperplasia** Severe dysplasia SIN 3*** Atypical hyperplasia** Carcinoma in-situ SIN 3*** Carcinoma in-situ 2.3.2 Plattenepithelkarzinome Die häufigsten malignen Neubildungen der Kopf-Halsregion sind Platten­ epithel­karzinome. Typische Merkmale sind ein unterschiedliches Ausmaß an Keratini­sierung und invasives Wachstum. Sonderformen des Plattenepithelkarzinoms Verruköses Karzinom Vorwiegend exophytisches Wachstum, seltener Tumor des älteren Menschen, 22 lokalisiert meist in der Mundhöhle (Gingiva und Wangenschleimhaut) oder Kopf-Halskarzinome Ätiologie und Histopathologie im Larynx. Der Tumor sitzt breitbasig auf, zeigt plumpzapfiges infiltratives Wachstum mit oft scharf gezogen erscheinender Abgrenzung gegenüber der Epithelunterlage und ist gekennzeichnet durch ein Epithel, das die üblichen zytologischen Malignitätskriterien vermissen lässt. Die Diagnosestellung kann besonders in der Abgrenzung zu nichtmalignen Läsionen wie einem Die häufigsten malignen Neubildungen der Kopf-Halsregion sind Plattenepithelkarzinome Platten­epithelpapillom, einer verrukösen Hyperplasie oder einer reaktiven inflamma­torischen papillomatösen Plattenepithelhyperplasie schwierig sein. Spindelzellkarzinom Biphasischer Tumor aus Zellen eines Plattenepithelkarzinoms und pleo­ mor­phen spindeligen Zellelementen, die als eine sekundär entwickelte sarkomatoide Tumorkomponente betrachtet werden. Wenn in einer Biopsie die Plattenepithelkomponente nicht erfasst ist, kann die Abgrenzung zu anderen Spindelzellsarkomen oder einer nodulären Fasziitis problematisch sein. Basaloides Plattenepithelkarzinom Seltene Variante, die bei hoher Tendenz zu einer lymphogenen und hämato­ genen Metastasierung ein aggressives Verhalten aufweist. Lokalisation meist Zungenbasis, Sinus piriformis und supraglottischer Larynx. Der Tumor zeigt ein Nebeneinander eines konventionellen Plattenepithelkarzinoms und einer Komponente aus kleinen basaloiden Zellen in soliden läppchenartigen Komplexen. Adenoides Plattenepithelkarzinom (akantholytisches Plattenepithelkarzinom) Selten; entsteht meist im Bereich der (Unter-)Lippe. Der Tumor zeigt durch Akantholyse ausgebildete pseudoglanduläre Spaltbildungen ohne Ausbildung echter Drüsen und ohne Vorliegen von Mukozyten. Die vorhandene Keratini­ sierung hilft in der Abgrenzung zum adenoid-zystischen Karzinom und mukoepidermoiden Karzinom. Adenosquamöses Karzinom Kontroversieller gemischter Tumor, meist im Larynx bei Männern. Papilläres Plattenepithelkarzinom Seltene Variante. Nasopharyngeales Karzinom/Lymphoepitheliales Karzinom (Schmincke-Tumor) Undifferenziertes epidermoides Karzinom mit prominenter lymphatischer Reaktion, typischerweise des Nasopharynx, assoziiert mit Nachweis von Epstein-Barr-Virus mittels In-situ-Hybridisierung oder PCR am Tumorgewebe. Kopf-Halskarzinome Ätiologie und Histopathologie 23 2.3.3 Adenokarzinome Ausgangsorte können die großen und kleinen Speicheldrüsen, seromuköse Drüsen der Nasenhöhle, der Nasennebenhöhlen und der oropharyngealen und laryngealen Schleimhaut sein. Die histologische Präsentation ist sehr unterschiedlich. Die Varianten der Speicheldrüsenkarzinome sind in Abschnitt Maligne Speicheldrüsentumore separat aufgelistet. Adenokarzinom vom intestinalen Typ Adenokarzinome des NNH-Systems treten gehäuft nach beruflicher Holzstaubexposition auf Zum Teil Assoziation mit Staubexposition in der Holzindustrie, in diesen Fällen meist Männer betroffen und meist lokalisiert im Sinus ethmoidalis. Bei Fällen ohne Staubexposition meist Frauen mit Lokalisation im maxillären Antrum. Sie gelten als aggressive Karzinome mit Rezidivneigung und Tendenz zu Lymphknoten- und Fernmetastasen. Low-grade Adenokarzinom/nasopharyngeales papilläres Adeno­karzinom Seltene Tumore, meist in der Nasenhöhle. Als low-grade klassifizierte Karzinome haben eine gute Prognose. 2.3.4 Maligne Speicheldrüsentumore Sie entstehen de novo oder manchmal aus (den wesentlich häufigeren) gutartigen Speicheldrüsentumoren: Maligner Mischtumor Entsteht fast immer aus einem pleomorphen Adenom, meist Bild eines gering differenzierten Adenokarzinoms NOS. Minimal invasive Karzinome haben eine fast ebenso exzellente Prognose wie gutartige Tumore, breit invasive jedoch sind extrem aggressiv und zeigen bei Diagnosestellung oft bereits Lymphknoten- und Fernmetastasen. Die Invasionstiefe ist prognostisch relevant, über 1,5 mm extrakapsuläre Invasion ist mit signifikant schlechterer Prognose assoziiert. Myoepitheliales Karzinom Zu 50% Entstehung de novo, sehr variable Histologie mit meist typischem immunhistochemischen Profil, variable Prognose. Basalzell-Adenokarzinom Low-grade Adenokarzinom meist der Parotis mit aggressiv- infiltrativem Wachstum, Nekrosenbildung, Ausbreitung. 24 Kopf-Halskarzinome Ätiologie und Histopathologie perineuraler und/oder perivaskulärer Mukoepidermoides Karzinom In vielen Serien der häufigste maligne Speicheldrüsentumor, meist der Parotis, mit typischer Histologie. Verhalten und Prognose variieren abhängig von Stadium und Tumordifferenzierung, wobei es kein international aner­ kanntes Grading-Schema gibt. High-grade Tumore zeigen meist schon Fernoder Lymphknotenmetastasen. Azinuszellkarzinom Lokalisiert in >90% der Fälle in der Parotis, äußerst variable und varianten­ reiche Histologie. Adenoid-zystisches Karzinom Nach WHO drei Varianten (tubulär, glandulär/kribriform, solid). Langsam wachsender, breit infiltrativer Tumor mit Tendenz zu perineuraler Ausbreitung. Unter allen lokalen malignen Tumoren höchste Rezidivrate (über 70%) auch Adenoid-zystische Karzinome: Nachsorge über mind. 10 Jahre nach 10 oder mehr Jahren. In bis zu 50% Fernmetastasen, Lymph­knoten­ metastasen eher selten. Prognostische Faktoren sind Lokalisation, Stadium, Grad, neurale Infiltration und Radikalität der Operation. Polymorphes low-grade Adenokarzinom Zweithäufigstes enorales Speicheldrüsenkarzinom, ca. 60% der Fälle am Gaumen lokalisiert. Histologisch und zytologisch monomorpher, aber infiltrativ wachsender Tumor mit sehr guter Prognose bei radikaler Entfernung, Rezidive auch nach Jahren kommen aber nicht so selten vor und liegen dann oft sinunasal, seltener im Bereich der Orbita oder sogar intrakraniell. Kribriformes Adenokarzinom der Zunge Erst 1999 beschriebene, seltene Entität, morphologisch Ähnlichkeiten mit polymorphem low-grade Adenokarzinom oder mit papillärem Schilddrüsen­ karzinom (immunhistochemisch aber immer Thyreoglobulin-negativ). Bei Diagnose­stellung immer bereits Lymphknotenmetastasen beschrieben. Epithelial-myoepitheliales Karzinom Seltener Tumor aus epithelialen und myoepithelialen Komponenten und duktaler Architektur, prognostisch als low-grade oder intermediate-gradeKarzinom einzustufen. Klarzellkarzinom Tumor der kleinen Speicheldrüsen an Gaumen, Zunge und Mundboden, bestehend aus monomorphen hellen Zellen ohne myoepitheliale Differen­ zierung, mit guter Prognose. Kopf-Halskarzinome Ätiologie und Histopathologie 25 Speicheldrüsengangkarzinom Karzinom der Drüsenausführungsgänge mit einer Histologie, die dem duktalen Mammakarzinom ähnelt. Der klinische Verlauf ist abhängig vom Differenzierungsgrad und dem Stadium (intraduktal oder bereits invasiv). Mehrere histologische Varianten sind beschrieben. High-grade Karzinome gehören zu den aggressivsten Speicheldrüsenkarzinomen. Hohes Risiko der Lymphknotenmetastasierung, klinisch negative Halslymphknoten sind histologisch oft bereits befallen. Die prognostische Relevanz des her2/neuStatus ist bei diesem Karzinom noch unklar. Sebazäres Karzinom Sebazäre Drüsen kommen vor allem in der Glandula parotis vor. Die Prognose ist abhängig von Differenzierungsgrad und Ausdehnung und scheint etwas besser zu sein als bei gleichartigen Karzinomen der Haut. Sebazäres Lymphadenokarzinom Extrem seltene, publikationswürdige Entität. Zystadenokarzinom Multizystischer Tumor mit invasiver Ausbreitung, bei niedrigem Grad und Stadium mit guter Prognose. Muzinöses Adenokarzinom Subtypen: Kolloidkarzinom und Siegelringzellkarzinom, typische massive intra-/extrazelluläre Schleimbildung, als high-grade Tumore eingestuft. Adenokarzinom Not Otherwise Specified (NOS) Adenokarzinome duktaler oder glandulärer Differenzierung, die keine diagnostischen Kriterien für einen anderen Adenokarzinomtyp aufweisen. Kleinzelliges (neuroendokrines) Karzinom In dieser Lokalisation seltener Tumor, eine Metastase eines Lungenkarzinoms ist prinzipiell klinisch auszuschließen. Die Prognose ist besser als bei gleichartigen Tumoren der Lunge. Großzelliges (undifferenziertes) Karzinom Seltener, aggressiver, breit invasiv wachsender Tumor, der bei Diagnose­ stellung oft bereits inoperabel ist. Auch hier sollte eine Metastase ausgeschlossen werden. Tritt oft zusammen mit einem anderen gutartigen oder malignen Speicheldrüsentumor auf. 26 Kopf-Halskarzinome Ätiologie und Histopathologie Primäres Plattenepithelkarzinom Wenn ausgehend von den Speicheldrüsen, immer ein aggressives Karzinom mit schlechter Prognose. Lymphoepitheliales Karzinom (siehe oben) 2.3.5 Andere Malignome Olfaktorisches Neuroblastom (Ästhesioneuroblastom) Ausgehend von olfaktorischen Stammzellen der Riechschleimhaut, meist in Nasen- und Nasennebenhöhlen. Neuroendokriner Tumor mit hoher Rezidivund Metastasierungsneigung, auch nach über 20 Jahren, weshalb immer ein Langzeit-Follow-up angezeigt ist. Seltene maligne Tumoren des oberen aerodigestiven Trakts sind Sarkome, Lymphome und das maligne Melanom. 2.4 Häufige Lokalisation von Metastasen von Kopf-Hals-Tumoren Häufigste Absiedlungsorte von Kopf-Hals-Tumoren sind die Lymphknoten der oberen und tiefen Halsregion, vornehmlich auf der Seite des Primär­ tumors. Hauptsitz von Fernmetastasen sind die Lungen. Dieser Umstand führt zu der manchmal nicht klärbaren Frage, ob es sich bei einem epider­ moid differenzierten Lungentumor um eine Metastase des bekannten Platten­ epithel­karzinoms des oberen aereodigestiven Systems oder um ein zweites Primum der Lunge handelt. 2.5 Bearbeitungsempfehlungen Pathologen der Operationspräparate für Die Aufgabe des Pathologen ist es, alle für den Kliniker möglicherweise bedeutsamen Informationen über den resezierten Tumor in seinen Befund einzuschließen. Dazu gehören Angaben über den histologischen Typ, den Differenzierungsgrad, die Tumorausdehnung, die Tumordicke, das Wachs­ tums­muster, Vorliegen oder Fehlen von perineuraler Ausbreitung und Gefäß­invasion sowie die Evaluation der Resektionsgrenzen mit Angabe des Tumorabstandes zu definierten Absetzungsrändern. Letzteres setzt voraus, dass vom Chirurgen am Operationspräparat Richtungsangaben mit Faden- oder Nadelmarkierungen klar gekennzeichnet werden. Bei Schleim­hautresektaten wird die Arbeit für den Pathologen erleichtert, Kopf-Halskarzinome Ätiologie und Histopathologie 27 wenn sie auf einer Korkplatte aufgespannt werden. Wenn Neckresektate zur Beurteilung vorliegen, müssen die Anzahl der Tumorherde bzw. der befallenen Lymphknoten, ihre Größe, ihre Lokalisation und Seite in Bezug zum Sitz des Primärtumors und Angaben zu einer allfälligen extrakapsulären Tumorausbreitung aufgelistet werden. 28 Kopf-Halskarzinome Ätiologie und Histopathologie 3 Tumor-Lokalisationen und Stadieneinteilungen Die Festlegung und Dokumentation des Tumorbezirks sowie die klinische (prätherapeutische) TNM Klassifikation (cT, cN und cM Stadium) ist unerläßlich für die Auswahl und Bewertung der Therapie. Die verbindliche Festlegung des klinischen Tumorstadiums erfolgt im Rahmen einer inter­ disziplinären Konferenz (Tumorboard) unter Berücksichtigung der klinischen und bildgebenden Untersuchungsergebnisse. Bestehen im Einzelfall Zweifel bezüglich der korrekten Zuordnung zu der T-, N-und M-Kategorie, soll Das klinische Tumorstadium wird im Tumorboard unter Berücksichtigung der klinischen und bildgebenden Untersuchungsergebnisse festgestellt die niedrigere, d. h. weniger fortgeschrittene Kategorie gewählt werden. Overstaging ist für den Patienten möglicherweise nachteiliger als Under­ staging. Understaging führt dazu, dass eine Behandlung am Ende nicht wie geplant durchgeführt werden kann. Overstaging führt dazu, dass möglicher­­weise wirksamere oder schonendere Therapieverfahren gar nicht erst zum Zuge kommen. Das initiale TNM-Stadium bleibt unverändert und wird nicht durch den weiteren Krankheitsverlauf beeinflusst. Das klinische TNM-Stadium wird durch das pathologische TNM-Stadium (postoperative histopatho­logische Klassifikation) ergänzt, nicht ersetzt. 3.1 Tumor-Lokalisationen und T-Stadien nach UICC 2010 In Anlehnung an die UICC-Klassifikation wird die Kopf-Hals Region in folgende Bezirke eingeteilt (13;14): Lippen, Mundhöhle, Oropharynx, Naso­­ pharynx, Hypopharynx, supraglottischer Larynx, glottischer Larynx, Sub­ glottis, Nasenhöhle/Siebbeinzellen, Kieferhöhle, Speicheldrüsen und Kopfund Gesichtshaut. Die Orts-Bezeichnung des Tumors erfolgt nach dem Bezirk, in dem der gedachte Masseschwerpunkt des Tumors liegt. Es kann nur ein Bezirk namensgebend sein (es gibt demnach kein Oro-Hypopharynx­ karzinom). Die Bezirke werden weiter aufgeschlüsselt und es werden ihnen mehr­­stufige Unterbezirke zugeordnet. Nach UICC gehören Schilddrüsen­ karzinome zu den Kopf-Hals-Tumoren, sie werden jedoch in diesen Die Orts-Bezeichnung des Tumors erfolgt nach dem Bezirk, in dem der gedachte Masseschwerpunkt des Tumors liegt Empfehlungen nicht abgehandelt 3.1.1 Lippen Häufiger ätiologischer Faktor in dieser Lokalisation ist die Sonneneinstrahlung. Die Tumorgröße bestimmt das T Stadium. Perineurales Wachstum kann zur Ausbreitung in die Mandibula führen, weshalb diese bei Staging und Followup immer mituntersucht werden sollte. Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 29 Unterbezirke der Lippe 1. Oberlippe, Lippenrot (C00.0) 2. Unterlippe, Lippenrot (C00.l) 3. Mundwinkel (C00.6) T-Stadien TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor Tis Carcinoma in situ Tl Tumor 2 cm oder weniger in größter Ausdehnung T2 Tumor mehr als 2 cm, aber nicht mehr als 4 cm in größter Ausdehnung T3 Tumor mehr als 4 cm in größter Ausdehnung T4a Lippe T4b Tumor infiltriert durch kortikalen Knochen, den N. alveolaris inferior, in Mundhöhlenboden oder in Haut (Kinn oder Nase) Tumor infiltriert Spatium masticatorium, Processus pterygoideus oder Schädelbasis oder umschließt die A. carotis interna 3.1.2 Mundhöhle Plattenepithelkarzinome der Zunge entwickeln sich meist seitlich, sind tief infitrativ und haben das höchste Metastasierungsrisiko unter allen epidermoiden Karzinomen der Mundhöhle. Wangenkarzinome können nach außen penetrieren. Im Bereich der Gingiva des Ober- und Unterkiefers können Karzinome mit entzündlich-reaktiven Schleimhautveränderungen verwechselt werden und umgekehrt. Karzinome haben bei Diagnosestellung meist einen radiologisch abzuklärenden Bezug zum Kieferknochen. Unterbezirke 1. Mundschleimhaut a) Schleimhaut der Ober- und Unterlippe (C00.3,4) b) Wangenschleimhaut (C06.0) c) Retromolargegend (C06.2) d) Sulcus buccomandibuIaris und -maxillaris (C06.1) 2. Oberer Alveolarfortsatz und Gingiva (C03.0) 3. Unterer Alveolarfortsatz und Gingiva (C03.1) 4. Harter Gaumen (C05.0) 5. Zunge a) Zungenrücken und Zungenrand vor den Papillae vallatae (C02.0,l) b) Zungenunterseite (C02.2) 6. Mundboden (C04) 30 Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor Tis Carcinoma in situ Tl Tumor 2 cm oder weniger in größter Ausdehnung T2 Tumor mehr als 2 cm, aber nicht mehr als 4 cm in größter Ausdehnung T3 Tumor mehr als 4 cm in größter Ausdehnung T 4a Tumor infiltriert durch kortikalen Knochen in äußere Muskulatur der Zunge (M. genioglossus, M. hyoglossus, M. palatoglossus und M styloglossus), Kieferhöhle oder Gesichtshaut T4b Tumor infiltriert Spatium masticatorium, Processus pterygoideus oder Schädelbasis oder umschließt die A. carotis interna T-Stadien Anmerkung: Eine nur oberflächliche Erosion des Knochens oder eines Zahnfaches durch einen Primärtumor der Gingiva berechtigt nicht zur Einordnung eines Tumor als T4. 3.1.3 Oropharynx Plattenepithelkarzinome der Tonsillen neigen zu rascher Tiefeninfitration mit Ausbreitung in die Zungenbasis und die laterale Pharynxwand sowie zu Wachstum unter intakter Mukosa in Richtung Nasopharynx. Sie entwickeln sich oft multifokal aus einem ausgedehnten Carcinoma in situ. An der Zungenbasis entstandene Karzinome zeigen schon in frühen Stadien zu über 70% Lymphknotenmetastasen, eventuell auch bilateral. 1. Vorderwand (glossoepiglottische Region) a) Zungengrund (hinter den Papillae Unterbezirke circumvallatae) b) Vallecula (C10.0) 2. Seitenwand (C10.2) a) Tonsillen (C09.9) b) Fossa tonsillaris (C09.0) und Gaumenbögen (C09.1) c) Glossotonsillarfurche (C10.2) 3. Hinterwand (C10.3) 1) 4. Obere Wand a) Orale Oberfläche des weichen Gaumens (C05.1) b) Uvula (C05.2) Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 31 T-Stadien TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor Tis Carcinoma in situ T1 Tumor 2 cm oder weniger in größter Ausdehnung T2 Tumor mehr als 2 cm, aber nicht mehr als 4 cm in größter Ausdehnung T3 Tumor mehr als 4 cm in größter Ausdehnung T4a Tumor infiltriert Nachbarstrukturen, wie Larynx, äußere Muskulatur der Zunge (M. genioglossus, M. hyoglossus, M. palatoglossus und M. styloglossus), Lamina medialis des Processus pterygoideus, harten Gaumen und Unterkiefer T4b Tumor infiltriert Nachbarstrukturen, wie M. pterygoideus lateralis, Lamina lateralis des Processus pterygoideus, Schädelbasis oder umschließt die A. carotis interna 3.1.4 Nasopharynx Die WHO Klassifikation unterscheidet Plattenepithelkarzinome (keratini­ sierend), nicht-keratinisierende Karzinome (bei diesen differenzierte und undifferenzierte Tumore) und basaloide Plattenepithelkarzinome. Diese Tumore verlaufen klinisch ungünstiger, wenn die Symptomatik länger als ein Jahr besteht, die Histologie des Tumors eine Verhornung aufweist, die tiefen Hals­lymph­knoten befallen sind, Hirnnerven befallen sind und Fernmetastasen vorliegen. Unterbezirke 1. Dach und Hinterwand: beginnt auf Höhe des Übergangs zwischen hartem und weichem Gaumen und endet an der Schädelbasis (C11.0,1) 2. Seitenwand: schließt die Rosenmüller-Grube ein (C11.2) 3. Untere Wand, entsprechend der nasalen Flache des weichen Gaumens (C11.3) T-Stadien T1 Tumor auf den Nasopharynx begrenzt oder mit Ausbreitung auf den Oropharynx und/oder Nasenhöhle T2 Tumor mit parapharyngealer Ausbreitung* T3 Tumor infiltriert Knochenstrukturen der Schädelbasis und/ oder Nasennebenhöhlen T4 Tumor mit intrakranieller Ausbreitung und/oder Befall von Hirnnerv(en), Fossa infra temporalis, Hypopharynx, Augenhöhle, Spatium masticatorium * Parapharyngeale Ausbreitung bedeutet die posterolaterale Infiltration 32 jenseits der Fascia pharyngeobasilaris. Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 3.1.5 Hypopharynx Hypopharynxkarzinome haben generell eine ungünstige Prognose. Submuköse Ausbreitung unter intakter Schleimhaut, frühe Neigung zu Lymph­gefäßeinbrüchen und –metastasen sowie zu Fernmetastasen sind typisch. Karzinome der Postkrikoidregion sind mit Plummer-Vinson-Syndrom und Mangelernährung assoziiert. Sie neigen zur Ausbreitung nach inferior und Vorwachsen gegen Trachea und Ösophagus. 1. Pharyngoösophageale Grenze (Postkrikoidgegend) (C 13.0): Erstreckt sich von der Höhe der Aryknorpel mit Verbindungsfalten bis zum Unterrand des Ringknorpels und bildet die Vorderwand des Hypopharynx. Unterbezirke 2. Sinus piriformis (C12.9): Erstreckt sich von der pharyngoepiglottischen Falte bis zum oberen Ende des Osophagus. Er wird seitlich vom Schildknorpel und medial von der hypopharyngealen Oberfläche der aryepiglottischen Falte (C13.1) sowie von Ary- und Ringknorpel begrenzt. 3. Hypopharynxhinterwand (C 13.2): Erstreckt sich zwischen der Höhe des oberen Randes des Zungenbeines (oder des Bodens der Vallecula) bis zur Höhe des Unterrandes des Ringknorpels und vom Apex eines Sinus piriformis zum anderen. TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor Tis Carcinoma in situ T1 Tumor auf einen Unterbezirk des Hypopharynx begrenzt und 2 cm oder weniger in größter Ausdehnung T2 Tumor infiltriert mehr als einen Unterbezirk des Hypopharynx oder einen benachbarten Bezirk oder misst mehr als 2 cm, aber nicht mehr als 4 cm in größter Ausdehnung, ohne Fixation des Hemilarynx T3 Tumor misst mehr als 4 cm in größter Ausdehnung oder Tumor mit Fixation des Hemilarynx T4a Tumor infiltriert Nachbarstrukturen, z. B. Schild-/Ringknorpel, Zungenbein, Schilddrüse, Ösophagus, zentrale Weichteile des Halses. T 4b Tumor infiltriert prävertebrale Faszien, umschließt die A. carotis interna oder infiltriert Strukturen des Mediastinums T-Stadien Anmerkung: Die zentralen Weichteile des Halses schließen die gerade Halsmuskulatur und das subkutane Fett ein. Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 33 3.1.6 Larynx Traditionell werden diese Tumore – auch in der TNM Klassifikation – in Tumore der Supraglottis, Glottis und Subglottis unterteilt. Prognostisch bedeutsam sind hier die Tumorgröße, der Lymphknotenstatus, und bei Lymph­knotenmetastasen das Vorhandensein einer extrakapsulären Tumor­ ausbreitung. Supraglottische Larynxkarzinome neigen zu bilateraler Hals­ lymph­knotenmetastasierung. SupragIottischer Larynx Unterbezirke a) Suprahyoidale Epiglottis einschließlich freiern Epiglottisrand, lingualer (vorderer) und laryngealer Oberfläche b) Aryepiglottische Falte, laryngeale Oberfläche c) Arytenoidgegend d) Infrahyoidale Epiglottis e) Taschenfalten T-Stadien 34 T1 Tumor auf einen Unterbezirk der Supraglottis begrenzt, mit normaler Stimmlippenbeweglichkeit T2 Tumor infiltriert Schleimhaut von mehr als einem benachbarten Unterbezirk der Supraglottis oder Glottis oder eines Areals außerhalb der Supraglottis (z. B. Schleimhaut von Zungengrund, Vallecula, mediale Wand des Sinus piriformis), ohne Fixation des Larynx T3 Tumor auf den Larynx begrenzt, mit Stimmlippenfixation, und/ oder Tumor mit Infiltration des Postkrikoidbezirks, des präepiglottischen Gewebes und/oder geringgradiger Erosion des Schildknorpels (innerer Kortex) T4a Tumor infiltriert durch den Schildknorpel und/oder breitet sich außerhalb des Kehlkopfes aus, z. B. Trachea, Weichteile des Halses eingeschlossen äußere Muskulatur der Zunge (M. genioglossus, M. hyoglossus, M. palatoglossus und M. styloglossus), gerade Halsmuskulatur, Schilddrüse, Ösophagus T4b Tumor infiltriert den Prävertebralraum, mediastinale Strukturen oder umschließt die A. carotis interna Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung Glottischer Larynx Unterbezirke a) Stimmlippen b) Vordere Kommissur c) Hintere Kommssur T1 Tumor auf Stimmlippe(n) begrenzt (kann auch vordere oder hintere Kommissur befallen), mit normaler Beweglichkeit T1a Tumor auf eine Stimmlippe begrenzt T1b Tumorbefall beider Stimmlippen T2 Tumor breitet sich auf Supraglottis und/oder Subglottis aus und/oder Tumor mit eingeschränkter Stimm­lippen­ beweglichkeit T3 Tumor auf den Larynx begrenzt, mit Stimmlippenfixation und/oder Invasion der Postkrikoidgegend und/oder des präepiglottischen Gewebes und/oder des paraglottischen Raumes mit geringgradiger Erosion des Schildknorpels (innerer Kortex) T4a Tumor infiltriert durch den Schildknorpel und/oder breitet sich außerhalb des Kehlkopfes aus, z. B. Trachea, Weichteile des Halses eingeschlossen äußere Muskulatur der Zunge (M. genioglossus, M. hyoglossus, M. palatoglossus und M. styloglossus), gerade Halsmuskulatur, Schilddrüse, Ösophagus T4b Tumor infiltriert den Prävertebralraum, mediastinale Strukturen oder umschließt die A. carotis interna T-Stadien Subglottis T1 Tumor auf die Subglottis begrenzt T2 Tumor breitet sich auf eine oder beide Stimmlippen aus, diese mit normaler oder eingeschränkter Beweglichkeit T3 Tumor auf den Larynx begrenzt, mit Stimmlippenfixation T4a Tumor infiltriert durch den Schildknorpel und/oder breitet sich außerhalb des Kehlkopfes aus, z. B. Trachea, Weichteile des Halses eingeschlossen äußere Muskulatur der Zunge (M. genioglossus, M. hyoglossus, M. palatoglossus und M. styloglossus), gerade Halsmuskulatur, Schilddrüse, Ösophagus T4b Tumor infiltriert den Prävertebralraum, mediastinale Strukturen oder umschließt die A. carotis interna T-Stadien Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 35 3.1.7 Nasenhöhle und Nasennebenhöhlen Über 50% der Tumore sind im Sinus maxillaris lokalisiert. Wegen der unspezifischen Frühsymptomatik werden viele dieser Tumore erst in einem fortgeschrittenen Stadium diagnostiziert. In der Regel handelt es sich um verhornende epidermoide Karzinome. Die Gruppe der nicht-keratinisierenden Karzinome in dieser Region hat eine über viele Jahrzehnte kontroversielle Nomenklatur; heute noch verwendete Synonyme sind Zylinderzellkarzinom und Übergangszellkarzinom (amerikanische Literatur). Bei den Karzinomen der Siebbeinregion handelt es sich meist um Adenokarzinome. Nasenhöhle und Siebbeinzellen Unterbezirke 1) Nasenhöhle a) Septum b) Nasenboden c) Laterale Wand d) Vestibulum 2) Siebbeinzellen a) rechts b) links T-Stadien 36 T1 Tumor auf einen Unterbezirk der Nasenhöhle oder Siebbeinzellen beschränkt, mit oder ohne Arrosion des Knochens T2 Tumor in zwei Unterbezirken eines Bezirkes oder Ausbreitung auf einen Nachbarbezirk innerhalb des NasenSiebbeinzellen-Areals, mit oder ohne Arrosion des Knochens T3 Tumor breitet sich in die mediale Orbita oder den Orbitaboden aus oder in Kieferhöhle, harten Gaumen oder Lamina cribrosa T4a Tumor infiltriert eine oder mehrere der folgenden Strukturen: Inhalt der vorderen Orbita, Haut von Nase oder Wange, minimale Ausbreitung in vordere Schädelgrube, Processus pterygoideus, Keilbeinhöhle oder Stirnhöhle T4b Tumor infiltriert eine oder mehrere der folgenden Strukturen: Orbitaspitze, Dura, Gehirn, mittlere Schädelgrube, Hirnnerven ausgenommen den maxillären Ast des N. trigeminus V2, Nasopharynx, Clivus Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung Kieferhöhle T1 Tumor auf die antrale Schleimhaut begrenzt ohne Arrosion oder Destruktion des Knochens T2 Tumor mit Arrosion oder Destruktion des Knochens (ausgenommen die posteriore Wand) einschließlich Ausdehnung auf harten Gaumen und/oder mittleren Nasengang T3 Tumor infiltriert eine oder mehrere der folgenden Strukturen: Knochen der dorsalen Wand der Kieferhöhle, Subkutangewebe, Boden oder mediale Wand der Orbita, Fossa pterygopalatina, Sinus ethmoidalis T4a Tumor infiltriert eine oder mehrere der folgenden Strukturen: Inhalt der vorderen Orbita, Wangenhaut, Processus pterygoideus, Fossa infratemporalis, Lamina cribrosa, Siebbeinzellen, Stirnhöhle T4b Tumor infiltriert eine oder mehrere der folgenden Strukturen: Orbitaspitze, Dura, Gehirn, mittlere Schädelgrube, Hirnnerven ausgenommen den maxillären Ast des N. trigeminus V2, Nasopharynx, Clivus. T-Stadien 3.1.8 Speicheldrüsen Unterbezirke Glandula parotis (C07.9) Glandula submandibularis (C08.0) Glandula sublingualis (C08.1) TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor T1 Tumor 2 cm oder weniger in größter Ausdehnung, ohne extraparenchymatöse Ausbreitung T2 Tumor mehr als 2 cm, aber nicht mehr als 4 cm in größter Ausdehnung, ohne extraparenchymatöse Ausbreitung T3 Tumor mehr als 4 cm in größter Ausdehnung und/oder mit extraparenchymatöser Ausbreitung T4a Tumor infiltriert Haut, Unterkiefer, äußeren Gehörgang, N. facialis T4b Tumor infiltriert Schädelbasis, Processus pterygoideus oder umschließt A. carotis interna T-Stadien Anmerkung: „Extraparenchymatöse Ausbreitung“ ist die klinische oder makro­ s­kopische Infiltration von Weichteilen oder Nerven, ausgenommen die unter T4a und T4b aufgelisteten. Der lediglich mikroskopische Nachweis entspricht nicht der „extraparenchymatösen Ausbreitung“ als Klassifikations­kriterium. Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 37 3.1.9 Kopf- und Gesichtshaut Unterbezirke Lippenhaut (ohne Lippenrot) (C44.0) Augenlid (C44. 1) Haut des äußeren Ohres (C44.2) Andere Partien der Gesichtshaut (C44.3) Haut von Kopf und Hals (C444) Haut des Stamms (einschließlich Analrand und perianale Haut) (C44.5) Haut von oberer Extremität und Schulter (C44.6) Haut von unterer Extremität und Hüfte (C44.7) Skrotum (C63.2) T-Stadien TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor T1 Tumor 2 cm oder weniger in größter Ausdehnung, ohne extraparenchymatöse Ausbreitung T2 Tumor mehr als 2 cm, aber nicht mehr als 4 cm in größter Ausdehnung, ohne extraparenchymatöse Ausbreitung T3 Tumor mehr als 4 cm in größter Ausdehnung und/oder mit extraparenchymatöser Ausbreitung T4a Tumor infiltriert Haut, Unterkiefer, äußeren Gehörgang, N. facialis T4b Tumor infiltriert Schädelbasis, Processus pterygoideus oder umschließt A. carotis interna Anmerkung: „Extraparenchymatöse Ausbreitung“ ist die klinische oder makro­ skopische Infiltration von Weichteilen oder Nerven, ausgenommen die unter T4a und T4b aufgelisteten. Der lediglich mikroskopische Nachweis entspricht nicht der „extraparenchymatösen Ausbreitung“ als Klassifikationskriterium. 38 Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 3.2 N-Stadien 3.2.1 N-Stadien außer Nasenrachen und Haut Die regionären Lymphknoten bei Kopf-Hals-Tumoren sind die Kopfund Halslymphknoten einschließlich der oberen mediastinalen Gruppe. Metastatischer Lymphknotenbefall in anderen Regionen wird als Fernmetastasierung kodiert. Das Stadium pN0 erfolgt nach selektiver NeckDissektion und histologischer Untersuchung üblicherweise von 6 oder mehr Lymphknoten oder nach radikaler oder modifiziert-radikaler NeckDissektion und histologischer Untersuchung üblicherweise von 10 oder mehr Lymphknoten. Wenn die untersuchten Lymphknoten tumorfrei sind, aber die Zahl der üblicherweise untersuchten Lymphknoten nicht erreicht wird, soll pN0 klassifiziert werden. Wenn die Größe ein Kriterium für die pNKlassifikation ist, werden die Metastasen, nicht die Lymphknoten gemessen. NX Regionäre Lymphknoten können nicht beurteilt werden N0 Keine regionären Lymphknotenmetastasen N1 Einzelner, auf der Seite des Tumors gelegener und bis zu 3 cm großer Lymphknoten N2a Einzelner, auf der Seite des Tumors gelegener und 3-6 cm großer Lymphknoten N2b Mehrere, auf der Seite des Tumors gelegene und bis zu 6 cm große Lymphknoten N2c beidseitige oder auf der gegenüberliegenden Seite gelegene und bis zu 6 cm große(r) Lymphknoten N3 Lymphknoten, die größer als 6 cm bemessen sind N-Stadien außer Nasenrachen und Haut In der Mittellinie gelegene Lymphknoten gelten als ipsilateral. 3.2.2 N-Stadien Nasenrachen NX Regionäre Lymphknoten können nicht beurteilt werden N0 Keine regionären Lymphknotenmetastasen N1 Metastase(n) in unilateralen Lymphknoten über der Supraklavikulargrube, 6 cm oder weniger in größter Ausdehnung N2 Metastase(n) in bilateralen Lymphknoten über der Supraklavikulargrube, 6 cm oder weniger in größter Ausdehnung N3a > 6 cm in größter Ausdehnung N3b Ausdehnung in die Supraklavikulargrube N-Stadien Nasenrachen Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 39 3.2.3 N-Stadien Karzinome der Haut Regionäre Lymphknoten für Hauttumore der Kopf-Hals-Region sind ipsilaterale präaurikuläre, submandibuläre, zervikale und supraklavikuläre Lymphknoten. N-Stadien Haut NX Regionäre Lymphknoten können nicht beurteilt werden N0 Keine regionären Lymphknotenmetastasen N1 Regionäre Lymphknotenmetastase(n) in einem Lymphknoten, 3 cm oder weniger in größter Ausdehnung N2 Metastase(n) in einem Lymphknoten, mehr als 3 cm, aber nicht mehr als 6 cm in größter Ausdehnung oder in multiplen Lymphknoten, keiner mehr als 6 cm in größter Ausdehnung N3 Metastase(n) in einem Lymphknoten, mehr als 6 cm in größter Ausdehnung 3.3 M-Stadien Es gibt kein Mx mehr! Mx wurde in der 7. Auflage der UICC-TNM-Klassifikation abgeschafft. M0 Keine Fernmetastasierung M1 Fernmetastasierung vorhanden Die Kategorie M1 kann wie folgt spezifiziert werden: 40 PUL Lunge OSS Knochen HEP Leber BRA Hirn LYM Lymphknoten (außer regionäre Lymphknoten MAR Knochenmark PLE Pleura PER Peritoneum ADR Nebenniere SKI Haut OTH Andere Organe Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 3.4 UICC-Stadiengruppierung 3.4.1 UICC-Stadiengruppierung außer Nasenrachen und Haut Auf der Basis des T-, N- und M-Stadiums werden UICC-Stadien ermittelt. UICC-Stadien außer Nasenrachenkarzinom und Haut sind: T N M Stadium 0 Tis N0 M0 Stadium I T1 N0 M0 Stadium II T2 N0 M0 Stadium III T3 N0 M0 T1-3 N1 M0 T1-3 N2 M0 T4a N0-2 M0 jedes T N3 M0 T4b N0-3 M0 jedes T jedes N M1 Stadium IVA Stadium IVB Stadium IVC UICC-Stadien außer Nasenrachen und Haut 3.4.2 UICC-Stadiengruppierung Nasenrachenkarzinom T N M Stadium 0 Tis N0 M0 Stadium I T1 N0 M0 Stadium IIA T2a N0 M0 Stadium IIB T2b N0, N1 M0 Stadium III T1, T2a, T2b T3 N2 N0, N1, N2 M0 M0 Stadium IVA T4 N0, N1, N2 M0 Stadium IVB jedes T N3 M0 Stadium IVC jedes T jedes N M1 UICC-Stadien Nasenrachen Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 41 3.4.3 UICC-Stadiengruppierung Haut UICC-Stadien Haut T N M Stadium 0 Tis N0 M0 Stadium I T1 N0 M0 Stadium II T2 N0 M0 Stadium III T3 N0 M0 T1-3 N1 M0 T1-3 N2, N3 M0 T4 Jedes N M0 jedes T jedes N M1 Stadium IV 3.5 R-Status (Residualtumor) Das Fehlen oder Vorhandensein von Residualtumor (Resttumor) nach Behandlung wird durch die R-Klassifikation beschrieben. Die Angabe des R-Status ist grundsätzlich nicht auf die Situation nach chirurgischer Therapie begrenzt, aber durch die Einteilung zum Teil impliziert und wird im klinischen Alltag ganz überwiegend für den Resektionsstatus nach chirurgischer Therapie verwendet. Die R-Klassifikation ist aus historischen Gründen nicht obligater Bestandteil der TNM·Klassifikation. Aufgrund ihrer prognostischen Bedeutung ist sie aber, insbesondere nach chirurgischer Therapie, unerlässlich. UICC-Klassifikation des R-Status RX Vorhandensein von Residualtumor kann nicht beurteilt werden R0 Kein Residualtumor R1 Mikroskopischer Residualtumor R2 Makroskopischer Residualtumor Ob makroskopischer Residualtumor verbleibt (R2), wird vom Operateur anhand der intraoperativen Vollständigkeit der Tumorresektion bewertet und im Operationsbericht vermerkt. Ob mikroskopischer Residualtumor vorliegt, wird anhand des minimalen Abstands der Tumorgrenzen vom Resektatrand im Rahmen der histopathologischen Aufarbeitung bewertet. Grundlage hierfür sind die Standards des Royal College of Pathologists (15) 42 Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung Klassifikation kleinster Abstand zwischen Tumor und Resektatrand in sano (R0) > 5 mm* knapp in sano (R-Status im Einzelfall zu klären) kleinster Abstand zwischen 5 mm und 1 mm non in sano (R1) kleinster Abstand unter 1 mm Randbildung (R1) Tumor im Resektatrand * Bei Laserresektionen > 3 mm 3.6 Fakultative Deskriptoren 3.6.1 Lymphgefäßinvasion Lx Lymphgefäßinvasion kann nicht beurteilt werden L0 Keine Lymphgefäßinvasion L1 Lymphgefäßinvasion 3.6.2 Veneninvasion Vx Veneninvasion kann nicht beurteilt werden V0 Keine Veneninvasion V1 Mikroskopische Veneninvasion 3.6.3 Perineurale Invasion (ab 2010) PnX perineurale Invasion kann nicht beurteilt werden Pn0 keine perineurale Invasion Pn1 perineurale Invasion 3.7 Abgeleitete und andere Klassifikationschemata Um eine einfachere Beschreibung der untersuchten Populationen und eine Prognose- und Risikostratifizierung zu erreichen, sind weitere vom UICCStadium abgeleitete Klassifikationsschemata gebräuchlich. Außerdem wird zwischen resektablen und nicht-resektablen Tumoren unterschieden. Diese Deskriptoren werden in zahlreichen Publikationen gebraucht, um die unter­ suchte Population zu charakterisieren. Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 43 3.7.1 Lokal begrenzt (limited), lokoregionär fortgeschritten (advanced) und rezidiviert oder metastatisch (recurrent or metastatic) Die häufige Klassifizierung 'locally advanced' reicht von T1N1 bis T4bN3 Deutsch Englisch UICC-Stadien Frühstadien Lokal begrenzt early stage limited I und II lokoregionär fortgeschritten locally advanced III bis IVb Rezidiv oder Fernmetastase recurrent or metastatic Präfix r IVc 3.7.2 Klassifikation nach Prognose des AJCC Cancer Staging Manual Prognosegruppe TNMMerkmale UICCKlassifikation low-risk T1-2 N0 I-II intermediate risk T3 N0 T1-3 N1 III high-risk T4a N0-N1 T1-T4a alle N2 IVa very high risk T4b alle N alle T N3 IVb poor prognosis alle T und N M1 IVc Niedriges Risiko Intermediäres Risiko Hohes Risiko Sehr hohes Risiko ungünstige Prognose 3.7.3 Klassifikation der Arbeitsgemeinschaft deutscher Tumorregister Gruppe Kürzel TNM-Merkmale In situ I Tis N0 M0 Lokal L T1-3 N0 Regional R T4, alle N, M0 alle T, N>0, M0 Fernmetastasen M alle T, alle N, M1 Systemerkrankung S nicht anwendbar unbekannt X Der Nachteil dieses Klassifikationsschlüssels ist die fehlende direkte Zuordnung zu UICC-Stadien. 44 Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 3.8 Ersterkrankung, Rezidiv, Zweittumor Ein erstmaliges Auftreten eines Kopf-Hals-Karzinoms bei einem Patienten wird als Ersterkrankung definiert. Ein erneutes Auftreten eines Karzinoms innerhalb einer 5 Jahres- Frist in einem Bereich, in dem der Patient bereits Zweitkarzinome sind im Kopf-Halsbereich häufig ein Karzinom hatte, wird als Rezidiv und nach den 5 Jahren als Zweittumor klassifiziert. Die Definition von Mehrfachkarzinomen im Kopf-Hals-Bereich wurde erstmals von Warren und Gates (16) aufgestellt und später modifiziert (17). Danach soll ein Zweittumor, der innerhalb einer 5-Jahresfrist entsteht, durch mindestens 2 cm nicht neoplastisch veränderte Mukosa von dem Primär­­­tumor oder dem Resektionsrand nach Entfernung des Ersttumors ent­ fernt sein. Treten die Zweittumoren gleichzeitig oder innerhalb von 6 Monaten auf, so bezeichnet man sie als synchron. Werden sie mehr als 6 Monate zeit­ lich versetzt diagnostiziert, so bezeichnet man sie als metachron. Kopf-Halskarzinome Tumor-Lokalisationen und Stadieneinteilung 45 4 Diagnostisches Vorgehen Minimal erforderlich ist eine vollständige Anamnese mit Dokumentation der Leitsymptome, des Zeitpunkts des Beginns der Symptome, Angaben zum Alkoholkonsum (Drinks pro Tag) sowie des Nikotinkonsums (pack years) und Erfassung von Begleiterkrankungen (s. Komorbiditäten). Diagnoseweisend ist die Inspektion des oberen Aerodigestivtraktes, im Bedarfsfall mit starren oder flexiblen Optiken sowie die Palpation von Mundhöhle und Oropharynx. Bei tumorverdächtigen Veränderungen muss eine histologische Sicherung durch Biopsie herbeigeführt werden. Dies kann in Lokalanästhesie oder im Rahmen einer Untersuchung in Narkose (Panendoskopie, s.u.) erfolgen. Bildgebend ist ein CT (oder MR) mit Kontrastmittel der Primärtumorregion, von Hals und Thorax, sowie eine CT- oder ultrasonografische Untersuchung des Oberbauches erforderlich. Leitsymptome Symptome von Kopf-Hals-Tumoren umfassen Schmerzen im Wangen-, Zungen- oder Gaumenbereich, nicht heilende Wunden auf der Lippe oder innerhalb der Mundhöhle, Knoten oder Geschwüre auf der Lippe, innerhalb der Mundhöhle oder des Rachens, weiße oder rote Flecken am Zahnfleisch oder der Zunge, Blutungen, Schmerzen oder Taubheitsgefühl im Mund, nicht heilende Halsentzündung oder „Fremdkörpergefühl“ im Hals, Kauoder Schluckschwierigkeiten, Kieferschwellungen (Zahnprothese passt nicht mehr oder wird unangenehm), Kieferöffnungsstörungen, Störungen der Zungenmobilität, Stimmklangveränderungen, Ohrschmerzen und meist harte, indolente Knoten am Hals. 4.1 Diagnoseverzögerung Die Mehrzahl der Patienten mit Kopf-Halstumoren stellen sich mit prog­ Vom ersten Symptom bis zur Einleitung der Therapie vergehen oft Monate nostisch ungünstigem fortgeschrittenem Tumorstadium im onkologischen Referenz­zentrum oder Schwerpunkt vor. Es stellt sich die Frage, ob die Zeit­spanne vom ersten Auftreten krankheitstypischer Symptome bis zur Diagnose­sicherung (Diagnoseverzögerung, Diagnostic delay) hierfür eine wesentliche Ursache ist und ob eine Verkürzung dieser Zeitspanne zu einem höheren Anteil von Patienten mit prognostisch günstigen frühen Tumorstadien führt. In den meisten Untersuchungen lag die Zeitspanne zwischen Auftreten erster Krankheitssymptome und der Erstvorstellung im Behandlungszentrum bei deutlich über 3 Monaten. Hinzu kommt die Zeitspanne zwischen Erstvorstellung im onkologischen Zentrum und Einleitung der definitiven Therapie, die in den meisten Untersuchungen ca. 4 Wochen beträgt. Die Datenlage über den Zusammenhang zwischen Diagnoseverzögerung und Krankheitsstadium bei Aufnahme im Zentrum/Schwerpunkt ist inkonsistent. 46 Ein solcher Zusammenhang kann derzeit nicht belegt werden. Möglicherweise Kopf-Halskarzinome Diagnostisches Vorgehen ist die Kinetik der Erkrankung für das Krankheitsstadium bei Aufnahme von größerer Bedeutung. Trotzdem gilt, dass alle Personen mit Verdacht auf einen Kopf-Halstumor unverzüglich in einem onkologischen Referenzzentrum oder Schwerpunkt vorgestellt werden sollen und im Zentrum ohne vermeidbaren Zeitverlust einer definitiven Therapie zugeführt werden müssen. Allgemein wird die Diagnoseverzögerung in 2 Phasen geteilt: die patienten­ bezogene Diagnoseverzögerung ist die Zeitspanne zwischen Erstauftreten von Krankheitssymptomen und Aufsuchen eines/r Arztes/Ärztin und die arztbezogene Diagnoseverzögerung ist die Zeitspanne zwischen Erst­ konsultation eines Arztes/Ärztin und der Vorstellung im onkologischen Referenz­zentrum bzw. onkologischem Schwerpunkt. Phaseneinteilung der Diagnoseverzögerung 4.2 Komorbidität und Performance Status Patienten mit Kopf-Halstumoren haben neben dem Tumorleiden häufig weitere Begleiterkrankungen (Komorbidität). Diese haben Einfluss auf die Prognose des Tumorleidens und beeinflussen die Therapieempfehlung. Im Hinblick auf die Prognose des Tumorleidens wurden mehrere Komorbiditäts­ indices entwickelt. Diese beruhen teils auf detaillierten Untersuchungen zu Erkrankungen einzelner Organsysteme, teils wird zur Bewertung des allgemeinen Gesundheitszustandes ein Scorewert abgeschätzt. In mehreren Untersuchungen zeigte sich der American Association of Anesthsiologists (ASA) Score als aussagekräftiger Parameter für den Einfluss der Komorbidität auf die Prognose des Tumorleidens. Es wird empfohlen, den ASA-Score als Komorbiditätsindex zu verwenden. Als Indices für den PerformanceStatus sind der Karnofski-Index und der Eastern Cooperative Oncology Group (ECOG) Performance Status gebräuchlich. Beide Indices haben bei Kopf-Halstumoren einen geringen Aussagewert, da bei Patienten mit KopfHalstumoren ganz überwiegend Werte von 80%-100% (Karnofsky) bzw. 0 oder 1 (ECOG) erhoben werden. Zusätzliche Risikofaktoren sind oft jahrelanger Nikotin- und C2H5OH Abusus, daraus resultierend Uneinsichtigkeit bezüglich der Tumorerkrankung und der daraus notwendigen Reduktion der zugeführten Noxen. Komorbiditäten Kopf-Halskarzinome Diagnostisches Vorgehen 47 4.3 Klinische Untersuchung Es wird ein vollständiger fachspezifischer Untersuchungsstatus erhoben. Dies umfasst die endoskopische Untersuchung des oberen Aerodigestivtraktes mit starren oder flexiblen Optiken, wenn möglich die Palpation des tumorsuspekten Bezirkes und die palpatorische Untersuchung des Halses. 4.4 Bildgebende Verfahren Synopsis von klinischer Untersuchung und bildgebenden Verfahren ausschlaggebend Bildgebende Verfahren dienen der Identifikation und Ausdehnungsbestimmung des Primärtumors, von lokoregionären Metastasen und von Fernmetastasen sowie der Erkennung von Rezidiven(18;19). Darüber hinaus sind sie essen­ tiell für die interdisziplinäre Kommunikation sowie die Dokumentation der Tumorausdehnung, die interdisziplinäre stadiengerechte Planung und Durch­ führung der Therapie und hierbei insbesondere der Operationsplanung, der Einschätzung der Prognose und für den Vergleich unterschiedlicher Therapien an vergleichbaren Patienten. Bildgebende Verfahren müssen die für das klinische Staging relevanten Fragen nach Infiltration von Haut, Muskeln, Nerven (perineurale Invasion), Gefäßen (Sinus cavernosus, Carotis communis und interna) Knochen und Schädelbasis, Knorpel, Ösophagus, Mediastinum sowie der prävertebralen Faszie beantworten. Für die Operationsplanung relevant ist unter anderem die Frage nach einer Mittellinienüberschreitung bei Zungen- und Zungengrundtumoren oder die Beteiligung von präepiglottischem Fettkörper, subglottischem Raum, Aryknorpel und vorderer Kommissur bei Larnyxkarzinomen. Primärtumore und Halslymphknotenmetastasen können sich der klinischen Untersuchung und auch der sensitivsten Bildgebung einschließlich moderner nuklearmedizinischer Techniken entziehen. Dies rührt daher, dass es sich oft um Tumorzellnester von einigen 1000 Zellen handelt, die erst im weiteren Krankheitsverlauf proliferieren und sich klinisch manifestieren. Dies ist typisch für sogenannte okkulte Halsmetastasen. Die Ausbreitung von Tumoren der Kopf-Hals-Region erfolgt oft entlang bindegewebiger fetthaltiger GewebsLamellen. Das Wachstum entlang dieser Gewebslamellen kann bild­gebend detektiert werden. Die Beteiligung des Gefäß-Nervenbündels, perineurales Wachstum oder extrakapsuläres Tumorwachstum bei Lymph­knoten­ metastasen sind wichtige Informationen bildgebender Verfahren. 48 Kopf-Halskarzinome Diagnostisches Vorgehen Minimal erforderliche bildgebende Staginguntersuchungen umfassen eine Oberbauchsonographie und ein Röntgen-Thorax in zwei Ebenen sowie eine Halssonographie. Dabei ist zu berücksichtigen, dass ohne Schnittbilddiagnostik eine ev. submuköse Tumorausbreitung nicht beurteilt werden kann und insbesondere kleinere Lungenmetastasen vielfach nicht im Röntgen-Thorax erkennbar sind. Empfohlen wird ein CT der Primärtumorregion, von Hals und Thorax sowie vom Oberbauch. Empfehlung Werden bei diesen oder sensitiveren Untersuchungen keine Hinweise für lokoregionäre oder Fernmetastasen gefunden, wird cN0 bzw. cM0 kodiert. 4.4.1 Halssonographie Die Halssonographie ist ein sensitives und spezifisches diagnostisches Verfahren zur Detektion von metastasensuspekten Halslymphknoten. Es sind zahlreiche Kriterien zur Differenzierung von normalen und tumorbefallenen Halssonographie auch für engmaschiges follow up Lymphknoten entwickelt worden, die brauchbare Hinweise zur Dignität liefern. Die Sonographie eignet sich zudem gut zur Darstellung von Zungenund Zungengrundtumoren. Insbesondere beim CUP-Syndrom lässt sich die Sonographie zur gezielten Biopsie oder Drahtmarkierung eines patho­ logischen Halslymphknoten verwenden. 4.4.2 Computertomographie Kopf-Hals Die Computertomographie der Kopf-Halsregion mit Kontrastmittel ist die Standarduntersuchung zur Bildgebung von Kopf-Halstumoren. Weiter­ CT ist das Standardverfahren führende Untersuchungen der Primärtumorregion und der loko­regionären Lymphabflusswege sind nur bei besonderen Fragestellungen erforderlich. Das CT mit Kontrast bildet den Tumor weitgehend größentreu ab und lässt die Beziehungen zu wichtigen Nachbarschaftsstrukturen erkennen. Eine ausreichend sensitive und spezifische Abbildung von Halslymphknoten wird erreicht. Dabei werden folgende Einstellungen bevorzugt: Scanbereich Os frontale oberhalb des Sinus frontalis bis oberes Mediastinum. Bei starken Zahnmetallartefakten ist die Akquisition einer 2. Schichtung mit Angulierung zur Okklusionsebene notwendig. Kopf-Halskarzinome Diagnostisches Vorgehen 49 Scaneinstellungen 120kV, 150mAs, Kollimation 32-128 x 0,5-0,6 mm, pitch 0.8-1.2, (rekonstr.) Schichtdicken axial, coronar und sagittal jeweils 2-3 mm, Rekonstruktions­ intervall 2-3 mm, Kern WT (plus gegebenfalls Knochen). Rekon­struktionen im Knochenkern sind obligat bei V.a. Infiltration der Schädel­basis und bei NNHTumoren. Kontrastmittel obligat, Konzentration ≥ 300 mgJ/ml, Volumen 100-120 ml, Injektionsrate 2-2,5 ml/sec., Startverzögerung 60-80 sec. 4.4.3 Computertomographie Thorax Beim primären Staging wird ein CT des Thorax empfohlen, das günstiger­ weise zugleich mit dem Kopf-Hals-CT durchgeführt wird. Bronchialsystem und Lungen sind eine häufige Lokalisation von simultanen Zweittumoren und Fernmetastasen. Andererseits bestehen oft unspezifische Befunde, die im Verlauf kontrolliert werden. Ungünstig ist es, wenn erst im Rahmen von Verlaufskontrollen erstmals ein Thorax-CT durchgeführt und ein Befund detektiert wird. Man kann nicht zwischen neuaufgetretenem und vorbe­ stehendem Befund differenzieren, wenn primär ein weniger sensitives bild­ gebendes Verfahren durchgeführt worden war. 4.4.4 Kernspintomographie Kernspin, wenn im CT zahlreiche Zahnartefakte zu erwarten sind oder bei speziellen Fragen zur Weichteilinfiltration Die Kernspintomographie ist die bildgebende Modalität mit dem höchsten Weichteilkontrast. Kernspintomographische Untersuchungen sind unter anderem indiziert bei Unverträglichkeit von Kontrastmitteln für CT und der Abklärung von Tumorinfiltration von Muskeln, Knorpel, Knochen, Orbita und intrakraniellen Strukturen. Das MR ist als primäres bildgebendes Verfahren indiziert, wenn aufgrund des Zahnstatus im CT zahlreiche Zahnartefakte zu erwarten sind, die die Tumorregion überstrahlen. Dabei werden folgende Einstellungen empfohlen: Spule Kopf + Halsspule, (additiv Oberflächenspulen) Untersuchungsbereich Sinus frontalis bis Jugulum (coronar), axiale Schichten adaptiert auf Lokal­ befund. 50 Kopf-Halskarzinome Diagnostisches Vorgehen Sequenzen STIR/TIRM: koronar, 3 mm Schichtdicke, 256-512er Matrix T1-SE: axial 3 mm Schichtdicke, 256-512er Matrix T2-TSE +/- Fatsat: axial 3mm Schichtdicke, 256-512er Matrix T1-SE nach i.v. KM (Gadolinium) mit Fatsat: axial (plus koronar bei Mund­ höhlen und Larynxtumoren sowie V.a. Schädelbasisinfiltration) 3 mm Schicht­ dicke, 256-512er Matrix T1-GRE/VIBE Fatsat nach i.v. KM: koronar 3 mm mit axialen und sagittalen Rekonstruktionen. MR-Angio nach i.V. KM und Time of flight Angio bei Gefäßfehlbildungen, -tumoren, Glomustumoren. 4.5 Sicherer Umgang mit CT, MR und US Kontrastmittel Es werden die ESUR (European Society of Urogenital Radiology) Guidelines für Kontrastmittel empfohlen (siehe http://www.esur.org/ESUR_ Guidelines.23.0.html) 4.6 Nuklearmedizinische Diagnostik 4.6.1 PET/CT CT und PET stellen komplementäre Untersuchungmodalitäten dar. Mit Hilfe moderner kombinierter PET/CT-Kamerasysteme ist es möglich, Tumore in einem Untersuchungsgang sowohl rein morphologisch mittels CT als PET/CT bei CUP-Syndrom oder bei unklaren radiologischen Befunden auch hinsichtlich Metabolismus mit Hilfe der PET zu charakterisieren. CT- und PET-Bilder werden überlagert dargestellt und beurteilt. Je nach Anforderung kann eine vollwertige diagnostische CT mit Kontrastmittel oder lediglich eine sogenannte „low-dose“-CT durchgeführt werden, die der Abschwächungskorrektur der PET-Daten dient und nur für lokalisatorische Zwecke herangezogen werden kann. Bei HNO-Tumoren ist 18F-FDG (Fluor­deoxy­glucose) der Tracer der Wahl. Die meisten Tumore, wie zum Beispiel das Plattenepithelkarzinom, zeigen einen gesteigerten Glucose­ meta­­bolismus. FDG als Glucoseanalogon wird dadurch im Gegensatz zu normalem Gewebe vermehrt in Tumorzellen angereichert. Einzelne, seltene Tumor­­entitäten, wie zum Beispiel das adenoidzystische Karzinom, können aber auch FDG-negativ sein und sind somit für eine FDG-PET nicht geeignet. Kopf-Halskarzinome Diagnostisches Vorgehen 51 Primärstaging Der Stellenwert der FDG-PET/CT in der Primärdiagnostik wird in der Literatur unterschiedlich diskutiert. Es herrscht kein Konsens, ob die FDG-PET /CT prinzipiell im Primärstaging zum Einsatz kommen sollte. Sinnvoll erscheint die FDG-PET bei unklaren Befunden in der rein morphologischen-radiologischen Bildgebung. Insbesondere in der Differenzierung zwischen maligner versus reaktiver Lymphadenopathie bei morphologisch vergrößerten Lymphknoten sowie in der Charakterisierung von nicht eindeutig zuordenbaren Befunden in der radiologischen Bildgebung (z.B. unklarer Lungenrundherd) kann die PET richtungsweisend sein. Zusätzlich sei das Potential der PET als sogenannte Markerfunktion erwähnt. Mit Hilfe der PET-Information können synchrone Karzinome bzw. Fernmetastasen festgestellt werden, die in der morphologischen Bildgebung unentdeckt bleiben. CUP-Syndrom Die Abklärung eines CUP-Syndroms stellt eine klare Indikation für eine FDGPET/CT dar. Um allerdings falsch positive Befunde durch postinterventionelle entzündliche Veränderungen zu vermeiden, sollte die PET möglichst vor einer invasiven Abklärung bzw. Durchführung von Biopsien erfolgen. Therapiemonitoring/Therapiekontrolle Für eine Bewertung der FDG-PET/CT im Therapiemonitoring ist die Daten­ lage zu wenig aufschlussreich. Beim Einsatz der FDG-PET im Abschluss­ staging ist darauf zu achten, dass ein ausreichender Abstand zur durch­ geführten Therapie eingehalten wird, um einerseits falsch negative Befunde bei Chemotherapie bzw. falsch positive Befund bei Radiatio infolge post­ radio­gener entzündlicher Veränderungen zu vermeiden (Chemotherapie: 6 Wochen nach Therapieabschluss; Strahlentherapie: 3 Monate nach Therapie­abschluss). Tumornachsorge/Rezidivdiagnostik Mit der FDG-PET ist es möglich narbige, ametabole Veränderungen von vitalem Tumorgewebe abzugrenzen Die FDG-PET/CT wird nicht als Standarduntersuchung im follow-up empfohlen. Radiologische Methoden, insbesondere die CT sind hierfür ausreichend. Beim Rezidivverdacht und im speziellen bei inkonklusiven bildmorphologischen Befunden stellt die FDG-PET jedoch eine sinnvolle Ergänzung dar. Mit der FDG-PET ist es möglich narbige, ametabole Veränderungen von vitalem Tumorgewebe abzugrenzen. Jeder positive PETBefund muss aber histologisch verifiziert werden, um entzündungsbedingte, falsch positive Befunde auszuschließen. 52 Kopf-Halskarzinome Diagnostisches Vorgehen 4.6.2 Knochenszintigraphie Mittels der Knochenszintigraphie ist es möglich pathologische ossäre Prozesse darzustellen, die mit einem gesteigertem Knochenstoffwechsel einhergehen. Neben benignen Veränderungen, wie zum Beispiel Entzündungen und degenerativen Veränderungen werden damit auch osteoblastische bzw. gemischtförmige Knochenmetastasen nachgewiesen. Festzuhalten ist, dass Knochenszintigraphie bei klinischem oder radiologischem Verdacht auf (seltene) ossäre Metastasierung rein osteolytische Metastasen sowie maligne Knochenmarksinfiltrationen mit dieser Methode nicht erkannt werden können. Bei HNO-Karzinomen ist der Einsatz bei lokal fortgeschrittenen Tumoren bzw. bei Tumoren mit nachgewiesenen extraossären Fernmetastasen sinnvoll, weiters in der Abklärung unklarer ossärer Herde in anderen Untersuchungsmodalitäten. 4.7 Panendoskopie in Narkose Die Panendoskopie dient der genauen Bestimmung der Tumorausdehnung, der Sicherung der histologischen Diagnose durch Gewebsbiopsie verdächtiger Bezirke sowie dem Ausschluss von simultanen Zweittumoren Panendoskopie in Vollnarkose im Regelfall erforderlich (20). Bei der Panendoskopie wird die chirurgische Resektabilität des Tumors festgestellt. Sie ist deswegen in erster Linie bei Patienten indiziert, bei denen eine chirurgische Therapie in Frage kommt oder bei denen eine Biopsie­gewinnung ohne Narkose nicht zumutbar ist. Bei der Panendoskopie wird in Vollnarkose (meist total intravenöse Anästhesie) die Mundhöhle, der Rachen, der Kehlkopf, der Tracheobronchialbaum und die Speiseröhre meist mit starren Rohren unter Zuhilfenahme von Optiken und/oder eines Operations­mikroskops visualisiert. Nur mit starren Rohren können die Weich­teile angehoben und die Schleimhaut von Mundhöhle und Rachen gestrafft werden. Dadurch können sonst in Schleimhautfalten verborgene Veränderungen detektiert werden. Bei Halslymhknotenmetastasen bei unbekanntem Primärtumor (CUP-Syndrom) werden, sofern kein Primärtumor visualisiert werden kann, Routinebiopsien aus dem Nasenrachen und dem Zungengrund gewonnen und eine Tonsillektomie durchgeführt (21). Die Visualisierung des Tracheobronchialbaumes gelingt mit starren Endo­ skopen im Regelfall bis zu den Segmentbronchien und den Abgängen der Subsegmentbronchien, die Visualisierung des Ösophagus bis zur Kardia. Wesentliche Risiken umfassen das Narkoserisiko, Zahnschäden und die Perforation der Speiseröhre. Eine genaue Evaluation bezüglich der Intubierbarkeit, aber auch der Möglichkeit einer ausreichenden Masken­ beatmung sollte präoperativ erfolgen, um in Übereinkunft mit dem Chirurgen einen sicheren Atemweg zu gewährleisten; bei schwierigen Verhältnissen empfiehlt sich eine fiberoptische Wachintubation. Zu den Kontra­indikationen gehören die Unmöglichkeit zur orotrachealen Intubation z.B. in Folge einer Kopf-Halskarzinome Diagnostisches Vorgehen 53 Kieferklemme oder HWS-Veränderungen. Die Möglichkeit zur Tracheotomie muss gewährleistet sein und der Patient muss hierüber aufgeklärt werden. Die Ausdehnung eines Tumors an der Schleimhautoberfläche kann visuell Sorgfältige Palpation der Tumorregion und des Zungengrundes während einer Panendoskopie am besten festgestellt werden. Tumore können unter der intakten Schleimhautoberfläche eine wesentlich größere Aus­dehnung haben, die sich visuell nicht erschließt (submuköses Wachs­ tum). Deswegen ist die manuelle oder instrumentelle Palpation des Tumors unerlässlich. Eine palpatorische Untersuchung des Zungengrundes wird in jedem Falle durchgeführt. Zur Feststellung submukösen Wachstums sowie der Tiefeninfiltration sind die Ergebnisse bildgebender Verfahren zu berück­ sichtigen. Über die Panendoskopie ist ein Operationsbericht zu erstellen. Dokumentiert werden die Schleimhautbefunde der einzelnen Bezirke und Unterbezirke Tumorzeichnung auf Formblättern des oberen Aerodigestivtraktes sowie die tatsächlichen Tumorgrenzen, also einschließlich palpatorisch erfassbarer submuköser Anteile. Diese werden zusätzlich in einer Tumorzeichnung auf geeigneten Vorlagen genau skizziert. 4.8 Sentinel-Lymphknotenbiopsie Sentinel-Lymphknoten (SL) liegen in der initialen lymphatischen Drainage einer primären bösartigen Läsion. Die Sentinel-Lymphknotenbiopsie (SLB) dient der Detektion subklinischer Metastasen in SL beim cN0-Hals. Der Primärtumor wird mit einem Radiotracer (meist Technetium-Tc99mSchwefel­kolloid oder -Albumin-Mikrokolloid) intramukodermal umspritzt und der Abfluss des Tracers in die SL wird mit einer Gammakamera dokumentiert (Lympho­szintigraphie). Am gleichen Tag verwendet der Operateur an der zuvor durch Gammaszintigraphie identifizierten Stelle eine steril überzogene hand­gehaltene Gamma-Sonde, um intraoperativ transkutan die Lage der SLs zu bestätigen. Daraufhin kann der SL freigelegt und zur histopathologischen Unter­suchung geschickt werden. Da die histopathologische Detektion im Schnell­schnitt nicht ausreichend zuverlässig ist, erfolgt im Falle des Nach­ weises von Mikrometastasen nach HE-Färbung möglichst in Seriens­chnitten die kurative Behandlung des Halses in einem zweiten Schritt gesondert. SLB können bei T1 und T2 Tumoren von Gesichts- und Kopf­haut, Mundhöhle und Oropharynx durchgeführt werden. Andere Kopf-Hals-Lokalisationen sind der Injektion des Radiotracers in der Regel nicht ohne Vollnarkose zugänglich. Aufgrund der Besonderheiten des zervikalen Lymphsystems 54 gibt es am Hals meist mehrere SL und häufig einen bilateralen Abfluss, so Kopf-Halskarzinome Diagnostisches Vorgehen dass zur vollständigen Sentinel-Entfernung meist mehrere Lymphknoten entfernt werden müssen. SL in der Nähe des Primärtumors sind aufgrund von Streustrahlung schwer zu finden. Bei Kopf-Hals Karzinomen der Sentinel-Lymphknotenbiopsie derzeit kein Standardverfahren Primärtumorstadien > T2 ist die SLB unzuverlässig. Die Ausdehnung und das Volumen dieser Tumore machen aberrante Abflusswege wahrscheinlich. Voroperierte oder vorbestrahlte Patienten sind für die SLB nicht geeignet. Zusammengefasst sind für die SLB bei frühen oralen und oropharyngealen Plattenepithelkarzinomen derzeit 3 Indikationen anerkannt: (1) Staging des ipsilateralen Halses bei einseitigen cT1/2 cN0 Tumoren, (2) Staging des ipsiund kontralateralen Halses bei Tumoren in der Mittellinie oder Tumoren mit Überschreiten der Mittellinie (CT1/2 cN0) und (3) Staging des kontralateralen Halses bei Tumoren in der Mittellinie oder Tumoren mit Überschreiten der Mittellinie (CT1/2 cN>0 ipsilateral)(22). Da die selektive Halslymphknotendissektion eine nur unwesentlich höhere Morbidität als die SLB aufweist und zugleich therapeutisch wirksam ist, wird beim cN0 Hals in erster Linie die selektive Halslymphknotendissektion anstatt einer SLB empfohlen. 4.9 Abklärung bei Verdacht auf Halslymphknotenmetastase bei unbekanntem Primärtumor (CUP Syndrom) Halslymphknotenmetastasen eines Plattenpithelkarzinoms erscheinen meist ca. 5% CUP-Syndrome als harte indolente zervikale Knoten. Lässt sich bei einer fachgerechten klinischen Untersuchung des oberen Aerodigestivtraktes ein Suspicium für einen Primärtumor im lymphatischen Quellgebiet eines Halslymphknotens nachweisen, so folgt die histologische Sicherung ausschließlich aus dem Primär­tumor-Suspicium. Ist das Primärtumor-Suspicium histologisch positiv, ist keine weitere histologische Abklärung des Halslymphknoten erforder­lich, sondern man kann mit ausreichender Wahrscheinlichkeit von einer Hals­ lymph­knotenmetastase ausgehen. Findet sich kein Primärtumor-Suspicium, wird zur zytologischen oder histologischen Abklärung eine Feinnadelbiopsie oder eine Stanzbiospie aus dem Knoten durchgeführt. Für die Diagnostik bei CUP-Syndrom ist im Regelfall ein PET/CT vor der obligatorischen Panendo­ skopie mit repräsentativen Gewebeentnahmen sinnvoll. Eine offene Biopsie aus einer potentiellen Halslymphknotenmetastase führt wegen Tumorzellverschleppung zu einer Verschlechterung der Prognose und darf nicht erfolgen. Beachte Kopf-Halskarzinome Diagnostisches Vorgehen 55 4.10 Zahnärztliche Rehabilitation Zahnmedizinische Diagnostik erforderlich Diagnostik und Planung der dentalen Das Ziel der dentalen Betreuung von Patienten mit Kopf-Halstumoren ist es, orale Komplikationen zu minimieren und eine Reduktion lokaler und systemischer Infektionen während und nach der onkologischen Therapie zu erreichen. Dazu ist eine enge Kooperation zwischen den behandelnden Kliniken, den Zahnambulatorien der Krankenkassen und dem nieder­ gelassenen Bereich notwendig. Die Maßnahme können in Maßnahmen prä, inter und post radiationem eingeteilt werden. 4.10.1 Maßnahmen prä radiationem Obligatorisch ist die dentale Fokussuche zum frühestmöglichen Zeitpunkt, spätestens 3 Wochen vor Beginn der geplanten Strahlentherapie. Sie beinhaltet eine gründliche zahnärztliche Untersuchung, die durch radiologische Aufnahmen ergänzt wird. Eine Panoramaaufnahme (OPTG) und ein Einzelbildstatus werden empfohlen. In den Fällen, wo es durch einen intraoralen Tumor zu Komplikationen bei den Einzelzahnaufnahmen kommt (Schmerzen), sollte mindestens eine Panoramaaufnahme, Bissflügelaufnahmen und wenn möglich bei jedem Zahn mit einer apikalen Transluzenz und jedem nicht sensiblen Zahn ein Einzelbild angefertigt werden. Ziel ist das Auffinden von Zähnen die potentiell als Infektionsherd zu betrachten sind (Risikozähne). Liegen diese Zähne im oder in der Nähe des Strahlenfeldes, sollten sie präventiv entfernt werden, um als Spätkomplikation die infizierte Osteoradionekrose zu vermeiden. Aufgrund der Gefäßversorgung sind die Molaren im Unterkiefer besonders kritisch zu untersuchen. Hierfür muss das voraussichtliche Strahlenfeld zur Fokussuche bekannt sein. Damit wird eine adäquate Extraktionsplanung möglich. Diese Extraktionen müssen in einem genügend langem Zeitraum (mindestens 10-14 Tage) vor Beginn der Strahlentherapie und/ oder Chemotherapie erfolgen, damit eine entsprechende Wundheilung gewährleistet werden kann. Als potentielle Foki gelten: • Alle endodontisch versorgten Zähne • Alle nicht sensiblen Zähne • Fortgeschritten parodontal geschädigte Zähne • Fortgeschritten kariös zerstörte Zähne • Teilretinierte Zähne mit Risiko zur Schlupfwinkelinfektion • Insuffizient konservierend versorgte Zähne, bei deren Restauration eine Beteiligung der Pulpa erwartet werden kann, da dies eine Wurzelbehandlung 56 zur Folge hätte Kopf-Halskarzinome Diagnostisches Vorgehen Desweiteren beinhaltet die Fokussuche eine umfassende zahnärztliche Untersuchung mit Sensibilitätsstatus und Kariesdiagnostik der einzelnen Zähne, Beurteilung der konservierenden und prothetischen Versorgung und Beurteilung des parodontalen Status. Insbesondere Zähne, deren konser­ vierende Versorgung mehr als 50% ausmacht und die im Strahlenfeld liegen, sind kritisch zu beurteilen. Die möglichen Infektionsherde und zahnärztlichen Befunde werden interdisziplinär diskutiert und die notwendigen Maßnahmen mit dem Patienten und seinem betreuenden Zahnarzt besprochen. Vor der tumortherapeutischen Behandlung sollten folgende orale Sanierungs­ maßnahmen erfolgen: • Extraktion der Risikozähne • Glätten scharfer Kanten an Zähnen, Füllungen und Zahnersatz • Notwendige konservierende Maßnahmen • Ggf. Abtragen scharfer Knochenkanten • Wenn metallische prothetische Konstruktionen oral fest auf Implantaten verankert sind (Stegkonstruktionen), die eine hohe Ordnungszahl im Elementensystem vorweisen, müssen diese entfernt werden (z.B. Gold 79) • Anfertigung von Schutzschienen zur Verringerung der Streustrahlung ausge­hend von metallischen Füllungen in der Mundhöhle die gleichzeitig als Applikationsträger für die Fluoridierungsmaßnahmen (s.unten) einge­ setzt werden können • Orale Prophylaxe durch Fachpersonal (Prophylaxeassistentinnen): - Entfernung aller harten und weichen Beläge am Restzahnbestand - Motivation und Instruktion zu überdurchschnittlicher Mundhygiene (Mund­hygieneprotokoll) - Instruktion Anwendung Fluoridierungsschiene und Fluoridgel 1,1% zur Kariesprophylaxe - Hilfe bei der Zubereitung der Mundspüllösung (z.B. Natriumhydrogen­ carbonat­mundspüllösung) • Ernährungsberatung In jedem Fall ist das zeitliche Fenster bis zum Beginn der Strahlentherapie zu berücksichtigen. 4.10.2 Maßnahmen intra radiationem In der Phase der tumortherapeutischen Bestrahlung bis zirka 6 Wochen danach sollten alle zahnärztlichen und chirurgischen Behandlungen unbedingt vermieden werden, die mit einer Wundsetzung einhergehen. Jede Schädigung der Mundschleimhaut stellt eine potentielle Eintrittspforte für Infektionserreger dar, die durch prophylaktische Maßnahmen vermieden werden sollte. Die Mukositis ist direkt durch toxische Zytostatika (z.B. Fluorouracil 5-FU, Kopf-Halskarzinome Diagnostisches Vorgehen 57 Methotrexat) und indirekt durch Übelkeit, Erbrechen und Unterernährung bedingt. Zur Prophylaxe sind in diesem Zeitraum zahnhygienische Maß­ nahmen und Mundspüllösungen (Natriumhydrogencarbonatlösung, Fluorid­ lösungen und Caphosol zur Remineralisation) und Salbeitee geeignet. Zur Vermeidung einer Prothesendruckstelle, die als Epitheldefekt eine Bestrahlungs­pause erzwingen würde, gilt unter Bestrahlung eine strenge Prothesen­karenz (auch 3 Monate bis zu 6 Monaten nach dem letzten Bestrahlungs­termin). Im Idealfall wird die Mundschleimhaut während der Bestrahlung einmal wöchentlich untersucht (bei Infektionen ggf. AB-Gabe, Fungo­statikum). Desweiteren können folgende Maßnahmen unterstützend verfolgt werden: • Ernährungsberatung (Karenz externer Noxen wie Alkohol, Nikotin, scharfe Speisen, stark zuckerhaltige Lebensmittel etc.) • Regelmäßiges Befeuchten der Mundhöhle • Täglicher Einsatz der Fluoridierungsschiene • Trismusprophylaxe-Mundöffnungsübungen • Stimulierung der Speichelflußrate: • Pilocarpin 5,0 mg 3/d bis 10 mg 3/d • künstlicher Speichel (Mouthkote, Xerolube, Moistir, Salivart, Sage) • Biotene Produkte Kaugummi, Zahnpasta • Akupunktur zur Stimulierung der Speichelflußrate 4.11 Erheben des Ernährungsstatus, Ernährungstherapie, Perkutane endoskopische Gastrostomie Mangelernährung und Kachexie sind bei Patienten mit Kopf-Halstumoren Bei fortgeschrittenen UICC-Stadien ist prätherapeutisch meist eine PEG-Anlage indiziert häufig und unbehandelt prognostisch ungünstig. Bei Patienten mit KopfHalskarzinomen soll im Rahmen der Erstdiagnose und wiederholt im weiteren Krankheitsverlauf ein Screening des Ernährungszustandes erfolgen. Als Instrument wird das Hauptscreening des Nutrition Risk Screening 2002 (NRS), ergänzt um das Präalbumin als biochemischer Marker empfohlen. Der Score beinhaltet die Erhebung anthropometrischer Daten (BMI), eine Beurteilung der oralen Nahrungszufuhr, eine Wertung des Schweregrades der Erkrankung, sowie das Alter des Patienten. Das numerische Ergebnis soll dokumentiert werden. Bei Patienten mit einem Scorewert ≥ 3 im NRSHaupt­screening soll eine Ernährungstherapie durch eine Fachkraft für Diätologie eingeleitet werden. Unter onkologischer Therapie sind zumindest wöchentliche Ernährungsvisiten durchzuführen. Nachkontrollen finden im Rahmen der onkologischen Nachuntersuchungen statt und werden überdies 58 dem Bedarf entsprechend geplant. Kopf-Halskarzinome Diagnostisches Vorgehen Diagnostischer Work Flow Kopf-Halskarzinome Diagnostisches Vorgehen 59 Eine perkutane endoskopische Gastrostomie (PEG) ist indiziert, wenn mit Störungen der Nahrungsaufnahme zu rechnen ist, die eine perorale Bedarfsdeckung über mehr als 14 Tage unwahrscheinlich machen. Alternativ zur endoskopisch perkutanen Gastrostomie kann eine CT-gesteuerte Gastrostomie oder eine chirurgische Gastrostomie erfolgen. Bei kurzfristiger (<14 Tage) Verhinderung der peroralen Nahrungs- und Flüssigkeitsaufnahme kommt eine nasogastrale Ernährungssonde in Betracht. 4.12 Diagnostik von Hören, Stimme, Sprechen, Schlucken Die Kopf- und Halsregion beherbergt Strukturen wichtiger funktionaler Systeme wie des Hörens, der Stimmbildung, des Sprechens und Schluckens, Stimme, Sprechen, Schlucken: Ausführliche Diagnostik und Beratung die für die Integration des Patieten in seine Umgebung von großer Bedeutung sind. Zur Beurteilung ihrer Funktionalität werden folgende diagnostische Maßnahmen empfohlen: • Erhebung des ohrmikroskopischen Befunds sowie audiometrische Abklärung des Hörvermögens, • Erhebung des Stimmstatus inklusive diagnostischer Lupenlaryngoskopie und - wenn möglich - Endo-Stroboskopie, • Spiegeltechnische und endoskopische Beurteilung der Artikulation, • Beurteilung des Schluckvermögens (i.d. R. mittels flexibler Video-Endo­­ s­kopie). 4.12.1 Erstuntersuchung Der TAKO empfiehlt eine phoniatrische Konsultation unmittelbar nach Diagnose­­stellung bzw. nach Festlegung des Tumortherapiekonzeptes. Dazu sollte der Patient/die Patientin ggf. eine Begleitperson beiziehen. Bei der ärztlichen Erstuntersuchung kann festgestellt werden, welche Aus­wirkung die Tumortherapie auf die oben genannten Strukturen und deren Funktions­ ausfall haben kann. Dabei werden mögliche präventive sowie erforderliche rehabilitative Maßnahmen geplant. Der Patient/die Patientin und ggf. die Begleitperson werden darüber ausführlich informiert und über die Modalitäten der Hör-, Stimm-, Sprech- und Schluckrehabilitation nach Tumortherapie aufgeklärt. Sollte bei der Erstuntersuchung bereits eine gravierende Schluckstörung als Folge der Tumortherapiekonzeptes festgestellt werden, ist die baldige Anlage einer PEG- Sonde zu empfehlen. 60 Kopf-Halskarzinome Diagnostisches Vorgehen 4.12.2 Stimmlosigkeit und Stimmersatz Bei Tumoren im Bereich der stimmbildenden Organe strebt die Tumortherapie grundsätzlich den Stimmerhalt an. Dies ist in einigen Fällen aber nicht möglich, sodass ein partieller oder totaler Stimmverlust eintritt (Kehlkopfteilresektion oder totale Kehlkopfentfernung), der einen Ersatzsphonationsmechanismus notwendig macht. Die mögliche Ersatzphonation hängt vom Ausmaß der notwendigen Resektion und den verbleibenden Reststrukturen des Larynx und/oder der oropharyngealen Strukturen ab. Deshalb ist zur Einschätzung der Stimmrehabilitation eine phoniatrische Konsultation notwendig. Als Standardverfahren der Stimmrehabilitation bei Kehlkopflosigkeit ist derzeit der Einsatz einer Stimmprothese (Stimmventil) bei pharyngotrachealer Fistel­ anlage etabliert. Da die Prothese wegen Besiedelung mit Candidaspezies und konsekutiver Undichte des Stimmventils (Stimmverschlechterung, Aspiration) nur zeitlich begrenzt benutzt werden kann, muss sie regelmäßig gewech­selt werden. Die Benutzungsdauer beträgt im Mittel etwa 3 Monate, variiert jedoch zwischen wenigen Wochen und mehreren Monaten. Zusätzlich zur operativen Stimmrehabilitation mittels Shuntbildung und Stimm­­prothese besitzt das Erlernen der Ruktusstimme (Oesophagusersatz­ stimme) als funktionelle Stimmrehabilitation nach wie vor seine Bedeutung. Bei ungenügender Stimmgebung mit der Stimmprothese ist mit der erlernten Ruktusstimme eine lautsprachige Verständigung möglich. Bei bestehenden Kontraindikationen für den Einsatz von Stimmprothesen (z.B. einer pulmonalen Grunderkrankung) ist die Ruktusstimme weiterhin eine etablierte Alternative der Stimmrehabilitation. Die Stimmrehabilitation mittels Stimmprothese und Ruktusstimme ermög­licht bei den meisten Patienten eine zufriedenstellende sprachliche Kommuni­ kation. Als dritte Form der Stimmrehabilitation nach totaler Kehlkopf­ent­ fernung steht in indizierten Fällen die elektronische Sprechhilfe zur Verfügung, die auch eine kurzfristige Verständigung ermöglicht. 4.12.3 Besonderheiten bei einzelnen Tumorlokalisationen Bei Lippenkarzinomen sind die Lippenform und möglicherweise der Mund­ schluss beeinträchtigt. Eine Rehabilitation zur Verbesserung der Artikulations­ fähigkeit und der Schluckfunktion ist hier je nach Ausmaß indiziert. Mundhöhlentumore haben häufig Bewegungsstörungen oder Substanz­ verluste der Zunge zur Folge, die zu Behinderungen der oralen Schluck­ phase und zu Artikulationsstörungen führen können. In diesen Fällen ist eine Rehabilitation zur Verbesserung der Artikulation und vor allem Schluck­ funktion erforderlich. Kopf-Halskarzinome Diagnostisches Vorgehen 61 Pharyngeale Tumoren können, je nach Lokalisation, zu einer Beein­ trächtigung der Gaumensegelbeweglichkeit führen. Die Folgen sind Nasalität (Rhinophonia aperta), Dysphagie (nasale Penetration) und Mittel­ohr­ belüftungs­störungen (Tubenfunktion). Auch hier sind rehabilitative Maßnahmen angezeigt. Bei Tumoren im Bereich des Hypopharynx und Larynx sind Stimmund Schluckstörungen eine mögliche Folge, die sich mitunter bei einer notwendigen Radiochemotherapie weiter verstärken können. Eine Stimmund insbesondere Schluckrehabilitation zur Verhinderung einer Aspiration sind hier dringend indiziert. Bei ausgeprägten Schluckstörungen kann eine lang­fristige parenterale Ernährung mittels Sondennahrung nötig werden, um eine Mangelernährung zu verhindern. Hierzu ist die Anlage einer PEGSonde angezeigt. Die Hörrehabilitation erfolgt nach ohrmikroskopischer Befunderhebung und audiologischer Diagnostik. Die Schluck-, und Stimmrehabilitation sowie die Verbesserung der Artikulation werden nach differenzierter (endoskopischer) Diagnostik der Strukturen zur Stimmfunktion und des Schluckvermögens durchgeführt. 4.12.4 Chemotherapie/Radiochemotherapie Vor, während und nach Chemotherapie oder Radiochemotherapie mit CDDP werden wegen dessen Ototoxizität audiologische Kontrolluntersuchungen empfohlen. Bei akut auftretender Hörminderung unter CDDP Therapie ermöglicht ein Wechsel zu Carboplatin eine Verringerung der Ototoxizität. Unter Chemotherapie/Radiochemotherapie entwickelt sich oft eine Mucositis, welche die Rehabilitation erschweren kann. Bei starker Schmerzsymptomatik und/oder erheblicher Schleimhautschwellung ist es dann notwendig, die Rehabilitation kurzfristig zu unterbrechen. 4.12.5 Zusammenfassung Eine Rehabilitation bei Störungen des Hörens, der Stimmbildung, des Sprechens und des Schluckens nach Tumortherapie ist indiziert, um dem Patienten eine Reintegration in seine Umgebung zu ermöglichen eine adäquate Lebensqualität zu bieten. Die Rehabilitation setzt eine phoniatrische Diagnostik zur Eruierung „funktioneller Reserven“ und Erstellung eines individuellen, mehr­ dimensionalen Rehabilitationskonzepts für eine gezielte Therapie voraus. Dabei kommen neben den notwendigen medizinischen Maßnahmen zur 62 organischen oder funktionellen Verbesserung der Stimm,-Sprech-und Kopf-Halskarzinome Diagnostisches Vorgehen Schluck­funktion die logopädische Therapie, Ergotherapie, Physiotherapie sowie eine entsprechende Ernährungsberatung zum Einsatz. Während der Rehabilitation sind regelmäßige phoniatrische Kontrollen angezeigt, um optimal aufeinander abgestimmte rehabilitative Maßnahmen jederzeit im Therapieverlauf zu gewährleisten. Die Rehabilitation soll möglichst früh beginnen („Akutrehabilitation“). Es ist damit zu rechnen, dass sie - mit Unterbrechungen - über einen längeren Zeitraum hinweg durchgeführt werden muss. Kopf-Halskarzinome Diagnostisches Vorgehen 63 5 Therapie 5.1 Therapiegrundsätze bei Erstdiagnose Im Regelfall erfolgt die Therapie von Tumoren der Stadien I und II unimodal chirurgisch oder radiotherapeutisch, die der fortgeschrittenen Stadien multimodal. Dabei sind die genaue Ausdehnung des Tumors, die Histologie, seine Beziehung zu kritischen Strukturen, der zu erwartende posttherapeutische Defektzustand, der Allgemeinzustand und vor allem der Wunsch des Patienten zu berücksichtigen. Bei Resektabilität (s.u.) wird die primäre chirurgische Therapie mit oder ohne postoperative Radiotherapie empfohlen, andernfalls die primäre Radiotherapie oder Radio­chemotherapie . (bei Larynxkarzinomen wird der Organerhalt durch teilablative chirurgische Verfahren oder primäre kombinierte Radiochemotherapie empfohlen). Bei Therapiealgorithmus 64 Kopf-Halskarzinome Therapie prätherapeutischem Verdacht auf extra­kapsuläres Lymphknotenwachstum wird eine primäre RCT und 6 Wochen nach Abschluss der Primärtherapie bei vollständigem Ansprechen des Primärtumors eine geplante Hals­ lymphknotendissektion empfohlen. Bei Kopf-Halstumoren der Tumor­stadien III und IV ist nach primärer chirurgischer Therapie eine postoperative Radiotherapie indiziert. Gelingt bei primärer chirurgischer Therapie keine R0Resektion oder wenn postoperativ extra­kapsuläres Lymphknotenwachstum festgestellt wird, ist eine postoperative Radio­chemotherapie indiziert. 6-12 Wochen nach Abschluss der Primärtherapie soll eine Kontrolle des Remissionsstaus erfolgen. Bei Tumorpersistenz nach Abschluss der Initial­ therapie ist wenn möglich eine Salvage-Chirurgie indiziert. 5.2 Chirurgische Therapie 5.2.1 Indikation zur chirurgischen Therapie – Resektabilität und Operationsrisiko Chirurgische Verfahren können unter kurativem und palliativem Ansatz eingesetzt werden. Eine chirurgische Tumorresektion unter kurativem Ansatz ist nur indiziert, wenn der Tumor resektabel ist. Der Begriff Resek­ tabilität ist nicht durch internationale oder nationale Leitlinien definiert. Unter Resektabilität wird verstanden, dass der Tumor und loko­regionäre Kurative chirurgische Therapie nur, wenn R0-Resektion mit großer Wahrscheinlichkeit erreichbar Metastasen mit großer Wahrscheinlichkeit mit einem adäquaten Sicherheits­ abstand bei für den Patienten vertretbarer Morbidität entfernt werden können. Adäquater Sicherheitsabstand bedeutet, dass am histo­patho­logischen Resektionspräparat allseits ein Abstand von 5mm zwischen Tumor­rand und Resektatrand nicht unterschritten wird (R0). Es wird geschätzt, dass ca. 75% der Patienten nach R1 Resektion gegenüber 25% nach R0 Resektion ein Lokalrezidiv entwickeln. Da das Tumorpräparat durch Entnahme und Fixierung um etwa 30% schrumpft (23), muss die Resektion intraoperativ allseits mit einem chirurgischen Sicherheitsabstand von 10mm zum sichtbaren oder tastbaren Tumorrand erfolgen, um einen histopathologischen Sicherheitsabstand von 5 mm zu gewährleisten. Bei Laserresektionen kann ein etwas geringerer Resektionsabstand gewählt werden, da der Laserschnitt selbst einen Durchmesser von ca. 0,5 mm hat und sich an ihn eine ca. 0,5 mm große Verkohlungs- und Nekrosezone anschließt. Tumor­freie Nachresektate haben keine vergleichbare Aussagekraft wie eine R0 Resektion, weil nicht gewährleistet ist, dass die Nachresektate an der richtigen Stelle entnommen wurden (24). Bei Resektion von Tumoren fortgeschrittener Tumorstadien sind in der Regel rekonstruktive Verfahren erforderlich, um den entstandenen Defekt zu versorgen. Eine R1-Resektion ist eine Indikation zur Nachresektion Kopf-Halskarzinome Therapie 65 oder zur postoperativen Radiotherapie (Stadium I/II) oder kombinierten Radiochemotherapie (Stadium III/IV) (9), die mit einer wesentlichen höheren Morbidität einhergeht als die adjuvante Radiotherapie nach R0 Resektion (25). In der Regel ist bei Fernmetastasierung keine primäre chirurgische Therapie von Primärtumor und lokoregionären Metastasen indiziert. Operationsplanung in enger Abstimmung mit dem Anästhesie-Team Neben der Resektabilität ist die Einschätzung des Operationsrisikos wesent­ liche Entscheidungsgrundlage. Eine präoperative anästhesiologische Unter­ suchung und gemeinsame perioperative Planung ist eine grundsätzliche Voraussetzung der chirurgischen Therapie von Kopf-Halstumoren. 5.2.2 Empfohlene chirurgische Verfahren unter kurativem Ansatz aufgeschlüsselt nach Tumorlokalisation Die chirurgischen Verfahren richten nach dem T und N Stadium und werden im Folgenden tabellarisch dargestellt. Die Empfehlungen lehnen sich an die Empfehlungen des ACO-ASSO Manual der Österreichischen Gesellschaft für chirurgische Onkologie (2), die Kurzgefassten Interdisziplinären Leitlinien 2008 - Empfehlungen zur Diagnostik und Therapie maligner Erkrankungen der Deutschen Krebsgesellschaft (3), die Empfehlungen für die Abklärung, Behandlung und Nachsorge von Patienten mit Karzinomen des Kopf-HalsBereiches der Schweizerischen Gesellschaft für Oto-Rhino-Laryngologie, Hals- und Gesichtschirurgie (26) sowie die Clinical Practice Guidelines Head and Neck Cancers des National Comprehensive Cancer Network der USA (5) an. Bei den folgenden chirurgischen Therapieempfehlungen ist T4 mit T4a gleichzusetzen, da ein Tumorstadium T4b im Regelfall bedeutet, dass der Tumor nicht resektabel ist. 66 Kopf-Halskarzinome Therapie Lippenkarzinom cT1 cT2 cN0 Resektion Resektion + Defektrekonstruktion cN1 Resektion + mRND cN2a/b Resektion + mRND cN2c Resektion + mRND bds. cN3 Resektion + RND Resektion + Defektrekonstruktion + mRND Resektion + Defektrekonstruktion + mRND Resektion + Defektrekonstruktion + mRND bds. Resektion + Defektrekonstruktion + RND cT3 cT4a Resektion + Defektrekonstruktion + SND Resektion + Defektrekonstruktion + mRND Resektion + Defektrekonstruktion + mRND Resektion + Defektrekonstruktion + mRND bds. Resektion + Defektrekonstruktion + RND Resektion + Defektrekonstruktion + SND Resektion + Defektrekonstruktion + mRND Resektion + Defektrekonstruktion + mRND Resektion + Defektrekonstruktion + mRND bds. Resektion + Defektrekonstruktion + RND Bei Primärtumoren nahe der Mittellinie oder cN2c ist die bilaterale SND und/ oder mRND anzustreben. Bei cT1cN1 Tumoren kann eine ipsilaterale SND anstatt einer mRND erwogen werden. Bei Tumorstadien >T2 kann eine kontralaterale SND auch bei klinischem negativem kontralateralem Hals erwogen werden. Mundhöhlenkarzinom cT1 cN0 cN1 cN2a/b cN2c cN3 enorale Resektion + SND enorale Resektion + mRND enorale Resektion + mRND enorale Resektion + mRND bds. enorale Resektion + RND cT2 enorale Resektion + Defektrekonstruktion + SND enorale Resektion + Defektrekonstruktion + mRND enorale Resektion + Defektrekonstruktion + mRND enorale Resektion + Defektrekonstruktion + mRND bds. enorale Resektion + Defektrekonstruktion + RND cT3 cT4a transfaziale Resektion + Defektrekonstruktion + SND transfaziale Resektion + Defektrekonstruktion + mRND transfaziale Resektion + Defektrekonstruktion + mRND transfaziale Resektion + Defektrekonstruktion + mRND bds. transfaziale Resektion + Defektrekonstruktion + RND transfaziale Resektion + Defektrekonstruktion + SND transfaziale Resektion + Defektrekonstruktion + mRND transfaziale Resektion + Defektrekonstruktion + mRND transfaziale Resektion + Defektrekonstruktion + mRND bds. transfaziale Resektion + Defektrekonstruktion + RND Kopf-Halskarzinome Therapie 67 Bei Primärtumoren nahe der Mittellinie oder cN2c ist die bilaterale SND und/ oder mRND anzustreben. Bei cT1cN1 Tumoren kann eine ipsilaterale SND anstatt einer mRND erwogen werden. Bei Tumorstadien >T2 kann eine kontralaterale SND auch bei klinischem negativem kontralateralem Hals erwogen werden. Oropharynxkarzinom cT1 cT2 cT3 cT4a cN0 transorale Resektion + SND transorale oder transzervikale Resektion + Defektrekonstruktion + SND transfaziale oder transzervikale Resektion + Defektrekonstruktion + SND transfaziale oder transzervikale Resektion + Defektrekonstruktion + SND cN1 transorale Resektion + mRND transorale oder transzervikale Resektion + Defektrekonstruktion + mRND transfaziale oder transzervikale Resektion + Defektrekonstruktion + mRND transfaziale oder transzervikale Resektion + Defektrekonstruktion + mRND cN2a/b transorale Resektion + mRND transorale oder transzervikale Resektion + Defektrekonstruktion + mRND transfaziale oder transzervikale Resektion + Defektrekonstruktion + mRND transfaziale oder transzervikale Resektion + Defektrekonstruktion + mRND cN2c transorale Resektion + mRND bds. transorale oder transzervikale Resektion + Defektrekonstruktion + mRND bds. transfaziale oder transzervikale Resektion + Defektrekonstruktion + mRND bds. transfaziale oder transzervikale Resektion + Defektrekonstruktion + mRND bds. cN3 transorale Resektion + RND transorale oder transzervikale Resektion + Defektrekonstruktion + RND transfaziale oder transzervikale Resektion + Defektrekonstruktion + RND transfaziale oder transzervikale Resektion + Defektrekonstruktion + RND Bei Primärtumoren nahe der Mittellinie oder cN2c ist die bilaterale SND und/ oder mRND anzustreben. Bei cT1cN1 Tumoren kann eine ipsilaterale SND anstatt einer mRND erwogen werden. Bei Tumorstadien >T2 kann eine kontralaterale SND auch bei klinischem negativem kontralateralem Hals erwogen werden. Nasopharynxkarzinom Das Nasopharynxkarzinom stellt im Regelfall keine Indikation zur chirurgischen Therapie des Primärtumors dar. Wenn nach Abschluss der Radiotherapie der Primärtumor nicht mehr, wohl aber resektable regionäre Lymphknotenmetastasen nachweisbar sind, ist eine Neckdissection angezeigt. Bei großen Metastasen (N3a), vor allem beim Plattenepithelkarzinom, kann in besonderen Fällen eventuell eine Neck- 68 dissection vor der Radiotherapie durchgeführt werden. Kopf-Halskarzinome Therapie Hypopharynxkarzinom cN0 cT1 transorale Resektiona) + SND cN1 transorale Resektion a) + mRND cN2a/b transorale Resektion a) + mRND cN2c transorale Resektion a) + mRND bds. cN3 transorale Resektion a) + RND cT2 transorale oder transzervikale Resektion + Defektrekonstruktion b) + SND transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + mRND transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + mRND transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + mRND bds. transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + RND a) cT3 transzervikale Resektion + Defektrekonstruktion b) + SND cT4a transzervikale Resektion + Defektrekonstruktion c) + SND transzervikale Resektion + Defektrekonstruktion b) + mRND transzervikale Resektion + Defektrekonstruktion c) + mRND transzervikale Resektion + Defektrekonstruktion b) + mRND transzervikale Resektion + Defektrekonstruktion c) + mRND transzervikale Resektion + Defektrekonstruktion b) + mRND bds. transzervikale Resektion + Defektrekonstruktion c) + mRND bds. transzervikale Resektion + Defektrekonstruktion b) + RND transzervikale Resektion + Defektrekonstruktion c) + RND a) in der Regel mit einem Operationslaser b) Hemilaryngo-Hemipharyngektomie nach Laccourreye c) Laryngektomie und (Hemi)pharyngektomie in der Regel erforderlich Supraglottisches Karzinom cN0 cT1 transorale Resektiona) + SND cN1 transorale Resektion a) + mRND cN2a/b transorale Resektion a) + mRND cN2c transorale Resektion a) + mRND bds. cN3 transorale Resektion a) + RND cT2 transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + SND transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + mRND transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + mRND transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + mRND bds. transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + RND cT3 transzervikale Resektion + Defektrekonstruktion b) + SND cT4a transzervikale Resektion + Defektrekonstruktion c) + SND transzervikale Resektion + Defektrekonstruktion b) + mRND transzervikale Resektion + Defektrekonstruktion c) + mRND transzervikale Resektion + Defektrekonstruktion b) + mRND transzervikale Resektion + Defektrekonstruktion c) + mRND transzervikale Resektion + Defektrekonstruktion b) + mRND bds. transzervikale Resektion + Defektrekonstruktion c) + mRND bds. transzervikale Resektion + Defektrekonstruktion b) + RND transzervikale Resektion + Defektrekonstruktion c) + RND Kopf-Halskarzinome Therapie 69 Aufgrund der Häufigkeit bilateraler zervikaler Metastasierungen ist eine beidseitige SND und/oder mRND anzustreben. a) in der Regel mit einem Operationslaser b) supraglottische Laryngektomie oder supracricoidale Laryngektomie mit Cricohyoidopexie (CHP), gelegentlich Laryngektomie erforderlich c) Laryngektomie und (Hemi)pharyngektomie in der Regel erforderlich Glottisches Karzinom cN0 cT1 transorale Resektiona) + SND cN1 transorale Resektion a) + mRND cN2a/b transorale Resektion a) + mRND cN2c transorale Resektion a) + mRND bds. cN3 transorale Resektion a) + RND cT2 transorale oder transzervikale Resektion + Defektrekonstruktion b) + SND transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + mRND transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + mRND transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + mRND bds. transorale a) oder transzervikale Resektion + Defektrekonstruktion b) + RND a) a) b) cT3 transzervikale Resektion + Defektrekonstruktion b) + SND cT4a transzervikale Resektion + Defektrekonstruktion c) + SND transzervikale Resektion + Defektrekonstruktion b) + mRND transzervikale Resektion + Defektrekonstruktion c) + mRND transzervikale Resektion + Defektrekonstruktion b) + mRND transzervikale Resektion + Defektrekonstruktion c) + mRND transzervikale Resektion + Defektrekonstruktion b) + mRND bds. transzervikale Resektion + Defektrekonstruktion c) + mRND bds. transzervikale Resektion + Defektrekonstruktion b) + RND transzervikale Resektion + Defektrekonstruktion c) + RND in der Regel mit einem Operationslaser vertikale Hemilaryngektomie oder supracricoidale Laryngektomie mit Cricohyoidoepiglottopexie (CHEP) c) Laryngektomie und (Hemi)pharyngektomie in der Regel erforderlich Subglottisches Karzinom T1–4: Keine standardisierte Therapie, da der Tumor sehr selten ist. Beim operativen Vorgehen ist meist eine Laryngektomie notwendig. Selten sind Teilresektionen möglich, in der Regel ist eine bilaterale Halslymph­ knotendissektion einschließlich Level VI erforderlich (paratracheale Lymph­ knoten). 70 Kopf-Halskarzinome Therapie 5.2.3 Prinzipien der chirurgischen Therapie des Halses Klassifikation und Terminologie der Halsdissektionen Die Klassifikation und Terminologie des Committee for Head and Neck Surgery and Oncology der American Academy of Otolaryngology-Head and Neck Surgery (27;28) hat sich inter­national durchgesetzt und wird für Tirol empfohlen. Demnach werden die Hals­lymph­­knotenstationen des rechten und des linken Halses bestimmten Leveln und Unterleveln zuge­ ordnet wie in neben­stehender Abbildung und unten­stehender Tabelle dargestellt. Nach dem Ausmaß der Resektion werden die Halsdissektionen in vollständige Hals­ dissektionen (Resektion aller Level I-V) und selektive Halsdissektionen eingeteilt, bei denen weniger als die Level I-V reseziert werden. Nach der Indikation werden Halsdissektionen in elektive und therapeutische Halsdissektionen unterteilt. Die elektive Halsdissektion wird im Gegensatz zur therapeutischen Halsdissektion per definitionem beim cN0-Hals durchgeführt und dient der Erkennung und Entfernung okkulter Halsmetastasen. Okkulte Halsmetastasen sind weder palpatorisch noch mit modernen bildgebenden Verfahren zu detektieren und können pathohistologisch extrakapsuläres Okkulte Halsmetastasen bei cN0-Hals ließen sich histopathologisch in 33% der Dissektionspräparate nach elektiver ND nachweisen Wachstum zeigen (29). Okkulte Halsmetastasen bei cN0-Hals ließen sich histopathologisch in 33% der Dissektionspräparate nach elektiver ND nach­weisen (30). Sie machen sich durch Halslymphknoten-Frührezidiv nach erfolgter Therapie bemerkbar, wenn die initial nicht detektierten metastatischen Tumorzellnester in den Halslymphknoten proliferieren und klinisch manifest werden. Durch die elektive ND oder die elektive Bestrahlung wird die Häufigkeit von Halsrezidiven reduziert (31;32). Zur elektiven Halsdissektion gibt 2 Alternativen: Engmaschige Kontrollen und elektive Bestrahlung der zervikalen Lymphabflusswege. Zu den Ergebnissen engmaschiger Kontrollen liegen nur wenige Daten vor. Das erforderliche sehr enge Follow up ist eine Belastung für den Patienten. Möglicherweise entstehen mehr Fernmetastasen, wenn Halsmetastasen nicht rechtzeitig erkannt werden und die Heilungsrate bei fortgeschrittenem Halsrezidiv ist Kopf-Halskarzinome Therapie 71 ungünstig. Bei Primärtumorlokalisationen mit einer Wahrscheinlichkeit für okkulte zervikale Metastasen von 25% oder mehr sollte eine elektive Hals­ dissektion oder eine elektive Halsbestrahlung erfolgen. Eine elektive Hals­ dissektion soll nach den Grundsätzen für selektive Halsdissektionen (s. unten) erfolgen. Level und Unterlevel des Halses Level Sublevel Bezeichnung I Ia Ib II submentale Gruppe submandibuläre Gruppe obere juguläre Gruppe Grenzen kranial des Zungenbeins, kaudal des M. mylohyoideus, ventral des dorsalen Randes der Glandula submandibularis zwischen den medialen Rändern der anterioren Bäuche des M. digastricus posterolateral zu Level Ia kraniokaudale Ausdehnung von der Schädelbasis bis zum Zungenbein, dorsal des Hinterrandes der Glandula Submandibularis, ventral des dorsalen Randes des M. sternocleidomastoideus IIa der V. jugularis interna benachbart IIb dorsal der V. jugularis interna III mittlere juguläre Gruppe kraniokaudale Ausdehnung vom Zungenbein bis zum kaudalen Rand des Ringknorpels, ventral des dorsalen Randes des M. sternocleidomastoideus IV untere juguläre Gruppe kraniokaudale Ausdehnung vom kaudalen Rand des Ringknorpels bis in Höhe der Schlüsselbeine, ventral einer Linie, welche den dorsalen Rand des M. sternocleidomastoideus und den posterolateralen Rand des M. scalenus anterior verbindet, lateral zur A. carotis communis V nuchale Gruppe, hinteres Halsdreieck VI VII 72 kraniokaudale Ausdehnung von der Schädelbasis bis zu den Schlüsselbeinen, dorsal einer Linie, welche den dorsalen Rand des M. sternocleidomastoideus und den posterolateralen Rand des M. scalenus anterior verbindet, anterior zum ventralen Rand des M. trapezius Va kraniokaudale Ausdehnung von der Schädelbasis zum kaudalen Rand des Ringknorpels, dorsal zum dorsalen Rand des M. sternocleidomastoideus Vb kraniokaudale Ausdehnung vom Ringknorpel bis zu den Schlüsselbeinen, dorsal einer Linie, welche den dorsalen Rand des M. sternocleidomastoideus und den posterolateralen Rand des M. scalenus anterior verbindet anteriore cervikale kraniokaudale Ausdehnung vom kaudalen Rand des Zungenbeins Gruppe bis zum kranialen Rand des Manubrium sterni, medial der A. carotis communis obere mediastinale Gruppe Kopf-Halskarzinome Therapie kaudal des kranialen Randes des Manubrium sterni medial der A. carotis communis Vollständige Halsdissektionen: radikale und modifiziert radikale Halsdissektion Vollständige Halsdissektionen umfassen zumindest die vollständige Resektion der Fett-Lymphknotempakete der Halslevel I-V. Sie sind bei klinisch positiven Halslymphknoten (>cN0) indiziert und werden nach der Resektion der drei Halsstrukturen m. sternocleidomastoideus, v. jugularis interna und n. accessorius weiter unterteilt in: • Radikale Halsdissektion (RND) mit Resektion aller drei genannten Strukturen • Modifiziert radikale Halsdissektion (MRND) mit Erhalt von m. sternocleido­ mastoideus, n. accessorius und v. jugularis interna • Modifiziert radikale Halsdissektion (MRND) mit Erhalt von m. sternocleido­ mastoideus und v. jugularis interna • Modifiziert radikale Halsdissektion (MRND) mit Erhalt von n. accessorius und v. jugularis interna • Modifiziert radikale Halsdissektion (MRND) mit Erhalt des n. accessorius Welche Form der vollständigen Halsdissektion durchgeführt wird, hängt von Lokalisation, Ausdehnung und Infiltrationsverhalten der tumorbefallenen Halslymphknoten ab. Andere theoretisch mögliche Varianten kommen selten vor, können sich aber intraoperativ ergeben Anmerkungen Der Begriff ‚funktionelle Halsdissektion‘ entspricht vom Resektionsausmaß der mRND mit Erhalt von m. sternocleidomastoideus, n. accessorius und v. jugularis interna, allerdings liegt hier ein besonderes von Suarez und Bocca etabliertes chirurgisches Konzept unter Berücksichtigung der Faszienräume des Halses vor. Selektive Halsdissektionen Bei der selektiven Halsdissektion werden nur bestimmte Halslymphknotenlevel reseziert. Grundlage hierfür ist die Beobachtung, dass in Abhängigkeit von der Lokalisation des Primärtumors bestimmte Halslymphknotenareale häufig, andere selten okkulte Halslymphknotenmetastasen aufweisen. Die typische Indikation für eine selektive Halsdissektion ist der cN0Hals und der klinisch fragliche cN1 Hals. Sie hat vor allem diagnostische In ausgewählten Fällen kann auch bei cN1 Hals eine selektive Halsdissektion indiziert sein Bedeutung. Bestätigt sich auch histopathologisch das Fehlen von Hals­ lymph­knotenmetastasen, kann bei R0-Resektion eines Primärtumors <T3 auf eine postoperative Radiotherapie in der Regel verzichtet werden (33). Kopf-Halskarzinome Therapie 73 Erbringt die histopathologische Aufarbeitung des entnommenen FettHalslymphknotenpaketes eine klinisch nicht erkannte Metastasierung, ist in der Regel eine postoperative Radiotherapie indiziert. Für Karzinome von Lippen und Mundhöhlen umfasst die selektive Halsdissektion die Level I-III, für Karzinome von Oropharynx, Hypopharynx und Larynx die Level II-IV (bei subglottischen Karzinomen und fort­ geschrittenen glottischen und hypopharyngealen Tumoren einschließlich Level VI), für Hauttumoren der seitlichen und hinteren Kopfhaut die Level II-V. Bei selektiven Halsdissektionen wird die Glandula submandibularis im Gegensatz zu vollständigen Halsdissektionen in der Regel belassen. Bei mittellinienüberschreitenden oder mittelliniennahen Primärtumoren ist die bds. selektive Halsdissektion oder die Kombination von vollständiger und selektiver Halsdissektion indiziert. Bei Mundhöhlen und Larynkarzinomen <T3 muss der Level IIB nicht in die selektive Halsdissektion inkludiert werden, da hier okkulte Metastasen selten sind und die Funktion des N. accessorius bei Dissektion des Levels IIB gefährdet ist. 5.2.4 Präoperative anästhesiologische Untersuchung und gemeinsame perioperative Planung Die genaue präoperative Evaluation erfasst außer den üblichen Vorunter­ Enge Abstimmung von Chirurgie und Anästhesie suchungen eine Erhebung des Venenstatus sowie der zu erwartenden Intubationsschwierigkeiten. Eine gemeinsame perioperative Planung umfasst auch die Vereinbarung der Intubationsdauer sowie eine mögliche Anlage einer Tracheotomie. Eine verlängerte Intubationsdauer wird empfohlen bei • kombinierten endopharyngeotrachealen Operationen mit Eröffnung des Halses von außen, • beidseitigen Eröffnungen des Halses im Sinne von beidseitigen Neck Dissektionen, • ausgedehnten einseitigen Halsoperationen mit und ohne Eröffnung des Pharyngealschlauches, • vermehrter interaoperativer Schwellung und Blutung, • Revisionen einer Nachblutung, • ausgedehnten enoralen und transoralen Resektionen, • drohenden oralen und oropharyngealen Nachblutungen und drohender Aspiration, 74 • Schwellungen im Bereich des Pharynx, Zungengrundes oder Larynx. Kopf-Halskarzinome Therapie Nach einer vereinbarten verlängerten Intubation erfolgt vor geplanter Extubation eine neuerliche gemeinsame Inspektion des Operationsgebietes und des oberen Luftweges. 5.2.5 Indikation zur präliminaren Tracheotomie bei Kopf-Hals Eingriffen Bei zahlreichen onkochirurgischen Eingriffen im Kopf-Hals Bereich ist eine geplante, präliminare Tracheotomie indiziert. Vorteile einer präliminaren Tracheotomie umfassen neben Sicherheitsaspekten (Nachblutung, Eine präliminare Tracheotomie ist häufig sinnvoll Schwellung, Aspiration) die schnellere Entwöhnung von der künstlichen Beatmung sowie die Möglichkeit für frühe Mobilisation und frühe Verlegung auf Normalstation. Nachteile sind die mit der präliminaren Tracheotomie verbundene Morbidität (Infektion, Pneumonie, Halsemphysem/Pneumo­ thorax, Trachealstenose, Blutungen) die eingeschränkte Kommunikation, mögliche Schluckprobleme und die mögliche Notwendigkeit eines Tracheo­ stoma­verschlusses als Zweiteingriff. Eine präliminare Tracheotomie sollte bei Tumoreingriffen im Rachen und Larynxbereich, bei Tumorstadien > T1, bei vorbestehenden Lungen­erkran­ kungen und positiver Alkoholanamnese erwogen werden. 5.2.6 Palliative chirurgische Verfahren Palliative chirurgische Verfahren sind bei Kopf-Hals-Tumoren häufig erforder­ lich. Die häufigsten Palliativeingriffe sind die Tracheotomie bei tumor­ bedingter Atemnot, transorales Tumordebulking meist mit dem Operations­ laser zur Verbesserung von Atmen und Schlucken sowie die transorale Glottiserweiterung zur Behebung von tumorbedingter Atemnot. 5.2.7 Empfehlung zur perioperativen Ernährung bei ausgedehnten tumorchirurgischen Eingriffen der Kopf-Halsregion Bei längerdauerndem intravenösem Ernährungsaufbau empfiehlt sich die Anlage eines zentralvenösen Zugangs. Bei den angegebenen Präparaten handelt es sich um Beispiele, es können alternativ ähnliche zugelassene Präparate zur Ernährung eingesetzt werden. Bei größeren tumorchirurgischen Eingriffen wird die Anlage eines ZVK empfohlen Kopf-Halskarzinome Therapie 75 Enteral/peripher-venöser Ernährungsaufbau Tag Kcal Sonde EE (Sonde) OP 1 2 3 PE (peripher-venös) Kcal Gesamt 1000 ml Glukose 5%, Elektrolytlösung 200 250 ml Isosource Standard® 20 ml/h 250 1206 ml Structokabiven peri® 830kcal 1030 500 ml Isosource Standard® 40 ml/h 500 1206 ml „StructoKabiven peri® 830 kcal“ 1330 750 ml Isosource Standard® 60 ml/h 750 1904 ml „StructoKabiven peri® 1300 kcal“ 2050 Enteral/zentral-venöser Ernährungsaufbau Tag Kcal Sonde EE (Sonde) 1000 ml Glukose 5%, Elektrolytlösung OP 1 2 3 PE (peripher-venös) Kcal Gesamt 200 250 ml Isosource Standard® 20 ml/h 250 25ml/h Structokabiven EF® 1477 ml 900 500 ml Isosource Standard® 40 ml/h 500 40ml/h StructoKabiven EF® 1477 ml 1480 750 ml Isosource Standard® 60 ml/h 750 50 ml/h StructoKabiven EF® 1477 ml 1950 Anmerkungen: Voraussetzung: Stoffwechselstabiler Patient, 60-70 kg KG. Beginn früh enteral (12-24h), minimal enteral (10-25 ml/h), Steigerung nach Verträglichkeit Flüssigkeit: Bevorzugt enterale Zufuhr je nach Bilanz Monitoring: Glukose, Triglyceride. Wasser- und fettlösliche Vitamine (Bsp.: Soluvit, Vitalipid): Bei mehrtägiger Gabe von Tag 1 EE = enterale Ernährung; PE = parenterale Ernährung Quellen: AKE, DGEM (Leitlinie Enterale und Parenterale Ernährung, 2008) 76 Kopf-Halskarzinome Therapie 5.3 Radiotherapie, Radiochemotherapie und Radioimmuntherapie Die Strahlentherapie kann als alleinige Therapieform oder adjuvant postoperativ durchgeführt werden. Die präoperative Strahlentherapie ist nicht mehr üblich, weil sich diese in zwei vergleichenden Studien bezüglich der Lokalrezidivrate (34;35) und in einer Untersuchung auch hinsichtlich des Überlebens (35) gegenüber einer postoperativen Radiotherapie unterlegen zeigte. Am häufigsten wird in der Behandlung von Kopf-Hals-Tumoren die perkutane Strahlentherapie mit Energien zwischen 4 und 15 Megaelektronen­ volt [MeV] mithilfe eines Linearbeschleunigers (LINAC) eingesetzt. Zur Immobilisation sind die Anfertigung einer individuellen thermoplastischen Maske, einer Fixationsschiene des Oberkiefers bzw. die Lagerung in einer Kopfschale erforderlich. Vor der RT ist eine Zahnsanierung unerlässlich. 5.3.1 Radiotherapie Primäre konventionell fraktionierte Radiotherapie Eine alleinige konventionell fraktionierte Radiotherapie kann bei Tumoren in den UICC Stadien I und II in kurativer Intention durchgeführt werden. Schlechtere Ergebnisse bringt die primäre Radiotherapie bei MuskelKnorpel- oder Knocheninfiltration (36). Als Alternative zur primären Operation beruht die Entscheidung zur Radiotherapie auf vergleichbar Standard ist eine CT-gestützte 3D Planung, anzustreben ist eine intensitätsmodulierte Bestrahlung guten Heilungsraten und der Möglichkeit eines guten funktionellen und ästhetischen Ergebnisses (37). Bei höheren Tumorstadien verfolgt die primäre konventionell fraktionierte Radiotherapie in der Regel eher palliative Ziel­setzungen. Die Strahlenbehandlung erfolgt in Form einer CT-gestützten 3D Planung, anzustreben ist eine intensitätsmodulierte Bestrahlung. Es werden einmal täglich 2Gy appliziert. Die Primärtumorregion erhält 70Gy, die Lymph­abflusswege zwischen 50 und 60Gy. Primäre hyperfraktionierte Radiotherapie Die hyperfraktionierte Radiotherapie ist eine Alternative zur kombinierten Radiochemotherapie oder Radioimmuntherapie, wenn diese Verfahren nicht zur Therapie geeignet sind. Bei der Hyperfraktionierung werden in der Regel zwei Bestrahlungen pro Tag mit einer jeweiligen Dosis von weniger als 2 Gy durchgeführt. Durch die Hyperfraktionierung wird die Dosisintensität erhöht. In einer Untersuchung der MARCH Gruppe (Meta-Analysis of Radiotherapy in Carcinomas of Head and neck Collaborative Group) zeigte sich eine Überlegenheit der hyperfraktionierten Strahlentherapie bei fortgeschrittenen Tumorstadien (III und IV) gegenüber der konventionell fraktio­nierten Strahlentherapie, während akzelerierte Therapieregime Kopf-Halskarzinome Therapie 77 keine Vorteile brachten (38). Die Strahlenbehandlung erfolgt in Form einer CT-gestützten 3D Planung, anzustreben ist eine intensitätsmodulierte Bestrahlung. Es werden zweimal täglich 1,3Gy appliziert. Die Primär­tumor­ region erhält 70,2Gy, die Lymphabflusswege zwischen 49,4 und 59,8Gy. Brachytherapie Die Brachytherapie ermöglicht die Verabreichung von biologisch hoch­wirk­ samen Dosen im unmittelbaren Tumorbereich bei gleichzeitiger Schonung des umliegenden, nicht tumorbefallenen Gewebes und führt dadurch einer­ seits zur ausgezeichneten lokalen Tumorkontrolle, anderseits zu einer akzep­ ta­blen Nebenwirkungsrate. Neben der hohen Konformität bietet die kurze Gesamtbehandlungszeit einen zusätzlichen strahlenbiologischen Vorteil. Brachytherapie sinnvolles therapeutisches Konzept Die Brachytherapie kann sowohl als primär definitive Monotherapie bei Tumoren in Frühstadien (Stad. I. und II.), als auch in Kombination mit einer perkutanen Radio(Chemo)therapie zur lokalen Dosisaufsättigung (Boost) mit kurativer Intention durchgeführt werden. Sie ist auch in der Rezidiv­situation nach vorangegangener Radiotherapie als Salvagetherapie oder auch als palliative Therapiemaßnahme ein wertvolles Instrument der Therapie. Voraussetzung einer erfolgreichen Behandlung sind die sorgfältige Patienten­ selektion und eine enge und harmonische interdisziplinäre Zusammenarbeit. Eine Indikation zur Brachytherapie kann bei Tumoren im Nasopharynx, Oropharynx und in der Mundhöhle gestellt werden. Applikationstechniken der Brachytherapie beinhalten Methoden der interstitiellen-, endoluminalen-, endocavitären- oder Kontaktbestrahlung. Betont werden muss, dass für die im deutschen Sprachraum allgemein verwendete high-dose-rate Brachytherapie (HDR) die Datenlage deutlich spärlicher ist als für die um Jahrzehnte länger angewandte low-dose-rate Brachytherapie (LDR). Eine Alternative zu den LDR- und HDR-Verfahren bietet das pulsed-dose-rate- (PDR) Verfahren, welches die radiobiologischen und bestrahlungstechnischen Vorteile der LDR- und der HDR- Brachytherapie vereint, allerdings nur in wenigen hochspezialisierten Zentren zur Verfügung steht. Postoperative adjuvante Radiotherapie Vorteil der postoperativen Radiotherapie ist die Möglichkeit der präziseren Indikationsstellung zur Dosis der Radiotherapie aufgrund der auf patho­ logisch-anatomischen Befunden begründeten Stadieneinteilung und Konstellation der individuellen Risikosituation. Strahlenbiologischen nach­ teilig sind der postoperativ veränderte Gefäßstatuts und die dadurch bedingte 78 relative Hypoxie mit reduzierter Strahlensensibilität. Kopf-Halskarzinome Therapie In den UICC-Stadien I und II ist bei den meisten Tumorlokalisationen entweder eine alleinige Tumorresektion oder eine alleinige Radiotherapie indiziert. Die Kombination von Tumoresektion und postoperativer adjuvanter Strahlentherapie ist in der Regel in den UICC Stadien III und Postoperative Radiotherapie bei fortgeschrittenen Stadien nach R0 Resektion IV indiziert (39). Ausgenommen hiervon ist die R1 oder R2 Resektion und das extrakapsuläre Lymphknotenwachstum, bei denen eine postoperative Radio­chemo­therapie indiziert ist (9). Eine postoperative RT ist auch im Stadium I und II bei Lymphangiosis carcinomatosa, perineuraler Invasion und Gefäßeinbruch indiziert. Die Datenlage spricht auch bei pT1pN1 und pT2pN1 nach R0-Resektion eher dafür, eine postoperative Radiotherapie einzu­leiten (40;41). Individuell zu entscheiden ist die Empfehlung bei pT3pN0 glottischem Larynxkarzinom nach Laryngektomie mit R0 Resektion. Die Strahlenbehandlung erfolgt in Form einer CT-gestützten 3D Planung, anzu­ streben ist eine intensitätsmodulierte Bestrahlung. Es werden einmal täglich 2Gy appliziert. Die Primärtumorregion erhält 60Gy, die Lymphabflusswege 50Gy. 5.3.2 Radiochemotherapie (RCT) Die Radiotherapie kann mit einer Chemotherapie kombiniert werden. Dies kann sequentiell, alternierend oder simultan (konkomitant) erfolgen. Dabei hat sich die konkomitante RCT gegenüber den sequentiellen Formen als überlegen erwiesen (42). Die primäre kombinierte RCT ist bei fortgeschrittenen Tumorstadien (UICC III und IV) der alleinigen RT überlegen, geht allerdings mit einer erhöhten Morbidität einher. Die RCT kann primär erfolgen bei nicht-resektablen fortgeschrittenen Kopf-Halskarzinomen oder mit dem Ziel des Organerhalts bzw. des Erhalts der Organfunktion bei Pharynx- und Larynxkarzinomen. Die postoperative RCT ist indiziert bei R1Resektion und extrakapsulärem Wachstum von Halslymphknotenmetastasen. Bei Lymphangiosis carcinomatosa, perineuraler Invasion und Gefäßeinbruch bei fortgeschrittenen Tumorstadien ist die postoperative RCT zu erwägen. Zum Ausschluss von Kontraindikationen gegen eine Chemotherapie muss vor Beginn einer RCT eine Freigabe durch einen Hämatologen/Onkologen erfolgen. Kopf-Halskarzinome Therapie 79 Primäre RCT Primäre konkomitante RCT Alternative zu OP + RT bei fortgeschrittenen Stadien Die primäre RCT ist bei nicht-resektablen fortgeschrittenen Kopf-Hals­ karzinomen indiziert und kann mit dem Ziel des Organerhaltes bzw. der Organfunktion bei resektablen Pharynx- und Larynxkarzinomen durchgeführt werden. Für Larynx und Hypopharynxkarzinome wurden die Indikationen zum Organerhalt vom internationalen Larynx Preservation Consensus Panel beschrieben. Demnach ist der Larynxerhalt durch RCT indiziert bei Patienten mit T2 und T3 Karzinomen des Larynx oder Hypopharynx, die nicht für einen partielle Laryngektomie in Frage kommen, keine Tracheotomie, keine Schluck­störung, keine Aspirationen und ein Alter unter 70 Jahren aufweisen. In einem kürzlich erschienen Cochrane Report war die kombinierte RCT der alleinigen RT bei nicht-resektablen Mundhöhlen- und Oropharynxkarzinomen überlegen. Allein CDDP basierte RCTs waren hinsichtlich der Gesamt­ mortalität der alleinigen RT bei einer OR von 0,66 (95% CI 0,57-0,77) überlegen. Zusätzlich 5-FU zu CDDP zeigte keine Verbesserung gegenüber allein CDDP basierten RCTs (OR im Vergleich zur alleinigen RT 0,71, 95% CI 0,62-0,81). Andere RCT-Kombinationen zeigten teils schlechtere Ergebnisse als die alleinige CDDP-basierte RCT (43) Als Referenzverfahren bei nicht resektablen Tumoren oder zum Organerhalt bei resektablen Tumoren wird die kombinierte RCT mit 70 Gy und 100 mg/m2 Cisplatin an den Tagen 1, 22 und 43 angesehen. (44) Die Strahlenbehandlung erfolgt in Form einer CT-gestützten 3D Planung, anzustreben ist eine intensitätsmodulierte Bestrahlung. Es werden einmal täglich 2Gy appliziert. Die Primärtumorregion erhält 70Gy, die Lymphabflusswege zwischen 50 und 60Gy. Postoperative RCT mit CDDP Postoperative RCT nach R1-Resektion oder extrakapsulärem Lymphknotenbefall In zwei unabhängigen prospektiven randomisierten Untersuchungen (EORTC #22931 und RTOG # 9501) wurde eine postoperative normofraktionierte RT mit 60-66 Gy in einem Untersuchungsarm um CDDP 100 mg/m2 an den Tagen 1, 22 und 43 ergänzt. Die Untersuchungen zeigten konsistent eine Überlegenheit der postoperativen RCT gegenüber der alleinigen RT. Der Vorteil der postoperativen RCT gegenüber der postoperativen alleinigen RT beschränkte sich auf Patienten nach R1-Resektion oder mit extrakapsulärem Lymph­knoten­befall. Die Kombination von normofraktionierter RT ( 60-66 Gy) mit 3 Zyklen CDDP mit 100 mg/m2 wird derzeit wegen der guten Datenlage durch diese beiden großangelegten Untersuchungen als Referenzverfahren der postoperativen RCT angesehen. Die Strahlenbehandlung erfolgt in Form 80 einer CT-gestützten 3D Planung, anzustreben ist eine intensitätsmodulierte Kopf-Halskarzinome Therapie Bestrahlung. Es werden einmal täglich 2Gy appliziert. Die Primärtumorregion erhält 70Gy, die Lymphabflusswege zwischen 50 und 60Gy. Alternative primäre und postoperative RCT mit 2 Zyklen täglicher CDDP Gabe 20 mg/m2 mit 5-FU Alternativ kann ein anderes CDDP Dosierungsschema in Kombination mit 5-FU verwendet werden. Hierbei werden 20 mg/m2 an den Tagen 1 bis 5 und 29 bis 33 in Kombination mit 5-FU als kontinuierliche Infusion über 120 Stunden mit einer Tagesdosis von 600 mg/m2 Körperoberfläche gegeben (45). Es werden 70 Gy bei primärer RCT gegeben und 60-66 Gy nach R1 Resektion bzw. extrakapsulärem Lymphknotenwachstum. Alternative primäre und postoperative RCT mit 2 Zyklen Mitomycin C (MMC) und 5-Flurouracil (5-FU) Aufgrund der guten Verträglichkeit empfehlen wir eine kombinierte Radio­ chemotherapie mit Mitomycin C 10 mg/m²/d (Absolutdosis 15 mg/d) d1 und d36 und 5-FU 1000 mg/m²/d (Absolutdosis 1500 mg/d) d1-4 und d36-39 (nur an Bestrahlungstagen). Eine erste Auswertung der HART-B-Studie (Budach et. al.) hat in der lokalen Wirksamkeit einen Vorteil für 5-FU/MMC ergeben, während 5-FU/Cisplatin eine bessere Wirkung auf Fernmetastasen zeigte. 5.3.3 Radioimmuntherapie Als Alternative zur RCT kann bei fortgeschrittenen Kopf-Halskarzinomen eine Radioimmuntherapie mit Cetuximab erfolgen. Cetuximab ist ein für die Therapie von Kopf-Halskarzinomen zugelassener monoklonaler Antikörper gegen den epidermalen Wachstumsfaktor-Rezeptor. In einer prospektiven, Radioimmuntherapie Alternative zur Radiochemotherapie randomisierten Studie war die Kombination von RCT + Cetuximab der alleinigen Radiotherapie überlegen (46;47). Es ist wie bei der RCT mit einer erhöhten Morbidität im Vergleich zur alleinigen RT zu rechnen. Cetuximab wird in einer Dosis von 400 mg/m2 an d1 gegeben (loading dose) und dann wöchentlich während der Dauer der Bestrahlung in einer Dosis von 250 mg/m2. Die Strahlenbehandlung erfolgt in Form einer CT-gestützten 3D Planung, anzustreben ist eine intensitätsmodulierte Bestrahlung. Es werden einmal täglich 2Gy appliziert. Die Primärtumorregion erhält 70Gy, die Lymphabflusswege zwischen 50 und 60Gy. Es sind anaphylaktische Reaktionen auf die Antikörpergabe möglich, die durch IgE-Antikörper gegen das Oligosccharid Galactose-alpha-1,3-Galactose auf dem Fab Fragment der schweren Kette des Antiköpers bedingt sind. Für die häufigen akneartigen Hautveränderungen existieren standardisierte Behandlungskonzepte. Kopf-Halskarzinome Therapie 81 5.4 Systemische Therapie 5.4.1 Palliative systemische Therapie Besteht die klinische Situation eines Lokalrezidivs ohne Möglichkeit für eine radiotherapeutische oder chirurgische Intervention bzw. liegen Fernmetastasen vor, so ist von einer palliativen Therapiesituation auszu­ gehen. In dieser Konstellation ist die Sinnhaftigkeit einer palliativen systemischen Therapie zu evaluieren. Ziel einer derartigen Therapie ist primär die Linderung tumorassoziierter Symptome, damit verbunden eine Verbesserung der Lebensqualität sowie sekundär auch eine Verlängerung der Überlebenszeit. Generell wird der Einsatz palliativer Systemtherapien bei Patienten mit Plattenepithel-Karzinomen des HNO-Bereichs häufig durch das Vorliegen von schwerwiegenden Komorbiditäten, reduziertem Performance Status sowie schlechter sozialer Einbettung der Betroffenen verkompliziert. Dementsprechend sind diese Faktoren bei der Auswahl der Therapie unbedingt zu berücksichtigen. Für Patienten mit gutem Allgemeinzustand hat sich die Kombination Cisplatin/5-FU/Cetuximab als Standard etabliert: Lebensverlängerung bei oft guter Lebensqualität durch Systemtherapie Cisplatin 100 mg/m2 Tag 1 5-FU 1000 mg/m2 Tag 1-4 Cetuximab 400 mg/m2 Tag 1 bzw. dann 250 mg/m2 wöchentlich Zykluswiederholung Tag 22 Bei entsprechend guter Verträglichkeit und adäquater Wirkung (zumindest Krankheitsstabilisierung) sollte die Verabreichung von 6 Zyklen dieser Therapie angestrebt werden. Im Anschluss daran ist die Fortführung einer Cetuximab-Erhaltungstherapie bis zur Progredienz zu empfehlen. Bei Vorliegen einer Kontraindikation gegen Cisplatin (v.a. Niereninsuffizienz) kann alternativ auch Carboplatin (AUC 5) eingesetzt werden. Ein durchaus großer Prozentsatz der Patienten kommt auf Grund oben genannter Faktoren (reduzierter Performance-Status, Komorbiditäten) nicht für eine Kombinationschemotherapie in Betracht. Für diese Situation ist kein klarer Standard definiert. Eine ganze Reihe von Zytostatika hat in Phase-II-Studien grundsätzliche biologische Aktivität bei Patienten mit Kopf-Halskarzinomen bewiesen. Alle diese Substanzen kommen somit 82 grundsätzlich für eine palliative Monotherapie in Betracht zumal auch Kopf-Halskarzinome Therapie aussage­kräftige vergleichende Studien fehlen. Die im Folgenden angeführten Therapieoptionen stellen somit eine Auswahl aus den gegebenen Möglich­ keiten dar und können je nach klinischer Situation eingesetzt werden: Platin + Cetuximab: Die Zugabe des EGFR-Antikörpers zu einer Platin-Mono­ therapie erhöht die Ansprechraten, bei gleichzeitig nur geringfügig erhöhter Toxizität. Diese Therapieoption bietet sich somit in Fällen mit hoher palliativer Dringlichkeit, jedoch Kontraindikation gegen eine Triple-Kombination (Cis/5FU/Cetuximab), an. Docetaxel: Taxane weisen in Phase-II-Studien neben Platinderivaten die höchsten Ansprechraten auf. Ein Vorteil von Docetaxel liegt im von der Nierenfunktion unabhängigen Metabolismus. Methotrexat (MTX): MTX galt lange Zeit als Referenzstandard. Auf Grund seiner guten Verträglichkeit stellt es eine vor allem bei älteren oder komorbiden Patienten eine Therapieoption dar. Da deutliche Tumorregressionen unter MTX jedoch selten sind gilt dies insbesondere dann, wenn eine Krankheits­ stabilisierung für einen palliativen Nutzen ausreichend ist. Cetuximab-Monotherapie: Geringe Toxizität. Moderate Ansprechraten (ca. 15%). Survival – Benefit als Monotherapie nicht durch randomisierte Studien abgesichert. Zweitlinientherapie: Der palliative Nutzen einer Zweitlinientherapie ist nicht erwiesen und es ist kein Standardvorgehen definiert. Dennoch ist ihr Einsatz weit verbreitete klinische Praxis. Der TAKO empfiehlt in dieser Situation eine besonders strenge Risiko-Nutzen-Abwägung. Generell sollte einer Monotherapie der Vorzug gegenüber einer Kombinationstherapie gegeben werden. Zur Auswahl stehen prinzipiell jene Substanzen, die bereits im Abschnitt zur Erstlinien­therapie angeführt wurden. 5.4.2 Präoperative neoadjuvante Chemotherapie bei Erstbehandlung fortgeschrittener Tumorstadien Zur präoperativen Chemotherapie bei Erstbehandlung fortgeschrittener Tumor­stadien wurden in den 80er und 90er Jahren zahlreiche Studien durch­geführt. In einer Meta-Analyse ergab sich für diese Behand­lungs­­ strategie insgesamt kein signifikanter Überlebensvorteil. Für die spezi­ fische Kombination Cisplatin/5-Fluorouracil war ein solcher Benefit zwar Kopf-Halskarzinome Therapie 83 detektierbar, er war jedoch numerisch deutlich geringer ausgeprägt als jener für eine konkomitante Radiochemotherapie, sodass diese das zu bevorzugende Therapieprocedere darstellt. In der Praxis für eine neoadjuvante Chemotherapie nachteilig sind des weiteren die Verzögerung der definitiven Therapie, die manchmal fehlende Bereitschaft der Betroffenen, sich nach einer präoperativen Chemotherapie noch einer definitiven Therapie zu unter­ziehen und das medikolegale Problem, wenn nach präoperativer Chemo­therapie im Resektionspräparat kein Tumor mehr nachweisbar ist. 5.4.3 Induktionschemotherapie vor kombinierter Radiochemotherapie bei Erstbehandlung fortgeschrittener Tumorstadien Ob die Sequenz aus einer taxanhaltigen Induktionschemotherapie (Docetaxel /Cisplatin/5-FU = TPF-Schema) gefolgt von einer Radiochemo- oder Radio­ immun­therapie einer alleinigen Radiochemo/immuntherapie überlegen ist, wird derzeit in randomisierten Studien geprüft. Bis zum Vorliegen dieser Resultate wird dieses Vorgehen als experimentell angesehen uns sollte Besonders bei organ- oder funktionserhaltenden Konzepten ist die Feststellung des Remissionsstatus und Einleitung weiterer Therapiemaßnahmen bei unvollständigen Ansprechen essentiell außerhalb von Studien einzelnen, speziellen Situationen (z. Bsp. junge Patienten mit sehr gutem Allgemeinzustand und ausgeprägten Lokal­ symptomen sowie Unmöglichkeit zu einem unverzüglichen Beginn der Radio­ chemotherapie) vorbehalten bleiben (43;49). 5.5 Feststellung des Remissionsstatus Bei nicht-chirurgischer Therapie ist klinisch die Einteilung nach den WHO Response-Kriterien (50) üblich und wird für Tirol auch für die Beschreibung des Remissionsstatus nach chirurgischer Therapie empfohlen: Vollständiges Ansprechen (Complete response; CR) Verschwinden aller bekannten Krankheitsmanifestationen Partielles Ansprechen (Partial response; PR) Größenabnahme aller bekannten Krankheitsmanifestationen (total tumor load) um 50% oder mehr ohne neu aufgetretene Läsionen oder Größenzunahme auch nur einer Läsion Keine Veränderung (No change; NC) Weder eine Größenabnahme aller Tumormanifestationen um mindestens 50% noch eine Größenzunahme von 25% oder mehr von einer oder mehreren Tumormanifestationen noch Entstehung neuer Läsionen Progressive Erkrankung (Progressive disease; PD) Größenzunahme von 25% oder mehr von einer oder mehreren Läsionen oder Entstehung neuer Läsionen. Die modernere und aufwändigere Einteilung nach den RECIST-Kriterien (51) 84 wird für klinische Studien empfohlen. Kopf-Halskarzinome Therapie Die Erfassung des Remissionsstatus soll 6-8 Wochen nach Abschluss der Therapie erfolgen und umfasst neben einer Endoskopie der ehemaligen Primärtumorregion mit histologischer Sicherung ein CT der ehemaligen Primärtumorregion, des Halses, des Thorax und des Abdomens. 5.6 Phase I Rehabilitation Dem Rehabilitationsplan 2009 der ÖBIG Forschungs- und Planungs­ gesellschaft mbH folgend wird unter Phase I Rehabilitation (Akutrehabilitation) die Frühmobilisation im Akutkrankenhaus verstanden. Diese umfasst physika­lisch-therapeutische Einzelmaßnahmen, funktions­orientierte physika­­ lische Therapie, physikalisch-medizinische Komplex­behandlung und die mehrdimensionale funktionelle Stimm- und Schluckrehabilitation („phonia­ trisch-logopädische Intensivtherapie“) vor allem bei Aspiration und Aphonie sowie den Einsatz weiterer Therapiebereiche (Ergotherapie, Psychotherapie, Logo­pädie) in patientenbezogenen unterschiedlichen Kombinationen und bei unterschiedlichem Zeitaufwand. Für diese Phase wird zum Teil auch der Begriff „Akutrehabilitation“ verwendet. Die Phase I Rehabilitation hat in der Behandlung von Kopf-Halstumoren einen hohen Stellenwert. 5.7 Therapiegrundsätze bei Rezidiv, Tumorpersistenz oder Fern­ metastasierung Das Auftreten von lokoregionären Rezidiven oder Tumorpersistenz ist prognostisch ungünstig, unter anderem weil die Behandlungsmöglichkeiten durch vorangegangene Therapien oft eingeschränkt sind. Es gelten grund­ sätz­lich die gleichen therapeutischen Prinzipien wie bei der Behandlung von erstdiagnostizierten Erkrankungen. Bei chirurgischer Resektion sind wegen der schlechten lokalen Heilungsaussichten infolge vorangegangener Moderne Konzepte bei Rezidiv oder Fernmetastasen wirksam Behandlungen im Regelfall gefäßgestielte oder freie Transplantate zur Defekt­rekonstruktion erforderlich. In vielen Fällen besteht die Möglichkeit für eine Reirradiation, auch in Kombination mit einer Chemotherapie. Bei singulären oder wenigen Fernmetastasen in Lunge oder Leber bieten sich chirurgische Resektion, Radiofrequenztherapie oder extrakranielle stereo­ taktische Bestrahlung als moderne Therapiemöglichkeiten an. Besteht keine Möglichkeit für chirurgische oder strahlentherapeutische Intervention, stehen palliative chemotherapeutische Verfahren im Vordergrund. Für die Grund­ sätze der supportiven Therapie wird auf die diesbezügliche TAKO-Leitlinie verwiesen. Kopf-Halskarzinome Therapie 85 6 Nachsorge und Rehabilitation 6.1 Nachsorgeuntersuchungen Tumornachsorge dient einerseits der Früherkennung von Rezidiven und Zweit­tumoren. Hierzu erfolgen an jedem Nachsorgetermin routinemäßig klinische Untersuchungen und zu bestimmten Terminen (s. Abbildung) zusätz­liche bildgebende Untersuchungen. Andererseits dient die Tumor­ nach­sorge der Behandlung von Erkrankungs- und Therapiefolgen, der Optimierung der Rehabilitation sowie der Dokumentation und Qualitäts­ sicherung. In der ersten Tumornachsorgeuntersuchung wird zunächst geprüft, ob das Behandlungskonzept schon vollständig umgesetzt ist oder z.B. noch eine Behandlung von Residualtumor erforderlich ist, ob ein Tracheo­­stomaverschluss oder eine PEG-Entfernung ansteht und ob schon eine Anschlussheilbehandlung erfolgt ist. Außerdem werden Folgen und Komplikationen dokumentiert, die Patienten über den bisherigen Verlauf der Behandlung beraten und ein Rehabilitationsplan erstellt. Oft ist eine psycho­ onkologische Behandlung erforderlich (s. Kapitel 7). Eine dritte wichtige Funktion von Nachsorgeuntersuchungen ist die optimale supportive Therapie bei inkurabler Situation. Empfohlene Nachsorge bei Kopf-Halstumoren, Intervalle und Untersuchungen Zu den regelmäßigen Untersuchungen im Rahmen der Tumornachsorge zählen neben der klinischen Untersuchung die Messung des Köpergewichts und die Blutentnahme für Laboruntersuchungen. Bei Lymphödem wird eine Lymph­drainage, bei Schulter-Arm-Syndrom oder Einschränkung der Hals­ 86 beweg­lichkeit eine Physiotherapie und bei Sprech-, Stimm-, oder Schluck­­ Kopf-Halskarzinome Nachsorge und Rehabilitation störung eine logopädische Therapie eingeleitet. Wesentlich ist die sorgfältige Zahnhygiene und Trismusprophylaxe, gelegentlich ist eine Schmerz­therapie erforderlich. 6.1.1 Erkennung von Rezidiven oder persistierender Tumorerkrankung Die möglichst frühe Erkennung von Rezidiven der Tumorerkrankung ist eine wesentliche Aufgabe der Tumornachsorge. Sie erfolgt durch Anamnese­ erhebung (neu aufgetretene Symptome, Gewichtsverlust, Verän­de­rungen der Schluck- oder Stimmfunktion) und klinische Untersuchung einschließ­lich Untersuchung mit starren oder flexiblen Optiken und Palpation. Bei unklaren Befunden werden weiterführende bildgebende Untersuchungen oder eine Spiegelung in Narkose mit Histologiegewinnung veranlasst. Bei begründetem Verdacht auf ein Rezidiv oder Tumorpersistenz erfolgt eine Vorstellung im interdisziplinären Tumorboard. 6.1.2 Erkrankungsfolgen Häufige Folgen der Erkrankung und ihrer Behandlung umfassen • Störungen von Mundöffnung, der Kau- und Schluckfunktion, • Zahnprobleme (Karies, Parodontose und Zahnausfall, Zust. n. Kiefer(teil) resektionen, oft ist eine aufwändige zahnärztliche und Mund-KieferGesichtschirurgische Behandlung erforderlich), • Strahlenulzera und Osteoradionekrose, • Lymphstau, • Mundtrockenheit (Xerostomie), chronische Entzündung der Mund- und Rachenschleimhäute, Verlust des Schmecksinnes, • Gewichtsverlust, Depressionen, Schwächung und Erschöpfung in Folge der Erkrankung und erschwerter Nahrungsaufnahme (oft PEG erforderlich), Anämie, • Verlust der Stimme, Artikulationsstörungen und undeutliche Sprache, offenes Näseln, • rezidivierende Atemnotzustände, bleibender Luftröhrenschnitt (Halsatmer), • Beeinträchtigungen der Kopf- und Armbeweglichkeit, Hals- Schulter­ schmerzen, Fehlstellungen von Kopf und Schulter, • ästhetische Beeinträchtigung (Verlust der oralen Kompetenz, Bartwuchs­ störungen, Narben, Hals- Asymmetrie, Lymphödem, Dermatitis) • oft bleibende Arbeitsunfähigkeit, wirtschaftliche Probleme, sozialer Rückzug (Regression). Kopf-Halskarzinome Nachsorge und Rehabilitation 87 Bei den beschriebenen Folgezuständen handelt es sich um häufige und schwere Gesundheitsstörungen. Bei frühzeitiger konsequenter Behandlung kann man die Entstehung dieser Gesundheitsstörungen verhindern oder wesentlich abmildern, eine Chronifizierung vermeiden und die Lebensqualität der Betroffenen erheblich verbessern. Außerdem trägt eine Behandlung wesentlich dazu bei, die Selbständigkeit im Alltag und die Arbeitsfähigkeit wiederherzustellen. 6.1.3 Laboruntersuchungen Zu den routinemäßig durchgeführten Laboruntersuchungen zählen ein kleines Blutbild, TSH, Elektrolyte und Präalbumin. Diese Untersuchungen werden im Bedarfsfall ergänzt. 6.1.4 Ernährung, Körpergewicht, Leistungsfähigkeit Bei den Nachsorgeuntersuchungen soll der Ernährungszustand durch das Hauptscreening des Nutrition Risk Screening 2002 (NRS) in regelmäßigen Abständen erfolgen. Bei Werten ≥ 3 soll eine Ernährungstherapie durch Fachkräfte für Diätologie eingeleitet werden. 6.1.5 Dentale Nachsorge Nach erfolgter Therapie stehen regelmäßige (alle 3 Monate) Kontrollen zur frühzeitigen Erfassung und adäquaten Therapie radiogen induzierter Komplikationen an der Bezahnung und an Kieferknochen sowie an der Mund­schleimhaut im Mittelpunkt. Im speziellen zu bewältigende Störungen betreffen Bestrahlungskaries, Einbissverletzungen durch Lymphstau von Hals und Zunge, Xerostomie, Trismus und Osteoradionekrose. In der Nachsorge sind folgende Punkte zu berücksichtigen: • Weiterführende Fluoridapplikation • Maßnahmen zur Stimulation der Speichelflußrate • Prothesenkarenz mindestens 3 bis zu 6 Monate • Wiederherstellung der Kaufunktion: wegen des reduzierten Restzahn­ bestandes, der Radioxerostomie, tumor-bedingter Kieferdefekte und der Verminderung der muskulären Balance aufgrund von Operations­narben und fibrotischer Strahlenfolgen ist eine konventionelle zahnärztlich-prothetische Versorgung oft nicht möglich, wünschenswert wären Implantat-getragene Zahnersatzversorgungen 88 Kopf-Halskarzinome Nachsorge und Rehabilitation • Konservierende Maßnahmen können durchgeführt werden, viel wichtiger ist aber die gute Mundhygiene, ein kariesprotektives Prophylaxeprotokoll und regelmäßiger Recall zur Begutachtung der Mundhygiene. • Eine Zahnextraktion sollte nicht vor Ablauf eines halben Jahres nach Beendigung einer Bestrahlung durchgeführt werden, falls notwendig nur unter folgenden Kautelen: perioperative, systemische antiinfektive Prophy­ laxe, möglichst atraumatisch ohne Osteotomie, Alveolotomie, primär plastische Schleimhautdeckung. • Implantate zur Haltverbesserung sollten im Unterkiefer frühestens 10 Monate nach Abschluss der Strahlentherapie eingebracht werden. • Bei nicht heilenden Ulzera im Kieferbereich bzw. Verdacht auf Osteo­ radionekrose ist eine umgehende kieferchirurgische Vorstellung indiziert. • Dehnungsübungen der Mundöffnung zur Behandlung oder Vorbeugung der Verschlechterung einer Kieferklemme sollten gegebenenfalls täglich durchgeführt werden. 6.1.6 Sozialmedizinische Betreuung in der Nachsorge Die Diagnose eines Kopf-Halstumors hat weitreichende Folgen für die Lebenssituation der Betroffenen. Sie sind oft auch nach der stationären Entlassung auf professionelle Hilfe durch Sozialberatung angewiesen, die in die Tumornachsorge eingebunden werden soll. Die Sozialberatung unterstützt Patienten mit Kopf-Halstumoren unter anderem bei der Antrags­stellung einer Anschlussheilbehandlung, bei Pensionsanträgen, Pflegegeld, Mietzinsbeihilfen, Grundsicherung, sowie Geltendmachung von sozialen Ansprüchen und Maßnahmen zur finanziellen Absicherung. Oft brauchen Betroffene Unterstützung bei Verhandlungen mit Krankenkassen, Pensionsversicherungen, Gerichten, Arbeitsämtern und weiteren Beratungs­ stellen. Die sozialmedizinische Versorgung ist in ein regionales Netzwerk von Sozial- und Pflegestationen, Rehabilitationseinrichtungen, niedergelassenen Ärzten, Palliativ- und Hospizeinrichtungen eingebunden. Kopf-Halskarzinome Nachsorge und Rehabilitation 89 6.2 Phase II Rehabilitation Die Phase II Rehabilitation erfolgt entweder nach Phase I im Anschluss an das Akutkrankenhaus (= „Anschlussheilverfahren“ oder „Rehabilitation nach Unfall“) oder nach einer akuten Krankenbehandlung im extramuralen Bereich (= „Rehabilitationsheilverfahren“). Sie findet grundsätzlich in Einrichtungen statt, die im Sinne des § 2 (1) KAKuG als Sonderkrankenanstalten genehmigt sind, die vorwiegend der Rehabilitation dienen. Der Übergang in die stationäre Rehabilitation erfolgt bei Anschlussheilverfahren entweder unmittelbar bzw. innerhalb von zwölf Wochen im Anschluss an einen Spitalsaufenthalt oder nach einer rehabilitationsrelevanten Krankenbehandlung, jedenfalls aber erst dann, wenn eine ausreichende Stabilität der Patientin/des Patienten für die Anwendung rehabilitativer Therapie in der erforderlichen Intensität und Dauer besteht. Rehabilitationsmedizinische Maßnahmen im Ausmaß von mindestens zwei bis drei Stunden täglich sollen durchgeführt werden können. Für die Rehabilitation der oben beschriebenen Erkrankungsfolgen kann durch eine geeignete stationäre Therapie den Gesundheitszustand dauerhaft Anschlussheilbehandlung nach Therapie fortgeschrittener Kopf-Halstumore in spezialisierten Kliniken gebessert und wiederholte stationäre Aufnahmen in Einrichtungen der Akut- und Maximalversorgung reduziert werden. Die stationäre Behandlung von Folgezuständen nach Kopf-Halstumorerkrankung in einer hierfür spezialisierten Einrichtung muss fester Bestandteil der integrativen Versorgung von Patienten mit Kopf-Halstumoren sein. Die stationäre Behand­lung ist wegen der notwendigen Therapiedichte und Intensität (viele aufeinander abgestimmte Behandlungen) in einer speziell dafür eingerich­ teten Klinik erforderlich. 6.2.1 Geeigneter Zeitpunkt und Dauer für Phase II Rehabilitation Im Regelfall sollte die erste stationäre Behandlung der Gesundheitsstörungen nach Kopf-Halstumor ca. 6 Wochen nach Abschluss der Initialtherapie erfolgen, also unter folgenden Bedingungen: • abgeschlossene Primärbehandlung - stabile Sekundärheilung, • Wundheilung abgeschlossen, • Fistelheilung bei Stimmanbahnung abgeschlossen, • Bestrahlung seit ca. 6 Wochen beendet, • Akute Haut- und Schleimhautentzündung ausgeheilt, • Mundtrockenheit und Lymphschwellung im Kopf-Halsbereich beginnend, aber noch nicht über Monate manifest und dadurch schwerer beeinflussbar, • Patient muss sich selbst versorgen können und aktiv am Behandlungs­ 90 programm teilnehmen. Kopf-Halskarzinome Nachsorge und Rehabilitation Die Dauer des stationären Aufenthalts wird nach medizinischen Gesichts­ punkten festgelegt und beträgt im Regelfall 3 Wochen. 6.2.2 Erforderliches Behandlungsangebot Für die Phase II Rehabilitation von Patienten mit Kopf-Halstumoren braucht es ein spezialisiertes und umfassendes, eng aufeinander abgestimmtes Behandlungsangebot mit hoher Behandlungsdichte. Erforderlich sind unter anderem: • Beratung im Umgang mit der Erkrankung und deren Folgen • Stimm- und Sprachtherapie (Logopädie) • Schlucktherapie (z.B. Facial-Oral Tract Therapy) • Spezielle Ernährungsberatung für Kopf-Hals-Patienten • Hilfsmittelschulung (Kanüle, PEG-Sonde) Phase II Rehabilitation von Patienten mit Kopf-Halstumoren braucht ein spezialisiertes und umfassendes, eng aufeinander abgestimmtes Behandlungsangebot mit hoher Behandlungsdichte • Atemtherapie • Lymphdrainage zur Entstauung der Kopf-Halslymphschwellung • Schmerzlinderung bei Kopf-Halslymphschwellung (z.B. Marnitztherapie) • Verbesserung der Beweglichkeit im Hals- Schulter- Oberarmbereich (Physiotherapie) • Medikamentöse und physiotherapeutische Schmerzbehandlung • Wassertherapie für Kehlkopflose • Psychologische und psychoonkologische Betreuung • Sozialmedizinische Beratung • Mitbehandlung von Begleiterkrankungen durch Internisten, Gastro­ enterologen, Urologen und Gynäkologen. 6.3 Ambulantes Behandlungsangebot und Home-Care Die stationären Behandlungsmöglichkeiten sollten um ein ambulantes Behand­lungsangebot ergänzt werden, das auf die speziellen Bedürfnisse von Kopf-Halstumorpatienten abgestimmt ist. Schwerpunkte hierfür sind Stimmund Sprachtherapie (Logopädie), Schlucktherapie, Spezielle Ernährungs­ beratung für Kopf-Hals-Patienten, Hilfsmittelschulung, Lymphdrainage zur Entstauung der Kopf-Halslymphschwellung, Physiotherapie, Medikamentöse und physiotherapeutische Schmerzbehandlung, psychoonkologische Betreu­ ung und sozialmedizinische Beratung. Eine wichtige Funktion haben die Home-Care Einrichtungen von Herstellern von Hilfsmitteln für Patienten mit Kopf-Hals-Tumoren. Durch sie erfolgt eine Patientenschulung und Anleitung bei der Verwendung von Hilfsmitteln und bei der Ernährung über Sonde. Kopf-Halskarzinome Nachsorge und Rehabilitation 91 Es wird als vorteilhaft erachtet, ambulanten Dienste und ambulantes Behandlungsangebot in ein integratives Behandlungskonzept einzubinden. Hierzu ist das vorhandene Behandlungsangebot zu sichten, die spezielle Kompetenz für die Patienten mit Kopf-Halstumoren sicherzustellen und es sind den Patienten brauchbare Empfehlungen an die Hand zu geben. 6.4 Selbsthilfegruppen In Tirol gibt es derzeit keine Selbsthilfegruppe für Kopf-Halstumorpatienten oder Kehlkopflose und Halsatmer. Es wird vorgeschlagen, gemeinsam mit der Tiroler Krebshilfe, der Selbsthilfe Tirol - Dachverband der Tiroler Selbsthilfegruppen und -vereine im Gesundheitsbereich sowie dem Verein der Kehlkopflosen und Halsatmer Österreichs die Bildung einer Selbsthilfegruppe Kopf-Hals-Tumore oder einer Tiroler Sektion des Verein der Kehlkopflosen und Halsatmer zu unterstützen. 92 Kopf-Halskarzinome Nachsorge und Rehabilitation 7 Psychosoziale Aspekte und Psychoonkologie 7.1 Begriffsdefinition „Psychoonkologie“ Die Psychoonkologie ist eine interdisziplinäre Fachrichtung, deren Ziel es ist, die verschiedenen psychosozialen Aspekte in Entstehung, Behandlung und Verlauf einer Krebserkrankung im Kinder-, Jugend- und Erwachsenenalter wissenschaftlich zu untersuchen und die entsprechenden Erkenntnisse in die Versorgung und Behandlung der PatientInnen und deren Bezugspersonen umzusetzen. Die drei wesentlichen Aufgabenbereiche in der Psychoonkologie beinhalten: • Die Betreuung und Behandlung der onkologischen PatientInnen sowie die Unterstützung der Angehörigen und Bezugspersonen. Die drei wesentlichen Aufgabenbereiche in der Psychoonkologie • Die Arbeit mit den onkologischen Behandlungsteams, die neben dem interdisziplinären Austausch über die einzelnen PatientInnen vor allem in Form von psychoonkologischen Fallkonferenzen, Super- oder Intervision sowie Aus- und Fortbildungsangeboten durchgeführt wird. • Die wissenschaftliche Auseinandersetzung mit psychosozialen Themen in der Onkologie. 7.2 Grundprinzipien der psychoonkologischen Versorgung Die Psychoonkologie ist ein integraler Bestandteil der onkologischen Diagnostik, Behandlung und Nachsorge von PatientInnen mit KopfHalstumoren. Über entsprechende Fachgesellschaften werden in Österreich Fort- und Weiterbildungs- Curricula angeboten, um die fachliche Qualifikation sicherzustellen. Die psychoonkologische Betreuung erfolgt im interdisziplinären Ansatz, in der Zusammenarbeit mit allen an der Behandlung des Patienten/der Patientin beteiligten Berufsgruppen, also PsychologInnen, ÄrztInnen, PflegerInnen, ErnährungstherapeutInnen, LogopädInnen, PhysiotherapeutInnen, SozialarbeiterInnen, SeelsorgerInnen etc. Dies impliziert, dass eine psychoonkologische Fachkraft im jeweiligen Versorgungssetting (stationäre und ambulante Behandlung, stationäre Rehabilitation, ambulante Nachsorge) im Behandlungsteam integriert ist und in regelmäßigem Austausch mit den medizinisch Behandelnden steht. Im stationären Kontext gewährleistet die Verankerung der psychoonkologischen Betreuung im Liaisonmodell durch eine hohe personelle Konstanz, eine regelmäßige Anwesenheit zu festgelegten Zeiten, durch die Teilnahme an Visiten, interdisziplinären Fallbesprechungen sowie durch interne Fortbildungstätigkeit über psychoonkologische Fragestellungen die Integration von psychoonkologischen Interventionen und Wissen in den klinischen Alltag. Kopf-Halskarzinome Psychosoziale Aspekte 93 • Psychoonkologische Behandlungsmaßnahmen sollten in das Gesamt­ konzept der onkologischen Therapie integriert werden. • Alle PatientInnen sollen frühzeitig über Möglichkeiten psychoonkologischer Hilfestellungen informiert werden. 7.3 Psychoonkologische Versorgungskonzepte und Interventionen Psychoonkologische Versorgung von PatientInnen mit Kopf-Halstumoren beinhaltet eine patientengerechte Information und Beratung, eine qualifizierte psychologische Diagnostik und Bedarfsfeststellung sowie eine gezielte psychoonkologische Behandlung zur Unterstützung der Bewältigung der Erkrankungs- und Behandlungsfolgen. Die Einbeziehung des sozialen Umfeldes, die Entlastung und Unterstützung der Angehörigen ist selbst­ verständlicher Bestandteil psychoonkologischer Arbeit. Die Mannigfaltigkeit und Komplexität möglicher psychischer Beeinträch­ tigungen bei Kopf-Halstumoren in unterschiedlichen Krankheits- und Behandlungs­phasen erfordern, dass der psychosoziale Behandlungsbedarf individuell festgestellt wird und eine psychoonkologische Fachkraft bei Bedarf einbe­zogen wird. Nur so kann auf die unterschiedlichen Problemlagen und Belastungen von PatientInnen adäquat eingegangen werden. Im Kopf-Hals-Bereich lokalisierte Tumore beeinträchtigen je nach Ausdehnung die grundlegendsten menschlichen Funktionen wie das Sprechen, das Schlucken, die Nahrungsaufnahme etc. und zeigen durch Gesichts­entstellungen „offensichtliche“ Auswirkungen von Krankheit und onkologischer Therapie. Der Verlust von Organen und Organfunktionen führt zu Körperbildveränderungen. Die Beeinträchtigung des eigenen Selbstwerts und die Verunsicherung im Umgang mit anderen Menschen gehören zu den höchsten Belastungen dieser PatientenInnengruppe. Soziale Belastungen entstehen häufig durch finanzielle Schwierigkeiten, unversorgte Familienangehörige – insbesondere Kinder – und nicht gesicherte Arbeitsplatzsituationen. Themenbereiche psychoonkologischer Interventionen bei PatientInnen mit Kopf-Hals-Tumoren sind: • Angst, Depression, Trauer, Belastungserleben • Krankheitsverarbeitung, Krankheitseinstellungen • gesundheitsbezogene Lebensqualität und funktioneller Status • Körperbild 94 • Selbstkonzept Kopf-Halskarzinome Psychosoziale Aspekte • soziale Beziehungen, Kommunikation, Stigmatisierungsgefühle • Substanzmissbrauch und -abhängigkeit • Fatigue • Schmerzen • Sexualität • Behandlungscompliance und -adherence • neuropsychologische Beeinträchtigungen (Aufmerksamkeit, Gedächtnis, Konzentrationsfähigkeit) Psychoonkologische Interventionen sind: • am individuellen Bedarf der Patientinnen auszurichten • sollten frühestmöglich angeboten werden • validierte Messinstrumente können zur Bedarfsfeststellung hilfreich sein, wie z.B.: - Psychoonkologische Basisdokumentation (PO-Bado) - Hospital Anxiety and Depression Scale (HADS) - Hornheider Screening-Instrument (HSI) - Fragebogen zur Belastung von Krebskranken (FBK) - NCCN Distress-Thermometer. Psychoonkologische Interventionen bei Kopf-Hals-TumorpatientInnen umfassen mit unterschiedlicher Schwerpunktsetzung im Akutkrankenhaus, in der Rehabilitationsklinik und im weiteren Verlauf der Nachsorge oder palliativen Versorgung folgende Maßnahmen: • supportive Einzelgespräche • Krisenintervention • Patientenschulung, psychoedukative Gruppenintervention • symptomorientierte Verfahren (Entspannung, Imagination) • neuropsychologisches Training • künstlerische Therapieverfahren (Kunst-, Musik- und Tanztherapie) • Paar- und Familiengespräche, Sexualberatung • Anbahnung und Vermittlung der Nachsorge • sozialrechtliche Beratung • Sterbebegleitung Zur Gewährleistung einer Kontinuität der psychoonkologischen Betreuung nach der stationären Behandlung sollen die PatientInnen über weiterführende ambulante und nachsorgende Angebote informiert werden (Krebsberatungsstellen, niedergelassene PsychoonkologInnen, Selbst­hilfe­ gruppen, Sozialberatung etc.). Kopf-Halskarzinome Psychosoziale Aspekte 95 Es hat sich als hilfreich erwiesen, neben den klassischen Parametern auch die Lebensqualität für die Beurteilung und Planung der Diagnostik und Therapiemaßnahmen mit einzubeziehen. Für die Erfassung der Lebensqualität können neben dem ausführlichen Gespräch auch strukturierte und standardisierte Fragebögen (wie bspw. der EORTC QLQ C30 oder FACT-G) eingesetzt werden. Anhand dieser Fragebögen können die Befindlichkeit der PatientInnen in somatischen (Intensität und Häufigkeit körperlicher Symptome, funktionelle Einschränkungen), psychischen (Angst, Depression, kognitive Einschrän­ kungen) und sozialen (Familienleben, Arbeit, Sexualität) Bereichen evaluiert werden. Sie sind in aufwendigen Studien hinsichtlich ihrer Messgüte (Reliabilitat, Validität und Sensitivität) überprüft worden. Mittlerweile liegen Studien zum Einsatz von Lebensqualitätsinstrumenten in der Routine­ versorgung vor. 7.4 Behandlungsbedarf und Indikationsstellung in der Psycho­onko­ logie PatientInnen mit Kopf-Halstumoren sind durch Diagnose, Behandlung und Nachsorge einer Vielzahl von psychosozialen Belastungsfaktoren ausgesetzt. Mehrere Untersuchungen ermittelten bei 40% der PatientInnen mit Tumoren im Kopf-Hals-Bereich behandlungsbedürftige psychische Auffälligkeiten, u.a. depressive Störungen, Angststörungen, Fatigue, Schlafstörungen, Körperbildstörungen etc. Diese psychosozialen Belastungen sind mit einer Reihe negativer Auswirkungen verbunden, beispielsweise einer schlechteren Compliance, geringerer Behandlungszufriedenheit, einer eingeschränkten Krankheitsbewältigung und einer verminderten Lebensqualität. Unbehandelte psychische Auffälligkeiten können chronifizieren, zu länger andauernder Hospitalisierung und damit zu erhöhten Behandlungskosten führen. In Studien zu ökonomischen Auswirkungen psychoonkologischer Behandlungen finden sich klare Hinweise dafür, dass eine adäquate psychosoziale Versorgung onkologischer PatientInnen Kosteneinsparungen für das Gesundheitssystem mit sich bringt. Im Rahmen der fachlichen Anforderungen an zertifizierten onkologischen Zentren wird u.a. auch der Versorgungsbedarf bzw. die mindestens notwendige psychoonkologische Ressource mit mindestens 1 Stelle für 300 PatientInnen festgelegt. 96 Kopf-Halskarzinome Psychosoziale Aspekte 8 Literaturverweise (1) Licitra L, Felip E. Squamous cell carcinoma of the head and neck: ESMO clinical recommendations for diagnosis, treatment and followup. Ann Oncol 2009; 20 Suppl 4:121-122. (2) Beck-Mannagetta J, Burian M, Vinzenz K. Manual der chirurgischen Krebstherapie - Kopf/Hals Malignome. Österreichische Gesellschaft für Chirurgische Onkologie. http://www.aco-asso.at/manual/ archiv/kopfhals/index.htm . 2010. Österreichische Gesellschaft für Chirurgische Onkologie. (3) Deutsche Krebsgesellschaft. Kurzgefasste Interdisziplinäre Leitlinien 2008. Empfehlungen zur Diagnostik und Therapie maligner Erkrankungen. Zuckschwerdt, 2008. (4) National Cancer Institute. Head and Neck Cancer. National Cancer Institute. http://www.cancer.gov/cancertopics/types/head-and-neck/ . 2009. National Cancer Institute. (5) National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Head and Neck Cancers. http://www.nccn.org/ professionals/physician_gls/PDF/head-and-neck.pdf . 2009. National Comprehensive Cancer Network. (6) Argiris A, Karamouzis MV, Raben D, Ferris RL. Head and neck cancer. Lancet 2008; 371(9625):1695-1709. (7) Cooper JS, Pajak TF, Forastiere AA, Jacobs J, Campbell BH, Saxman SB et al. Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med 2004; 350(19):1937-1944. (8) Bernier J, Domenge C, Ozsahin M, Matuszewska K, Lefebvre JL, Greiner RH et al. Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med 2004; 350(19):1945-1952. (9) Bernier J, Cooper JS, Pajak TF, van Glabbeke M, Bourhis J, Forastiere A et al. Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (# 9501). Head Neck 2005; 27(10):843-850. (10) Oberaigner W, Mühlböck H, Harrasser L. Tumorregister Bericht der Diagnosejahre 2004 - 2006. http://www.iet.at/fileadmin/iet/files/ tumorregister/trt_bericht_2008_webfassung.pdf , 3-122. 2008. Innsbruck, IET - Institut für klinische Epidemiologie der TILAK GmbH. (11) Prince ME, Sivanandan R, Kaczorowski A, Wolf GT, Kaplan MJ, Dalerba P et al. Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma. Proc Natl Acad Sci U S A 2007; 104(3):973-978. Kopf-Halskarzinome Literatur 97 (12) Barnes L, Eveson JW, Reichart P, Sidransky D. Pathology and Genetics of Head and Neck Tumours (World Health Organization Classification of Tumours). Lyon: IARC Press, 2005. (13) Sobin LH, Gospodarowicz MK, Wittekind C, International Union aC. TNM classification of malignant tumours. 7th ed ed. Chichester, West Sussex, UK: Wiley-Blackwell, 2010. (14) Wittekind C, Meyer HJ. TNM: Klassifikation maligner Tumoren. 7. Auflage ed. Weinheim: Wiley-VCH Verlag GmbH & Co., 2010. (15) Helliwell TR, Woolgar JA. Standards and minimum datasets for reporting cancers. Dataset for histopathological reports on head and neck carcinomas and salivary neoplasms. 2nd ed. 1-29. 2005. London, Royal College of Pathologists. (16) Warren S, Gates O. Multiple primary malignant tumors: a survey of the literature and statistical study. Am J Cancer 1932; 51:1358. (17) Schwartz LH, Ozsahin M, Zhang GN, Touboul E, De Vataire F, Andolenko P et al. Synchronous and metachronous head and neck carcinomas. Cancer 1994; 74(7):1933-1938. (18) Saleh A, Mathys C, Mödder U. Staging von Kopf-Hals-Tumoren mit bildgebenden Verfahren (Teil I: T-Staging). Radiologie up2date 2007; 7:275-300. (19) Saleh A, Mathys C, Mödder U. Staging von Kopf-Hals-Tumoren mit bildgebenden Verfahren(Teil II: N- und M-Staging). Radiologie up2date 2008; 8:15-30. (20) Guardiola E, Chaigneau L, Villanueva C, Pivot X. Is there still a role for triple endoscopy as part of staging for head and neck cancer? Curr Opin Otolaryngol Head Neck Surg 2006; 14(2):85-88. (21) Kothari P, Randhawa PS, Farrell R. Role of tonsillectomy in the search for a squamous cell carcinoma from an unknown primary in the head and neck. Br J Oral Maxillofac Surg 2008; 46(4):283-287. (22) Kovacs AF. Sentinel lymph nodes in oral and pharyngeal cancer. Laryngorhinootologie 2010; 89(12):758-766. (23) Mistry RC, Qureshi SS, Kumaran C. Post-resection mucosal margin shrinkage in oral cancer: quantification and significance. J Surg Oncol 2005; 91(2):131-133. (24) Wolfensberger M. Der Einfluss tumorpositver Resektionsränder auf die Prognose beim Pflasterzellkarzinom von Mundhöhle, Pharynx und Larynx. Laryngo Rhino Otol 1989; 68:566-568. (25) Bieri S, Bentzen SM, Huguenin P, Allal AS, Cozzi L, Landmann C et al. Early morbidity after radiotherapy with or without chemotherapy in advanced head and neck cancer. Experience from four nonrandomized 98 studies. Strahlenther Onkol 2003; 179(6):390-395. Kopf-Halskarzinome Literatur (26) Schweizerische Gesellschaft für Oto-Rhino-Laryngologie HuG. Empfehlungen für die Abklärung, Behandlung und Nachsorge von Patienten mit Karzinomen des Kopf-Hals-Bereiches. orl-hno.ch/d/ patienten/Patienten_Informationen_Krebs_2011.pdf , 1-69. 2011. (27) Robbins KT, Clayman G, Levine PA, Medina J, Sessions R, Shaha A et al. Neck dissection classification update: revisions proposed by the American Head and Neck Society and the American Academy of Otolaryngology-Head and Neck Surgery. Arch Otolaryngol Head Neck Surg 2002; 128(7):751-758. (28) Robbins KT, Shaha AR, Medina JE, Califano JA, Wolf GT, Ferlito A et al. Consensus statement on the classification and terminology of neck dissection. Arch Otolaryngol Head Neck Surg 2008; 134(5):536-538. (29) Gourin CG, Conger BT, Porubsky ES, Sheils WC, Bilodeau PA, Coleman TA. The effect of occult nodal metastases on survival and regional control in patients with head and neck squamous cell carcinoma. Laryngoscope 2008; 118(7):1191-1194. (30) Shah JP. Patterns of cervical lymph node metastasis from squamous carcinomas of the upper aerodigestive tract. Am J Surg 1990; 160(4):405-409. (31) Shasha D, Harrison LB. Elective irradiation of the N0 neck in squamous cell carcinoma of the upper aerodigestive tract. Otolaryngol Clin North Am 1998; 31(5):803-813. (32) Fletcher GH. Elective irradiation of subclinical disease in cancers of the head and neck. Cancer 1972; 29(6):1450-1454. (33) Kolli VR, Datta RV, Orner JB, Hicks WL, Jr., Loree TR. The role of supraomohyoid neck dissection in patients with positive nodes. Arch Otolaryngol Head Neck Surg 2000; 126(3):413-416. (34) Tupchong L, Scott CB, Blitzer PH, Marcial VA, Lowry LD, Jacobs JR et al. Randomized study of preoperative versus postoperative radiation therapy in advanced head and neck carcinoma: long-term follow-up of RTOG study 73-03. Int J Radiat Oncol Biol Phys 1991; 20(1):21-28. (35) Kramer S, Gelber RD, Snow JB, Marcial VA, Lowry LD, Davis LW et al. Combined radiation therapy and surgery in the management of advanced head and neck cancer: final report of study 73-03 of the Radiation Therapy Oncology Group. Head Neck Surg 1987; 10(1):19-30. (36) Corvo R. Evidence-based radiation oncology in head and neck squamous cell carcinoma. Radiother Oncol 2007; 85(1):156-170. (37) Budach W, Belka C, Budach V. Konventionell und unkonventionell fraktionierte alleinige Strahlentherapie bei Plattenepithelkarzinomen des Pharynx und Larynx. Onkologe 2001; 7:550-556. Kopf-Halskarzinome Literatur 99 (38) Bourhis J, Overgaard J, Audry H, Ang KK, Saunders M, Bernier J et al. Hyperfractionated or accelerated radiotherapy in head and neck cancer: a meta-analysis. Lancet 2006; 368(9538):843-854. (39) Mendenhall WM, Amdur RJ, Hinerman RW, Villaret DB, Siemann DW. Postoperative radiation therapy for squamous cell carcinoma of the head and neck. Am J Otolaryngol 2003; 24(1):41-50. (40) Byers RM, Clayman GL, McGill D, Andrews T, Kare RP, Roberts DB et al. Selective neck dissections for squamous carcinoma of the upper aerodigestive tract: patterns of regional failure. Head Neck 1999; 21(6):499-505. (41) Jackel MC, Ambrosch P, Christiansen H, Martin A, Steiner W. Value of postoperative radiotherapy in patients with pathologic N1 neck disease. Head Neck 2008; 30(7):875-882. (42) Munro AJ. An overview of randomised controlled trials of adjuvant chemotherapy in head and neck cancer. Br J Cancer 1995; 71:83-91. (43) Furness S, Glenny AM, Worthington HV, Pavitt S, Oliver R, Clarkson JE et al. Interventions for the treatment of oral cavity and oropharyngeal cancer: chemotherapy. Cochrane Database Syst Rev 2011;(4):CD006386. (44) Adelstein DJ, Li Y, Adams GL, Wagner H, Jr., Kish JA, Ensley JF et al. An intergroup phase III comparison of standard radiation therapy and two schedules of concurrent chemoradiotherapy in patients with unresectable squamous cell head and neck cancer. J Clin Oncol 2003; 21(1):92-98. (45) Rades D, Fehlauer F, Sheikh-Sarraf M, Kazic N, Basic H, Poorter R et al. Toxicity of two cisplatin-based radiochemotherapy regimens for the treatment of patients with stage III/IV head and neck cancer. Head Neck 2008; 30(2):235-241. (46) Bonner JA, Harari PM, Giralt J, Azarnia N, Shin DM, Cohen RB et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 2006; 354(6):567-578. (47) Bonner JA, Harari PM, Giralt J, Cohen RB, Jones CU, Sur RK et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival. Lancet Oncol 2010; 11(1):21-28. (48) Adelstein DJ, Tan EH, Lavertu P. Treatment of head and neck cancer: the role of chemotherapy. Crit Rev Oncol Hematol 1996; 24(2):97-116. 100 Kopf-Halskarzinome Literatur (49) Pignon JP, Le Maitre A, Maillard E, Bourhis J. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 93 randomised trials and 17,346 patients. Radiother Oncol 2009; 92(1):414. (50) Miller AB, Hoogstraten B, Staquet M, Winkler A. Reporting results of cancer treatment. Cancer 1981; 47(1):207-214. (51) Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45(2):228-247. Kopf-Halskarzinome Literatur 101